致雏鹅痛风相关病原的分子检测
2023-10-26王家英金美玲储丽丽王笑言张大丙
王家英,金美玲,储丽丽,王笑言,张大丙
(中国农业大学动物医学院 农业部动物流行病学重点实验室,北京 海淀 100193)
鹅星状病毒(Goose astrovirus,GoAstV)基因2型(GoAstV-2)是2014年从雏鹅肠炎病例中发现的一种新病毒,属星状病毒科、禽星状病毒属的未定种[1]。在雏鹅痛风病例中,GoAstV-2的感染率很高[2],目前多认为GoAstV-2是雏鹅痛风的主要致病病原[3-8]。鹅细小病毒(Goose parvovirus,GPV)是细小病毒科、细小病毒亚科、依赖细小病毒属成员,感染雏鹅可导致小鹅瘟发生[9]。在雏鹅痛风病例中,亦曾检出GPV,但GPV阳性率高低不等[8,10-12]。
2021年3月,在江西省某养鹅场,已使用雏鹅痛风和小鹅瘟抗体制品进行过预防性接种的雏鹅在5日龄时发生痛风病。本试验旨在通过星状病毒通用RT-PCR和水禽细小病毒通用PCR对7日龄死亡病例的组织样品进行检测,并对扩增产物进行测序和序列分析,评估雏鹅痛风病例中GoAstV-2和GPV混合感染情况,以期为雏鹅痛风的防控提供数据支持。
1 材料与方法
1.1 主要试剂 TRIzol,购自Thermo Fisher Scientific公司;血液/组织/细胞基因组DNA提取试剂盒,购自天根生化科技(北京)有限公司;M-MLV反转录酶、M-MLV 5×Buffer、dNTP(10 mmol/L),均购自普洛麦格生物技术有限公司;RNase Inhibitor,购自TaKaRa公司(大连);2×Phanta Max Buffer、Phanta Max Super-Fidelity DNA Polymerase、dNTP Mix(10 mmol/L),均购自南京诺唯赞生物科技股份有限公司;AxyPrep DNA凝胶回收试剂盒,购自康宁生命科学(吴江)有限公司;pEASY-Blunt Zero载体、Trans-T1感受态细胞,均购自北京全式金生物技术有限公司。
1.2 主要仪器 珠磨式组织匀浆机,Biospec公司产品;紫外凝胶成像仪,英国GENIUS公司产品。
1.3 病例来源 2021年3月,从江西省某养鹅场收集9只7日龄病死兴国灰鹅。
1.4 试验方法
1.4.1 大体病变观察和病料处理 剖检9只7日龄病死兴国灰鹅,观察大体病变,分别采集肝脏样本,共9份,按1∶5(W/V)比例加入灭菌生理盐水,用珠磨式组织匀浆机制成匀浆,在4 ℃条件下,12 000 g离心15 min,收获上清液。
1.4.2 核酸提取 用TRIzol从250 μL上清液提取病毒RNA;用血液/组织/细胞基因组DNA提取试剂盒从200 μL上清液提取DNA。
1.4.3 GoAstV的RT-PCR检测 用参考文献[13]报道的引物ORF1bR(表1)进行反转录。将5 μL RNA模板与2 μL引物ORF1bR混合,置70 ℃作用5 min,冰浴5 min,再加入M-MLV反转录酶1 μL、M-MLV 5×Buffer 5 μL、dNTP(10 mmol/L)5 μL、RNase Inhibitor 0.5 μL和DEPC水6.5 μL,混匀后置42 ℃作用1 h、94 ℃作用5 min。
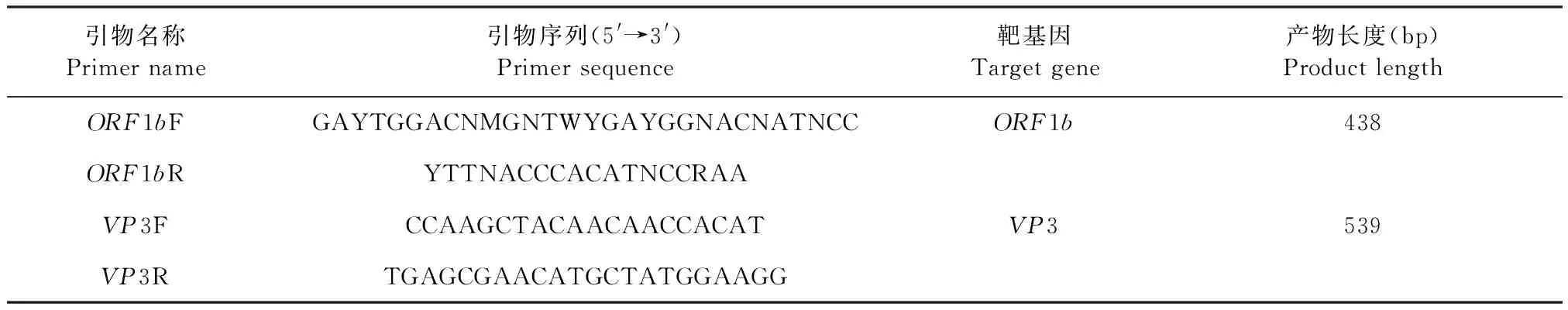
表1 检测临床样品所用引物Table 1 Primes used for clinical sample detection
PCR扩增体系(50 μL):cDNA 5 μL、引物ORF1bF和ORF1bR(表1)各2 μL、2×Phanta Max Buffer 25 μL、Phanta Max Super-Fidelity DNA Polymerase 1 μL、dNTP Mix(10 mmol/L)1 μL和ddH2O 14 μL。按照参考文献[13]报道的程序通过PCR扩增GoAstV的ORF1b基因。PCR产物经1.5%琼脂糖凝胶电泳,用紫外凝胶成像仪观察并拍照记录。
1.4.4 GPV的PCR检测 用参考文献[14]报道的引物VP3F和VP3R(表1)通过PCR扩增GPV的VP3基因。取DNA 5 μL,按1.4.3建立50 μL PCR反应体系。PCR扩增程序:94 ℃预变性10 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,共35个循环;72 ℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳,用紫外凝胶成像仪观察并拍照记录。
1.4.5 克隆和测序 用1.5%琼脂糖凝胶电泳分离PCR产物,用AxyPrep DNA凝胶回收试剂盒进行纯化。将PCR产物克隆至pEASY-Blunt Zero载体,构建重组质粒。用重组质粒转化Trans-T1感受态细胞,经细菌培养和阳性克隆子筛选,委托北京擎科生物科技有限公司测序。
1.4.6 序列同源性分析和遗传演化分析 用SnapGene 5.0(Insightful Science)进行序列编辑,在GenBank中用BLASTx(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列相似性检索。从GenBank下载GoAstVORF1b序列和GPVVP3序列作为参考序列,用Clustal W程序(https://www.genome.jp/tools-bin/clustalw)分析序列同源性,用MEGA 6软件中的邻接法(Neighbor-joining method)[15]进行遗传演化分析。
2 结果
2.1 大体病变观察 剖检病死雏鹅,可见典型的内脏痛风和关节痛风。在心脏、肝脏(图1A)、腺胃、肌胃、脾脏(图1B)、胰腺、肠道、肠系膜(图1C)和腹膜的表面均可见白色尿酸盐沉积。肾脏肿胀,有尿酸盐沉积,输尿管扩张,内含白色物质(图1D)。胆囊肿胀,充盈胆汁,部分病例的胆囊内含白色尿酸盐结晶。有些病例的食道和肌肉表面也见有尿酸盐沉积。膝关节、跗关节、跖趾关节和趾节间关节肿胀,剖检可见后肢各个关节有不同程度的尿酸盐沉积。剖开颈部、背部和翅部皮肤,可见颈部、躯干和前肢各关节均有不同程度的尿酸盐沉积。
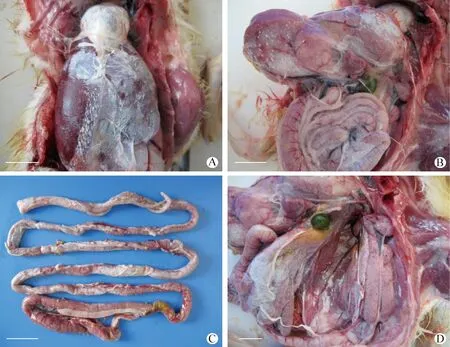
图1 病死雏鹅的大体病变(标尺=10 mm)Fig.1 Gross lesions in dead goslings(Bar=10 mm)A:心脏和肝脏; B:腺胃、肌胃和脾脏; C:胰腺、肠道和肠系膜; D:肾脏和输尿管A:Heart and liver; B:Muscle stomach,glandular stomach and spleen; C:Pancreas,intestinal tract and mesentery; D:Kidney and ureter
2.2 GoAstV和GPV的检测 用星状病毒的通用RT-PCR和水禽细小病毒的通用PCR进行检测,9份肝脏样品均为阳性(图2)。测序和序列分析结果显示,438 bp扩增产物为GoAstV的ORF1b序列,539 bp扩增产物为GPV的VP3序列。用缩写JX表示样品的地区来源,用阿拉伯数字1~9代表9只病死兴国灰鹅,用英文字母a和b分别表示从同一份肝脏样品检出的GoAstV和GPV,将GoAstV的毒株号称为JX1a株、JX2a株和JX3a株等,将GPV的毒株号称为JX1b株、JX2b株和JX3b株等。
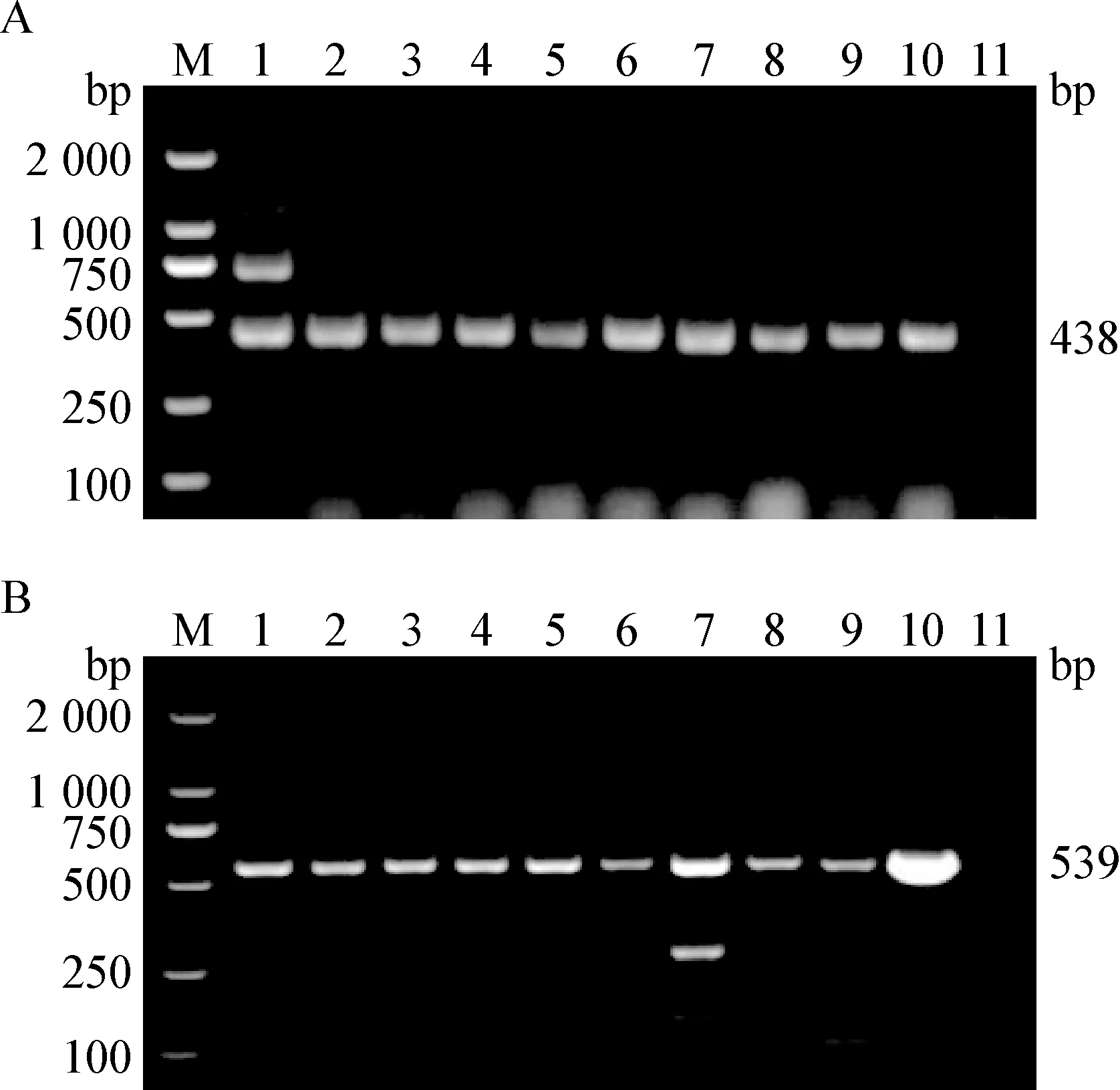
图2 临床样品中GoAstV-2 ORF1b基因(A)和GPV VP3基因(B)的扩增Fig.2 Amplification of GoAstV-2 ORF1b gene (A) and GPV VP3 gene (B) in clinical samplesM:DL-2 000 DNA相对分子质量标准; 1~9:肝脏; 10:阳性对照; 11:阴性对照M:DL-2 000 DNA Marker; 1-9:Livers; 10:Positive control; 11:Negative control
2.3 序列同源性分析和遗传演化分析 对所有扩增产物进行序列测定,Clustal W分析结果显示,在扩增的GoAstV 438 ntORF1b区,本试验所测JX1a株、JX2a株和JX3a株等9株GoAstV的核苷酸序列同源性为99%~100%,与HN1G株、HN2G株和GD株等11株GoAstV-2参考毒株[1,4-7,16,17]的核苷酸序列同源性为95%~98%,与B2株、B10株和B14株等4株GoAstV-1参考毒株[18]和GoAstV-3参考毒株FLX株[19]的核苷酸序列同源性为63%~67%。用438 ntORF1b序列进行遗传演化分析的结果显示,本试验所测9株GoAstV与已知GoAstV-2聚为同一个分支,而已知GoAstV-1和GoAstV-3形成2个独立的分支(图3)。

图3 GoAstV ORF1b基因的遗传演化分析Fig.3 Phylogenetic analysis based on ORF1b genes of GoAstV毒株表示方式:毒株号/宿主/国家/检测或分离时间; Go:鹅; Ch:鸡; CH:中国; SL:斯里兰卡; ▲:本试验所测毒株; 以火鸡星状病毒1型(Turkey astrovirus 1,TAstV-1)n130株作为Outgroup; 括号中为序列登录号Virus strains are denoted as following:Strain number/Host/Country/Year of detection or isolation; Go:Goose; Ch:Chicken; CH:China; SL:Sri Lanka. ▲:Strains detected in this study. Turkey astrovirus 1 (TAstV-1) strain n130 is included as an outgroup.GenBank accession numbers of the sequences are indicated in parentheses
在扩增的GPV 539 ntVP3区,本试验所测JX1b株、JX2b株和JX3b株等9株GPV的核苷酸序列同源性为99%~100%,与HN1P株、HN2P株和HN3P株等从肉鸭异常换羽病例检出的GPV[20]的核苷酸序列同源性亦为99%~100%,与JS1株、HB株和QH15株等从鸭短喙与侏儒综合征(Short beak and dwarfism syndrome,SBDS)病例分离的GPV[21-24]的核苷酸序列同源性为97%~99%,与B株、LB株和VG32-1株等GPV经典毒株[25-29]的核苷酸序列同源性为93%~98%。用539 ntVP3序列进行遗传演化分析的结果显示,GPV形成2个不同的分支(称为1分支和2分支),2分支进一步分为2个亚分支(称为2.1分支和2.2分支),B株、LB株和VG32-1株等GPV经典毒株聚为1分支,从鸭SBDS病例分离的JS1株、HB株和QH15株等GPV分离株聚为2.1分支,本试验从雏鹅痛风病例检出的JX1b株、JX2b株和JX3b株等9株GPV以及HN1P株、HN2P株和HN3P株等肉鸭异常换羽相关毒株聚为2.2分支(图4)。

图4 GPV VP3基因遗传演化分析Fig.4 Phylogenetic analysis based on VP3 genes of GPV毒株表示方式:毒株号/宿主/国家/检测或分离时间(如果信息能获得); Go:鹅; Pd:北京鸭; Cv:樱桃谷鸭; Md:番鸭; Sw:天鹅; CH:中国; UK:英国; GE:德国; HU:匈牙利; ▲:本试验所测毒株;蓝色:从肉鸭异常换羽病例检出的GPV; 以番鸭细小病毒(Muscovy duck parvovirus,MDPV)FM株作为Outgroup; 括号中为序列登录号Virus strains are denoted as following:Strain number/Host/Country/Year of detection or isolation (if available); Go:Goose; Pd:Pekin ducks;Cv:Cherry Valley ducks; Md:Muscovy ducks; Sw:Swan; CH:China;UK:England;GE:Germany;HU:Hungary. ▲:Strains detected in this study; Blue:GPV strains detected form duck abnormal molting cases. Muscovy duck parvovirus (MDPV) strain FM is included as an outgroup. GenBank accession numbers of the sequences are indicated in parentheses
3 讨论
在本试验中,雏鹅死亡病例均有典型的内脏和关节尿酸盐沉积,表明用痛风抗体进行被动免疫未能提供有效保护;从所有病例的肝脏样品中均检出GoAstV-2和GPV,表明该雏鹅群存在GoAstV-2和GPV混合感染,与以往报道[8,10-12]相符。尽管有研究表明,使用GoAstV-2分离株接种雏鹅可复制出雏鹅痛风,但死亡率明显低于自然感染所引起的死亡率,尿酸盐沉积病变也较自然感染轻微[3-5]。据Woode 等报道,星状病毒与其他肠道病毒混合感染时可使疾病更为严重[30]。因此,有必要评估GPV或其他病毒与GoAstV-2的混合感染在雏鹅痛风病发生中的作用。在本试验中所观察的雏鹅死亡病例并无小鹅瘟的特征病变,这一结果表明,用小鹅瘟抗体进行被动免疫可控制小鹅瘟的发生。然而,从所有病例均可检出GPV,表明小鹅瘟抗体产品未能完全抑制GPV的复制。
在雏鹅痛风流行之前,已在我国鹅群发现GoAstV。用438 ntORF1b序列进行遗传演化分析,可将GoAstV分为3个基因型:2011年从江西省6~7周龄健康朗德鹅检出的毒株[16]属于基因1型(GoAstV-1);2014年从湖南省雏鹅肠炎病例检出的毒株[1,19]分别属于基因2型(GoAstV-2)和基因3型(GoAstV-3)。从雏鹅痛风病例中检出的毒株多属于GoAstV-2[2-8]。也有研究者从雏鹅痛风病例分离到与GoAstV-3 FLX株相近的毒株,并用此类分离株复制出雏鹅痛风[31]。本试验检出的9株GoAstV均属于GoAstV-2,进一步说明GoAstV-2是雏鹅痛风的主要致病病原。
用VP1和VP3基因序列进行遗传演化分析,可将GPV区分为亚洲毒株(Asian strains)、疫苗或低致病性毒株(Vaccine &low pathogenic strains)、匈牙利强毒株(Hungarian virulent strains)和西欧毒株(West-European strains)[26],亦可进一步细分为疫苗或GPV低致病性毒株(Vaccine &low pathogenic GPV strains)、亚洲GPV毒株(Asian GPV strains)、欧洲1群毒株(European group 1 strains)、欧洲2群毒株(European group 2 strains)和欧洲3群毒株(European group 3 strains)[9]。事实上,在文献[9,20,26,32]报道的VP1和VP3进化树以及本试验所构建的VP3进化树中,不同来源的GPV均形成2个主要分支,在本试验中提出的2分支对应于Tatár-Kis等[26]和Palya等[33]报道的西欧分支以及Swayne等[9]提出的欧洲3群,这类毒株是鸭SBDS的致病病原。1分支包含了Tatár-Kis等[26]和Swayne等[9]提出的其他所有分支,这类毒株是小鹅瘟的致病病原或弱毒疫苗株。1分支毒株对鸭无明显致病性[32,34],2分支毒株对于鸭的毒力显著增强[32],但对于鹅的致病性较经典毒株有所减弱[35]。从肉鸭异常换羽病例检出的毒株与SBDS毒株高度相似,但在进化树分别聚类,形成2个不同的小分支,反映出2分支毒株在鸭群流行后可能进一步发生了变异[20],故将SBDS的致病病原和肉鸭异常换羽相关毒株分别称之为2.1分支和2.2分支。本试验从雏鹅痛风病例检出的毒株与肉鸭异常换羽相关毒株极为相似,归属于2.2分支,这类毒株对于雏鹅的致病性还有待于评估。
