猪圆环病毒2d亚型病毒样颗粒的构建和鉴定
2023-10-26刘兆禄徐胜男丛雁方赵玉惠蒋贻海
刘兆禄,徐胜男,丛雁方,赵玉惠,蒋贻海
(1. 青岛蔚蓝生物股份有限公司,山东 青岛 266102 ; 2.青岛蔚蓝生物制品有限公司,山东 青岛 266114)
猪圆环病毒2型(Porcine circovirus type 2,PCV2)是引起断奶仔猪多系统衰竭综合征(Post weaning multisystemic wasting syndrome,PMWS)的主要病原体。自1991年加拿大首次报道PMWS以来[1],该病已蔓延至世界各地,是全世界养猪业面临的重要传染病之一[2],对于我国的养猪业同样引起了巨大的经济损失[3]。该病主要症状表现为仔猪渐进消瘦,腹部乃至全身皮肤有斑块,伴随肺脏肿胀、淋巴结肿大和肾脏水肿等[4]。虽然通过改善饲养环境和减轻应激等方式可以避免感染猪的临床症状,但不能完全抑制PCV2的感染[5]。目前,疫苗接种仍是预防PCV2感染最有效的手段。
PCV2基因组全长约1.7 kb,包含2个主要的开放阅读框(Open reading frame,ORF):ORF1和ORF2。其中,ORF1主要编码病毒复制相关蛋白Rep(Rep'),ORF2编码PCV2唯一的结构蛋白Cap[6,7]。Cap蛋白包含重要的抗原中和表位,能够介导病毒的识别和入侵,是PCV2主要的免疫蛋白,并且在体外能够自组装成病毒样颗粒(Virus-like particles,VLPs),是PCV2疫苗研制的重要靶蛋白[8]。
目前,市售的PCV2亚单位疫苗已被证明可有效预防PCV2的传播,相比灭活疫苗,其抗原成分单一,不存在散毒的风险,对猪场PCV2的清除更具有优势[9]。近年来,通过流行病学调查发现,PCV2优势流行毒株已开始从PCV2b亚型转变为PCV2d亚型[10],这种抗原性差异对于当前疫苗免疫保护和病毒基因进化的影响仍存在争议。昆虫细胞-杆状病毒表达系统具有安全性好,周期短,产量高,能够对外源蛋白进行翻译后加工等优点,并可使重组蛋白具有与病毒天然蛋白相似的结构和活性,更有利于VLPs形成[11]。鉴于此,本试验采用昆虫细胞-杆状病毒表达系统表达PCV2d Cap蛋白,并对其进行表达鉴定和免疫原性分析,以期为研制有效新型的PCV2亚单位疫苗提供参考。
1 材料与方法
1.1 主要试剂 pFastBac Dual-HBM质粒、Sf9悬浮和贴壁细胞,均由本公司保存;2×Phanta Master Mix酶和ClonExpress Mix press无缝克隆酶,均购自南京诺唯赞股份有限公司;BamH I、XbaI、XhoI和NheI限制性内切酶,均购自美国Thermo公司;DH5α感受态细胞,购自宝生物工程(大连)有限公司;DH10 Bac感受态细胞,购自北京华越洋生物有限公司;质粒小提试剂盒,购自北京天根生物有限公司;病毒DNA/RNA共提取试剂盒,购自青岛英赛特生物有限公司;HRP标记的羊抗鼠IgG,购自北京博奥森生物技术有限公司;FITC标记的IgG和Cellfectin®II Reagent转染试剂,均购自美国Invitrogen公司。
1.2 主要仪器 层析柱(型号StarPack Mars SP HiRes 1 mL Column),购自苏州星谱生物科技有限公司;PCR仪、紫外凝胶成像仪和荧光显微镜,均购自伯乐生命医学产品(上海)有限公司;透射电子显微镜,购自上海日立高新技术国际贸易有限公司。
1.3 试验方法
1.3.1 基因合成 参考本实验室分离的PCV2d毒株(GenBank登录号:ABV21950.1)Cap蛋白基因序列,根据昆虫细胞的偏好,对cap基因进行密码子优化,送至生工生物科技(上海)有限责任公司优化合成。
1.3.2 引物设计和合成 昆虫细胞-杆状病毒表达系统所用pFastBac Dual-HBM载体具有PH和P10两个启动子,因此,应用该表达系统可构建含双目的基因的重组供体质粒。以优化后cap基因为模板,分别针对pFastBacTMDual-HBM载体的PH和P10启动子,进行引物设计,引物序列如表1所示。
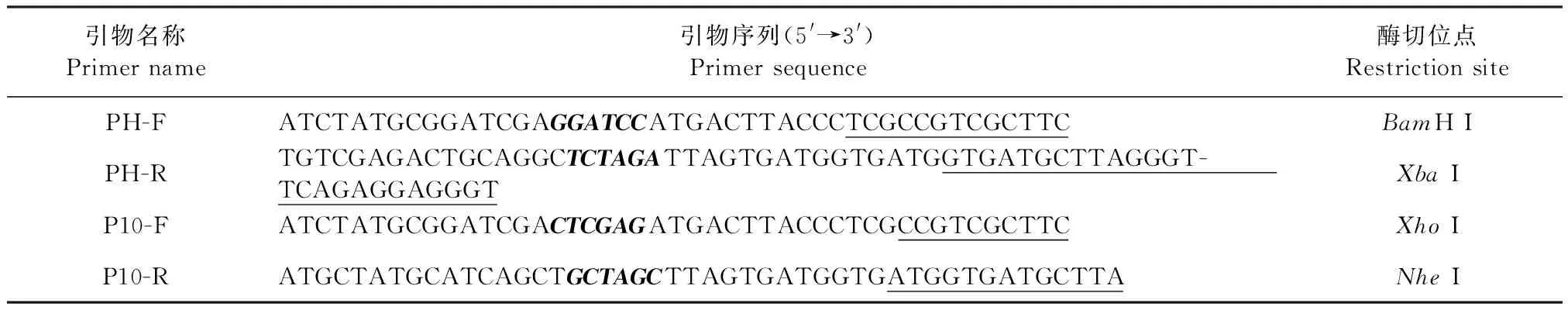
表1 PCR扩增引物序列Table 1 Primer sequences for PCR amplification
1.3.3 目的基因的扩增 以cap基因为模板,分别应用PH-F/R、P10-F/R两对引物进行PCR。PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s、60 ℃退火40 s、72 ℃延伸90 s,共35个循环;72 ℃终延伸10 min。PCR产物经1%琼脂糖凝胶电泳鉴定,回收并测定浓度,分别命名为PH-cap和P10-cap。
1.3.4 重组质粒和穿梭质粒的构建 用限制性内切酶BamH I和XbaI对pFastBac Dual-HBM载体的PH启动子下游序列进行双酶切,并进行纯化回收。利用ClonExpress Mix press无缝克隆酶将纯化回收的载体与PH-cap片段按摩尔比1∶2于50 ℃反应15 min。将连接产物转化DH5α感受态细胞,挑取阳性菌落进行PCR鉴定,并送至生工生物科技(上海)有限责任公司测序,鉴定正确的重组质粒命名为pFB-cap。用限制性内切酶XhoI和NheI对pFB-cap的P10启动子下游基因进行双酶切,采用同样的方式将线性化载体与P10-cap片段进行连接、转化和测序鉴定,构建含有双cap基因的重组质粒pFB-cap-cap。
将测序结果正确的pFB-cap-cap重组质粒转化至DH10Bac感受态细胞,经蓝白斑筛选,将阳性重组子进行PCR鉴定,鉴定正确的重组穿梭质粒命名为rBacmid-cap-cap。
1.3.5 重组杆状病毒的拯救和鉴定 按照Cellfectin®II Reagent脂质体转染试剂盒说明书操作,将穿梭质粒rBacmid-cap-cap转染至Sf9贴壁细胞内,27 ℃培养96 h后通过显微镜观察细胞病变情况,并收获细胞上清病毒液,命名为rBV-cap-cap。将P1代rBV-cap-cap接种Sf9细胞盲传至P3代,收获上清,4 ℃保存备用。收获的重组杆状病毒进行基因组的提取,以全基因组为模板,PH-F/R为引物进行PCR鉴定。
1.3.6 间接免疫荧光试验(Indirect immunofluorescence assay,IFA) 将P3代重组杆状病毒接种至含单层Sf9细胞的24孔板中,27 ℃培养48 h;用-20 ℃预冷的80%冷甲醇室温固定30 min;加入1∶100稀释的本实验室制备的Cap单抗,室温孵育1 h;加入1∶200稀释的FITC标记的羊抗鼠IgG,室温避光孵育1 h,置于荧光显微镜下观察结果。
1.3.7 Western blot 将P3代重组杆状病毒按1∶100体积比接种于Sf9悬浮细胞,27 ℃悬浮培养96 h,收获细胞培养物。将细胞上清、破碎后上清和沉淀分别加入5×上样缓冲液,100 ℃煮沸变性5 min,进行12% SDS-PAGE分离,半干法转印至NC膜上,加入封闭液室温封闭2 h;加入1∶80稀释的本实验室制备的Cap单抗,孵育1 h;加入HRP标记的羊抗鼠IgG,37 ℃孵育1 h;在NC膜上滴加曝光液进行曝光,分析蛋白表达情况。
1.3.8 PCV2d Cap蛋白的纯化和鉴定 将200 mL P3代重组杆状病毒离心,弃去上清,沉淀用PBS重悬,用细胞破碎仪匀浆破碎细胞,匀浆后混合液离心取上清备用。用去离子水清洗层析柱至少3个柱体积,去除柱内20%保存液;用平衡液平衡层析柱至少3个柱体积,直至紫外吸收基线和电导检测基线平稳后,上样200 mL Cap蛋白样品,流速1 mL/min;用平衡液继续淋洗层析柱,直至紫外吸收基线平稳;用洗脱液洗脱Cap蛋白。纯化后的Cap蛋白进行SDS-PAGE鉴定。
1.3.9 Cap蛋白电镜观察 将纯化后的PCV2d Cap蛋白滴加至电镜专用铜网上,室温吸附结合5 min,待铜网干燥后,用1%磷钨酸染色2 min,吸去铜网边缘多余液体,进行电镜观察,鉴定PCV2d VLPs的形态和大小。
2 结果
2.1 目的基因的扩增 以PCV2dcap基因为模板,PH-F/R和P10-F/R分别为引物,进行PCR扩增,均获得726 bp的目的条带(图1),与预计大小相符。
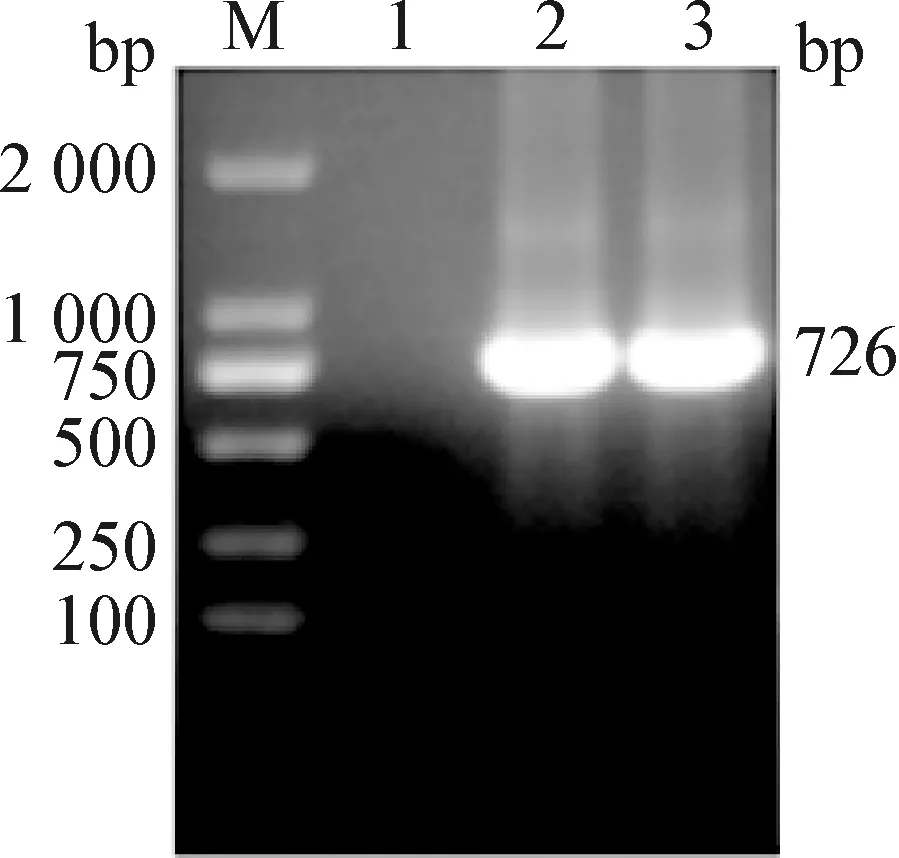
图1 cap基因的PCR扩增Fig.1 PCR amplification of cap geneM:DL-2 000 DNA 相对分子质量标准; 1:阴性对照; 2:PH-cap基因片段; 3:P10-cap基因片段M:DL-2 000 DNA Marker; 1:Negative control; 2:PH-cap gene fragment; 3:P10-cap gene fragment
2.2 重组质粒和重组穿梭质粒的构建 获得的重组质粒pFB-cap-cap经测序鉴定正确。重组穿梭质粒rBacmid-cap-cap的PCR鉴定结果如图2所示,目的片段大小与预期结果相符,表明重组穿梭质粒构建成功。
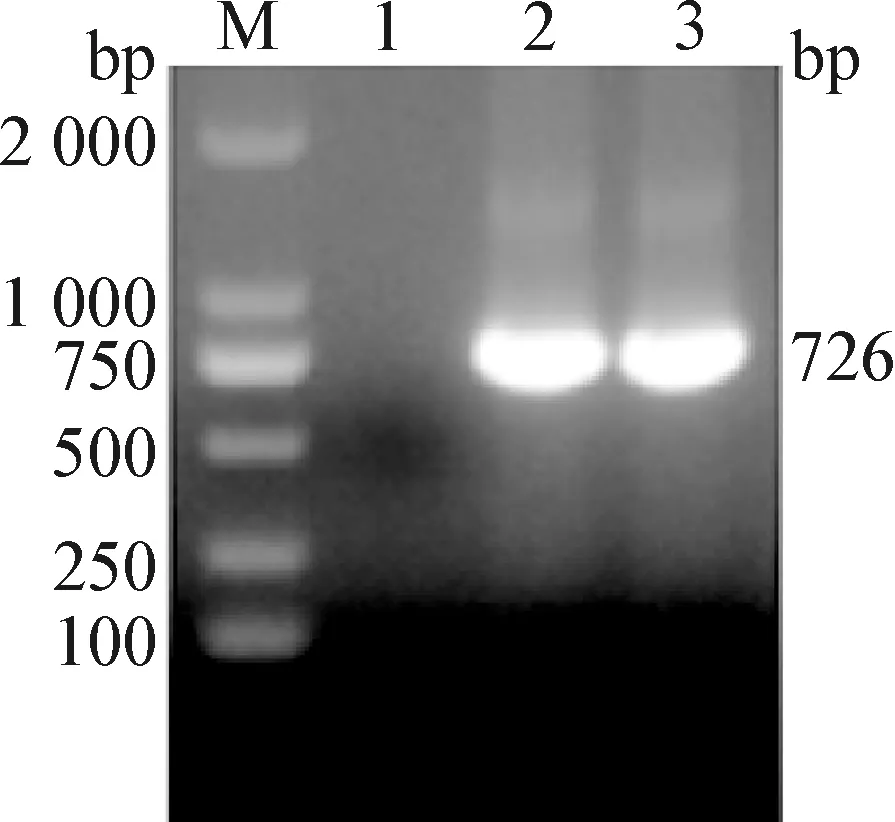
图2 重组穿梭质粒rBacmid-cap-cap的PCR鉴定Fig.2 PCR identification of recombinant bacmid rBacmid-cap-capM:DL-2 000 DNA 相对分子质量标准; 1:阴性对照; 2:PH-cap基因片段; 3:P10-cap基因片段M:DL-2 000 DNA Marker; 1:Negative control; 2:PH-cap gene fragment; 3:P10-cap gene fragment
2.3 重组杆状病毒的拯救和鉴定 重组穿梭质粒转染Sf9细胞约96 h后,通过显微镜观察发现,细胞出现变大变圆并从培养皿中脱落等明显病变现象(图3)。提取P1代rBV-cap-cap基因组DNA经PCR 鉴定为阳性(图4)。
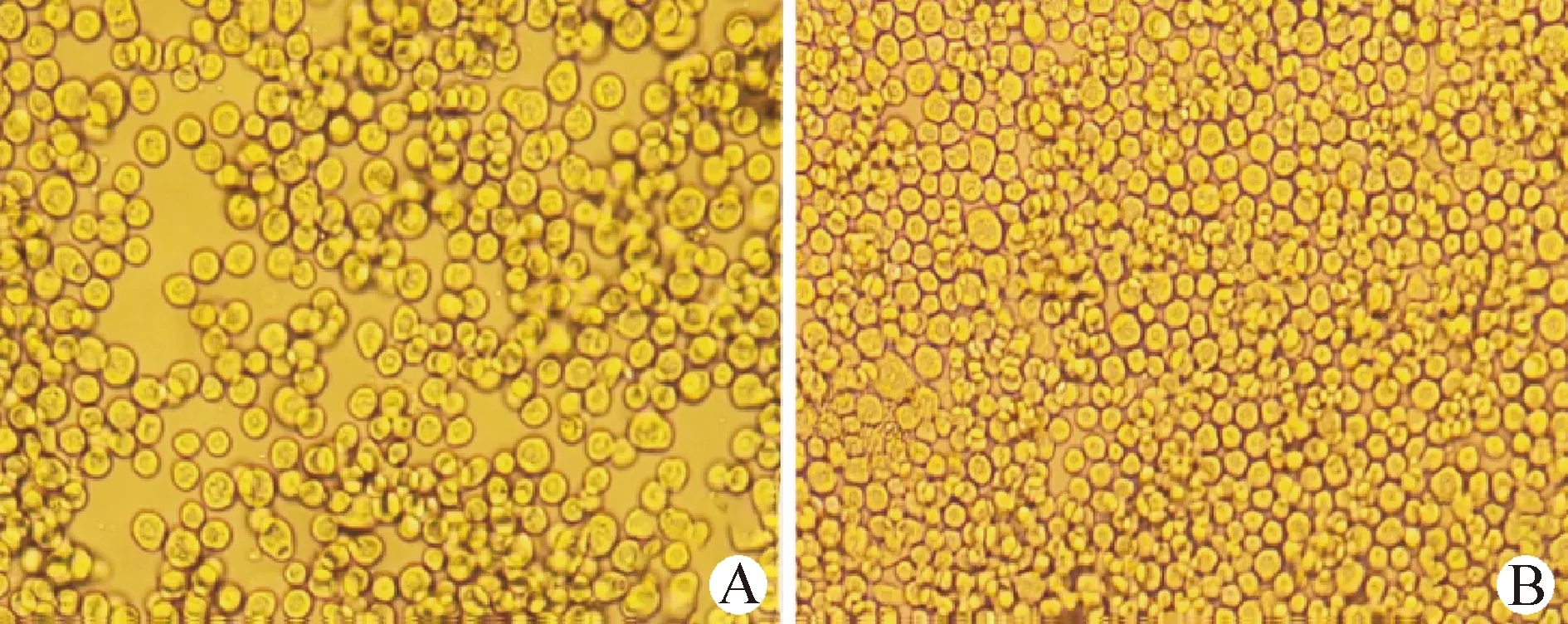
图3 显微镜观察Sf9细胞状态(200×)Fig.3 Microscopic observation of Sf9 cell status (200×)A:Sf9细胞接毒96 h; B:正常Sf9细胞A:Sf9 cells infected for 96 hours; B:Normal Sf9 cells
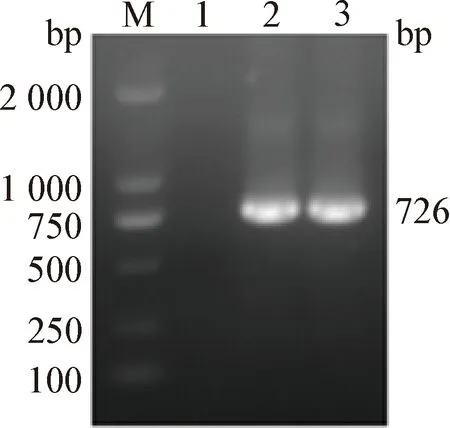
图4 重组杆状病毒rBV-cap-cap的PCR鉴定Fig.4 PCR identification of recombinant baculovirus rBV-cap-capM:DL-2 000 DNA 相对分子质量标准; 1:阴性对照; 2:PH-cap基因片段; 3:P10-cap基因片段M:DL-2 000 DNA Marker; 1:Negative control; 2:PH-cap gene fragment; 3:P10-cap gene fragment
2.4 PCV2d Cap蛋白表达的鉴定 将P3代重组杆状病毒接种贴壁Sf9细胞,27 ℃培养48 h后进行IFA鉴定,结果显示,接种rBV-cap-cap的Sf9细胞在荧光显微镜下能看到明显的绿色荧光,而正常Sf9细胞无绿色荧光(图5)。Western blot鉴定结果显示,细胞培养上清、超声破碎后上清和超声破碎后沉淀均能检测到28 kDa大小的特异性蛋白条带(图6)。以上结果表明,Cap蛋白在Sf9细胞中得到表达,且蛋白可分泌至培养液中,并且表达产物具有一定的反应原性。
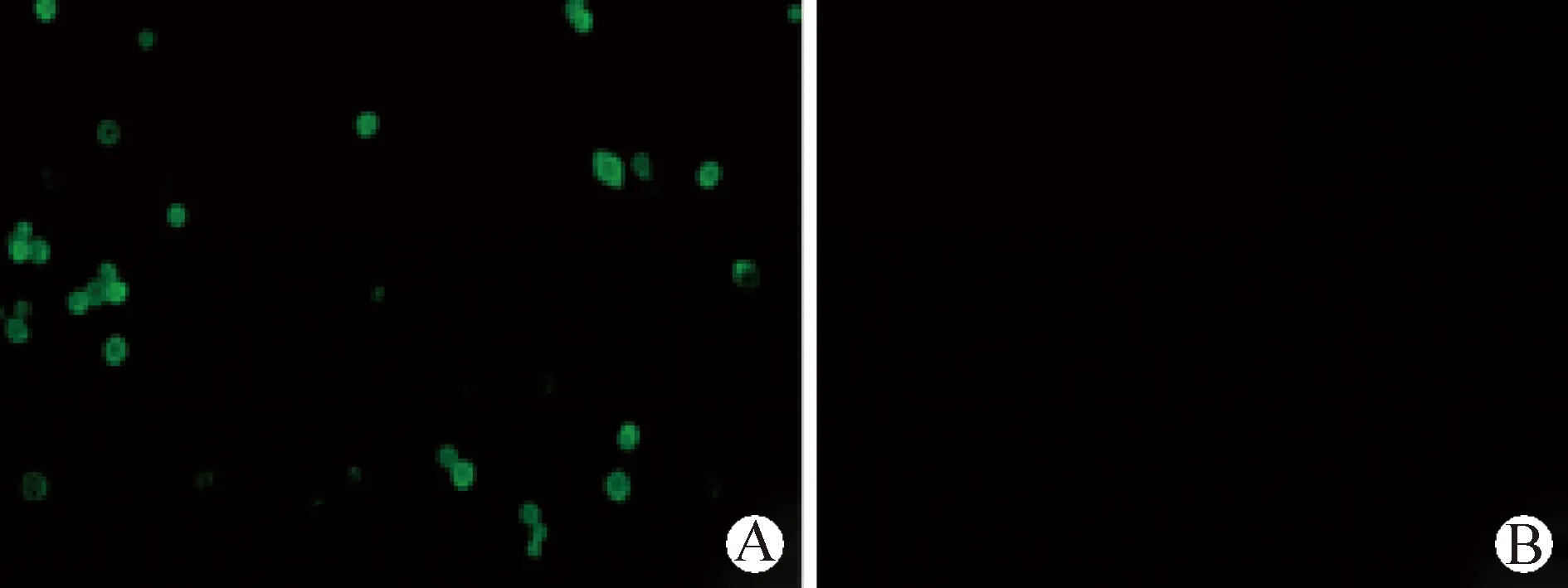
图5 Cap蛋白的间接免疫荧光鉴定(200×)Fig.5 Identification of Cap protein by indirect immunofluorescence assay(IFA) (200×)A:接种rBV-cap-cap的Sf9细胞; B:正常Sf9细胞A:Sf9 cells inoculated with rBV-cap-cap; B:Normal Sf9 cells
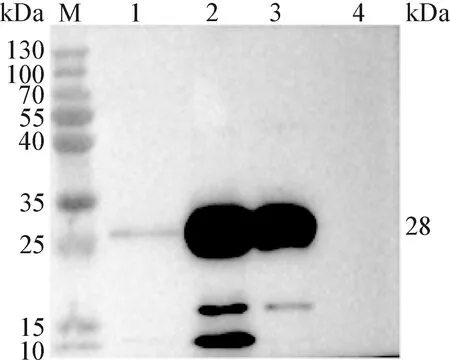
图6 Cap蛋白的Western blot鉴定Fig.6 Identification of Cap protein by Western blotM:蛋白分子量标准; 1~3:分别为接种rBV-cap-cap的Sf9细胞培养上清、超声破碎后上清和超声破碎后沉淀; 4:正常Sf9细胞上清对照M: Protein Marker; 1-3: Culture supernatant, supernatant after ultrasonic disruption, and precipitate after ultrasonic disruption of Sf9 cells inoculated with rBV-cap-cap, respectively; 4: Normal Sf9 cell culture supernatant control
2.5 Cap蛋白的纯化和鉴定 将重组杆状病毒匀浆后收集细胞裂解液上清,经阳离子柱纯化Cap蛋白,利用SDS-PAGE鉴定纯化后的目的蛋白,结果如图7所示,纯化后的样品在28 kDa处有目的条带。
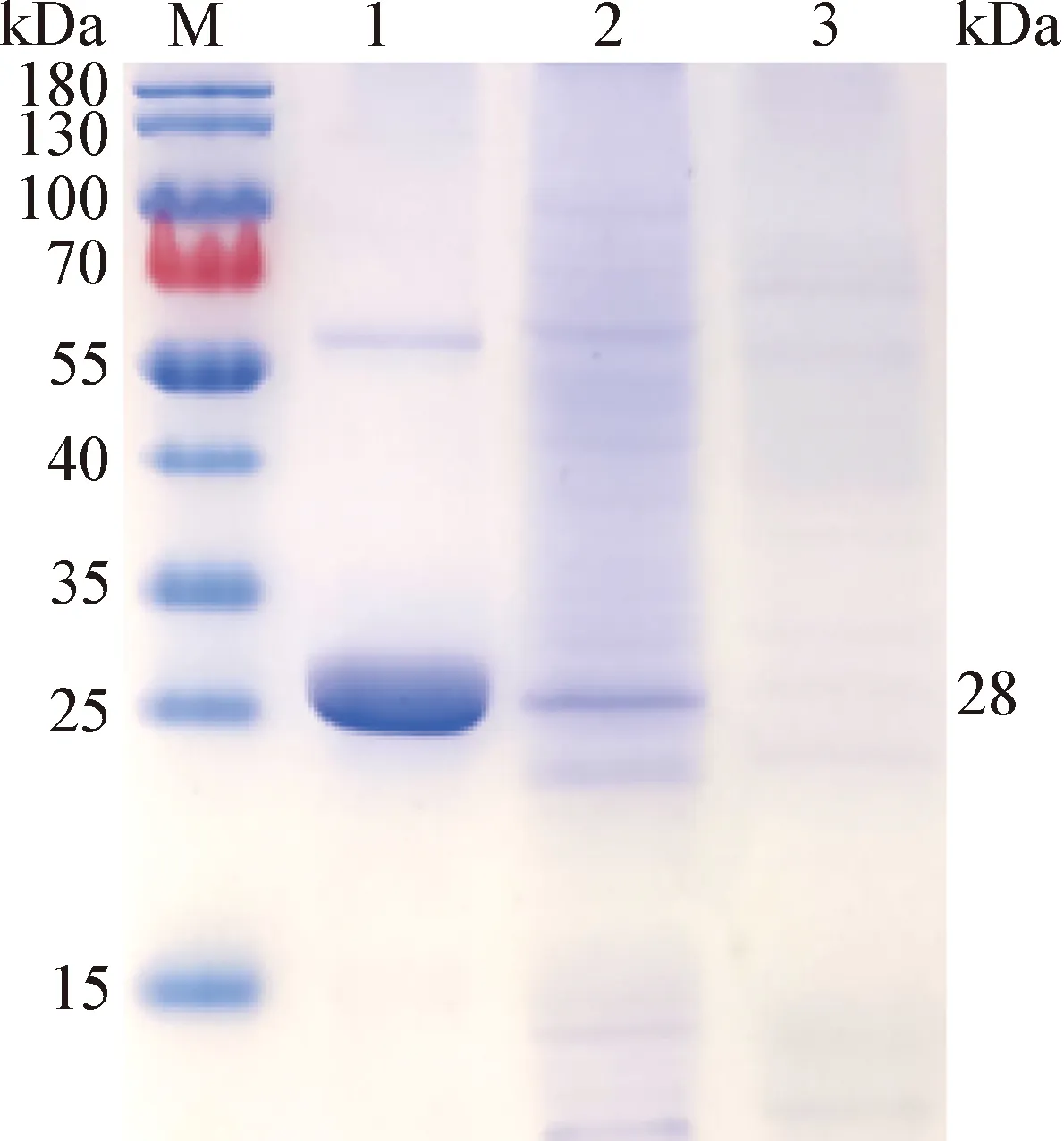
图7 纯化后Cap蛋白的SDS-PAGE鉴定Fig.7 Identification of purified Cap protein by SDS-PAGEM:蛋白分子量标准; 1:纯化后样品; 2:未纯化样品;3:rBV-pFastBac Dual空杆对照M:Protein Marker; 1:Purified sample; 2:Unpurified sample;3:rBV-pFastBac Dual empty control
2.6 Cap蛋白电镜观察 将浓缩纯化后的Cap蛋白进行电镜观察,发现Cap蛋白能够自组装形成大小均一的、直径为17~18 nm的VLPs(图8)。

图8 PCV2d VLPs电镜观察Fig.8 Electron microscopy observation of PCV2d VLPs
3 讨论
PCV2自1998年在我国首次报道以来[12],现已广泛流行于我国各大养猪场,其基因型的遗传演化分析结果显示,目前PCV2a、PCV2b、PCV2d三种基因型共存,以PCV2d为主要优势流行毒株,该毒株可引起更严重的猪圆环病毒相关疾病(Porcine circovirus associated disease,PCVAD)[13]。PCV2主要通过免疫细胞侵入猪体,破坏免疫细胞和机体免疫功能,感染猪的免疫功能较低,无法形成有效的免疫应答来清除循环病毒。因此,对猪进行预防性免疫保护十分重要。目前,市面上的疫苗毒株和PCV2各亚型代表毒株全基因进化树分析显示,大部分疫苗毒株都属于PCV2a和PCV2b亚型,只有SH毒株属于PCV2d亚型[14,15]。针对当前流行毒株PCV2d的疫苗研发,对提高现有疫苗免疫效力具有重大意义。
亚单位疫苗是将已知或者预测的某段或某几段抗原表位插入不同表达体系内大量表达所需多肽抗原的疫苗。Cap蛋白是PCV2唯一的结构蛋白,含有多个PCV2的抗原表位,能够在体外自发形成VLPs。Cap蛋白被证实可以诱导PCV2产生中和抗体,具有良好的免疫原性,成为近年来研制PCV2亚单位疫苗主要的免疫原性蛋白[16]。昆虫细胞杆状病毒表达系统作为一种真核表达体系,可通过糖基化和磷酸化等修饰外源蛋白,使表达产物具有与天然蛋白相似的结构和活性[17],并且杆状病毒本身具有高度的种属特异性,不感染哺乳动物,安全性高,是一种适用于兽用疫苗研究的表达系统[18]。其中,杆状病毒载体灭活疫苗Ingelvac CircoFLEX®已于2006年上市,成为欧洲首个可同时保护仔猪和母猪的PCV2疫苗,英特威公司研制的Circumvent®和先灵葆雅公司研制的Porcilis®PCV灭活疫苗也均已实现商品化。
本试验采用昆虫细胞-杆状病毒表达系统,通过无缝克隆技术成功在体外表达PCV2d Cap蛋白,经验证其能够与PCV2单克隆抗体产生特异性结合,并且能自组装形成VLPs结构,为进一步研究Cap蛋白的功能,研发更高效的PCV2d亚单位疫苗提供了新思路和参考依据。
