外周血T 淋巴细胞亚群及NLR 对进展期胃癌免疫治疗疗效的预测价值分析
2023-10-25王冬慧荀玉芳高晓鹏李文斌
王冬慧 荀玉芳 高晓鹏 郭 玮 李文斌 贾 莉
在中国胃癌是一种常见的恶性肿瘤,由于早期胃癌患者症状缺乏特异性,以及中国未广泛开展胃癌的早期筛查,80%~90%的胃癌患者确诊时已处于进展期[1-2]。多数进展期胃癌患者已失去根治手术的机会,化学治疗、放射治疗等非手术方式则成为延长患者生存期的手段[3]。PD-1 是T 淋巴细胞的调节蛋白,在调节T 淋巴细胞衰竭中发挥着重要作用[4]。随着免疫治疗的发展,以程序性死亡受体-1(PD-1)抑制剂为代表的免疫抑制剂在进展期胃癌的治疗中显示出独特优势[5]。既往研究发现,胃癌患者的细胞免疫处于免疫抑制状态,与健康人群相比,其外周血CD3+、CD4+T 淋巴细胞占比及CD4+/CD8+比值显著降低,CD8+T淋巴细胞占比显著升高[6];经免疫治疗后,CD3+、CD4+T 淋巴细胞占比及CD4+/CD8+比值较治疗前显著升高,CD8+T 淋巴细胞占比则较治疗前显著降低[7]。由此推测,外周血T 淋巴细胞亚群可能与胃癌免疫治疗反应性相关,可作为疗效评价的参考指标。中性粒细胞与淋巴细胞比值(NLR)是反映全身炎症反应的有效指标。研究表明,具有较高的基线NLR 水平的肿瘤患者易出现免疫治疗抵抗,且肿瘤进展风险和患者死亡风险均显著增高[8]。目前尚缺少预测进展期胃癌免疫治疗疗效的有效指标。本研究探讨了外周血T 淋巴细胞亚群及NLR 对进展期胃癌免疫治疗疗效的预测价值,旨在为患者的个性化治疗提供可靠依据。
1 研究对象与方法
1.1 研究对象
选择2020 年11 月至2023 年2 月于山西省运城市中心医院接受免疫治疗的86 例进展期胃癌患者作为研究对象。纳入标准:(1)18~80 岁;(2)经胃镜检查或活体组织病理检查证实为胃腺癌[9];(3)无手术指征,应用PD-1 抑制剂进行免疫治疗,且至少完成1 个疗程;(4)卡氏评分≥60 分,预计生存期3 个月及以上;(5)根据TNM 分期标准[10],患者均为Ⅲ~Ⅳ期;(6)影像学检查结果示至少有1 处可测量病灶。排除标准:(1)除免疫治疗外,还接受了其他抗肿瘤治疗;(2)存在心、肺、肝、肾功能异常;(3)存在免疫缺陷或合并其他恶性肿瘤;(4)合并免疫或代谢性疾病;(5)近3 个月内发生严重感染;(6)合并再生障碍性贫血、骨髓纤维化等影响骨髓造血功能的疾病。入组患者的年龄为33~78 岁,平均年龄为(54.72±8.29)岁,平均卡氏评分为(82.18±10.23)分,平均BMI 为(23.69±3.21)kg/m2; 低分化56 例,中/高分化30 例;有淋巴结转移43 例;TNM 分期Ⅲ期48 例,Ⅳ期38 例。所有患者均签署知情同意书,本研究经医院医学伦理委员会批准(批件号202013)。
1.2 免疫治疗方案
入组患者均应用PD-1 抑制剂进行免疫治疗。用法:每日200 mg 静脉滴注,30 min 输注完毕,以21 d 为1 个疗程,用药至患者不耐受或疾病进展[11-12]。本研究的入组患者均至少完成1 个疗程。
1.3 疗效评价标准
根据实体瘤免疫治疗疗效评价标准(iRECIST)[13]评估疗效,将完全缓解、部分缓解、疾病稳定的患者纳入治疗有效组(n=55),将疾病进展的患者纳入治疗无效组(n=31)。
1.4 T 淋巴细胞亚群及NLR 检测
于免疫治疗前1 日采集所有入组患者的空腹肘静脉血5 mL,置于抗凝管内,分别加入鼠抗人CD4-PC5 单克隆抗体、鼠抗人CD25-FITC 单克隆抗体、鼠抗人CD127-PE 单克隆抗体、三色荧光单克隆抗体CD4-FITC/CD8-PE/CD3-PC5、鼠抗人CD16+CD56-PE/CD19-PC5/CD3-FITC 荧光单克隆抗体(以上抗体均购自美国Beckman Coulter 公司),避光孵育15 min;滴加500 μL 溶血剂(购自美国Beckman Coulter 公司),室温下充分裂解红细胞15 min;加入2 mL PBS 溶液,混匀后,1 300 r/min离心5 min,弃上清;加入500 μL PBS 溶液,使用FC500 型流式细胞仪(购自美国Beckman Coulter 公司)进行分析。
于免疫治疗前1 日采集所有入组患者的空腹肘静脉血2 mL,使用BC-2600 型全自动血液细胞分析仪 (购自深圳迈瑞生物医疗电子股份有限公司)测定中性粒细胞计数和淋巴细胞计数,计算NLR。
1.5 随访
采用电话和门诊复查的方式对患者进行随访,起始时间为接受免疫治疗的当日,每月1 次,随访截止时间为2023 年3 月1 日,终点事件为病情进展或患者死亡。随访期间无患者失访。
1.6 统计学方法
应用SPSS 20.0 软件对数据进行统计学分析。符合正态分布的计量资料以均数±标准差(±s)表示,2 组间比较采用独立样本t检验。计数资料以例(%)表示,组间比较采用卡方检验。采用多因素logistic 回归模型分析进展期胃癌免疫治疗疗效的影响因素。采用ROC 曲线分析T 淋巴细胞亚群及NLR 对进展期胃癌免疫治疗疗效的预测价值。P<0.05 为差异有统计学意义。
2 结果
2.1 外周血T 淋巴细胞亚群水平与进展期胃癌免疫治疗疗效的关系
以CD3+T 淋巴细胞(872 个/μL)、CD4+T 淋巴细胞(521 个/μL)、CD8+T 淋巴细胞(414 个/μL)水平及CD4+/CD8+比值(1.38)的中位数为临界值,将CD3+T 淋巴细胞水平≥872 个/μL 者纳入高CD3+组,<872 个/μL 者纳入低CD3+组;CD4+T 淋巴细胞水平≥521 个/μL 者纳入高CD4+组,<521 个/μL 者纳入低CD4+组;CD8+T 淋巴细胞水平≥414 个/μL 者纳入高CD8+组,<414 个/μL者纳入低CD8+组;CD4+/CD8+比值≥1.38 者纳入高CD4+/CD8+组,<1.38 者纳入低CD4+/CD8+组。结果显示,高CD3+组的治疗有效率显著高于低CD3+组,高CD4+组的治疗有效率显著高于低CD4+组,高CD4+/CD8+组的治疗有效率显著高于低CD4+/CD8+组,组间比较差异均有统计学意义(P均<0.05);高CD8+组与低CD8+组的治疗有效率差异无统计学意义(P>0.05)。见表1。
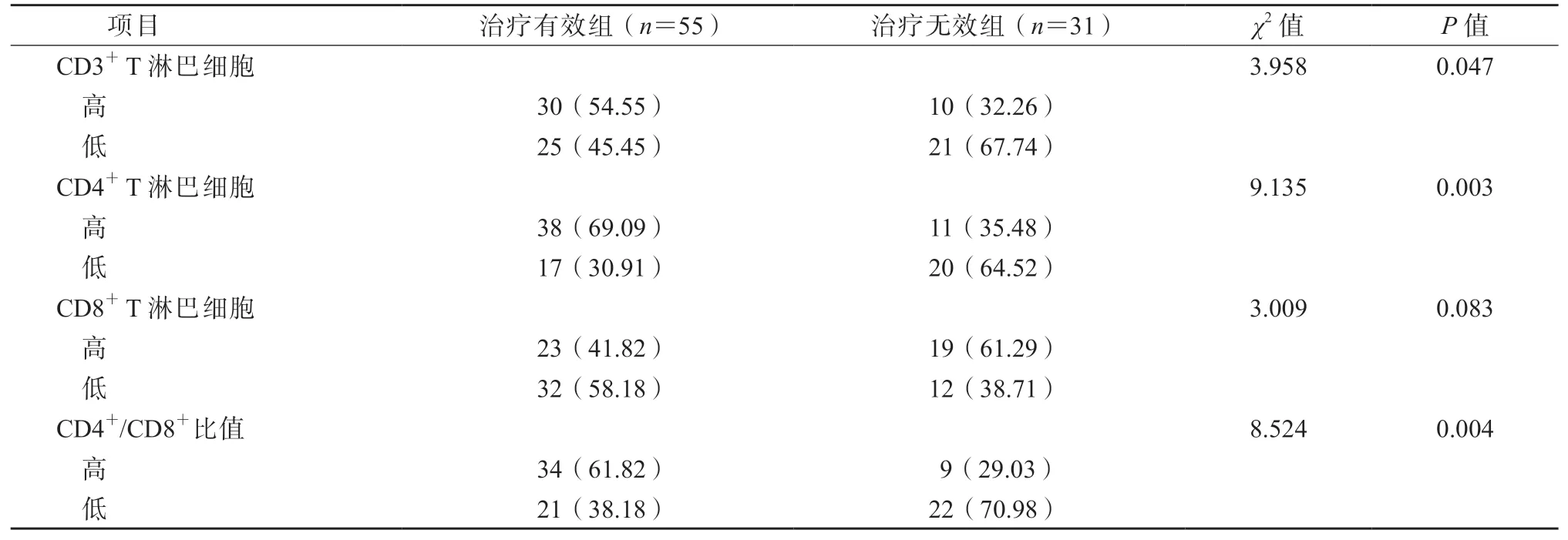
表1 外周血T 淋巴细胞亚群水平与进展期胃癌免疫治疗疗效的关系/例(%)
2.2 NLR 与进展期胃癌免疫治疗疗效的关系
以NLR 的中位数(3.3) 为临界值, 将NLR ≥3.3 的患者纳入高NLR 组,<3.3 的患者纳入低NLR 组。结果显示,低NLR 组的治疗有效率显著高于高NLR 组,差异有统计学意义(P<0.05)。见表2。
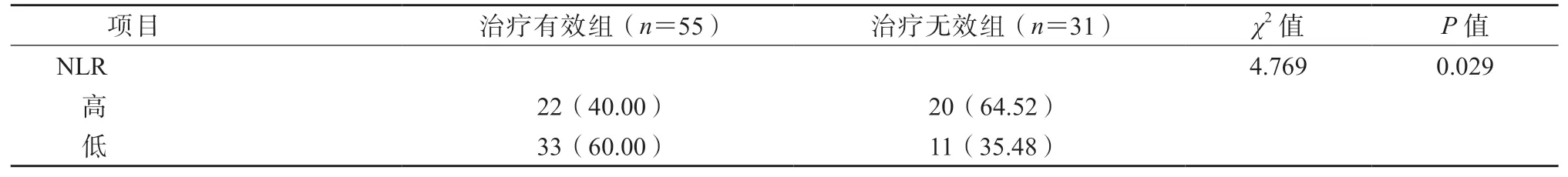
表2 NLR 与进展期胃癌免疫治疗疗效的关系/例(%)
2.3 影响进展期胃癌免疫治疗疗效的单因素分析
单因素分析结果显示,分别与低分化、有淋巴结转移的患者比较,中/高分化、无淋巴结转移患者的治疗有效率均显著升高,差异均有统计学意义(P均<0.05)。不同年龄、BMI、TNM 分期患者的免疫治疗疗效差异均无统计学意义(P均>0.05)。见表3。
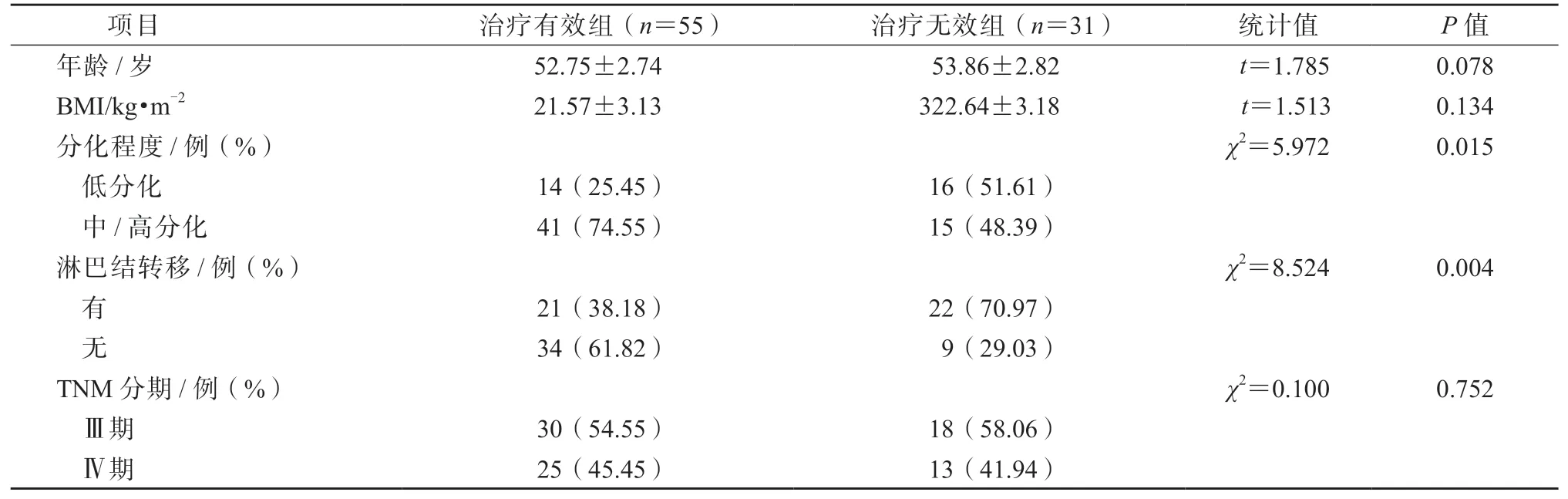
表3 外周血T 淋巴细胞亚群水平与进展期胃癌免疫治疗疗效的关系/例(%)
2.4 影响进展期胃癌免疫治疗疗效的多因素logistic 回归模型分析
以免疫治疗的疗效(有效=1,无效=0)作为因变量,将CD3+T 淋巴细胞 (≥872 个/μL=1,<872 个/μL=0)、CD4+T 淋巴细胞 (≥521 个/μL=1,<521 个/μL=0)、CD4+/CD8+比值(≥1.38=1,<1.38=0)、NLR(≥3.3=1,<3.3=0)、分化程度(中/高分化=1,低分化=0)、淋巴结转移(无=1,有=0)作为自变量,纳入多因素logistic回归模型分析,结果显示CD3+T 淋巴细胞、CD4+T 淋巴细胞、CD4+/CD8+比值、NLR、分化程度、淋巴结转移均是影响进展期胃癌免疫治疗疗效的独立危险因素(P均<0.05)。见表4。
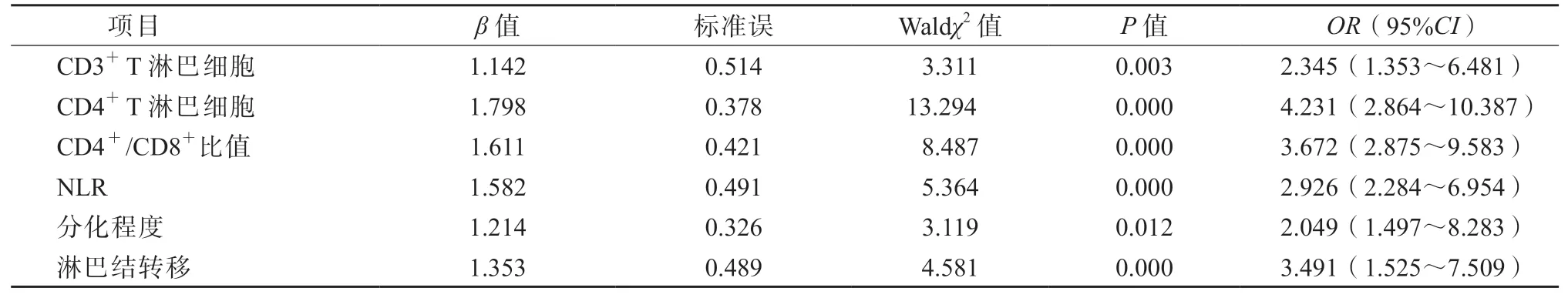
表4 影响进展期胃癌免疫治疗疗效的多因素logistic 回归模型分析
2.5 T 淋巴细胞亚群及NLR 对进展期胃癌免疫治疗疗效的预测价值
ROC 曲线分析结果显示,外周血T 淋巴细胞亚群及NLR 对进展期胃癌免疫治疗疗效均有一定的预测价值,其中CD4+T 淋巴细胞、CD4+/CD8+比值、NLR 和CD3+T 淋巴细胞的AUC 均>0.6。见表5、图1。
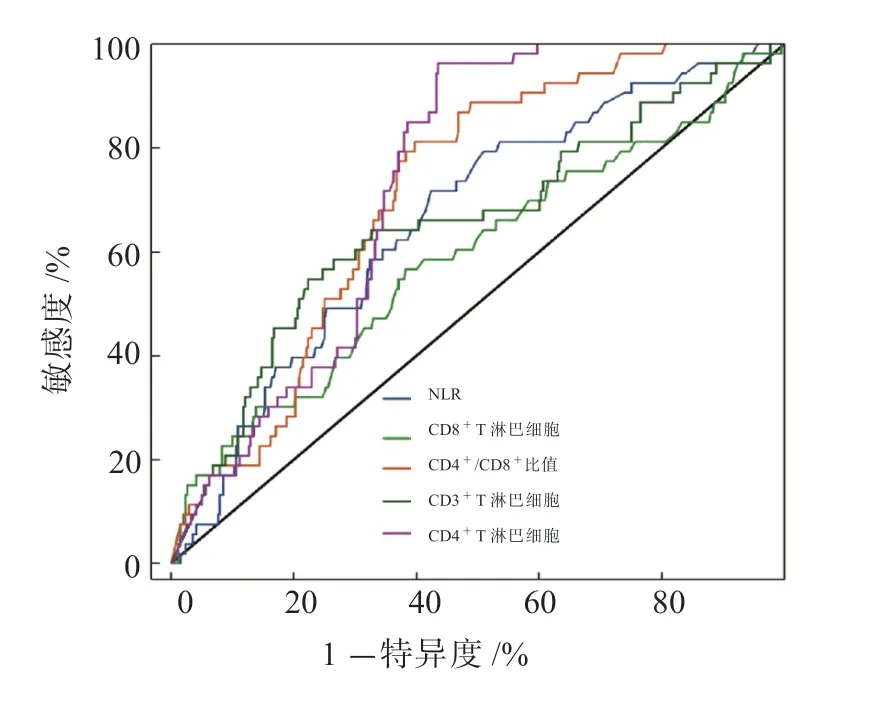
图1 T 淋巴细胞亚群和NLR 预测进展期胃癌免疫治疗疗效的ROC 曲线
3 讨论
流行病学研究显示,在中国胃癌的发病率和病死率均居恶性肿瘤第3 位,疾病的社会负担较重[14]。有研究报道,胃癌患者的5 年生存率仅为49.48%,处于较低水平[15]。根治术是目前胃癌患者获得长期生存的唯一方法,但由于多数患者确诊时疾病处于进展期,已失去手术机会,故化学治疗、放射治疗和靶向治疗等手段成为进展期胃癌的重要治疗方式[16]。肿瘤免疫治疗是近年来快速发展的新一代治疗方法,具有较好的应用前景。研究表明,以PD-1 抑制剂为代表的免疫治疗方案在进展期胃癌的治疗中发挥了重要作用[17]。不同于靶向治疗,进展期胃癌免疫治疗目前尚未有明确的疗效预测因子[18]。因此,寻求对进展期胃癌免疫治疗疗效具有良好预测价值的因子,对指导临床治疗具有重要意义。
T 淋巴细胞亚群是机体重要的免疫细胞群,在恶性肿瘤的发生和进展中具有重要作用[19]。研究表明,外周血T 淋巴细胞亚群水平的测定有助于评估胃癌患者的病情及预后,可为临床治疗和预后判断提供可靠依据[6]。本研究结果显示,高CD3+、CD4+T 淋巴细胞水平及高CD4+/CD8+比值的患者的治疗有效率高于低水平者;且多因素logistic 回归模型分析显示,CD3+T 淋巴细胞、CD4+T 淋巴细胞、CD4+/CD8+比值均是影响进展期胃癌免疫治疗疗效的独立危险因素,这提示T 淋巴细胞水平较低可影响进展期胃癌患者的免疫应答,从而促使肿瘤进展。
随着免疫治疗的广泛应用,其相关的不良反应逐渐成为临床医生关注的焦点。研究发现,炎症是免疫相关不良反应的发生机制之一。经免疫治疗后,炎症因子被大量释放,可引起炎症因子风暴,进而影响疗效,甚至威胁患者生命[20]。NLR 是一项炎症/免疫相关指标。Hwang 等[21]的研究发现,NLR 与肿瘤内T 淋巴细胞重塑相关,且免疫检查点阻断期间高NLR 与肿瘤转移及治疗反应相关。本研究结果显示,低NLR 组的治疗有效率显著高于高NLR 组,且多因素logistic 回归模型分析显示,NLR 是影响进展期胃癌免疫治疗疗效的独立危险因素,这符合以往的研究结果[20]。本研究还发现,分化程度、淋巴结转移亦是影响进展期胃癌免疫治疗疗效的独立危险因素,在临床上还需进行综合分析。ROC 曲线分析结果显示,外周血T 淋巴细胞亚群及NLR 对进展期胃癌免疫治疗疗效均有一定的预测价值,其中CD4+T 淋巴细胞、CD4+/CD8+比值、NLR、CD3+T 淋巴细胞的AUC 均>0.6,临床上可根据实际情况进行选择。
综上所述,外周血T 淋巴细胞亚群和NLR 均可作为预测进展期胃癌免疫治疗疗效的生物标志物,具有临床推广价值。本研究存在不足之处:(1)样本量较小,拟在今后扩大样本量进一步探讨;(2)本研究仅针对PD-1 抑制剂的疗效预测进行分析,下一步将对其他免疫治疗方案进行探讨,以进一步证实外周血T 淋巴细胞亚群及NLR 在进展期胃癌免疫治疗疗效预测中的价值;(3)随访时间较短,无法明确上述指标对远期疗效的预测价值,拟在今后的研究中延长随访时间,进一步观察。
