血清4型禽腺病毒广西分离株单克隆抗体的制备及鉴定
2023-10-25谢丽基邓显文谢芝勋谢志勤罗思思黄娇玲张民秀曾婷婷张艳芳
谢丽基,邓显文,谢芝勋,韦 悠,谢志勤,罗思思,李 孟,黄娇玲,张民秀,范 晴,王 盛,曾婷婷,张艳芳
(广西壮族自治区兽医研究所,广西兽医生物技术重点实验室,农业农村部中国(广西)-东盟跨境动物疫病防控重点实验室,南宁 530001)
血清4型禽腺病毒(Fowl adenovirus serotype 4, FAdV-4)是引起高致病性和高传染性心包积液肝炎综合征的病原,感染的家禽出现急性死亡,病死率为20%~80%[1]。FAdV-4 感染能够导致宿主免疫抑制,由此导致的免疫失败、继发感染、混合感染进一步加剧了心包积液肝炎综合征的危害[2]。2015年以前,该病在我国多地零星发现,但自2015年6月起,该病在我国河南、河北、安徽、山东、广东、广西和江苏等多个省份呈暴发式流行[3-5]。
现有的禽腺病毒检测方法主要有病毒分离鉴定、血清学诊断和分子生物学检测方法。病毒分离鉴定检测周期长,不利于大规模检测;血清学方法中比较常用的为ELISA检测方法,如基于禽腺病毒Hexon、Fiber-1和Fiber-2等基因的原核表达蛋白为包被抗原建立的间接ELISA方法[6-8];禽腺病毒分子生物学检测方法有PCR、限制性内切酶分析、实时荧光定量PCR、环介导等温核酸扩增技术(LAMP)等,可用于禽腺病毒感染早期的诊断[9]。
当前,国内除FAdV-4外,FAdV-8a、FAdV-8b、FAdV-10及FAdV-11等血清型在我国鸡群中也均有流行和感染的报道[10-11],多血清型的流行给该病的检测和防控带来很大挑战。据报道,研究人员从某些禽用弱毒疫苗中检测到了FAdV-4[12-13],对养禽业产生巨大危害。因此,迫切需求建立能快速鉴别诊断FAdV-4的检测方法。本研究以FAdV-4广西分离株(FAdV-4-GX2018-005)作为免疫原免疫小鼠,经过ELISA筛选,成功研制了能特异性识别FAdV-4的单克隆抗体,为开展FAdV-4污染的检测及相关疾病诊断提供储备。
1 材料和方法
1.1 实验材料 SPF级雌性BALB/c小鼠购自广西医科大学实验动物中心;FAdV-4-GX2018-005病毒、骨髓瘤SP2/0细胞、FAdV-4 18个分离株(2015年后分离自不同年份、广西不同市县)、血清1~11型禽腺病毒、新城疫病毒(NDV)、禽呼肠孤病毒(ARV)、减蛋综合症病毒(EDSV)和传染性支气管炎病毒 (IBV)由广西兽医生物技术重点实验室保存;弗氏完全佐剂、弗氏不完全佐剂、HAT选择培养基、灭活剂β-丙内酯、PEG4000融合试剂和鼠源MAb亚类鉴定试剂盒均购自Sigma公司;胎牛血清购自Invitrogen公司;DMEM/F12培养基购自Hycon公司;BW-V1160 ViraTrapTMAdenovirus Purification Miniprep Kit购自Biomiga公司;Protein G Resin购自北京全式金生物技术股份有限公司;HRP 和FITC标记的山羊抗小鼠 IgG 抗体购自深圳晶美生物工程有限公司。
1.2 FAdV-4-GX2018-005的培养及纯化浓缩 使用18日龄的SPF鸡胚,制备SPF鸡胚肝细胞[14]。将SPF鸡胚肝细胞在75 cm2细胞培养瓶中培养至90%,接种0.1 mL保存的FAdV-4-GX2018-005病毒,作用1 h后,用PBS 洗涤2~3次,加入含2.5%胎牛血清的DMEM/F-12,培养观察2~3 d,细胞出现变圆,并有60%的细胞发生脱落时,将细胞培养瓶置于-80 ℃中反复冻融3次,通过0.22 μm的过滤器过滤收集病毒上清液,参照BW-V1160 Vira TrapTM Adenovirus Purification Miniprep Kit试剂盒说明书,对FAdV-4-GX2018-005病毒进行纯化浓缩,测定TCID50。
1.3 单克隆抗体检测方法的建立 以FAdV-4-GX2018-005全病毒(TCID50=10-7.125)作为包被抗原,参照刘延珂等[15]的方法,经方阵试验优化包被抗原浓度、二抗(HRP 标记的山羊抗小鼠IgG抗体)浓度和显色时间等,建立FAdV-4-ELISA检测方法。具体的方法如下:以FAdV-4作为包被抗原,100 μL/孔,4 ℃过夜;PBST(含0.05%吐温的PBS)洗涤3次;2%牛奶的PBS进行封闭,200 μL/孔,37 ℃孵箱中2 h,用PBST(含0.05%吐温的PBS)洗涤3次;加入杂交瘤细胞培养上清、阴性对照(其它对照病毒的阳性血清)、空白对照(PBS)、阳性对照(FAdV-4阳性血清)作为一抗,100 μL/孔,37 ℃孵育1 h;用PBST(含0.05%吐温的PBS)洗涤3次;加入HRP 标记的山羊抗小鼠IgG抗体作为二抗,100 μL/孔,37 ℃孵育1 h;用PBST(含0.05%吐温的PBS)洗涤3次,加入显色液显色10 min,每孔加入50 μL终止液(含2 mol/L硫酸)终止。在波长450 nm下测吸光值。
1.4 单克隆抗体的制备与鉴定
1.4.1 动物免疫及细胞融合 将纯化的FAdV-4-GX2018-005病毒(稀释为107TCID50/mL)用灭活剂β-丙内酯灭活后,按1∶1的等体积比例与弗氏完全佐剂混合乳化作为免疫抗原,多点皮下(0.5 mL/只,病毒剂量为2.5×106TCID50)注射免疫6~8周雌性BALB/c小白鼠。首免后21 d和35 d,按1∶1的比例等体积将弗氏不完全佐剂与FAdV-4-GX2018-005病毒混合乳化后进行加强免疫。首免后49 d采血测抗体效价,选抗体效价最高的BALB/c小白鼠,在细胞融合前3 d用灭活FAdV-4-GX2018-005病毒(不加佐剂)经腹腔注射加强免疫。
1.4.2 细胞融合 无菌取免疫小鼠脾脏放入细胞筛,做成脾细胞悬液,计算细胞数,按5∶1的比例将脾细胞与骨髓瘤细胞Sp2/0进行混合,使用PEG4000融合试剂(50%的比例)进行细胞融合试验,具体融合方法参照参考文献[16]进行。
1.4.3 杂交瘤细胞筛选 用HAT选择培养基(含次黄嘌呤、氨基蝶呤、胸腺嘧啶脱氧核苷)培养融合细胞,在融合后9 d、12 d、15 d收集细胞培养上清液。使用FAdV-4-ELISA,对融合细胞的上清液进行检测。将ELISA检测为阳性的细胞孔,用有限稀释法连续进行3次单细胞亚克隆。亚克隆的细胞培养10 d后,收集细胞上清液进行FAdV-4-ELISA检测。将分泌抗体效价高且效价稳定的细胞株进行冻存保种。
1.4.4 单克隆抗体生物学特性分析 抗体分泌稳定性的分析:在液氮中冻存3个月、6个月后,将阳性杂交瘤细胞连续传代3次后,收集上清液,用ELISA方法检测FAdV-4单克隆抗体的效价,测定阳性杂交瘤细胞分泌抗体的能力。
腹水抗体效价检测:经腹腔注射8周龄BALB/c小白鼠1 mL灭菌注射级白油,7~14 d后腹腔注射2×106个对数生长期的阳性杂交瘤细胞,密切观察BALB/c小白鼠的健康状况与腹水征象,接种细胞7~10 d后可产生腹水,收获的腹水参照Protein G Resin柱说明书进行纯化后,进行效价测定。
单克隆抗体亚类鉴定:收集阳性杂交瘤细胞的上清液,按照鼠源MAb亚类鉴定试剂盒说明书的操作步骤,对FAdV-4单克隆抗体进行亚类鉴定。
1.4.5 单克隆抗体特异性检测 参照刘延珂等[15]的方法,以禽腺病毒其他血清型毒株(FAdV-1~FAdV-11)、NDV、ARV、EDSV和IBV等病毒作为包被抗原,腹水纯化后的FAdV4单克隆抗体为一抗,进行ELISA检测,评价FAdV-4单克隆抗体的特异性。以18株FAdV-4分离株(不同时间不同养殖场分离的病毒)作为包被抗原,腹水纯化后的FAdV-4单克隆抗体为一抗,进行ELISA检测,评价FAdV-4单克隆抗体的广谱性。
1.4.6 间接免疫荧光试验(IFA) 将SPF鸡胚肝细胞在12孔细胞培养板培养至90%,接种104TCID50FAdV-4-GX2018-005病毒,感染1.5 h后,用PBS冲洗2次,用含2.5%胎牛牛血清的DMEM/F12培养基继续培养48 h,吸弃培养液,用冰预冷甲醛固定细胞,以腹水纯化后的FAdV-4单克隆抗体作为一抗,37 ℃温育1 h,以FITC标记的山羊抗小鼠 IgG 抗体作为二抗,同时设立阴性对照组,37 ℃温育1 h,洗涤3次,晾干,荧光显微镜下观察和拍照结果。阴性对照为SPF鸡胚肝细胞不接种FAdV-4-GX2018-005,直接用FAdV-4单克隆抗体进行IFA试验。
2 结果与分析
2.1 FAdV-4-GX2018-005的纯化浓缩 FAdV-4-GX2018-005病毒,经BW-V1160 ViraTrapTMAdenovirus Purification Miniprep Kit纯化浓缩后,TCID50为107.125/mL。
2.2 单克隆抗体检测方法的建立 FAdV-4-GX2018-005全病毒包被抗原的浓度为104TCID50(100 μL/孔),4 ℃过夜;封闭条件:2%牛奶的PBS进行封闭,200 μL/孔,37 ℃孵箱中2 h;单抗(杂交瘤细胞上清/腹水)37 ℃孵育1 h;山羊抗小鼠IgG抗体的作用浓度为1∶1000,37 ℃孵育1 h;底物显色时间为10 min。阳性判断标准为待检血清OD450nm大于0.102,小于0.102为阴性。
2.3 杂交瘤细胞的筛选 将FAdV-4-GX2018-005免疫的BALB/c小白鼠脾脏细胞与骨髓瘤细胞Sp2/0进行细胞融合后,用建立的FAdV-4-ELISA检测方法,对第9天、第12天、第15天融合细胞上清液进行检测筛选,获得43个阳性抗体孔,选择其中24个OD值阳性孔进行亚克隆化,经过3次亚克隆化和筛选,共获得3株阳性杂交瘤细胞见图1(3A3、13A11和4D5)。

A:3A3杂交瘤细胞;B:13A11杂交瘤细胞;C:4D5杂交瘤细胞图1 3株杂交瘤细胞Fig 1 Three hybridomas
2.4 单克隆抗体生物学特性分析 抗体分泌稳定性试验结果显示,3A3、13A11和4D5这3株杂交瘤细胞冻存3、6个月后复苏传代,经FAdV4-ELISA检测杂交瘤细胞株培养上清液,3株细胞抗体ELISA效价达28以上,3株杂交瘤细胞株抗体分泌稳定性良好。腹水抗体效价检测结果显示,3株杂交瘤细胞均能诱导小鼠产生高效价抗体,效价达到220以上。单克隆抗体亚类的鉴定结果(表1)显示,3A3杂交瘤细胞分泌的抗体重链为IgG2a亚类,轻链为K链;13A11和4D5杂交瘤细胞分泌的抗体重链为IgG2b亚类,轻链为K链。
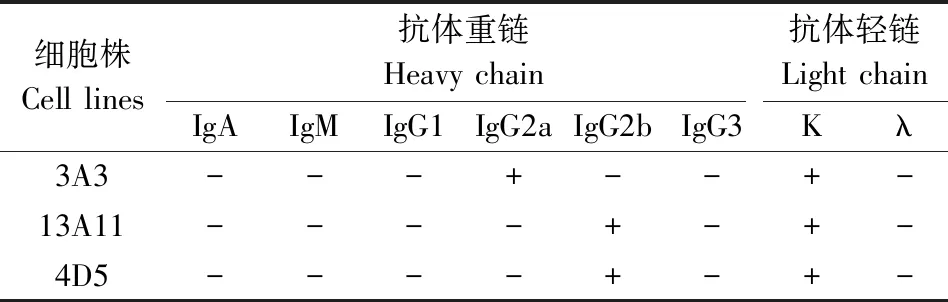
表1 单克隆抗体亚类鉴定结果Tab 1 Subclass of monoclonal antibody
2.5 单克隆抗体特异性检测结果 以不同血清型FAdV及NDV、ARV、EDSV和IBV病毒作为包被抗原,对3株阳性杂交瘤细胞(3A3、13A11和4D5)制备的单克隆抗体进行ELISA检测,结果(表2)表明,3A3、13A11和4D5杂交瘤细胞制备的单克隆抗体,只与FAdV-4-GX2018-005毒株产生良好反应,与其它血清型FAdV及NDV、ARV、EDSV、IBV无交叉反应,说明3株阳性杂交瘤细胞制备的抗体具有良好的特异性(表2)。
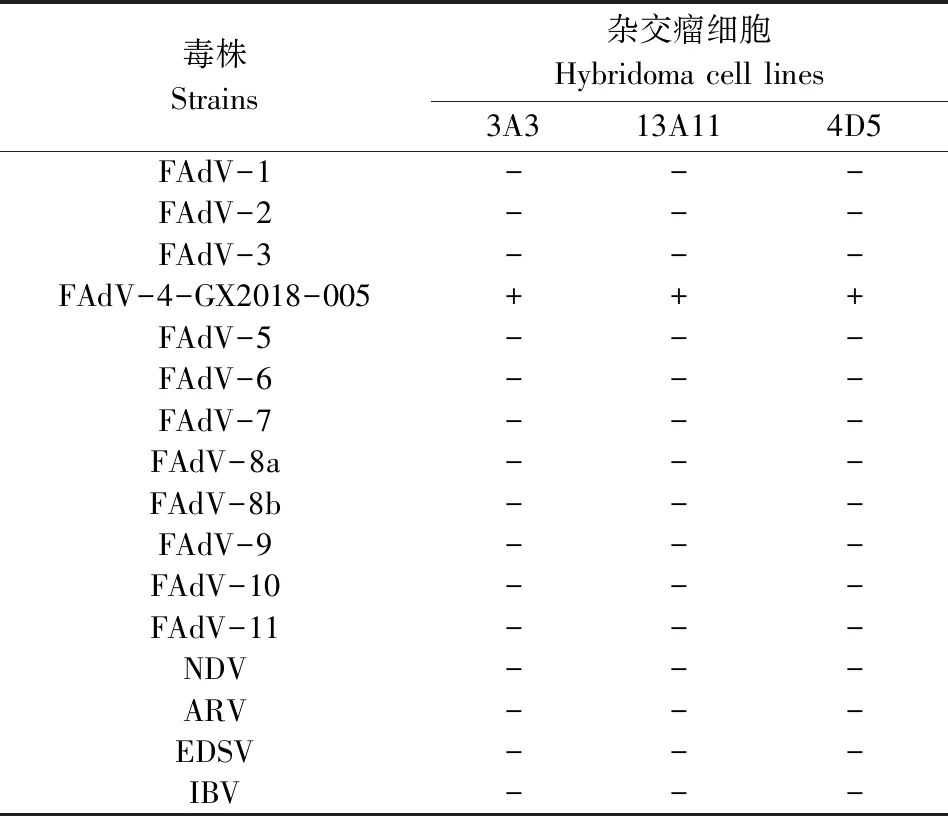
表2 单克隆抗体的特异性检测Tab 2 The specificity detection of MAbs
以本实验室保存的18株FAdV-4分离株为包被抗原,对3株阳性杂交瘤细胞(13A3、13A11和4D5)制备的单克隆抗体进行ELISA检测,结果(表3)表明,3A3、13A11和4D5杂交瘤细胞制备的抗体,与18株FAdV-4分离株产生阳性反应,说明本研究制备的单克隆抗体与FAdV-4分离株的反应具有广谱性。

表3 单克隆抗体对18株FAdV-4分离株的检测结果Tab 3 The specificity detection of MAbs to 18 FAdV-4 strains
2.6 间接免疫荧光试验 以3株杂交瘤细胞(3A3、13A11和4D5)制备的单克隆抗体作为一抗,对感染FAdV-4-GX2018-005的细胞进行IFA检测,荧光显微镜下观察发现,FAdV-4-GX2018-005感染的细胞中有明亮的绿色荧光,阴性对照细胞中未见绿色荧光(图2)。
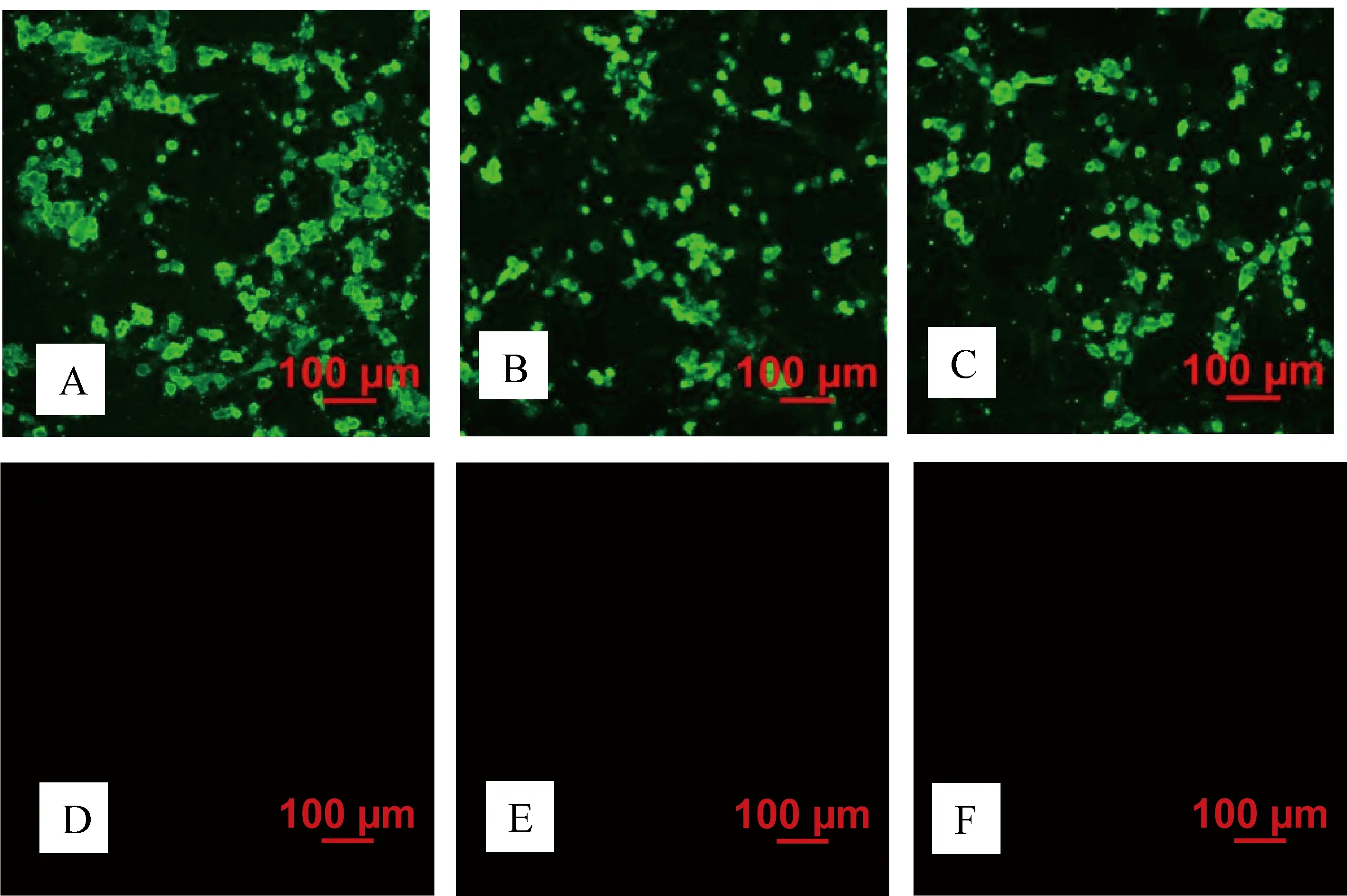
A:3A3株单抗+FAdV-4-GX2018-005;B:13A11株单抗+FAdV-4-GX2018-005;C:4D5株单抗+FAdV-4-GX2018-005;D:3A3株对照;E:13A11株对照;F:4D5株对照A:MAbs of cell line3A3+FAdV-4-GX2018-005;B:MAbs of cell line 13A11+FAdV-4-GX2018-005;C:MAbs of cell line 4D5+FAdV-4-GX2018-005;D:Negative control of 3A3;E:Negative control of 13A11;F:Negative control of 4D5图2 FAdV-4单克隆抗体的IFA试验结果Fig 2 IFA result of FAdV-4 MAbs
3 讨 论
目前对于FAdV-4单克隆抗体的研究,均以penton、Fiber 2和Hexon这三个主要的结构蛋白为免疫原研制的。王萍等以FAdV-4全病毒免疫小鼠后,以Fiber-2原核表达产物为筛选抗原研发Fiber-2单克隆抗体[17],该单克隆抗体与FAdV-4反应为阳性,FAdV-8为阴性,其它血清型的FAdV的反应性未确定。刘娜等用Fiber-2和Hexon蛋白筛选单克隆抗体并研制胶体金试纸,该单克隆抗体与FAdV-4反应为阳性,其它血清型的FAdV的反应性未确定[18]。侯力丹等将penton基因的原核表达蛋白为抗原免疫小鼠,筛选制备了penton单克隆抗体,该单克隆抗体与禽腺病毒的所有血清型均发生阳性反应[19]。
作为常见的垂直传播性病毒之一,SPF鸡胚中一旦携带FAdV便会造成生产的禽用弱毒疫苗出现污染,为该病的防控带来很大风险。据报道,研究人员从某些禽用弱毒疫苗中检测到了FAdV-4[12-13]。
在本研究中,以FAdV-4-GX2018-005作为免疫原免疫小鼠,经过ELISA筛选,成功研制了分泌单克隆抗体的杂交瘤细胞3株(13A3、13A11和4D5)。这3株杂交瘤细胞分泌的单克隆抗体,能特异地与FAdV-4 的19个毒株发生阳性反应,与禽腺病毒其它血清型(FAdV-1、FAdV-2、FAdV-3、FAdV-5、FAdV-6、FAdV-7、FAdV-8a、FAdV-8b、FAdV-9、FAdV-10和FAdV-11)以及对照毒株的反应为阴性,弥补了现有FAdV单克隆抗体不明确与血清1~11型禽腺病毒的反应性,或不能特异检测FAdV-4的不足。同时,该单克隆抗体在IFA 检测中明确易判FAdV-4的感染。本研究所研发的特异检测FAdV-4 的单克隆抗体,弥补了特异检测FAdV-4的抗体缺失问题,可用于建立特异检测FAdV-4的ELISA检测试剂盒及胶体金试纸条,为实现SPF鸡胚等疫苗生产原料以及疫苗成品FAdV-4的高效检测奠定了基础。
