肾黏液样小管状和梭形细胞癌影像学特征及病理分析
2023-10-25马肖枫傅钰涵张舒云冯建钜
马肖枫 傅钰涵 张舒云 冯建钜*
肾黏液小管状和梭形细胞癌(MTSCC)是一种独特的低级别肾肿瘤,发病率占肾癌的<1%,2004 年被列入世界卫生组织肾肿瘤分类,在2016 年版分类标准中,关于其恶性、等级低的描述已被删除[1]。由于MTSCC无显著临床表现和影像学特征,确诊主要依据病理组织学及免疫组化检查,但在常规镜检和免疫组化(IHC)分析中,部分MTSCC 与I~II 型乳头状肾细胞癌(pRCC)存在高度重叠,仍无法区分[2]。有临床证据表明,通过基于其CT 和MR 的影像学特征,可在术前对该肿瘤类型的诊断进行怀疑[3],但目前国内外文献对于该病的报道也仅限病例报道及病例回顾性研究,缺乏对该病的系统性、指南性认知。本文探讨6 例经手术病理证实的MTSCC,对其影像表现进行分析,提高对本病的影像学认识。
1 资料与方法
1.1 临床资料 回顾性分析2015 年9 月至2021 年11月诸暨市人民医院经手术病理证实的6 例MTSCC 患者。男3 例,女3 例;年龄31~72 岁。1 例因血尿就诊,其余体检发现。
1.2 检查方法 (1)CT 检查:采用Philips iCT 128 排螺旋CT 成像,横断位螺旋扫描,层间距、层厚均为3~5 mm,薄层重建0.9 mm,并通过多平面重组获得冠、矢状位图像,增强采用非离子型造影剂碘海醇320,总量80 mL,以3.0 mL/s 速度经静脉团注法注射,皮髓期、实质期、排泄期扫描在注射对比剂后30~33 s、55~60 s、180 s 开始。(2)MRI 检查: 采用GE signal HDxt 1.5T MRI 扫描仪,横断位梯度回波T1Dual(TR180 ms,TE2.2/4.7 ms),横断位脂肪抑制快速自旋回波T2加权序列(TR6,000 ms,TE86 ms),冠状位FIESTA(TR4.1 TE 1.7),增强LAVA(TR6.6 TE3.1),层厚3.0~4.0 mm,扫描视野12~16 cm,扫描间隔1 mm。平扫后均用欧乃影(Gd-DTPA)行三期增强扫描: 注射剂量为 0.1 mmol/kg,经肘静脉以 2 mL/s 的流率团注,增强扫描时间为注射对比剂后30~33 s(皮髓期)、55~60 s(实质期)及180 s(排泄期)。
1.3 影像学分析 由两名影像科高年资主治医师(腹部诊断经验均为5 年以上)独立阅片,如影像诊断意见不一,协商讨论达成统一。阅片医师对手术结果并不知情,在影像工作站(picture archiving and communication system,PACS)阅片后找出病灶,并记录和分析影像学特征:肿瘤的部位、大小、形态、边界、CT 密度、MRI信号、增强扫描特点、周围侵犯及远处转移等情况。于肿瘤最大层面以及上下各一层面上来绘制肿瘤的感兴趣区域(Region of interest,ROI),ROI 为圆形,尽可能覆盖测量层面肿瘤,测量肿瘤实质部分分别在平扫、皮质期、髓质期、延迟期的CT 值(HU)和ADC 值,共测量三次,测量避开血管,钙化和坏死部分,分别记录相应的平均值。通过绘制数据点折线图,寻找CT 强化特点、峰值。
2 结果
2.1 手术与病理 6 例均行全肾切除术。5 例突出肾实质外,1 例完全位于肾实质内。4 例切面灰白质软,2例切面淡黄质硬,2 例有出血坏死,2 例有钙化。5 例为低级别MTSCC,镜下形态相似,表现为束状排列的梭形细胞、紧密排列成小管状的立方形细胞,包埋在黏液样基质中,核级别低,异常核分裂现象少。1 例为高级别MTSCC,镜下可见病理性核分裂及片状坏死,Ki-67 约40%(+)。免疫组织化学: EMA(+)5 例、Vim(+)6 例、CK7(+)6 例、P504S(+)4 例、CD10(-)4 例、CD117(-)3 例、Villin(-)2 例、Ki-67(+)2%~10% 5 例。
2.2 影像学表现 6 例MTSCC 均为单发肿块,位于右肾4 例,左肾2 例;最大径约2.0~7.6 cm。5 例形态为类圆形,1 例为楔形,3 例有假包膜。6 例边界清晰,均未侵犯周围组织、淋巴结及远处转移。CT 平扫3 例呈均匀等或低密度,3 例密度不均匀,1 例有出血,1 例环形钙化,1 例有出血、囊变、钙化。MRI 平扫T1WI序列等低或低信号为主,T2WI 序列等高或高信号为主,1 例见环形低信号环,对应肿块边缘环形钙化灶,DWI呈高信号,ADC 呈低信号。增强扫描CT 与MRI 表现相仿,呈缓慢渐进性轻中度强化,2 例见平台强化。见图1。
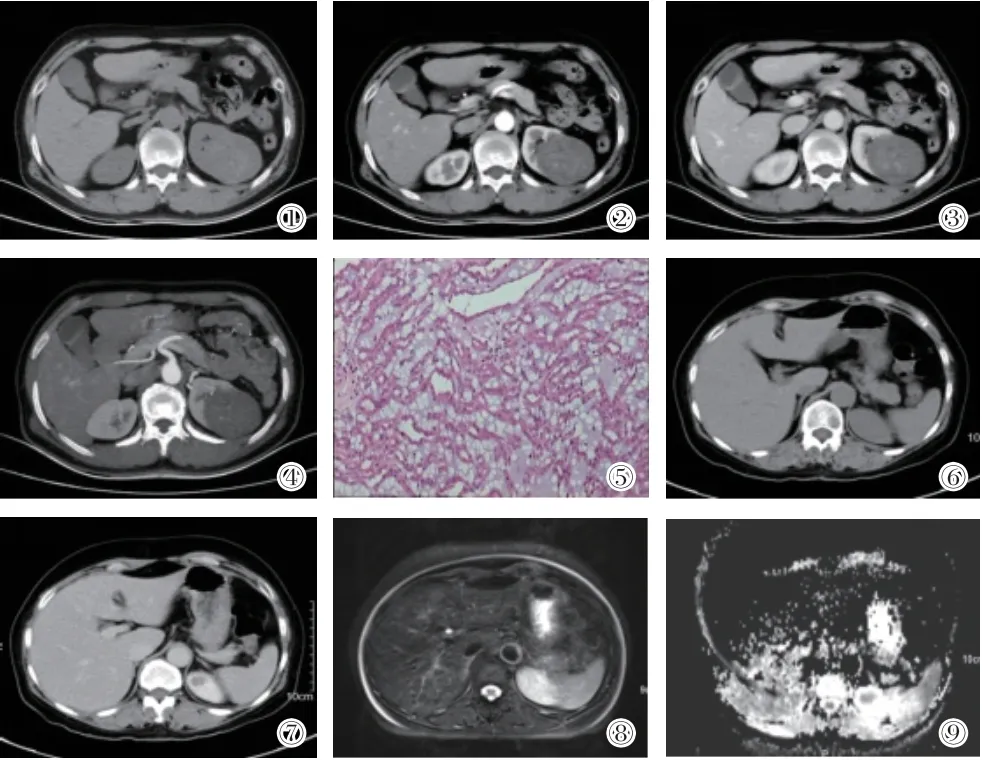
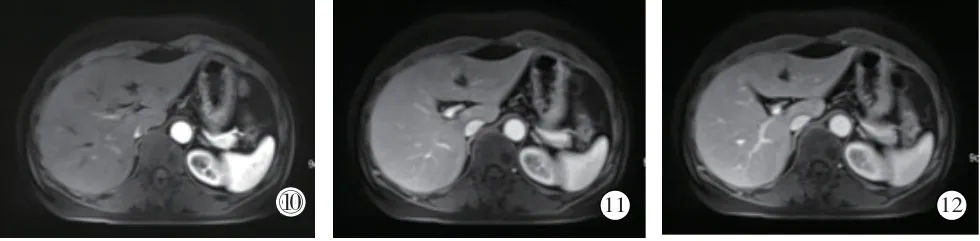
图① CT平扫示左肾实质内类圆形稍低密度影,伴出血。②-③增强扫描皮髓期、实质期示强化明显低于肾皮质,内见少许絮状强化区。④CTA示肿瘤内血管不丰富。⑤镜下见多量小管状结构,局灶见黏液。病理诊断:左肾低度恶性肾细胞癌,结合形态及免疫组化考虑黏液样小管状及梭形细胞癌伴坏死。免疫组织化学: EMA(+)、Rcc(-)、CD10(-)、Vim(+)、CK7(+)、P504S(+)、CD117灶(+)、E-cad(+)、TFE3(-)、Ki-67(+)2%。图⑥-⑫CT平扫呈等密度为主,T2WI呈高信号为主,ADC信号较低,增强扫描皮髓期肿瘤强化程度明显低于肾皮质,排泄期肿瘤呈持续性轻度强化
3 讨论
相关文献报道MTSCC 大都发生在成人,年龄跨度较大,而女性发病率高[3-4],多数为无症状的、偶然发现的肿瘤[5]。本组6 例患者,年龄31~72 岁,除1 例患者因血尿就诊外,其余患者均为偶然发现,与报道相符。但男女比例为1 ∶1,可能与样本量较少有关。
镜下MTSCC 为三种结构(梭形细胞形成的束状结构以及立方形细胞构成的小管、实性细胞索)和两种肿瘤细胞(梭形细胞和立方形细胞)包埋在黏液样间质中。瘤内核级别低,异常病理核分裂现象少。因此,MTSCC 多为低级别肿瘤,预后良好,较少出现复发及转移,但国内外文献相继报道高级别或肉瘤样变MTSCC术前或术后出现转移病例[6]。在本组中,5 例为低级别MTSCC,预后良好,1 例镜下见片状坏死及病理性核分裂,诊断为高级别MTSCC,术后3 个月余即出现腹膜后多发转移,与文献报道相符。免疫组化多数MTSCC表达CK7、CK18、EMA、Vimentin 阳性,而近曲小管分化的有些标志物如:CDl5、CD10 及 villin 表达阴性。
肿瘤体积通常较大,最大径多>3 cm,生物学形态多表现良性扩张生长模式,与周围肾实质界限分明[7]。本组患者肿瘤最大径2.0~7.6 cm,均表现为边界清晰的孤立性肿块,形态规则,与文献报道一致。瘤体较大可能与肿瘤恶性程度低,临床症状不明显,发现较晚有关。镜下肿瘤细胞体积较小,富含黏液样间质,且瘤内血管极少,故CT 平扫密度较低,低于相邻正常肾实质密度。MRI 平扫T1WI 呈等、低信号,T2WI 呈中等高-高信号,DWI 呈高信号,ADC 值通常较低[8]。T2WI 信号强度的高低与肿瘤内黏液样间质或黏蛋白含量有关。轻微程度的黏液时表现为T2WI 低信号,当显示中度或显著程度的黏液时则表现为T2WI 高信号[9]。T2WI 高信号灶也可表现为水肿或坏死[10]。肿瘤通常密度、信号较均匀,当出现出血、囊变坏死及钙化时则密度、信号不均。出现囊变可能是因肿瘤富含黏液,局部形成黏液湖有关,而黏液沉积则较易形成钙化。T2WI 低信号也可能是出血及钙化。本组6 例平扫CT 值约29~37 HU,较正常肾实质密度低,3 例密度均匀,3 例因出现出血、囊变坏死或钙化而密度不均,本组2 例行磁共振检查,1 例出现囊变,T2WI 为高信号,1 例出现环形钙化,对应T2WI 边缘低信号环,与文献描述一致。
镜下MTSCC 血管稀少,微血管密度低,为乏血管肿瘤,又含有较多黏液成分,对比剂渗透速度缓慢,此病理基础导致肿瘤早期强化程度低、渐进性缓慢轻度强化[10]。本组6 例,CT 平扫密度为29~31 HU,低于正常肾皮质,动脉期CT 值约32~40 HU,早期强化程度<10 HU,排泄期达峰值,强化幅度约2~29 HU,为渐进性轻中度强化,有2 例有平台强化趋势,与相关文献报道[7-10]一致。
鉴别诊断:MTSCC 与肾脏富血供肿瘤如肾透明细胞癌、嗜酸细胞腺瘤等较易鉴别,主要与其他乏血供肾细胞癌进行鉴别。(1)肾乳头状癌:男性较多,主要位于肾皮质,平扫密度稍高,轻度渐进性强化,较MTSCC强化程度高,出血、坏死、囊变及钙化较MTSCC 常见,T2WI 呈低信号,而MTSCC 以T2WI 高信号为主[11]。(2)集合管癌:通常位于中心髓质,浸润性生长,较易侵犯肾窦,常见淋巴结及远处转移,CT 平扫表现为高密度,强化程度较MTSCC 高[12]。(3)嫌色细胞癌:平扫密度及信号一般较均匀,钙化较MTSCC 易出现,强化峰值多出现在皮髓质期,常见放射状瘢痕或轮辐状强化及钙化[7]。
综上所述,MTSCC 是一种新的肿瘤实体,通常表现为肾脏孤立性肿块,边界清楚,恶性征象少,少有周围侵犯,少有淋巴结及远处转移,偶有出血囊变钙化,平扫CT 呈等、低密度或混杂低密度,MRI 表现为T1WI以等、低信号或混杂低信号为主,T2WI 以中等-高信号或混杂高信号为主,DWI 序列呈高信号,ADC 呈低信号,CT/MRI 动态增强主要为缓慢渐进性轻中度强化和平台强化相结合的表现形式。通过术前影像学提示,可以帮助病理医师诊断MTSCC,避免对肿瘤分级和其他亚型的误解。
