PAK5激酶促进肺结核患者外周血单核细胞活化
2023-10-25郑高明金育娇范超明
郑高明 金育娇 范超明
近年来,结核病(tuberculosis,TB)发病呈上升趋势,包括艾滋病在内的免疫力低下人群以及重症监护室耐药菌感染者是TB 发病的高危人群。世界卫生组织发布的《2022 年全球结核病报告》显示,2021 年全世界新发TB 患者1060 万例[1]。我国估算的新发结核病患者数为78.0 万,占全球结核病例的7.4%。结核分枝杆菌(mycobacterium tuberculosis,MTB)是结核病的病原体,单核巨噬细胞是消灭MTB 的“前线细胞”,活化的单核巨噬细胞吞噬并分解MTB,将MTB 抗原呈递给T细胞,启动细胞免疫。但MTB 能通过各种机制长期隐匿在单核巨噬细胞内,二者之间的斗争决定着疾病的转归[2]。p21 活化激酶5(PAK5)是一种丝氨酸/苏氨酸蛋白激酶,通过与广泛的细胞内蛋白相互作用参与多个信号转导通路,调节细胞活化、增殖、迁移等[3]。MTB感染患者时,单核细胞活化与PAK5 蛋白的关系尚不清楚。本文旨在评估肺结核患者外周血单核细胞活化与PAK5 的相关性,为借助PAK5 增强单核细胞活性辅助治疗结核病提供依据。
1 资料与方法
1.1 临床资料 选取2017 年10 月至2023 年5 月杭州师范大学附属医院65 例确诊为活动性肺结核患者(结核组),以及65 例健康体检者(对照组)。结核组纳入标准:年龄≥18 岁的活动性肺结核患者;排除标准:免疫缺陷者、糖尿病、心血管疾病、其它感染性疾病和肿瘤。活动性结核是基于结核病相关的临床症状和体征,及结核分枝杆菌病原学、病理学、影像学等检查有活动性结核诊断的证据,所有患者通过痰培养出结核分枝杆菌确诊。结核组中男45 例,女20 例;年龄(51±20)岁。对照组中男35 例,女30 例;年龄(32±10)岁。
1.2 方法 (1)血常规检测:空腹采集EDTA-K2 抗凝外周血,采用迈瑞BC-6900 全自动血液分析仪(迈瑞,中国)检测白细胞数量,检测按仪器规程进行。(2)流式细胞术检测:取EDTA-K2 抗凝全血100μL 加至流式分析管,溶血后洗涤,加入PBS 10μL、 5×Binding buffer 2.5μL,CD45-FITC 0.5μL,CD14-APC 0.5μL,HLA-DR-PB 荧光抗体0.5μL(BioLegend,美国),室温避光孵育15 min,再加入二抗,室温避光孵育30 min,流式细胞仪(Navios,Beckman Coulter,美国)上机检测单核细胞数量和比例。细胞固定后行透膜处理,加入PAK5 一抗(Abnova,中国台湾)或兔源IgG 同型对照抗体(Invitrogen,美国),室温避光孵育30 min,加入山羊抗兔IgG-AF488 二抗(Thermo,美国),室温避光孵育30 min,流式细胞仪上机检测单核细胞内PAK5 蛋白。(3)荧光定量PCR 检测:①单核细胞分离:取新鲜EDTA 抗凝全血2.5 mL,加入等体积PBS 稀释全血;在15 mL 离心管中加入5 mL Ficoll 分离液(Biochrom,Germany),4℃ 1,000 g 离心30 min;吸取血浆与分离液之间的白膜层细胞至15 mL 离心管中,加入PBS 10 mL洗涤白膜层细胞,4℃ 250 g 离心10 min,弃上清液;加入Percoll 分离液4 mL(1.8 mL Percoll + 2 mL Minimal Essential Medium Eagle + 0.2 mL 10×Earle Balanced Salt Solution,Pharmacia,Germany),4℃ 420 g 离心30 min,收集中间层富集的单核细胞。②单核细胞RNA 提取和定量PCR:采用核酸提取纯化试剂盒(湖南圣湘公司,中国),按说明书要求提取并纯化单核细胞总RNA。采用TAKARA 逆转录试剂盒(RR037A),按说明书要求进行RNA 逆转录反应。采用TAKARA 定量PCR 试剂盒(RR820A),按说明书要求进行荧光定量PCR 反应,获得靶基因PAK5 和ACTB(内参基因)的Ct 值,并计算2-ΔΔCT值进行统计学分析。相关引物序列见表1。

表1 荧光定量PCR使用的引物
1.3 统计学分析 采用SPSS23.0 统计软件。正态分布的计量资料采用(±s)表示,两组比较用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 单核细胞比例及单核/淋巴细胞比值 与对照组比较,结核组外周血中单核细胞占全部白细胞的比例11.1%±2.3%高于对照组单核细胞占比5.3%±1.4%,结核组外周血中单核/淋巴细胞比值(0.49±0.20)高于对照组单核/淋巴细胞比值(0.16±0.05),差异均有统计学意义(t=13.452,P<0.001;t=9.870,P<0.001)。见图1。
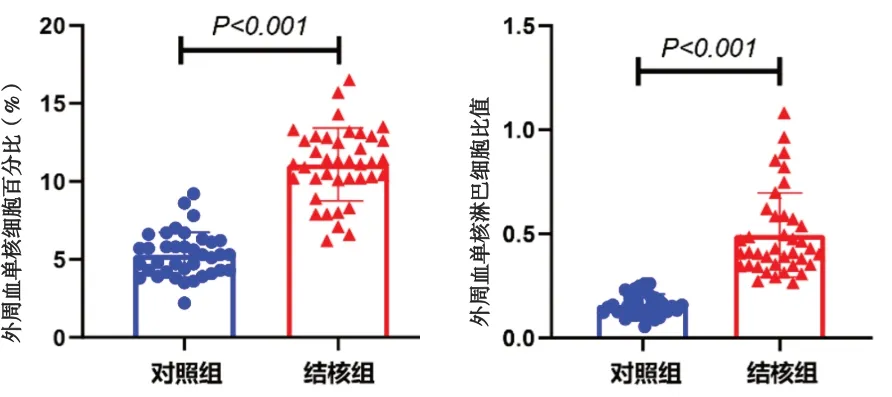
图1 两组外周血单核细胞比例和单核细胞/淋巴细胞比值
2.2 单核细胞活化比和活化数 结核组单核细胞活化比93.9%±4.6%高于对照组单核细胞活化比72.9%±15.2%,结核组单核细胞活化数(970±334)个/L 高于对照组(281±149)个/L,差异均有统计学意义(t=8.258,P<0.001;t=11.511,P<0.001)。见图2。
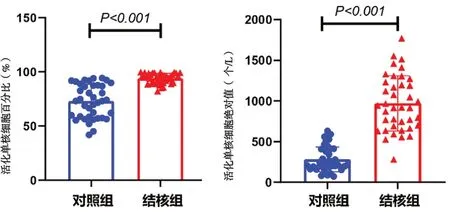
图2 两组外周血单核细胞活化比和活化数
2.3 活化单核细胞的PAK5 蛋白表达阳性率 结核组活化单核细胞PAK5 蛋白表达阳性率84.71%±11.15%高于对照组75.33%±11.64%,差异有统计学意义(t=2.207,P=0.035)。见图3。

图3 两组活化单核细胞PAK5蛋白表达阳性率
2.4 活化单核细胞PAK5 基因mRNA 表达水平 结核组活化单核细胞PAK5 mRNA 表达水平(0.97±0.06)高于对照组(0.16±0.07),差异有统计学意义(t=7.519,P<0.001)。见图4。
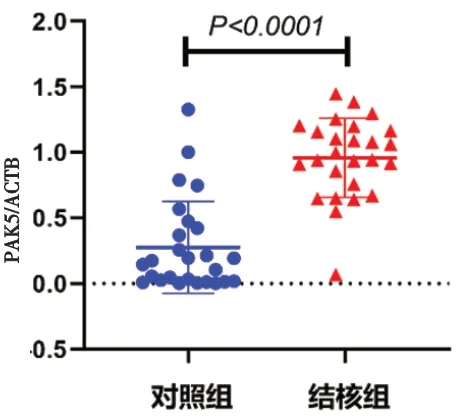
图4 两组活化单核细胞PAK5基因mRNA表达水平
3 讨论
结核病是严重威胁全球公共卫生的重大传染病,防治形势日趋严峻。MTB 是导致结核病的病原体,而单核巨噬细胞是机体抵抗MTB 感染的主要效应细胞。活化的单核巨噬细胞不仅可启动固有免疫应答,分泌炎性因子杀伤或直接吞噬MTB,还可以通过抗原递呈作用,激活获得性免疫应答[2]。机体感染MTB 后,单核细胞可经MCP-1、IFN-γ、TNF-α 等细胞因子刺激而活化,并向感染部位聚集,进入组织发育为组织特异性巨噬细胞,获得强大的吞噬杀菌能力,从而清除或携带MTB[4]。脂阿拉伯甘露聚糖(lipoarabinomannan,LAM)是MTB 细胞壁的一种糖脂,可与单核细胞膜上的Toll样受体2(TLR2)结合,激活细胞内多条信号通路,诱导单核细胞向巨噬细胞转化[5]。而在感染早期,MTB分泌的小分子抗原CFP10、ESAT6 等也可与单核细胞表面结合,激活相应的信号通路而活化单核细胞[6]。活化的单核巨噬细胞首先吞噬MTB,然后迁移至局部淋巴结,表达和通过MHC 分子递呈抗原而激活T 细胞[7],但MTB 也可以阻碍单核巨噬细胞抗原递呈[8],这些单核巨噬细胞不能杀灭细胞内的MTB,且其显著的迁移能力将有助于MTB 从感染部位向其它组织播散[9]。有研究发现,单核细胞膜上表达的模式识别受体,能帮其识别MTB 病原体相关分子模式而使其激活,活化后的单核巨噬细胞增加表面MHC I、MHC II 及协同刺激分子的表达,导致MTB 抗原更好递呈给T 细胞,使得T 细胞对MTB 发挥更有效的杀伤作用[10]。同时活化的单核巨噬细胞也能通过产生一氧化氮(NO)、促进吞噬小体向吞噬溶酶体及自噬溶酶体成熟等发挥着抗结核作用[11]。因此,单核细胞的活化对于机体清除MTB 非常重要。单核细胞活化的表面标志物主要是HLA-DR、CD25、CD69 等。本研究结果显示,结核患者外周血中单核细胞膜上的HLA-DR 等活化标志物的表达阳性率高于体检健康者,提示结核患者单核细胞活化比更高,结核分枝杆菌可以通过某种信号通路激活单核细胞,诱导其向巨噬细胞分化,进而参与机体对MTB 的杀灭和清除。
PAK5 是一个重要的信号转导分子,在多条信号转导通路中发挥作用。研究表明,单核细胞活化与p65-NFκB 通路激活密切相关[12],提示PAK5 蛋白可能通过磷酸化p65-NFκB,促进HLA-DR 表达而活化单核细胞。本研究中,活动性肺结核患者的外周血中单核细胞比例增高,这个现象可能是由于结核病时,血循环中的单核细胞被激活而募集到肺部形成肉芽肿来控制MTB 感染所致。此外,活动性肺结核患者单核细胞与淋巴细胞比值也增高,这可能是由于MTB 感染人体后,骨髓造血干细胞有着向髓系分化的倾向,导致髓系及淋巴系比例增高[13]。与体检健康者相比较,活动性肺结核患者外周血中的活化单核细胞的PAK5 蛋白表达阳性率增高,同时PAK5 基因mRNA 表达水平增高,这进一步提示PAK5 蛋白参与单核细胞活化,诱导单核细胞向巨噬细胞分化增殖,并向感染灶迁移,发挥消灭MTB 的生物学功能。
综上所述,活动性肺结核患者单核细胞比例、单核细胞活化比和活化数、PAK5 蛋白表达阳性率和PAK5基因mRNA 表达水平均增高,提示结核分枝杆菌感染时,PAK5 蛋白具有促进单核细胞向活化单核细胞转变的潜能,这为今后通过PAK5 蛋白增强单核细胞功能控制结核病提供可能,且为目前抗结核辅助治疗提供新的方向。
