人牙龈间充质干细胞条件培养液促进大鼠皮肤创面愈合的实验研究
2023-10-25张洁杨华军赵伟蒋巧平李敏胡胜杰
张洁 杨华军 赵伟 蒋巧平 李敏 胡胜杰
皮肤创伤破坏皮肤的生理功能并严重损害人们的生活质量,寻找促进皮肤创面愈合的方法一直是临床工作的重要内容。间充质干细胞(mesenchymal stem cell,MSCs)在皮肤损伤修复方面成果丰富。牙龈间充质干细胞(gingival mesenchymal stem cells,GMSCs)是从牙龈中分离出的成体干细胞,已证实其在牙周组织再生领域中发挥重要作用[1],但调控这一生物学过程的内在机制并不明确。近来研究显示:MSCs 发挥作用的途径是通过其旁分泌能力而非直接再生机制介导[2]。本研究通过建立大鼠皮肤切割伤模型,于创周4 点注射牙龈间充质干细胞条件培养液(human gingival mesenchymal stem cells derived conditioned medium,GMSCs-CM)并观察其用于皮肤创面愈合的效果,旨在探讨GMSCs-CM在皮肤创面愈合中的作用机制,为临床皮肤创伤愈合寻找新的治疗方法。
1 材料和方法
1.1 材料 (1)实验动物:20 只8~10 周龄SD 大鼠,体质量约250 g,SPF 级,由斯贝福(北京)生物技术有限公司提供,生产许可证号:SCXK(京)2019-0010。饲养环境:室温23 ℃,采光良好,通风,给予专用饲料和水,专用笼喂养。实验遵循国家制定的实验动物使用和保护指南。动物实验伦理审查表编号:(2020)年伦审(临研)第(08)号。(2)实验试剂:DMEM 培养基(Gibco,美国);基础培养基(赛百慷公司);兔抗人CD31 抗体(北京中杉金桥生物公司,中国);兔抗鼠pCNA 抗体(Gene Tex 公司,美国);兔抗鼠VEGF 抗体(Immunoway 公司,美国);兔抗鼠TGF-b1(华安生物,中国);兔抗鼠β-Actin 抗体(Abclonal 公司,美国);Invent Minute(TM)动物总蛋白提取试剂盒(英文特生物技术,美国)。(3)实验仪器:4℃离心机ST16R(Thermo 公司,美国);CAVOY(凯元)Mini P-4 小型垂直电泳仪(CAVOY,中国);Clinx ChemiScope 荧光及化学发光成像系统(Clinx,中国);Nano Drop 2000(Thermo Fisher,美国)。
1.2 实验方法 (1)细胞来源和培养:GMSCs 购自赛百慷生物技术股份有限公司,使用基础培养基传代培养,实验选用第3~4 代。人成纤维细胞为重庆医科大学赠送,使用DMEM 培养基培养,实验选用第5 代。(2)制备GMSCs-CM:将5×105GMSCs 接种在T25 的培养瓶培养,当细胞达80%融合时漂洗,加入无添加剂的基础培养基5 mL。培养48 h 后收集细胞上清液于15 mL 离心管中,500 g 离心5 min,使用0.22 μm 孔径滤过膜过滤,即得到GMSCs-CM。将收集到的GMSCs-CM 采用Millpore 超滤离心管浓缩(5,000 g,40 min,4℃),nanodrop 测定蛋白质浓度,备用。(3)大鼠皮肤切割伤模型制备:20 只大鼠经异氟烷吸入麻醉后,俯卧于手术台,备皮,消毒。取脊柱中下部的两侧对称皮肤,选择2 cm 直径圆孔定位,脊柱左侧一个孔,右侧两个孔,三孔保持>0.8 mm 间距以避免肌肉收缩影响愈合判定,因每只鼠三个孔注射同一种药物故不考虑药物间相互渗透干扰。使用眼科剪沿定位线边缘剪开皮肤,钝性分离筋膜层以减少皮下毛细血管出血,后沿定位线剪下全部皮肤,将每只鼠三个孔全部剪除完毕止血后,放置于布有加温垫的鼠盒中等待苏醒。(4)实验动物分组和处理:20 只大鼠建立皮肤切割伤模型,随机分为GMSCs-CM 组和PBS 组,每组各10 只。GMSCs-CM 组在模型建立后立即于创周4 点注射GMSCs-CM 200 μL(15 μg/mL),PBS 组在模型建立后立即于创周4 点注射PBS 液200 μL(15 μg/mL),1 次/d,连续3 d。模型制备并注射的当天记为第1 天。(5)创面愈合情况和愈合率测定:分别在第1、3、7、14 天用游标卡尺测量大鼠创面的大小(第1 天为注射后立即测量,视为初始创面面积),每只鼠测量三个数据求取平均值,观察皮肤创面愈合情况并计算创面愈合率,创面愈合率=(初始创面面积-第N 天创面面积)/初始创面面积×100%。(6)创面组织病理形态观察:造模第14 天处死大鼠,取创周5 mm 皮肤标本,制成组织蜡块并切片,行HE 染色处理后显微镜下观察。(7)免疫组化分析:同(6)标本处理方法制成组织切片,免疫组织化学染色检测CD31(1 ∶200)的表达。采用EnVison 两步法进行。参考Weidner[3]提出的计数方法,应用CD31 标记毛细血管内皮细胞的细胞质和细胞膜,以单个棕黄色内皮细胞或内皮细胞团作为1 个毛细血管,在低倍镜(40 倍)下选出3 个血管密集区域,转100 倍镜下随机选3 个视野,计数毛细血管数量,取平均值为MVD值。(8)Western blot 方法检测各时间点大鼠皮肤创面组织中增殖细胞核抗原(proliferating cell nuclear antigen,PCNA),转化生长因子β1(transforming growth factor beta 1,TGF-b1)和血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)蛋白的表达:从造模第3、7、14 天的创周5 mm 皮肤组织中提取细胞总蛋白,进行蛋白质印迹以检测目标蛋白。BCA 法检测蛋白浓度,在10%变性SDS-PAGE 凝胶上运行40 μg 总蛋白,浓缩胶60 V 电泳1 h,分离胶100 V 电泳2 h,常规湿法转膜90 min,5%脱脂奶粉封闭2 h,免疫抗体反应(稀释比例:一抗:PCNA 1 ∶1,000,VEGF 1 ∶1,000,TGF-b1 1 ∶1,000。β-actin 1 ∶3,000;二抗:山羊抗兔1 ∶5,000)。ECL 化学发光系统检测,凝胶成像系统显影。
1.3 统计学分析 采用GraphPad Prism 8 进行统计学分析与绘制图像。计量资料以(±s)表示,当方差齐时,采用双因素方差分析(Two-way ANOVA)进行多组间比较,并采用Bonferroni 进行检验。P<0.05 为差异有统计学意义。
2 结果
2.1 大鼠创面愈合率 与PBS 组相比,GMSCs-CM 组在第3、7、14 天的创面面积均有不同程度的缩小;第14 天,GMSCs-CM 组的创面接近完全愈合(见图1A)。分别计算两组第3、7、14 天的创面愈合率,结果显示(见图1B):第7、14 天时GMSCs-CM 组的创面愈合率明显高于PBS 组(P<0.05)。

图1 大鼠创面愈合情况和愈合率。A. PBS组和GMSCs-CM组同一只大鼠不同时间段的创面愈合情况;B.各组治疗第 3、7、14天的创面愈合率。**P<0.01
2.2 大鼠创面皮肤组织学观察 (1)HE 染色:取GMSCs-CM 组和PBS 组第14 天的创面组织进行HE 染色,比较两组组织学差异。结果显示:PBS 组显示为不良的成纤维细胞及血管,有少量炎细胞浸润。GMSCs-CM 组大鼠皮肤创面中成纤维细胞、胶原纤维和血管增加,炎症细胞浸润明显(见图2)。(2)免疫组化:取GMSCs-CM 组和PBS 组第14 天的创面组织进行免疫组织学分析。CD31 染色阳性的细胞呈棕黄色,排列可见明显的血管管状结构(见图3);PBS 组中MVD 为(14.67±1.53),GMSCs-CM 组中MVD 为(30.33±4.16),GMSCs-CM 组中MVD 显著高于PBS 组(P<0.01)。
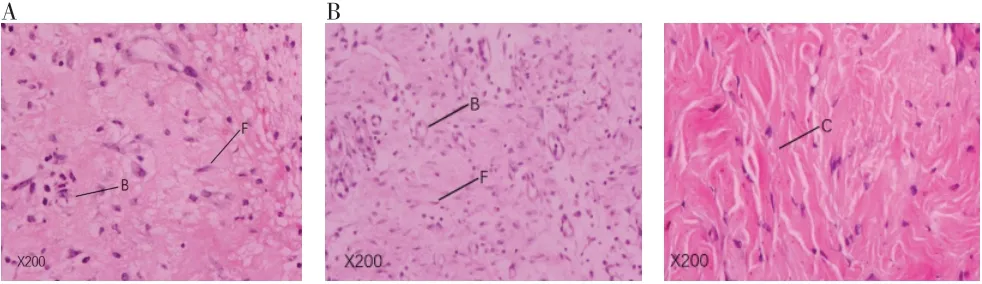
图2 治疗第14天大鼠创面组织HE染色(×200)。A.PBS组,不良的成纤维细胞(F)和血管(B),少量炎细胞浸润;B. GMSCs-CM组,可见成纤维细胞、胶原纤维(C)和血管增加,炎症细胞浸润明显

图3 治疗第14天大鼠创面组织CD31免疫组化染色(×100)。CD31表达阳性主要存在于新生的毛细血管内皮细胞中,染色呈棕黄色(箭头所示)。A.PBS组,新生的毛细血管数量较少;B.GMSCs-CM组,新生的毛细血管数量较多且密集
2.3 GMSCs-CM 对大鼠皮肤创面组织中PCNA、VEGF、TGF-b1的表达影响 取GMSCs-CM组和PBS组治疗第3、7、14 天的创面组织,检测PCNA、VEGF、TGF-b1的蛋白表达,结果显示(见图4):与PBS 组相比,GMSCs-CM 组PCNA、VEGF、TGF-b1 表达均上调且差异有统计学意义(P<0.05)。
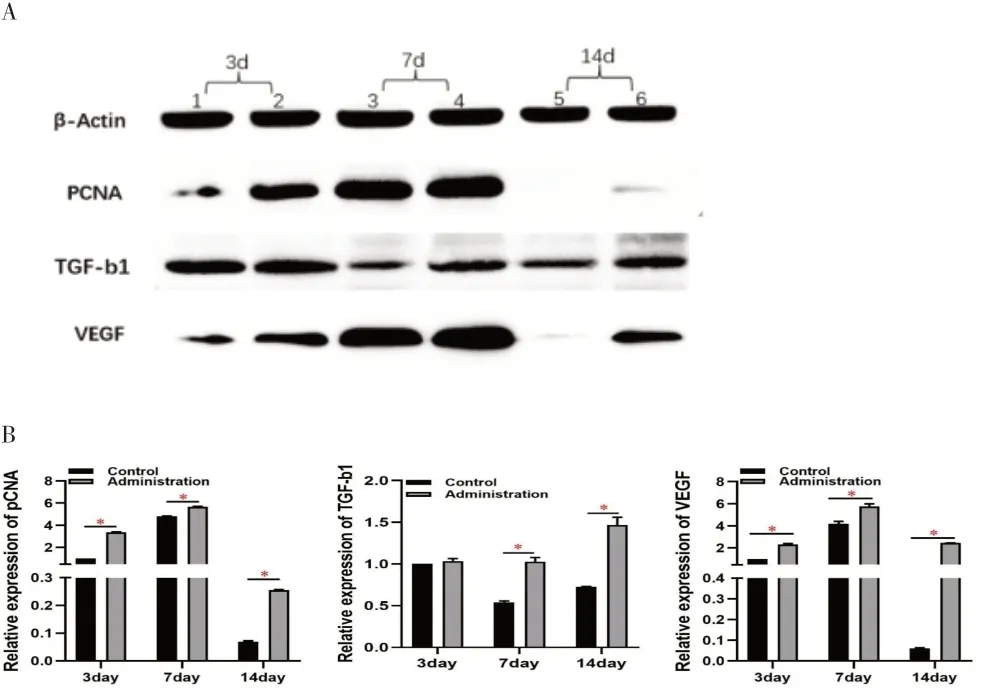
图4 Western blot检测抗体显影结果及灰度值分析图。A.Western blot检测抗体显影结果(1、3、5:PBS组;2、4、6:GMSCs-CM组);B.Western blot检测灰度值分析
3 讨论
创面愈合对维持皮肤的完整性和功能性起到至关重要的作用,MSCs 是目前创面愈合治疗中最有价值的医疗手段[4]。近年来研究表明:MSCs 发挥生物学效应的主要方式是通过旁分泌作用而非直接分化机制。GMSCs作为口腔来源的MSCs 更易以微创的方式获得,已有研究证明GMSCs 在角膜、牙周、神经组织修复中起治疗作用[5]。本实验研究中通过建立大鼠皮肤创面切割伤模型,将培养的GMSCs-CM 局部注射入大鼠皮肤创面,通过对比观察显示:GMSCs-CM 组不仅创面愈合速度更快,且创面愈合率增高,治疗第7、14 天时创面愈合率与PBS 组相比均有显著差异。
成纤维细胞在皮肤创面愈合过程中的调节作用占主导地位[6]。本实验通过病理学检查发现:GMSCs-CM组创面组织的成纤维细胞数量和胶原纤维的数量明显增多。PCNA 是DNA 复制和修复的重要因素,作为评价细胞增殖状态的重要指标,已证实在皮肤组织的发生和修复过程中表达增强[7]。实验蛋白质印迹分析结果显示:各个时间段GMSCs-CM 组PCNA 的表达水平均高于PBS 组,治疗7 d 时PCNA 的表达水平最高,而随着愈合时间的推进,PCNA 的水平又逐渐降低。结果提示:注射GMSCs-CM 可促进成纤维细胞增殖,而随着愈合过程的进展又不至于过度增殖导致皮肤组织纤维化而形成瘢痕。
血管生成被认为是创面愈合所必需的[8]。新生的血管参与肉芽组织的形成,并为生长中的组织提供营养和氧气,其对于细胞的增殖和为炎症细胞创造通路至关重要。CD31 是血管内皮细胞的标志物,用于评估伤口愈合过程中的新生毛细血管[9]。作者通过采用CD31 进行免疫染色来确定伤口修复区域的新生毛细血管密度,结果显示:与PBS 组相比,GMSCs-CM 组CD31 表达阳性细胞数量增加,表明GMSCs-CM 在体内促进新生血管的形成。同时实验显示,随着毛细血管新生同时出现的还有大量的炎症细胞,分析这主要与炎症细胞产生大量的原血管生成介质有关。
创面愈过程受各种因子的调节。生长因子VEGF 是刺激血管生成的重要因素,其与其他血管生成因子协同作用以刺激和维持血管系统。同时有研究证实,VEGF的表达水平显示出与血管密度相似的增加趋势[10]。VEGF 转录的分泌在急性病变中升高,在创面愈合早期,VEGF 作用于血管生成和肉芽组织形成[11]。TGF-b1全程参与并调节创面愈合的三个阶段[12]:愈合早期调节免疫细胞功能助于炎症消退;组织形成期促进再上皮化进程;基质重塑阶段调控细胞外基质的平衡状态。本实验蛋白质印迹分析结果显示:GMSCs-CM 处理的创面中VEGF 和TGF-b1 的蛋白含量较PBS 组均升高,14 d 时PBS 组VEGF 的表达下降明显,而GMSCs-CM组VEGF 表达虽有下降但仍维持在较高的水平。14 d时TGF-b1 的表达较PBS 组升高显著。因此,作者认为GMSCs-CM 通过增加血管生成因子的释放而影响血管和肉芽组织的形成,从而加速创面愈合的速度。
综上所述,注射GMSCs-CM 可加快皮肤创面成纤维细胞的增殖并减少过度的瘢痕增生,同时增加创面毛细血管和肉芽组织的形成,从而加快再上皮化进程促进创面的愈合,其潜在的机制可能是通过上调VEGF 和TGF-b1 的表达来实现。因此,GMSCs-CM 可成为临床上促进皮肤创面愈合的一种新的治疗策略。
