一株铜绿微囊藻溶藻真菌的分离鉴定及溶藻特性*
2023-10-24洪桂云朱钰妮黄浚峰朱曙光
洪桂云 朱钰妮 黄浚峰 朱曙光
(1.安徽建筑大学环境与能源工程学院,安徽 合肥 230601;2.建筑能效控制与评估教育部工程研究中心,安徽 合肥 230601)
近年来,全球气候变暖和水体富营养化加剧导致蓝藻水华在世界范围内频繁爆发,已成为全球性的水环境问题[1-2]。蓝藻水华不仅破坏淡水生态系统的结构和功能[3],而且其代谢过程中还会产生大量有毒有害次生代谢物质,如蓝藻毒素、恶臭气体等,从而影响水产养殖业的发展和饮用水的安全[4-6]。铜绿微囊藻(Microcystisaeruginosa)是常见的优势蓝藻水华藻种之一,太湖、巢湖、滇池曾多次爆发铜绿微囊藻水华,因此寻找高效经济的防止藻类爆发的方法成为眼下人们重点关注的问题。
目前,国内外主要的藻类控制方法有物理法、化学法和生物法3大类。物理法能直接消除水中的藻类,且不产生二次污染,但成本高,难以大规模应用[7]。化学法工艺简单,操作方便,但不能从根本上改善水质,且容易造成二次污染[8]。生物法因其经济、高效、环境友好的特点逐渐成为控藻的主流方法[9-10]。自然界中有许多微生物对藻类具有抑制作用,包括放线菌[11]、真菌[12-13]、细菌[14]等。MOHAMED等[15]搜集了1960—2021年关于水华蓝藻控制的文献共145篇,其中关于细菌对蓝藻生长影响的论文多达95篇,而关于真菌溶藻能力和溶藻方式的报道相对较少,目前只有15种真菌被鉴定为能够抑制和裂解蓝藻细胞。有研究发现,真菌对铜绿微囊藻的降解速率可能比细菌更快[16]。因此,本研究从富营养化水体及附近土壤中分离筛选出一株溶藻真菌,研究其溶藻特性、溶藻方式及溶藻效果,为利用溶藻真菌控藻提供更多实验基础。
1 材料与方法
1.1 供试藻种
铜绿微囊藻购自中国科学院淡水藻种库(FACHB),经活化后接种于BG11培养基,置于恒温光照条件下培养,温度设置为25 ℃,光照强度设置为2 000 lx,光暗比为12 h∶12 h,每天早中晚3次手动振荡摇匀预培养7 d。
1.2 溶藻菌株的分离与鉴定
在安徽建筑大学校内两个小池塘各取500 mL水样,并在水样采集地附近各取距地面10 cm处的潮湿土样10 g。水样采回后立即经0.8 μm滤膜粗过滤,再过0.45 μm纤维滤膜,然后把0.45 μm纤维滤膜剪成小份,投入150 mL液体察氏培养基中,30 ℃、150 r/min振荡培养72 h。土样取回后溶入500 mL蒸馏水中并在150 r/min下振荡2 h,静置,取10 mL上清液加入到150 mL液体察氏培养基中,30 ℃、150 r/min振荡培养72 h。同时设空白对照组,为150 mL液体察氏培养基,30 ℃、150 r/min振荡培养72 h。在培养后的5瓶菌液中各取10 mL,按体积比1∶9加入预培养后的铜绿微囊藻藻液中。取黄化藻液,平板划线分离单菌落,在30 ℃下培养72 h后选20种形态、大小各异的单菌落,再进行复选,取最早使藻液黄化的溶藻真菌菌株JHQ3进一步研究。
用TaKaRa试剂盒提取溶藻真菌菌株脱氧核糖核酸(DNA)[17],采用琼脂糖凝胶电泳分析所提取的DNA。以提取的DNA为模板,用真菌的ITS通用引物对真菌基因组进行聚合酶链式反应(PCR)扩增,其中上游引物为P1(5’-TCCGTAGGTGAACCTGCGG-3’),下游引物为P2(5’-TCCTCCGCTTATTGATATGC-3’)。扩增条件为:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,35个循环;最后72 ℃延伸7 min。PCR扩增得到的目的片段经琼脂糖凝胶电泳分离后,在紫外灯下切割并收集长度为500 bp左右的片段,经Axygene胶回收试剂盒纯化后测序。将测得的序列用DNAstar软件编辑后,在美国国家生物信息中心(NCBI)数据库中利用Blast软件与GenBank中已知的ITS序列进行同源性比较,选取同源性较高的序列利用MEGA 4.0软件构建系统发育树。
1.3 菌株JHQ3生长曲线的测定
采用干重法测定生长曲线。将菌株JHQ3接种于100 mL液体察氏培养基中制成菌悬液,150 r/min振荡培养24 h,使菌悬液浑浊,取5 mL加入500 mL灭菌的液体察氏培养基,继续150 r/min振荡培养。每隔12 h取出10 mL用定量滤纸过滤,过滤前记录滤纸质量,过滤后100~105 ℃烘干后再次称量,过滤前后的质量差为菌体干重。绘制以时间为横坐标,菌体干重为纵坐标的曲线,即为菌株JHQ3的生长曲线。结果表明,JHQ3在0~4 h处于停滞期,4~36 h处于对数期,36~72 h处于稳定期,72 h后进入衰亡期。处于稳定期时真菌生物量最大,故后续选取稳定期菌液作为原菌液进行溶藻实验。
1.4 菌株JHQ3溶藻方式探究
对分离得到的菌株JHQ3原菌液采取3种方式处理:10 000 r/min离心10 min,得到上清液a;移走上清液后的离心渣用灭菌后的液体察氏培养基定容至5 mL,使菌体重新悬浮,得到菌悬液b;不作处理为原菌液c。分别将上清液a、菌悬液b和原菌液c按体积比1∶99接种至预培养后的铜绿微囊藻藻液中进行溶藻实验。空白对照组不加菌液,用相同体积的BG-11培养基代替。6 d后采用超声辅助热乙醇提取/分光光度法测定叶绿素a,并按式(1)计算溶藻率。
1.5 菌株JHQ3的溶藻特性研究
1.5.1 菌液浓度对溶藻效果的影响
将原菌液分别稀释至100、10-1、10-2、10-3、10-4、10-5、10-6,按体积比1∶99分别接种至预培养后的铜绿微囊藻藻液中进行溶藻实验,并设置对照组不加菌液(下同),6 d后测定叶绿素a并计算溶藻率。
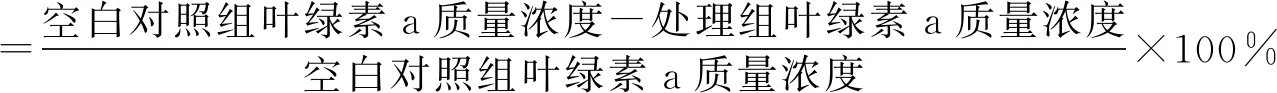
(1)
1.5.2 光照时间对溶藻效果的影响
将原菌液按体积比1∶99接种至预培养后的铜绿微囊藻藻液中进行溶藻实验,光暗比考察了12 h∶12 h和24 h∶0 h两组,分别设了对照组,6 d后测定叶绿素a并计算溶藻率。
1.5.3 培养温度对溶藻效果的影响
将原菌液按体积比1∶99接种至预培养后的铜绿微囊藻藻液中进行溶藻实验。培养温度考察了20、25、30 ℃,并分别设置对照组,6 d后测定叶绿素a并计算溶藻率。
1.5.4 pH对溶藻效果的影响
将液体察氏培养基pH分别调整为5、6、7、8、9,将原菌液按体积比1∶99接种至预培养后的铜绿微囊藻藻液中进行溶藻实验,并分别设置对照组,6 d后测定叶绿素a并计算溶藻率。
1.5.5 添加表面活性剂对溶藻效果的影响
将1 mL原菌液转接到100 mL液体察氏培养基中,30 ℃、160 r/min振荡培养24 h,分别加入1 mL质量分数0.05%的乙二胺四乙酸(EDTA)和Tween-80,继续振荡培养2 d,将此时的原菌液按体积比1∶99接种至预培养后的铜绿微囊藻藻液中进行溶藻实验,并设置对照组,6 d后测定叶绿素a并计算溶藻率。
2 结果与分析
2.1 溶藻菌株的分离与鉴定结果
将PCR扩增JHQ3产物与NCBI数据库比对,构建系统发育树(见图1),发现菌株JHQ3与AspergillussydowiiMEF105(KT315450)聚于一枝,因此鉴定菌株JHQ3为萨氏曲霉菌属(Aspergillussydowii)。
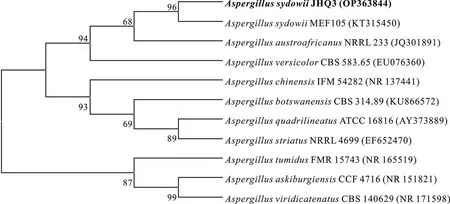
图1 菌株JHQ3的系统发育树
2.2 溶藻菌株JHQ3的溶藻方式
由图2可见,原菌液c和菌悬液b的溶藻效果好,溶藻率分别达到98.21%、91.07%,不过上清液a也可通过释放的胞外物质达到溶藻效果,其溶藻率为71.43%。由此说明,该溶藻菌株主要通过自身直接裂解藻细胞溶藻,也通过分泌胞外活性物质溶藻[18],故可判断溶藻菌株JHQ3的溶藻方式是直接溶藻和间接溶藻并存,且以直接溶藻方式为主[19]。
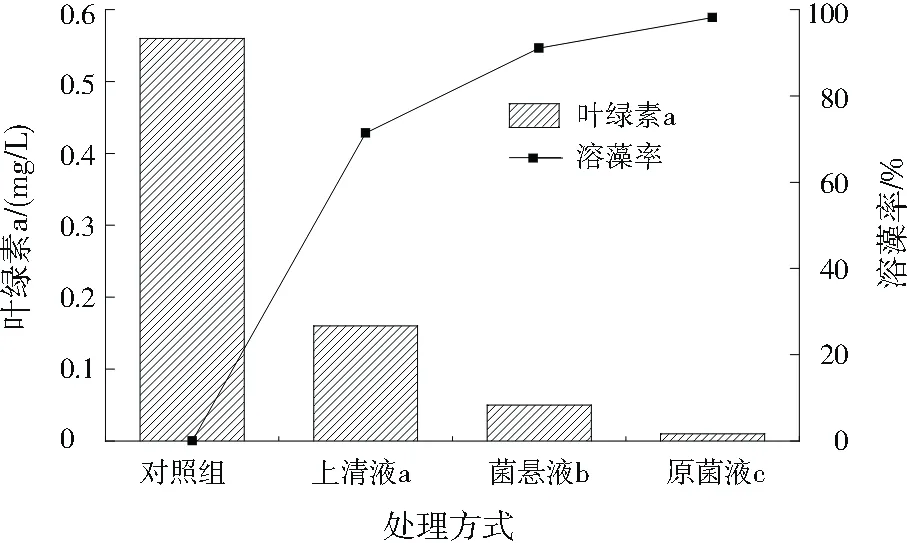
图2 溶藻菌株JHQ3的溶藻方式探究
2.3 菌株JHQ3的溶藻特性
2.3.1 菌液浓度对铜绿微囊藻的溶藻效果影响
由图3可见,原菌液(菌液浓度100)溶藻率最高,达到97.56%,稀释至10-1、10-2、10-3的菌液溶藻率分别为92.68%、85.37%、12.20%,菌液浓度稀释至10-3以下,溶藻效果较差。菌液浓度是反映细菌密度的重要参数。洪桂云等[20]研究细菌不同菌液浓度对铜绿微囊藻的去除效果也表明,菌液浓度越高,溶藻效果越好,与本研究结论一致。
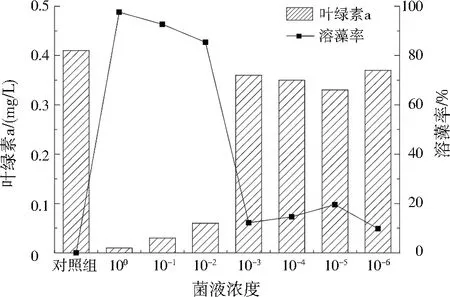
图3 不同菌液浓度的溶藻效果
2.3.2 光照时间对铜绿微囊藻的溶藻效果影响
由图4可见,在光暗比为12 h∶12 h时溶藻效率高于24 h∶0 h时,说明接近自然光照条件能够使溶藻菌起到更好的溶藻效果,有利于实际应用。

图4 不同光照时间的溶藻效果
2.3.3 培养温度对铜绿微囊藻的溶藻效果影响
由图5可见,在30 ℃培养温度下,溶藻率为94.06%,溶藻效果较好,25、20 ℃培养温度下,溶藻率分别为81.44%、61.06%,这是因为萨氏曲霉菌属的适宜生长温度为30~37 ℃,因此实际应用溶藻菌JHQ3控藻时,温度宜控制在30 ℃以上。
2.3.4 pH对铜绿微囊藻的溶藻效果影响
由图6可见,pH为7时溶藻效果最优,溶藻率达83.39%;pH为9时溶藻效果最差,溶藻率只有50.00%,说明溶藻菌株JHQ3在碱性条件下会受到较大抑制,能耐一定的酸性,但在中性条件下对铜绿微囊藻的溶藻效果最好。朱叶飞等[21]、刘茜[22]得出pH为6时溶藻效果最好,袁轲婷等[23]得出pH为8时溶藻效果最好,与本研究比较接近。
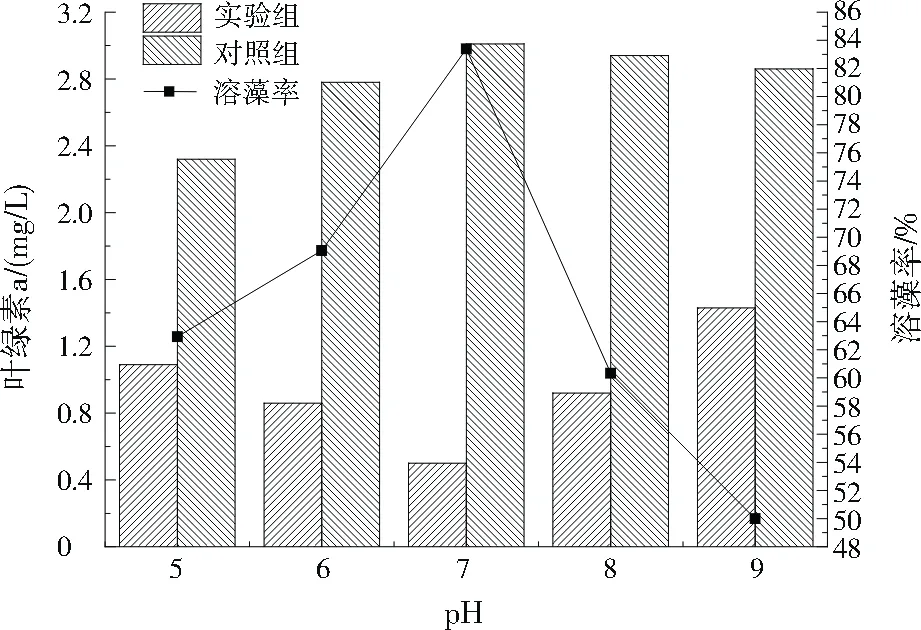
图6 不同pH的溶藻效果
2.3.5 添加表面活性剂对铜绿微囊藻的溶藻效果影响
由图7可见,与对照组相比,添加表面活性剂Tween-80或EDTA均会抑制JHQ3溶藻,而且添加EDTA的抑制效果比添加Tween-80更为明显。
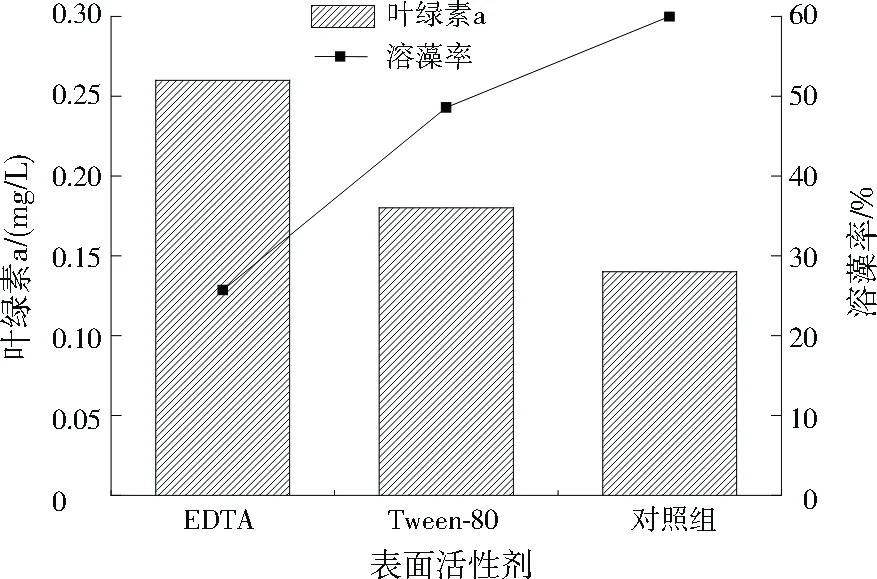
图7 添加表面活性剂的溶藻效果
3 结 论
(1) 从校园环境中筛选到溶藻效果较好的溶藻真菌菌株JHQ3。通过ITS序列分析,初步鉴定菌株JHQ3为萨氏曲霉菌属。
(2) 溶藻菌株JHQ3的溶藻方式研究表明,该菌株溶藻方式以直接溶藻为主,间接溶藻为辅。
(3) 溶藻菌株JHQ3原菌液的溶藻率最高可达97.56%,该菌株在30 ℃下溶藻效果最好,溶藻率可以达到94.06%,pH为7时溶藻效果达83.39%,光暗比12 h∶12 h时溶藻效果较好,表面活性剂对溶藻真菌JHQ3有一定的抑制作用,EDTA的抑制作用要大于Tween-80的抑制作用。
