miR-196b 靶向ERG 促进肺腺癌的增殖和迁移
2023-10-24刘邦卿李剑锋刘晓辉张劲男梁金屏
刘邦卿 ,李剑锋 ,刘晓辉 ,张劲男 ,梁金屏
(1)唐山市人民医院胸外二科;2)头颈外科,河北 唐山 063000)
肺腺癌(lung adenocarcinoma,LUAD)是最常见的非小细胞肺癌(non-small cell lung cancer,NSCLC)类型,其特征是淋巴细胞浸润密集,并且在早期容易发生转移[1]。近年来,随着LUAD 的治疗逐渐从传统治疗演变为基于癌细胞基因特征定制的个性化治疗,肺癌患者的预后大幅改善[2]。但目前LUAD 仍然容易复发并造成患者死亡,5 a总生存率仍低于15%[3]。因此,有必要探索LUAD 发生和转移的潜在机制,这可以为开发LUAD 治疗的新方法提供新的途径。
微小RNA(microRNA,miRNA)是介导不同分子过程的关键参与者,它们比蛋白质编码基因更常参与肿瘤发生[4]。据报道,miR-196b 作为致癌基因参与调控几种癌症的进展,例如结直肠癌[5]和胃癌[6-7];同时,抑制miR-196b 的表达还能够促进神经胶质瘤细胞对替莫唑胺化疗和放疗的敏感性[5]。在肺腺癌中,人们同样发现miR-196b 具有促癌作用[8-10]。可见miR-196b 在多个癌症中都起到了促癌的作用,但其在LUAD 中的作用机制仍需完善。ETS 相关基因(ETS-related gene,ERG)是E-26 转换特异性(E-26 transformation-specific,ETS)转录因子家族成员之一,在血管生成、造血和骨发育等发育过程中发挥重要作用[11]。ERG 作为致癌基因在前列腺癌中起到了很重要的作用,研究发现,ERG 是前列腺癌潜在的诊断和预后生物标志物,能够促进前列腺癌细胞的增殖和迁移[12-13];而在肝癌中,着色性干皮病基因G 组(xeroderma pigmentosum group D,XPG)基因过表达可下调ERG 的表达,进而抑制肝癌(hepatocellular carcinoma,HCC)细胞的增殖,促进其凋亡[14]。然而,目前ERG 在肺腺癌中的作用仍不明确。
本研究前期总结了前人的研究成果,同时利用生信分析发现miR-196b 在LUAD 中高表达,通过设计实验探究miR-196b 是否在LUAD 中发挥关键作用,发现miR-196b 对LUAD 增殖、迁移和侵袭的促进作用是通过靶向负调控ERG 基因的表达来实现的。这项研究可能为阐明LUAD 肿瘤发生的机制提供新的机会。
1 材料与方法
1.1 主要材料
本研究使用的培养基DMEM-H 和RPMI-1640 购自中国北纳生物公司,Lipofectamine®3000 试剂盒、Trizol 试剂盒购买自美国Invitrogen公司,PrimeScript RT 试剂盒、SYBR Premix Ex Taq 购买自日本Takara 公司,1 %蛋白酶抑制剂购自美国Sigma 公司,聚偏二氟乙烯膜购自美国Millipore 公司,基质胶购于美国BD Bioscience公司,ERG(ab92513,1∶1 000)、GAPDH(ab181602,1∶10 000)、IgG(ab205718,1∶20 000)抗体购自英国Abcam 公司,miR-196b-mimic(miR-mimic)及其阴性对照NC-mimic、miR-196b-inhibitor(miR-inhibitor)及其阴性对照NC-inhibitor、ERG过表达载体(oe-ERG)及其空载体(oe-NC)均购买于GenePharma 公司(中国),载体pmiRGLO、荧光素酶测定系统来自美国Promega 公司,Applied Biosystems ABI 7500 实时PCR 系统、RIPA 裂解缓冲液、化学发光发色底物、MTT、二甲亚砜购于美国Thermo Fisher Scientific 公司,Image Lab软件、酶标仪来自美国Bio-Rad 公司,Transwell小室购于美国Corning Costar 公司。
1.2 生信分析
从癌症基因组图谱(the cancer genome atlas,TCGA)(https://portal.gdc.cancer.gov/)数据库下载TCGA-LUAD 疾病Isoform Expression 数据(癌旁组织:46 例,肿瘤组织:521 例),将样本文件合并成表达量矩阵。从miRBase(http://www.mirbase.org/)数据库下载人类miRNA 注释文件对表达量进行注释,利用‘edgeR’包[15]对mRNA进行差异分析(|logFC| >1.5,FDR <0.05)。基于TCGA 数据库下载患者miR-196b 的表达量数据与患者生存状况数据,根据这些数据通过‘survive’包绘制K-M 曲线。
通过 TargetScan 数据库(http://www.target scan.org/vert_72/),对差异miRNA 的下游靶基因进行预测。从TCGA(https://portal.gdc.cancer.gov/)数据库选择TCGA-LUAD 疾病Gene Expression 数据,下载count 数据类型(癌旁组织:59 例,肿瘤组织:535 例)。将样本文件进行合并成表达量矩阵。从GENECODE(https://www.gencodegenes.org/)数据库下载人类基因组注释文件对表达量矩阵进行注释提取mRNA 表达量矩阵数据,利用‘edgeR’包对mRNA 进行差异分析(|logFC| >1.5,FDR <0.05)。
1.3 细胞培养
本研究使用的细胞系均购自北纳生物公司,在37 ℃,5 %CO2的条件下培养,培养条件与Zhang 等[16]相同。各细胞使用的培养基,见表1。

表1 研究使用的细胞系及培养基Tab.1 Cell lines and media used in the study
1.4 细胞转染
实验方法参考Sheng K 等[17]。利用Lipofectamine® 3000 试剂盒将miR-196b-mimic、NCmimic、miR-196b-inhibitor、NC-inhibitor 转染到HCC-78 细胞系中,使用定量qRT-PCR 确定转染是否成功。同样,利用Lipofectamine® 3000 试剂盒将oe-ERG、oe-NC 转染到HCC-78 细胞系中,使用定量qRT-PCR 或Western blot 分析确定转染是否成功。
1.5 实时荧光定量PCR
使用Trizol 试剂盒从LUAD 细胞中提取总RNA。miRNA 和mRNA 通过PrimeScript RT 试剂盒逆转录成cDNA。qRT-PCR 由SYBR Premix Ex Taq 在Applied Biosystems ABI 7 500 实时PCR 系统下进行。使用GAPDH 作为ERG 内源性参照,U6 作为miR-196b 的内源性参照;引物序列,见表2,所有检测结果均采用2-ΔΔCt值的方法进行分析[18]。

表2 引物序列表Tab.2 Primer Sequence Table
1.6 蛋白质印迹法
将细胞在含有1 %蛋白酶抑制剂的RIPA 裂解缓冲液中裂解。在4 ℃下以16 000 r/min 离心20 min 后,用BCA 蛋白测定试剂盒对总蛋白进行定量,然后在98 ℃下变性10 min。通过SDSPAGE 凝胶电泳分离蛋白质,然后将其转移至聚偏二氟乙烯膜,在含有0.1 % Tween 20(TBST)的配制的5 %脱脂牛奶中封闭1 h,随后,将膜与一抗ERG,GAPDH 在4 ℃下过夜孵育。第2 天用TBST 在室温下洗涤3 次后,将膜与辣根过氧化物酶偶联的二抗IgG 在室温下孵育2 h,然后使用TBST 洗膜3 次。最后通过使用增强的化学发光发色底物进行发光反应,并使用Image Lab 软件进行分析[19]。
1.7 细胞增殖实验
将HCC-78 以每孔3 000 个细胞的密度接种到96 孔板中。分别在培养时间0 h、24 h、48 h或72 h 时,将细胞与MTT 溶液相互作用4 h,弃去上清液,添加100 µL 二甲基亚砜溶解甲瓒。使用酶标仪检测570 nm 处的吸光度[20]。
1.8 划痕愈合实验
将转染的HCC-78 细胞以1×105的细胞密度接种在6 孔板中并生长至80 %融合。使用200 µL 移液器吸头沿直线划伤单层细胞。通过PBS 洗涤去除细胞碎片,随后将划伤的细胞在无血清培养基中培养。在划痕后0 h 和48 h 使用显微镜拍摄图像并记录划痕宽度[21]。
1.9 Transwell 实验
对于迁移测定,将2×104个细胞悬浮在无血清培养基中并接种于上层小室,下室填满30%FBS 培养基。对于侵袭测定,根据制造商的方案,用基质胶包被上室,然后加入含2×104个细胞的无血清培养基,下室填满30% FBS 培养基[22]。最后,在显微镜下分别计数用0.1%结晶紫染色的迁移和侵袭细胞并拍照。
1.10 双荧光素酶实验
将含有miR-196b 假定结合位点的ERG 的3′非翻译区(untranslated region,UTR)以及对应的突变序列插入到载体pmiRGLO 中,构建pmiRGLOERG-WT、pmiRGLO-ERG-MUT。根据制造商的规程,使用Lipofectamine 3000 将ERG-WT 或ERG-MUT 与miR-mimic 或miR-NC 共转染到HCC-78 细胞中。转染 48 h 后,使用荧光素酶测定系统检测荧光素酶活性[23]。
1.11 统计学处理
所有统计分析均由 GraphPad Prism 6.0 进行。数据表示为平均值±标准偏差(SD),通过t检验或单向方差分析(两两比较采用最小二乘法)用于比较组间差异。P<0.05 被认为差异具有统计学意义。
2 结果
2.1 在肺癌组织中miR-196b 高表达,ERG 低表达
为预测肺腺癌中的差异表达基因,基于TCGA-LUAD 进行差异分析。肺腺癌的miRNA 表达量数据和临床数据分析结果显示,miR-196b在肺腺癌组织中表达升高[癌旁样本中的相对表达为(4.422±1.045),肿瘤样本中的相对表达为(6.317±2.468)],见图1A。以miR-196b 表达的中位值为界线将LUAD 患者分为miR-196b 高表达组和miR-196b 低表达组,K-M(Kaplan-Meier)曲线分析发现miR-196b 高表达患者的5 a 生存率低于miR-196b 低表达患者(P=0.001 6),说 明miR-196b 高表达与患者的生存率呈负相关,见图1B。在得到以上的研究结果后,笔者想进一步了解miR-196b 的调控机制。基于TCGA 数据库结合文献[24]确定研究对象ERG,发现ERG 在肺腺癌组织中下调[癌旁样本中的相对表达为(11.544±0.606),肿瘤样本中的相对表达为(9.300±0.844),P=3.50e-17],见图1C。
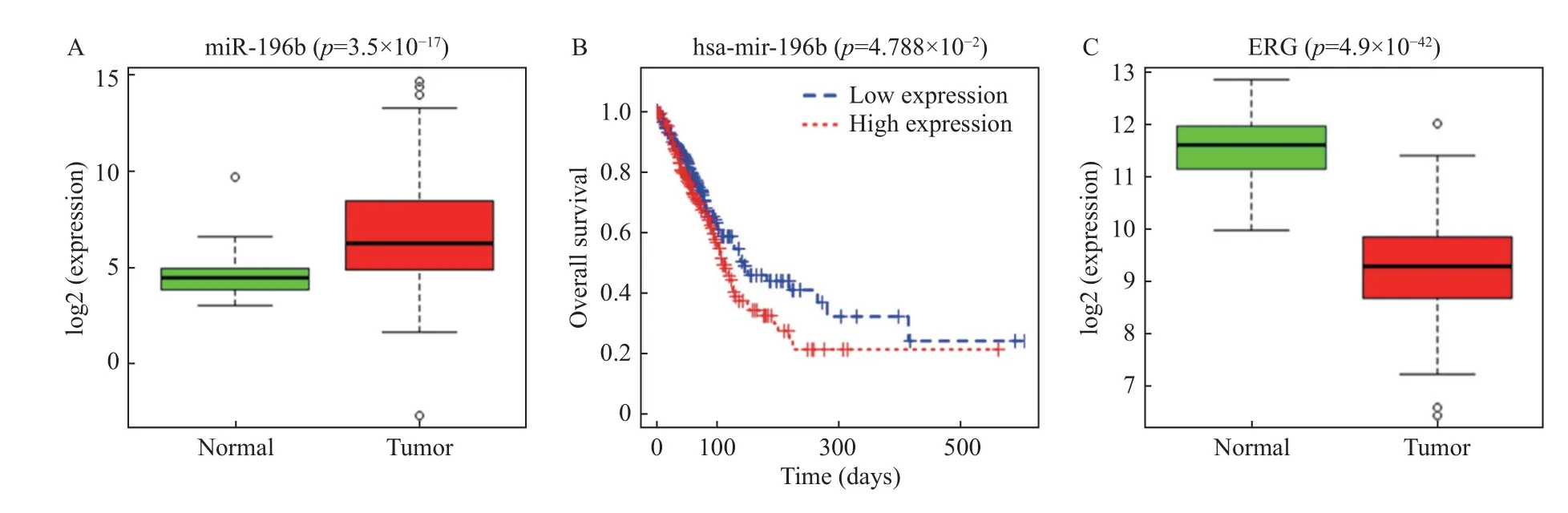
图1 miR-196b 和ERG 在肺腺癌中的表达情况Fig.1 Expression of miR-196b and ERG in lung adenocarcinoma
2.2 miR-196b 在肺腺癌细胞中高表达
基于以上生信结果,在细胞实验中进一步检测miR-196b 表达量。结果显示,与BEAS-2B 细胞(1±0.08)相比,miR-196b 在HCC-78、PC-9、H1395、Calu-3 细胞系中的表达均升高[分别为(4.55±0.23),(2.07±0.18),(3.14±0.22)和(2.54±0.18),(P<0.05)]。且在HCC-78 中升高的最多,见图2,在后续分析中选用HCC-78 细胞系做相关的实验。
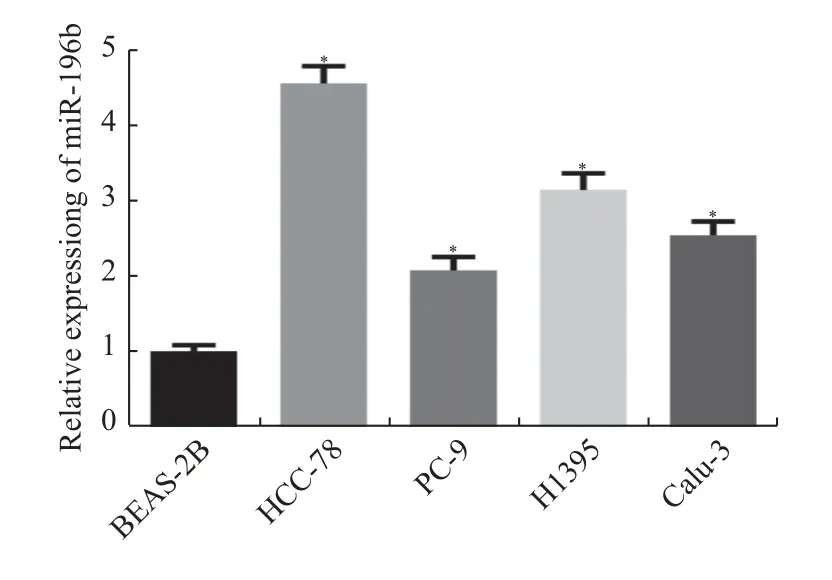
图2 miR-196b 在肺腺癌细胞中的表达情况Fig.2 Expression of miR-196b in lung adenocarcinoma cells
2.3 miR-196b 可影响肺腺癌细胞的增殖、迁移和侵袭
对miR-196b 进行过表达和敲低处理(miRmimic,miR-inhibitor),同时设置对照组(NCmimic,NC-inhibitor)以研究miR-196b 对LUAD进展的影响。过表达处理后的细胞系中miR-196b 的表达量(22.71±1.19)较对照组(1±0.07)上调(P<0.05),过表达效率为22 倍;而敲低处理后的细胞系中miR-196b 的表达量(0.25±0.03)较对照组表达水平(1±0.07)下调(P<0.05),达到75 %的沉默效率(P<0.05),见图3A。说明转染结果良好,可以用于后续的实验。

图3 miR-196b 可影响肺腺癌细胞的增殖、迁移和侵袭Fig.3 miR-196b can affect the proliferation,migration and invasion of lung adenocarcinoma cells
为了探究转染处理后细胞增殖能力的变化情况,利用MTT 实验进行检测,结果显示过表达处理组[72 h 时光密度值为(1.687±0.123)]与对照组[72 h 时光密度值为(1.245±0.108)]相比增殖能力上调,而敲低处理组[72 h 光密度值为(0.925±0.094)]的增殖能力与对照组[72 h 光密度值为(1.245±0.108)]相比下调,差异具有统计学意义(P<0.05),见图3B。
划痕愈合实验和Transwell 实验结果表明过表达处理后的细胞系迁移和侵袭能力[划痕愈合率为(35.57±2.08),迁移细胞个数为(314±27),侵袭细胞个数为(288±21)]与对照组[划痕愈合率为(20.94±1.73),迁移细胞个数为(201±16),侵袭细胞个数为(166±11)]相比增强,差异具有统计学意义(P<0.05),而敲低处理后细胞系迁移和侵袭能力[划痕愈合率为(18.13±1.61),迁移细胞个数为(179±14),侵袭细胞个数为(106±9)]与对照组[划痕愈合率为(43.64±2.51),迁移细胞个数为(298±21),侵袭细胞个数为(249±12)]相比减弱,差异具有统计学意义(P<0.05),见图3C~3D。
2.4 ERG 是miR-196b 的靶基因
笔者搜索TargetScan 数据库发现,ERG 3′-UTR 与miR-196b 有一段互补序列,见图4A,推测ERG 是miR-196b 的潜在靶基因。双荧光素酶实验结果显示,miR-mimic 降低了转染ERG 3′-UTR WT 的细胞的荧光素酶活性,但不能降低转染 ERG 3′-UTR MUT 的细胞的荧光素酶活性,见图4B。这说明miR-196b 与ERG 之间存在物理上的相互作用,即miR-196b 能靶向结合ERG。
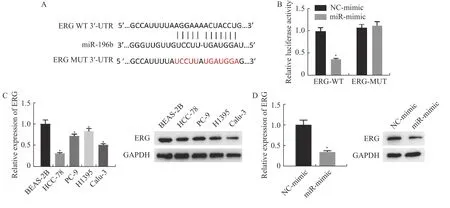
图4 miR-196b 的靶点检测及不同处理组细胞中ERG 的表达情况Fig.4 Target detection of miR-196b and expression of ERG in cells of different treatment groups
然后探究了ERG 在各个细胞系的表达情况,结果显示,ERG 的mRNA 和蛋白表达水平在肺腺癌细胞系中下调[BSEA-2B 细胞的ERG 相对mRNA 表达水平是(1±0.09),HCC-78、PC-9、H1395、Calu-3 细胞系中ERG 的mRNA 表达水平分别为(0.31±0.02),(0.72±0.04),(0.83±0.06)和(0.51±0.03),(P<0.05)],且在HCC-78 中表达最低,见图4C。此外,为验证ERG 和miR-196b 功能上的关系,通过qRT-PCR 和Western blot 检测miR-196b 在HCC-78 细胞中过表达后ERG 的mRNA 和蛋白表达量,结果发现miR-196b 过表达组中 ERG 的 mRNA 表达量(0.35±0.03)较对照组(1±0.11)下调,蛋白表达也呈降低趋势,差异具有统计学意义(P<0.05),见图4D。
2.5 miR-196b 能靶向下调ERG 促进肺腺癌细胞的增殖、迁移和侵袭能力
为验证miR-196b 是否通过靶向ERG 在LUAD 进展中发挥作用。构建单独过表达/沉默miR-196b,同时过表达miR-196b 和ERG,同时沉默miR-196b 和ERG 的LUAD 细胞系HCC-78,并通过qRT-PCR 和Western blot 检测转染效果。结果显示单独过表达miR-196b 时,ERG 的mRNA 和蛋白表达量下调(P<0.05),而miR-196b 与ERG 同时进行过表达处理时,ERG 的mRNA 和蛋白表达量较单独过表达miR-196b 时上升(P<0.05)。单独沉默miR-196b 时,ERG 的mRNA 和蛋白表达量得到了升高(P<0.05),而miR-196b 与ERG 同时沉默处理时,ERG 的mRNA 和蛋白表达量较单独沉默miR-196b 时下降(P<0.05),见图5A。接下来,利用MTT、划痕愈合和Transwell 实验对不同处理组细胞增殖、迁移和侵袭能力进行检测。结果显示,单独过表达miR-196b 的处理组细胞系增殖、迁移和侵袭能力较对照组增强,而同时过表达miR-196b 与ERG 的处理组细胞增殖、迁移和侵袭能力又得到了恢复。单独沉默miR-196b 的处理组细胞系增殖、迁移和侵袭能力较对照组下降(P<0.05),而同时沉默miR-196b 与ERG 的处理组细胞增殖、迁移和侵袭能力又得到了恢复,见图5B~图5D。

图5 miR-196b 能靶向下调ERG 促进肺腺癌细胞的增殖、迁移和侵袭能力Fig.5 miR-196b can target down regulate ERG to promote the proliferation,migration and invasion of lung adenocarcinoma cells
3 讨论
miRNA 基于调节肿瘤相关基因表达的能力,在调节肿瘤特性中起着关键作用[25]。miR-196b在癌症中发挥双重作用,研究报道miR-196b 低表达在胃癌[7],白血病[26]中具有肿瘤抑制作用。最新研究表明,在头颈部鳞状细胞癌中miR-196b 高表达与不良预后相关[27]。这些发现表明,miR-196b 有作为肿瘤治疗靶点的潜力。在肺腺癌中,miR-196b 已被发现能够通过靶向AQP4[8]促进肺腺癌的增殖和迁移。结合前人的研究,miR-196b 可能通过靶向多个基因发挥作用,其对LUAD 的影响机制还需继续探究。研究结果显示,与正常对照相比,miR-196b 在肺腺癌中的表达水平上调,过表达miR-196b 能够增强LUAD 细胞的增殖、迁移和侵袭能力,这与前人的研究一致,敲低miR-196b 后则可明显抑制LUAD 细胞的增殖、迁移和侵袭能力。本研究进一步表明miR-196b 在LUAD 中可能充当肿瘤促进因子。
为了阐明miR-196b 参与LUAD 发病机制,笔者分析了受miR-196b 调控的靶基因,利用TargetScan 数据库搜索 miR-196b 靶基因,并选择ERG 为进一步研究的候选者。ERG 于1987 年发现,是E-26 家族的成员,对整个组织和细胞的生长发育至关重要[28]。ERG 是一种著名的致癌基因,人们发现在前列腺癌中,ERG 的高表达与患者临床特征(晚期肿瘤分期、发生远端转移等)[29-30]和促进细胞行为(增殖、迁移和侵袭)[12,31]有关。还有研究发现ERG 的过表达能够促进肝细胞癌的血管生成[32],下调ERG 的表达可抑制肝癌细胞增殖,促进凋亡[14]。在肺腺癌中,ERG 可作为预测LUAD 患者的预后标志物[33]。然而,ERG 在肺腺癌中的具体调控作用仍然不能确定。本研究发现ERG 在肺腺癌中下调,miR-196b 能够靶向抑制ERG 的表达,过表达ERG 回复过表达miR-196b 对肺腺癌细胞增殖、迁移侵袭能力的促进作用。结果显示,miR-196b 在LUAD 中表现出明显的促癌作用,并可以被ERG 过表达所逆转。但该结果与前列腺癌和肝细胞癌中的研究并不一致,笔者猜测这可能是因为肿瘤存在异质性造成的。LUAD 细胞由于其分化特征与肝细胞、前列腺细胞存在区别而导致基因对肿瘤细胞的生长存在不同的影响。早前也有研究报道TM4SF1等基因由于肿瘤异质性的存在导致其在不同癌种中表现出不同的作用,笔者猜测ERG 在不同癌种中存在不同的表现也是因为类似原因[34-36]。笔者的研究创新性地发现miR-196b 与ERG 在LUAD中的靶向调节关系,并发现了ERG 基因对LUAD细胞表性的影响与在其他癌种中的差异。表明miR-196b 在LUAD 中可能通过调节多个靶点发挥作用。这为miR-196b 可能作为癌症治疗靶点提供依据。
但本研究仍存在不足之处,例如目前本研究仅限于体外实验,缺乏体内验证;验证的细胞生物学功能较少;对miR-196b-ERG 调控轴的上下游因子缺乏进一步挖掘。在未来的工作中,将在此基础上,利用体内实验对本研究的结论进行验证;探究miR-196b/ERG 调控轴对LUAD 其他生物学功能的影响;同时进一步探索miR-196b/ERG 调控轴的上下游因子,完善LUAD 发生发展的分子调控网路。总而言之,笔者目前的研究表明,miR-196b 在LUAD 中上调,并且能通过靶向下调ERG 的表达来促进肺腺癌的增殖、迁移和侵袭,该研究为探索miR-196b 和ERG 在癌症中的功能提供了重要见解。
