过表达及敲减LncRNA RP11-521C20.3 的非小细胞肺癌A549稳转细胞株的构建
2023-10-24李春桃张雪梅苏琰迪张剑青
李春桃,张雪梅,苏琰迪,张剑青
(昆明医科大学第一附属医院呼吸与危重症医学二科,云南 昆明 650032)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是常见的慢性呼吸系统疾病,是基因易感患者在接触有害的气体或颗粒后出现气道和/或肺泡异常,最终出现呼吸道症状,如慢性咳嗽、咳痰、胸闷、气促;胸部CT 影像提示肺部肺气肿征象;肺功能检测提示阻塞性通气功能障碍;最终导致患者生活质量下降、致残致死等不良结局,目前COPD 已成为全球死亡和住院的主要原因[1]。目前研究报道人类基因中只有1.5%左右的基因编码蛋白质,其它大量基因转录为非编码RNA。长链非编码RNA(long noncoding RNA,lncRNA)本身不具有编码蛋白质的功能,但可以抑制或增强蛋白质编码基因的表达[2],从多个层面参与调节细胞分化和个体发生的生理过程,也可参与炎症反应、氧化应激、细胞凋亡等病理过程[3]。
lncRNAs 已经被证实在COPD 发病过程中扮演了重要的角色[4-6],但其在COPD 中的具体表达及其生物学功能仍未完全诠释清楚,本课题组前期基因芯片的结果发现lncRNA RP11-521C20 与BMF mRNA 有负相关关系,可能在BMF 的基因转录和翻译上有重要作用。另采用RT-qPCR 技术检测吸烟COPD 合并肺癌及无COPD 肺癌的远癌肺组织中基因表达量,结果显示吸烟COPD 并肺癌患者肺组织中的BMF mRNA 表达量高于无COPD 肺癌者,相反lncRNARP11-521C20.3 表达下调,同时大鼠COPD 模型的肺组织检测结果也证实了该表达关系,通过mRNA 和lncRNA 基因芯片的结果,分析lncRNA RP11-521C20.3 与BMF 的共表达关系,结果显示两者存在负相关[7]。据既往研究BMF 在细胞凋亡通路中发挥重要作用[8],而lncRNA RP11-521C20.3 则是调控其表达的重要分子,这提示lncRNA RP11-521C20.3可能在COPD 的细胞凋亡机制中起重要作用。肺泡上皮细胞是肺的主要结构细胞,具有分泌肺表面活性物质、进行气体交换等作用。肺泡上皮细胞凋亡在COPD 的发生、发展过程中起到了关键的作用,肺泡间隔内肺泡上皮细胞和毛细血管内皮细胞进行性凋亡、细胞外基质丢失可导致肺泡腔扩大、肺泡间隔变薄,形成了COPD 的肺气肿表现[9-13]。本研究拟构建lncRNA RP11-521C20.3慢病毒过表达及敲减质粒,包装病毒后构建lncRNA RP11-521C20.3 过表达及敲减A549 稳转细胞株,为进一步研究lncRNA RP11-521C20.3在COPD 肺泡上皮细胞凋亡的分子生物学机制提供开展体外细胞实验的细胞模型。
1 材料与方法
1.1 实验材料及试剂
A549 和293T 细胞购自赛百慷上海生物技术股份有限公司;TriQuick Reagent 总RNA 提取试剂购自Solarbio 公司;Ham's F-12K 购自于Procell 公司;胎牛血清购自于Sigma 公司;嘌呤霉素购自于Beyotime 公司;PBS 1×、0.25%胰蛋白酶消化液(含EDTA)、2xSYBR Green qPCR Master mix、Servicebio RT First Strand cDNA Synthesis Kit 购自于Serivicebio 公司;TriQuick Reagent 总RNA 提取试剂购自Solarbio 公司;FastQuant RT Kit 购自TIANGEN 公司;异丙醇、无水乙醇、氯仿购自西陇化工公司;限制性内切酶SbfI/EcoRI、限制性内切酶AgeⅠ和EcoRⅠ购自天根生化科技(北京)有限公司;RP11-521C20抗体购自ABCAM 公司;GAPDH 抗体购自ABCAM 公司;PCR 仪购自Applied Biosystems 公司;凝胶成像分析仪购自培清科技公司;冷冻高速离心机购自ThermoFisher 公司;倒置显微镜购自Questar 公司;倒置荧光显微镜购自Mshot 公司;台式低速离心机购自可成仪器公司。
1.2 实验方法
1.2.1 LncRNA RP11-521C20.3 过表达慢病毒质粒载体构建(1)PCR 扩增引物序列。在NCBI数据库中检索目的基因的mRNA 序列,选择其CDS 序列采用Primer 5.0 引物设计软件按照引物设计原则进行引物设计。获得目的基因的上下游引物后在NCBI 数据库中应用Primer-BLAST 在线工具进行引物特异性检测,检测合格的引物用于后续实验。LncRNA RP11-521C20.3 PCR 扩增引物序列步骤,见表1。

表1 LncRNA RP11-521C20.3 PCR 扩增引物序列步骤Tab.1 LncRNA RP11-521C20.3 PCR amplification primer sequence
(2)LncRNA RP11-521C20.3 过表达慢病毒重组载体构建。采用SbfI/EcoRI 限制性内切酶对过表达载体进行酶切,酶切反应体系,见表2。

表2 过表达重组载体构建酶切反应体系Tab.2 Enzyme digestion reaction system for construction of overexpressed recombinant vectors
将上述试剂及材料混合,水浴锅(37℃)孵育2 h 以上。琼脂糖凝胶电泳用于检测酶切产物的效果,琼脂糖凝胶电泳后将目标载体条带从凝胶上切下,回收凝胶。构建重组质粒(并设计1 组不含lncRNA RP11-521C20.3 片段的质粒作为对照组)。反应体系,见表3,过表达质粒图谱,见图1。

表3 过表达重组质粒反应体系Tab.3 Overexpressed recombinant plasmid reaction system
将上述试剂混合均匀,37℃孵育30 min,置于冰上5 min。将适量反应液转移至DH5α 感受态细胞,培养结束后,取适量菌液均匀涂抹于含氨苄青霉素的平板上,倒置于恒温培养箱中培养12~16 h。挑取1 µL 作为模板进行菌落PCR 鉴定。鉴定引物:Forward:5′-CCAGATCTGTTGACCAACT TTCAAGAGAAGTTGGTCAACAGATCTGG-3′,Reverse:5′-CCAGATCTGTTGACCAACTTCTCTTGAAAG TTGGTCAACAGATCTGG-3′。鉴定反应体系,见表4。PCR 反应(94℃ 3sec;55℃ 30sec;72℃1 min/kb,循环30 次)。产物经1.5%琼脂糖凝胶电泳,选取阳性克隆转化子转化,挑菌,质粒抽提,并测序。目的质粒转染293T 细胞后,RTqPCR 检测表达。

表4 过表达重组质粒鉴定体系Tab.4 Identification system of overexpressed recombinant plasmid
(3)慢病毒包装及滴度测定。转染前24 h,将293T 细胞以5×106细胞数/15 mL 接种到10 cm培养皿中,待细胞密度达到70%后,在灭菌的离心管中加入试剂,见表5。室温温育15 min,然后将上述混合液加至293 T 细胞的培养基中,充分混匀后,细胞培养箱(5% CO2,37 ℃)6 h,换新鲜培养基转染48 h,收集上清液,进行离心(半径5 cm,4 000 r/min,4 ℃,10 min),采用0.45 µm滤器过滤上清液后,于40 mL 超速离心管中进行离心(25 000 r/min,离心半径12 cm,离心120 min),弃上清液,加病毒保存液,充分溶解后再次离心(10 000 r/min,离心半径10 cm,离心5 min),上清液分装于试管中,-80℃保存。

表5 慢病毒包装试剂Tab.5 Lentivirus packaging reagent
1.2.2 LncRNA RP11-521C20.3 慢病毒敲减重组载体构建(1)合成lncRNA RP11-521C20.3 shRNA 序列。根据lncRNA RP11-521C20.3(Gene ID:NM_005082.5)序列设计了shRNA 序列并进行合成设计,序列信息,见表6。

表6 shRNA 序列Tab.6 shRNA sequence
(2)LncRNA RP11-521C20.3 shRNA 载体构建
设计好siRNA 靶点,进行引物合成。用寡糖退火缓冲液将合成的寡核苷酸溶解于20 µM 溶液中,每条互补单链30 µL。然后将低聚核苷酸混合物在95℃的水浴锅中加热5 min,打开并在室温下自然冷却,形成双链低聚核苷酸片段。载体pSLenti-U6-shRNA-CMV-EGFP-F2A-Puro-WPRE 进行AgeI 和EcoRI 双酶切,酶切反应体系,见表7,敲减表达质粒图谱,见图2。
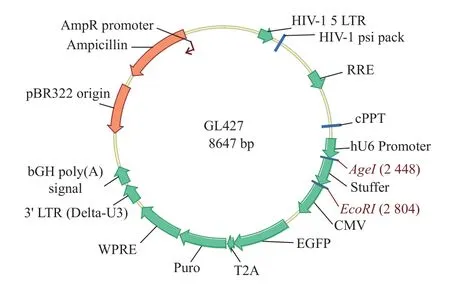
图2 LncRNA RP11-521C20.3 敲减表达质粒图谱Fig.2 LncRNA RP11-521C20.3 knockdown expression plasmid map

表7 敲减载体构建酶切反应体系Tab.7 Enzyme digestion reaction system for knockdown vector construction
将上述试剂混合,37℃水浴锅孵育2 h 以上。酶切产物经琼脂糖凝胶电泳检测,琼脂糖凝胶电泳后将目标载体条带从凝胶中切断,进行胶回收。敲除片段连接到表达载体上,在16℃下连接过夜。连接产物转化至DH5α 感受态细胞。挑取平板上长出的转化子于10 µL LB 培养液中,取1 µL 进行菌落PCR 鉴定。反应体系和PCR 循环条件,见表8。进行PCR 反应(94℃ 3sec;55℃ 30sec;72℃ 1 min/kb。共30 个循环)。对菌落鉴定得到的阳性克隆进行测序和验证。

表8 敲减重组体PCR 鉴定体系Tab.8 Knock-down recombinant PCR identification system
(3)慢病毒包装。将目的质粒转染至293T 细胞并接种于10 cm 培养皿,6 h 后换液,继续培养72h。将上清液离心(4 000 r/min,4 ℃,离心半径5 cm)。对浓缩病毒溶液进行过滤、收集和包装。将包装好的慢病毒转染293T 细胞后检测病毒滴度。
1.2.3 慢病毒感染A549 细胞及稳转细胞株建立在6 孔板中接种约1×105个细胞/孔(次日细胞融合达到30%~40%)。本次实验MOI(感染复数推荐值w 为5。根据公式:病毒体积(µL)=细胞数×MOI/滴度(TU/mL)×1 000,即慢病毒添加量为:2.5/孔。加入病毒后混匀,继续培养。感染后12 h 细胞形态良好,未发生不良反应,感染后24 h 后更换新鲜培养基,继续培养。分别于感染48 h、72 h、96 h 后在荧光显微镜下观察并作图。根据分子实验结果确认过表达/敲减慢病毒。在转染细胞中加入2 µg/mL 嘌呤霉素清除未转染的细胞及已转染表达不正常的细胞。
1.2.4 RT-qPCR 检测lncRNA RP11-521C20.3的表达取细胞样品,按照说明提取总RNA,反转录得到cDNA,进行RT-qPCR 检测,PCR 体系为:2×SYBR Green qPCR Master Mix 10 µL,正反义链均各0.4 µL,cDNA 2 µL,加水至20 µL,95℃30sec,1 个循环进行预变性;95℃ 15sec,60℃30sec,40 个循环。数据采用仪器自带软件分析:ABI Prism7300 SDS Software。lncRNA RP11-521C20.3 正向引物为5′CCCTGCTTTGGGGTTGT GA-3′,反向引物为 5′-GGAGGCTTTGTGGCTTGCT-3′。
1.3 统计学处理
采用SPSS 20.0 处理分析数据,组间均数比较采用t检验。P<0.05 认为差异具有统计学意义。
2 结果
2.1 LncRNA RP11-521C20.3 重组载体构建及鉴定
以人胚肾293 细胞cDNA 为模板进行PCR 扩增得到全长lncRNA RP11-521C20.3 片段。载体pcSLenti-pA-MCS-CMV-SFH-EGFP-P2A-Puro-WPRE 用SbfI/EcoRI 内切酶酶切后与lncRNA RP11-521C20.3 目的基因构建重组质粒,测序结果显示,质粒基因序列与目的基因序列一致,见图3。

图3 lncRNA RP11-521C20.3 过表达重组质粒测序结果Fig.3 Sequencing results of lncRNA RP11-521C20.3 overexpressed recombinant plasmid
设计并合成了siRNA 核苷酸序列。将载体pSLenti-U6-shRNA-CMV-EGFP-F2A-Puro-WPRE 用AgeI 和EcoRI 双酶切,与经过退火获得的目的片段shRNA 连接并过夜,转化DH5α 感受态细胞,涂板,挑菌,质粒抽提,测序鉴定,结果显示插入的片段序列与设计合成的靶向lncRNA RP11-521C20.3 核苷酸序列一致,见图4。

图4 lncRNA RP11-521C20.3 敲减重组质粒测序结果Fig.4 Sequencing results of lncRNA RP11-521C20.3 knockdown recombinant plasmid
2.2 慢病毒包装及滴度测定
对构建好的lncRNA RP11-521C20.3 重组载体进行包装,包装后的慢病毒转染293T 细胞后,进行病毒滴度检测。结果显示:转染72 h,100×荧光显微镜下可观察到293T 细胞荧光数量明显增加,见图5。计算转染时的细胞数、病毒稀释倍数、稀释后的病毒体积和每个基因组整合的平均病毒拷贝数,并计算病毒滴度。其中pcSLenti-pA-RP11-521C20.3-CMV-SFH-EGFPP2A-Puro-WPRE(RP11-521C20.3 过表达)滴度为:5.91E+08(Tu/mL),pcSLenti-pA-MCS–CMVSFH-EGFP-P2A-Puro-WPRE(RP11-521C20.3 过表达对照)滴度为:6.64E+08(Tu/mL),pSLenti-U6-shRNA(RP11-521C20.3)-CMV-EGFP-F2APuro-WPRE(RP11-521C20.3 敲减)滴度为:5.34E +08(Tu/mL)。各慢病毒的滴度均大于1.0E +08(Tu/mL),能满足后续实验要求。

图5 293T 细胞中慢病毒滴度检测荧光图片(100×)Fig.5 Fluorescent image of lentivirus titer detection in 293T cells(100×)
2.3 稳转细胞株的筛选及鉴定
2.3.1 LncRNA RP11-521C20.3 过表达稳转细胞株的筛选及鉴定将过表达lncRNA RP11-521C20.3 的慢病毒载体感染A549 细胞,在感染后24 h、48 h、72 h 在100×荧光显微镜下观察转染效率,并收集明场图像和荧光图像。结果表明lncRNA RP11-521C20.3 过表达的慢病毒感染A549 细胞72 h 后,细胞转染效率大于90%,可以验证lncRNA RP11-521C20.3 表达水平,见图6。

图6 LncRNA RP11-521C20.3 过表达慢病毒载体转染A549 细胞明场图像和荧光图像(100×)Fig.6 LncRNA RP11-521C20.3 overexpressed lentiviral vector transfected A549 cells with bright field image and fluorescence image(100×)
为了验证转染后RP11-521C20.3 表达水平,转染96h 后收集细胞样品进行RT-qPCR 检测。结果表明,OV-lncRNA RP11-521C20.3 组的lncRNA RP11-521C20.3 基因mRNA 表达量高于NC-lncRNA RP11-521C20.3 组(P<0.001),差异倍数为(20.43±0.69),见图7。

图7 RT-qPCR 检测A549 稳转株中lncRNA RP11-521C20.3 表达量Fig.7 The expression of lncRNA RP11-521C20.3 in stable A549 strain was detected by RT-qPCR
2.3.2 LncRNA RP11-521C20.3 敲减稳转细胞株的筛选及鉴定分别用构建好的lncRNA RP11-521C20.3 敲减的慢病毒载体,感染A549 细胞,感染后24 h、48 h、72 h 在100×荧光显微镜下观察转染效率并采集明场图像和荧光图像。结果表明:lncRNA RP11-521C20.3 敲减的慢病毒感染A549 细胞72 h 后,细胞转染效率大于90%,可以进行一步验证lncRNA RP11-521C20.3 表达水平,见图8。

图8 RP11-521C20.3 敲减慢病毒载体转染A549 细胞明场图像和荧光图像(100×)Fig.8 RP11-521C20.3 knockdown virus vector transfected A549 cells bright field image and fluorescence image(100×)
为了验证转染后lncRNA RP11-521C20.3 表达水平,转染96 h 后收集细胞样品进行RT-qPCR 检测。结果表明,sh-lncRNA RP11-521C20.3 组的lncRNA RP11-521C20.3 基因mRNA 表达量低于sh-NC 组(P<0.001),差异倍数为(0.21±0.08),见图9。

图9 RT-qPCR 检测A549 稳转株中lncRNA RP11-521C20.3 表达量Fig.9 The expression of lncRNA RP11-521C20.3 in stable A549 strain detected by RT-qPCR
3 讨论
lncRNAs 因其在调节多种生物过程中的作用而备受关注,其可以通过靶向mRNAs 调节不同的细胞过程,如增殖、凋亡、炎症、迁移和上皮-间质转化等,借此来调节慢性气道疾病的发生和进展[14-15]。多研究[16-18]提示COPD 患者较健康者存在大量lncRNAs 差异表达,且在COPD 的相关发病机制如细胞增殖、细胞凋亡、炎症、肺功能受损中具有重要作用。Tang 等[16]对COPD 和健康对照肺组织进行lncRNAs 基因芯片分析发现,差异表达的lncRNAs 有5,094 个,其中TUG1、BC038205、MEG3、LOC646329 和BC13059 显著增加,SNHG5、LOC729178、LINC00229、LOC339529和PLAC 显著减少,敲除lncRNA TUG1 可通过抑制纤维连接蛋白和α-SMA 的表达水平促进HFL1 和BEAS-2B 细胞增。Gu 等[19]发现lncRNA可能通过介导SIRT1/FoxO3a 和SIRT1/p53 信号通路,调控COPD 患者AEC II 的细胞衰老。CNVR_3425.1 通过抑制lncRNA FENDRR 水平,从而增加中国人群肺癌和COPD 的罹患风险[20]。lncRNA 在COPD 病理生理过程中的炎症反应和肺功能受损中发挥重要关键作用,研究发现lnc-IL7R 表达降低不仅与气道上皮细胞的炎症有关,且能够预测肺功能受损、COPD 恶化/加重[6]。Bi等[17]选取非COPD 吸烟者、COPD 吸烟者和健康不吸烟者的肺组织行全基因组lncRNAs 分析,发现诱导RNA175876|ENST00000554946 的表达可能影响炎症反应的过程。运动对COPD 引起膈肌功能障碍的防治具有积极作用,刘等[21]对其进行进一步研究发现,运动可以降低COPD 诱导的lncRNA H19 表达,从而抑制lncRNA H19 通过靶向miR-181/PDCD4 轴促进与烟雾相关的慢性阻塞性肺病的进展。lncRNA CASC2 过表达可减轻香烟烟雾提取物诱导的细胞凋亡和炎症反应,血清CASC2 在重度COPD 患者中过表达,且与非COPD 吸烟者相比,COPD 患者血清中CASC2 降低,与FEV1 呈正相关[22]。Lnc-NEAT1 的表达与GOLD 分期及IL-6、IL-8、IL-17、TNF-α 水平呈正相关,在COPD 急性加重期患者中最高,其次是COPD 期患者和健康人群[18]。
慢病毒载体可以有效地将外源shRNA 或外源基因整合到宿主染色体中,长期表达目的基因序列,显著提高目的shRNA 或目的基因的转导效率,从而实现目的shRNA 或目的基因的稳定、长期表达[23]。本课题组前期发现,与非COPD 吸烟组相比,COPD 组的lncRNA RP11-521C20.3 表达下调,因此本研究拟构建lncRNA RP11-521C20.3 过表达及敲减的A549 细胞株,为研究lncRNA 在COPD 的凋亡机制中的具体机制作用做准备。AEC II 的凋亡,在COPD 的发病中具有重要作用,AEC II 的凋亡可造成肺泡正常结构破坏,肺气肿形成[24-25],本研究采用的A549 细胞为体外常用II 型肺泡上皮细胞模型,通过重组质粒载体制备了lncRNA RP11-521C20.3 过表达和敲减慢病毒,转染A549 细胞后,成功获得了lncRNA RP11-521C20.3 过表达和敲减的稳转细胞株,最终用RT-qPCR 证明过表达组lncRNA RP11-521C20.3表达量较对照组上升,敲减组lncRNA RP11-521C20.3 则较对照组下降。为后续感染AECⅡ凋亡细胞模型,观察lncRNA RP11-521C20.3 过表达或敲减对肺泡上皮细胞存活与凋亡的影响,从而进一步研究阐明lncRNA RP11-521C20.3-BMF信号通路调控COPD 中AEC Ⅱ凋亡的作用及机制提供部分实验依据。
