丁酸对TNFα 所致肠上皮屏障损伤的保护作用
2023-10-24刘路琼张永进谢振荣何成禄黄永坤
刘路琼 ,陈 通 ,张永进 ,谢振荣 ,何成禄 ,黄永坤
(1)昆明医科大学第一附属医院儿科;2)科研实验中心;3)样本库;4)检验科,云南 昆明 650032)
溃疡性结肠炎是当前的公共卫生问题之一,其发病率在全球范围内呈上升趋势,影响患者的生活质量,增加患者的经济负担。该病以结肠粘膜和黏膜下层炎症为特征,而肠粘膜上皮屏障作为机体和外界之间的第一道屏障,其功能紊乱与该病的发生及发展有着密切的关系[1],因此,寻找可以改善肠屏障功能状态的药物对溃疡性结肠炎的发病机制及临床研究均具有重要意义。
TNFα 被认为是溃疡性结肠炎发生的前炎症因子之一,血清及结肠局部表达均升高[2],参与该病的发生及发展,与肠上皮屏障功能密切相关[3]。研究证实,使用抗TNFα 的药物可以明显改善肠粘膜功能,提高患者的生活质量[4],进一步证实TNFα 在溃疡性结肠炎中的损伤作用。而丁酸不仅为结肠上皮细胞提供能量,而且低浓度时促进结肠黏膜上皮细胞增值,减轻炎症反应,改善上皮细胞间紧密连接,有助于维持肠上皮屏障的完整性和通透性[5]。同时,体外实验证明,Caco2 细胞在普通培养条件下,可自发形成具有上下极性的单细胞层,其特征与肠粘膜上皮肠腔一侧的分化特征类似,因而被广泛用于体外评估肠上皮屏障功能[6]。但丁酸是否可以通过改善TNFα 诱导的肠上皮损伤减轻溃疡性结肠炎肠粘膜损伤目前还不明确,为此,本实验通过探索TNFα 刺激Caco2 细胞的最佳浓度和时间,并以此为基础探索丁酸对Caco2 细胞屏障损伤的保护作用,之后探索TNFα 和丁酸共同作用于Caco2细胞时的最佳时间和浓度,并研究肠上皮屏障功能的通透性和紧密连接蛋白ZO-1 和Occludin 表达及在细胞内分布的变化情况,以期为溃疡性结肠炎发病过程中肠上皮屏障损伤的基础研究和探寻新治疗方案作用机制提供思路。
1 材料与方法
1.1 主要试剂及仪器
兔抗Occludin 多克隆抗体([EPR20992],1∶200,ab216327,Abcam),兔抗ZO-1 多克隆抗体(1∶500,ab96587,Abcam),山羊抗兔IgG H&L(HRP)(1∶10 000,ab6721,Abcam),Alexa Fluor 488 标记的山羊抗兔IgG(1∶1 000,ab150081,Abcam),丁酸(107-92-6,Sigma),TNFα(HZ-1014,Proteintech),CCK-8 试剂盒(GK10001,GLPbio),Transwell 小室(3413,康宁),Trizol reagent(15596026,Invitrogen),RevertAid First Strand cDNA(91258333,Thermo Scientific),细胞爬片(YA0350,Solarbio),荧光酶标仪(Victor Nivo,PerkinElmer),超微量分光光度计(NanoDrop 2000/2000c Spectrophotometer,ThermoScientific),基因扩增仪(Thermal Cycler T960,Heal Force),实时定量PCR 仪(QuantStudioTM5,Life Technologies Holding Pte Ltd),免疫荧光显微镜(N-SIM/C2si,Nikon)。
1.2 Caco2 细胞培养与实验分组
人结肠癌Caco2 细胞株来自中国科学院昆明动物所,5%CO2细胞培养箱(PHCbi,MCO-18AC,USP No.6244103,普和希株式会社),Caco2 细胞使用含10%胎牛血清(F8318-500 mL,Sigma)的DMEM/F12 培养基(C11330500BT,Gibco)培养,之后置于37℃,5%CO2细胞培养箱。当细胞密度达到80%~90%后弃原有培养基,PBS 清洗2 次后用0.25%EDTA 胰酶(25200114,Gibco)消化细胞,调整细胞密度后按实验方案接种于细胞培养板中,培养至细胞稳定贴壁备用。
(1)TNFα 实验分组:加入不同浓度的TNFα 工作液,使其在反应体系的终浓度为0,20,50,100,200,500 和1 000 ng/mL,分别作用0,12,24,36,48,60,72 h。
(2)丁酸实验分组:丁酸在反应体系的终浓度为0,0.05,0.1,0.2,0.5,1,2,5,10,20 mM/L,分别作用36,48 和60 h。
1.3 CCK-8 检测细胞存活率
细胞接种于96 孔板中培养,按照实验分组进行不同干预。每孔加含有10%的CCK-8 的无血清培养基100 µL,37℃避光孵育2 h,酶标仪检测TNFα 和丁酸作用后450 nm 处的OD 值。结果通过细胞增殖活力计算得到:细胞活力(%)=[A(加药)-A(空白)]/[A(0 加药)-A(空白)]x100。其中A(加药)代表有培养基,细胞,药物和CCK-8的孔的OD 值,A(0 加药)代表有培养基,细胞和CCK-8 的孔的OD 值,A(空白)代表有培养基和CCK-8 的孔的OD 值。1 次实验设置3 个平行孔,各组试验重复3 次。
1.4 单层上皮屏障FITC-dextran 渗透性检测
Caco2 细胞(1×104/200 µL)接种于Transwell 24 孔板中的上室内,下室内加入1.5 mL 新鲜培养基,Caco2 细胞接种稳定贴壁后,隔日更换培养基,待培养21 d 后,按照实验分组,予TNFα(终浓度为100 ng/mL)和丁酸(终浓度为0.2 mM/L)干预48 h。将细胞原培养基吸出,上室换成含有终浓度为1 mg/mL 的FITC-dextran 的无血清培养基100 µL,下室换为无血清培养基1 mL,放回细胞培养箱,37℃孵育2 h 后从下室吸取100 µL 培养基到荧光酶标仪上检测。根据已知浓度梯度的稀释液的标准曲线计算FITC-dextran 的透过率。
1.5 RT-qPCR 检测不同干预细胞ZO-1 和Occludin 的mRNA 表达量
取出细胞后弃旧培养基,PBS 清洗1 次,按照TRIzol 试剂说明书提取不同因素干预的Caco2细胞的总RNA,超微量分光光度计测定总RNA浓度及纯度。用RevertAid First Strand cDNA 试剂盒以2 µg 总RNA 为模板在基因扩增仪制备cDNA。之后以cDNA 为模板,采用实时定量PCR 仪,SYBR Green 荧光染料进行相对定量。在20 µL 反应体系中,加入cDNA 模板2 µL,无酶水6.0 µL,SYBR Premix 荧光定量反应试剂10 µL,上游、下游引物各1.0 µL。该实验设定的反应条件如下:95℃预变性2 min;PCR 反应阶段:95℃变性15 s,60℃退火10 s,72℃延伸20 s,重复变性,退火及延伸,共循环40 次;溶解曲线为95℃15 s,60℃ 60 s,95℃ 15 s。实验中使用的引物序列如下:ZO-1:上游(5′-3′):ACCAGTAAGTCGTCC TGATCC,下游(5′-3′):TCGGCCAAATCTTCTCAC TCC;Occludin:上游(5′-3′):ACAAGCGGTTTTA TCCAGAGTC,下游(5′-3′):GTCATCCACAGGCGA AGTTAAT;GAPDH(5′-3′):上游:CATGAGAAGT ATGACAACAGCCT,下游(5′-3′):AGTCCTTCCAC GATACCAAAGT,以GAPDH 为内参,采用2-ΔΔCt公式计算得出结果。
1.6 免疫荧光检测ZO-1,Occludin 在Caco2细胞中的表达与分布
各组细胞经过PBS 清洗1 次后,用预冷甲醇固定细胞爬片5 min,PBS 清洗1 次,之后用0.3% Triton-X100 室温孵育10 min,而后PBS 再次清洗1 次。10%山羊血清封闭1 h,PBS 清洗1 次,而后孵育一抗(ZO-1,1∶500;Occludin,1∶200),于4℃冰箱过夜,次日37℃孵育箱或室温复温后,PBS 清洗3 次,二抗孵育1 h,PBS清洗3 次,最后用含DAPI 的抗荧光淬灭剂封片。置于荧光显微镜下观察,拍照并用Image J 进行分析。
1.7 统计学处理
采用GraphPad Prism 9.0 对数据进行整理,统计和分析及绘图。以均数±标准差(Mean±SD)表示正态分布的计量资料,多组间比较采用AVONA 方差分析,组间2 组比较采用Dunnett’s法,而析因设计的实验采用析因方差分析,组间2 组比较采用Tukey 法,P<0.05 为差异有统计学意义。
2 结果
2.1 丁酸保护TNFα 所致Caco2 细胞单层屏障损伤
2.1.1 TNFα 对Caco2 细胞存活率的影响CCK-8 检测细胞存活率结果表明,不同终浓度TNFα(0,20,50,100,200,500,1 000)ng/mL作用于Caco2 细胞(0,12,24,36,48,60,72)h后,与0 ng/mL TNFα 组相比,(20,50,100)ng/mL TNFα 组的细胞存活率随着TNFα 浓度的增加而降低,而(200,500,1 000)ng/mL TNFα 干预后细胞存活率下降不明显;与0 h 相比,随着作用时间延长,Caco2 细胞存活率逐渐下降,之后细胞存活率下降速度明显减慢。20 ng/mL TNFα 组作用24,36,48,60 h 后细胞的存活率分别为:(91.807±0.018)%,(82.979±0.041)%,(72.675±0.015)%,(67.987±0.012)%;50 ng/mLTNFα 组作用24,36,48,60 h 后细胞的存活率分别为:(77.205±0.026)%,(69.885±0.027)%,(53.903±0.112)%,(46.266±0.032)%;100 ng/mL TNFα组作用24,36,48,60 h 后细胞的存活率分别为:(62.927±0.019)%,(55.524±0.032)%,(34.429±0.008)%,(29.674±0.012)%;200 ng/mL TNFα组作用24,36,48,60 h 后细胞的存活率分别为:(60.098±0.018)%,(51.074±0.028)%,(27.407±0.099)%,(23.748±0.077)%。随着TNFα 浓度越高作用时间越长,细胞的存活率越低,100 ng/mL作用48 h 与36 h 和60 h 分别相比,P<0.000 1;200 ng/mL TNFα 作用48 h 与36 h 和60 h 相比,分别为P<0.000 1 和P<0.01。相比TNFα 作用36 h 和60 h,TNFα 作用48 h 诱发更加明显的细胞存活率下降幅度;与200 ng/mLTNFα 作用48 h相比,100 ng/mL TNFα 诱发Caco2 细胞存活率下降的幅度更大。故选择100 ng/mL TNFα 作用48 h 为后续实验干预条件,见图1A。

图1 丁酸和TNFα 对Caco2 细胞存活率的影响Fig.1 The effect of butyric acid and TNFα on the survival rate
2.1.2 不同浓度丁酸作用不同时间对Caco2 细胞存活率的影响由于100 ng/mL TNFα 作用时间48 h 后可以明显降低Caco2 细胞存活率,因而,进一步研究不同终浓度丁酸作用36,48 和60 h后对Caco2 细胞存活率的影响。CCK-8 实验结果表明,当丁酸的终浓度为0~0.2 mM/L 时,随着浓度的增加,丁酸促进细胞增值的能力越强,但其终浓度大于0.5 mM/L 时,降低细胞存活率;在丁酸的终浓度波动在0~0.5 mM/L 范围内,随着作用时间的延长,不同浓度丁酸提高Caco2 细胞存活率的作用越来越弱。在丁酸终浓度为0.2 mM/L 时,作用36,48 和60 h 均可以明显促进Caco2 细胞的增值,细胞存活率分别为(120.953±0.118)%,(113.793±0.054)%,(109.098±0.035)%,3 组间相互比较,P<0.000 1,见图1B。
2.1.3 丁酸和TNFα 共同作用时对Caco2 细胞存活率的影响由于终浓度为100 ng/mL 的TNFα 作用48 h 后能明显降低细胞存活率,且不同浓度丁酸刺激Caco2 48 h 后已经可以明显提高细胞存活率,为此,在形成单层屏障的Caco2 细胞中同时加入终浓度为100 ng/mL 的TNFα 和不同浓度丁酸(0.05,0.1,0.2,0.5 mM/L)作用48 h。CCK-8 细胞活力检测实验结果发现:当丁酸与TNFα 共同作用48 h 后,TNFα 降低细胞存活率的作用被抑制,提示丁酸可以抑制TNFα 对细胞的损伤。丁酸终浓度为0.05~0.2 mM/L 之间时,丁酸的保护作用逐渐增强。与0 mM/L 组(100.007±0.219)%相比,0.05,0.1,0.2 mM/L 丁酸组的细胞存活率分别为(109.388±0.127)%(P<0.000 1),(122.416±0.131)%(P<0.000 1),(146.288±1.188)%(P<0.000 1)。丁酸终浓度大于0.2 mM/L时,对TNFα 所致的损伤仍有保护作用(P<0.000 1),但保护作用呈下降趋势,见图1C。为此,确定终浓度为100 ng/mL 的TNF 和0.2 mM/L的丁酸作用48 h 作为后续研究Caco2 的实验条件。
2.2 TNFα 和丁酸对Caco2 生长情况的影响
倒置显微镜下观察:丁酸和TNFα 干预 48 h后,对照组和丁酸干预组细胞生长状态良好,细胞间连接紧密,边界清晰,丁酸组更明显;丁酸和TNFα 共同干预组和TNFα 干预组细胞生长状态欠佳,密度减低,出现皱缩,边界不清晰,与周围细胞脱离,TNFα 干预后细胞形态及数量改变更加明显,见图2。
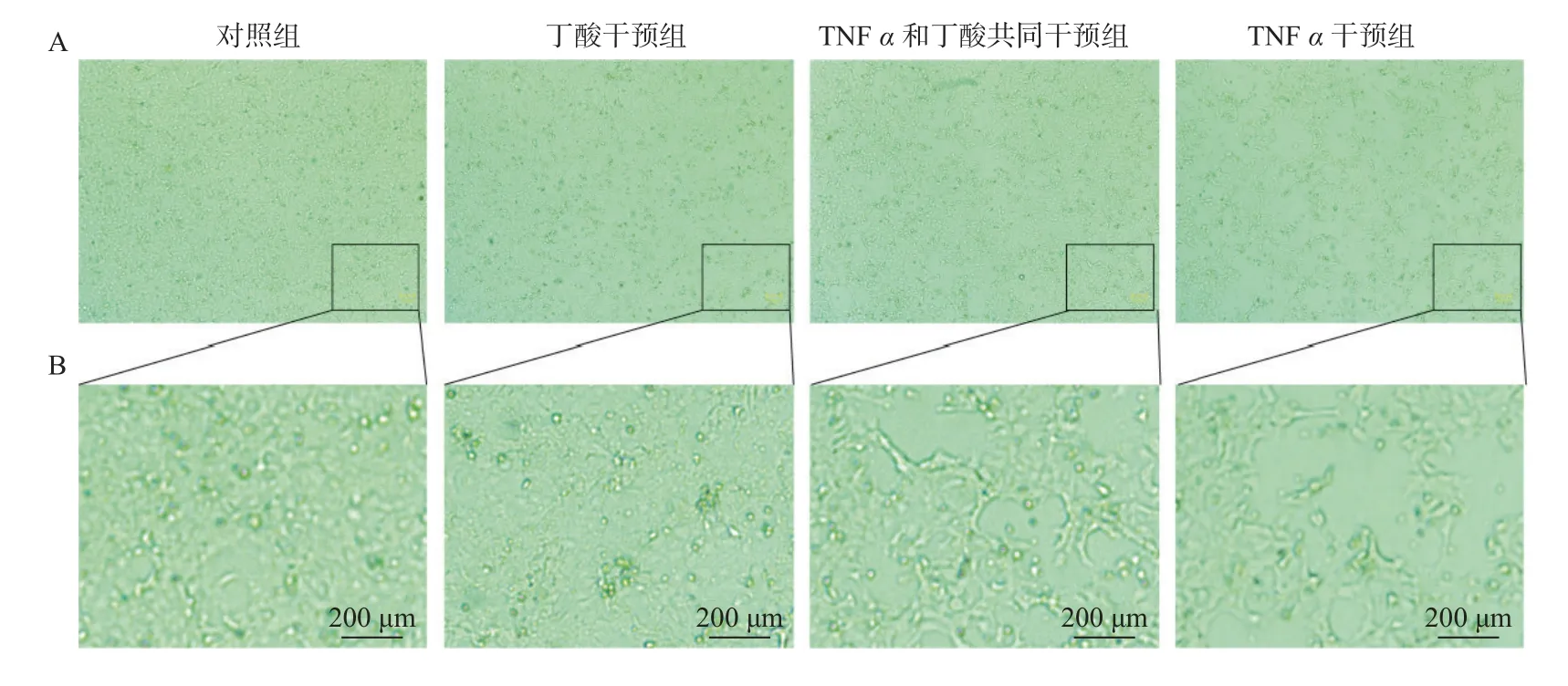
图2 TNFα 和丁酸干预Caco2 细胞48 h 后对细胞形态及生长状态的影响(标尺=200 µm)Fig.2 The morphology and growth of Caco2 cells after 48 h of intervention of TNF α and butyric acid(scale bar=200 µm)
2.3 TNFα 和丁酸对Caco2 细胞所形成的的单层上皮屏障渗透性的影响
与对照组Transwell 下室内的FITC-dextran 的浓度(3.337±0.125 3 )µg/mL 相比,丁酸干预组中的FITC-dextran 浓度(3.013±0.012 62 )µg/mL 下降(P<0.05),而TNFα 和丁酸共同干预组和TNFα 干预组中的FITC-dextran 浓度(6.301±0.040 62 )µg/mL 升高(P<0.000 1),TNFα 干预组更甚(P<0.000 1);与TNFα 和丁酸共同干预组,TNFα 干预组的浓度(8.291±0.060 87 )µg/mL 升高更加明显(P<0.000 1)。证明丁酸可以减轻TNFα 所致的Caco2 细胞单层屏障FITC-dextran的升高,见图3。
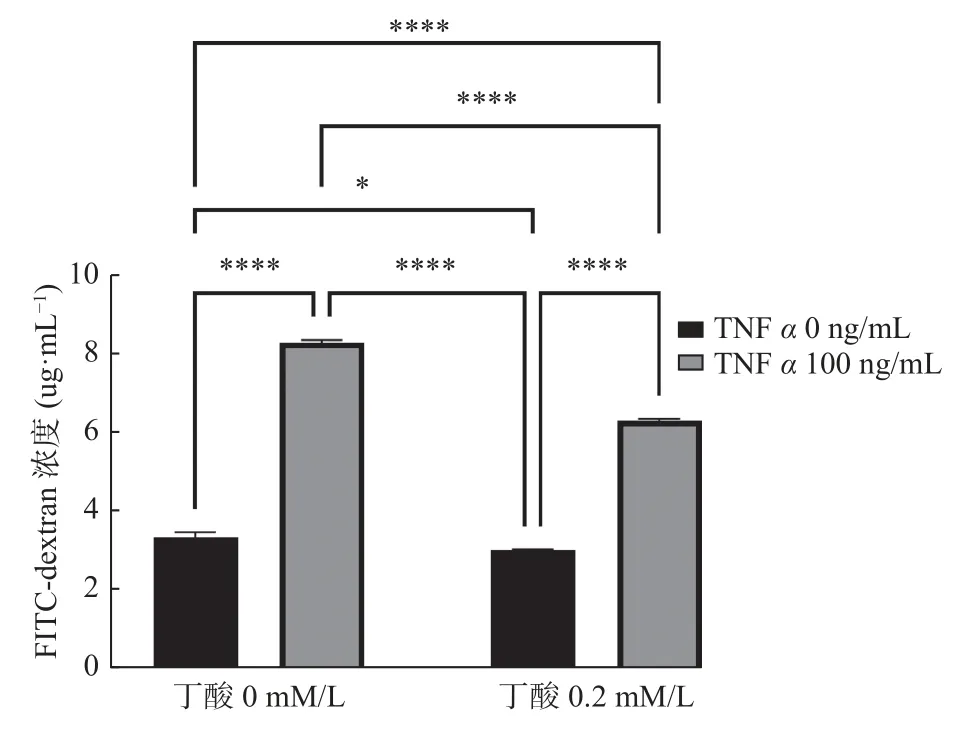
图3 TNFα(100 ng/mL)和丁酸(0.2 mM/L)共同作用48 h对Caco2 单层上皮屏障渗透性的影响Fig.3 The combined effect of TNFα(100 ng/mL)and butyric acid(0.2 mM/L)on the permeability of the Caco2 monolayer epithelial barrier after 48 hours
2.4 TNFα 和丁酸对 Caco2 细胞 ZO-1 和Occludin mRNA 表达的影响
RT-qPCR 发现:TNFα 和丁酸作用48 h 后,与对照组相比,丁酸干预组ZO-1 的mRNA 表达变化不大(P >0.05),TNFα 和丁酸共同干预组中ZO-1 表达量较对照组无差异,而TNFα 单独干预组ZO-1 的mRNA 表达降低(P<0.05);与TNFα 干预组相比,TNFα 和丁酸共同干预组中ZO-1 表达量升高(P<0.01),见图4A;与对照组相比,丁酸干预组基因的表达升高(P<0.05),丁酸和TNFα 组共同干预和TNFα 干预组的表达下降(分别为P<0.05 和P<0.01),而丁酸和TNFα 共同干预组Occludin 的mRNA 表达高于TNFα 干预组(P<0.01)。证明丁酸可以减轻TNFα 所致的Caco2 紧密连接蛋白表达量减少,见图4B。

图4 TNFα 和丁酸单独或共同作用48 h 对Caco2 细胞紧密连接蛋白的mRNA 表达的影响Fig.4 The mRNA expression of tight junction proteins in Caco2 cells after exposure to TNF α or butyric acid for 48 h
2.5 TNFα 刺激对Caco2 细胞ZO-1 和Occludin在细胞的表达和分布的影响
免疫荧光显示:TNFα 刺激减少细胞数量,下调ZO-1 和Occludin 的表达量并扰乱ZO-1 和Occludin 在细胞内的定位,使其更加接近细胞核,细胞膜和膜周分布减少,细胞间连接变得松散,不均匀,甚至出现断裂。而丁酸能够增加细胞数量并ZO-1 和Occludin 的表达量,使其在细胞膜和膜周分布更加紧密,细胞连接完整,减轻TNFα 所致的细胞损伤,改善细胞数量及细胞间连接状态,见图5~图6。

图5 TNFα 和丁酸和作用48h 后Caco2 细胞ZO-1 表达和分布的变化(免疫荧光染色,放大倍数为×800,DAPI 标记细胞核为蓝色,ZO-1 染为绿色)Fig.5 The expression and distribution of ZO-1 on Caco2 cells after exposure to TNF α and Butyric acid for 48 hours(immunofluorescence staining,magnification at ×800,DAPI labeled nucleus as blue,ZO-1 stained as green)

图6 丁酸和TNFα 作用48 h 后Caco2 细胞Occludin 表达和分布的变化(免疫荧光染色,放大倍数为800 倍,DAPI 标记细胞核为蓝色,Occludin 染为绿色)Fig.6 The expression and distribution of Occludin on Caco2 cells after exposure to TNF α and Butyric acid for 48 hours(immunofluorescence staining,magnification at ×800,DAPI labeled nucleus as blue,Occludin stained as green)
3 讨论
溃疡性结肠炎病因和发病机制复杂,在世界范围内的发病率逐渐上升,死亡率也在增加,社会负担加重。发病过程中,肠粘膜及黏膜下层受到累及,肠道菌群及菌群代谢产物发生明显的改变。它们之间的相互作用影响患者对治疗的反应及预后[7]。本实验研究发现,低浓度丁酸可以促进肠上皮细胞生长,改善其存活率及生长状态,维持肠上皮屏障的完整性,增加紧密连接蛋白ZO-1和Occludin 的mRNA 表达,并维持其在细胞内的正常分布,从而减轻TNFα 所致的肠上皮屏障损伤。
3.1 溃疡性结肠炎病理特点
由于溃疡性结肠炎的炎症局限于黏膜和黏膜下层,因而,结肠上皮细胞在该病的发病过程中扮演重要角色[8]。结肠上皮屏障主要由单层肠上皮细胞和细胞间紧密连接蛋白组成[9]。其维持肠上皮细胞结构完整性的功能与肠粘膜屏障的连续性密切相关,其功能失调是导致肠粘膜通透性增加的关键因素,也是介导溃疡性结肠炎发生和发展的关键因素[10]。紧密连接由Occludin,Claudin,和ZO 等蛋白构成,Occludin 与ZO-1 结合组成紧密连接的基础,其相互作用影响着紧密连接的完整性。Occludin 具有封闭细胞间隙、调控细胞旁转运和调节信号传导等作用,而ZO-1 影响细胞的增值、分化和生长,调控者细胞间信号转导和渗透[11]。FITC-dextran 作为一种荧光物质,可以用来反映肠上皮屏障的完整性和通透性[12],当肠上皮屏障损伤后,该物质在Caco2 形成的单层上皮屏障中的透过率增加,而完整的上皮结构可以明显降低FITC-dextran 的透过率。
3.2 溃疡性结肠炎与TNFα
溃疡性结肠发病过程中,炎症因子所发生的级联反应导致如TNFα、IL-12 等前炎症因子的产生,随即通过胞内蛋白(如JAK 等)进行信号传导[13]。TNFα 与潘氏细胞的坏死,血管形成,巨噬细胞的活化和T 细胞的活化有关,随着该病所处的阶段而变化,个体间也存在差异。且TNFα在维持肠道完整性及肠道炎症的发生发展过程中扮演重要角色[14]。因而,成为众多当前治疗的作用靶点之一[15-16]。抗TNFα 的治疗也被证实在炎症性肠病中有治疗效果[17],但具体的作用机制并不明确。故而本实验中直接选择TNFα 作为刺激因素,借助Caco2 细胞构建体外肠屏障损模型进一步探讨TNFα 对Caco2 的作用,为后续的机制研究奠定基础。本实验中20,50,100 ng/mL 的TNFα 可以明显降低Caco2 细胞存活率,以100 ng/mL 浓度作用48 h 明显。TNFα 刺激Caco2细胞后,细胞存活率下降,细胞生长状态欠佳,细胞间连接变得松散,FITC-dextran 的渗透增加,细胞间紧密连接蛋白ZO-1 和Occludin 的表达下降,在细胞内的分布也发生改变,排列杂乱。
3.3 丁酸与肠上皮紧密连接
丁酸是一种短链脂肪酸,由结肠微生物发酵未被分解的碳水化合物获得,为肠粘膜上皮细胞提供其所需的60%~70%的能量,且有助于稳定肠道PH 值,肠道菌群及肠道电解质等,促进肠上皮细胞增值,还可以通过识别G 蛋白偶联受体和过氧化物酶受体,影响炎症因子和趋化因子的表达,也可以抑制严重因子的表达,促进抗菌肽分泌,维持肠上皮的完整性,从而缓解溃疡性结肠炎[18]。丁酸可以介导AMPK 磷酸化,抑制MLC2 磷酸化,促进ZO-1 形成紧密连接,修复屏障障碍,改善肠上皮的结构及功能,调控肠粘膜的通透性[19-20]。因而,丁酸在促进肠上皮细胞增值,维持肠上皮细胞的完整性中发挥重要作用。在双盲,以安慰剂为对照的小规模研究中,发现在传统治疗基础上服用丁酸钠微型胶囊2 月的溃疡性结肠炎患者生活质量得到明显改善[21]。在DSS 诱导的结肠炎小鼠模型中,提前给予丁酸钠干预,可以减轻肠道炎症并改善肠上皮屏障通透性及增加ZO-1 的表达[22]。而本实验中,不同浓度丁酸作用下,低终浓度时(0~0.5 mM/L)提高细胞存活率,促进细胞生长,高浓度时则表现出相反的作用,证实低浓度丁酸对肠粘膜屏障具有保护作用。0~0.5 mM/L 终浓度丁酸作用36,48 和60 h 后均可促进细胞增生,0.2 mM/L 终浓度丁酸发挥最大效应。
当TNFα 与丁酸同时作用时,细胞的存活率可得到明显改善,证明丁酸可以拮抗TNFα 对细胞的损伤。当TNFα 和丁酸共同作用48h 后Caco2 细胞的存活率得到改善,细胞形态和生长状态好转,降低的FITC-dextran 的通透性得到提高,ZO-1 和Occludin 的mRNA 表达量增加,在细胞的分布较TNFα 单独作用明显改善,意味着Caco2 细胞皮屏障功能损伤减轻,进一步证实丁酸可以减轻TNFα 所致肠上皮屏障损伤。
综上所述,丁酸可以提高肠上皮细胞的存活率,改善其生长状态,降低肠上皮的渗透性并维持细胞间紧密连接,有效减轻TNFα 所致的肠屏障损伤。本研究存在的不足之处在于:本研究重点关注在TNFα 和丁酸干预后Caco2 的形态及屏障功能状态变化,尚未进行相关机制研究,需要更深的实验加于明确。另外,本实验只针对Caco2 细胞进行实验,而肠上皮细胞株还有很多,需要进一步明确TNFα 和丁酸对其它肠道细胞株的影响。总之,本研究探讨了丁酸对TNFα 所致Caco2 单层细胞屏障功能损伤的影响,为进一步明确丁酸在溃疡性结肠炎治疗中的作用机制提供实验基础。
