Corilagin 对OX-LDL 诱导的HUVECs 细胞损伤的保护作用及对MyD88 信号通路表达的影响
2023-10-24陶代菊李雨晴陈临宜杨仁华沈志强
陶代菊,陈 鹏,李雨晴,陈临宜,杨仁华,何 波,沈志强
(昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明 650500)
动脉粥样硬化(atherosclerosis,AS)是一种以大动脉壁聚集脂质沉积物为主要特征的慢性炎症性疾病,其发病机理是一个复杂的级联反应,ox-LDL 的形成和摄取是AS 进展的关键步骤[1]。在氧化环境中,低密度脂蛋白(low density lipoprotein,LDL)被氧化修饰为氧化型LDL(oxidized low density lipoprotein,ox-LDL),ox-LDL 会与内皮细胞以及单核细胞/巨噬细胞上的多种清道夫受体(scavenger receptors,SRs)结合,最终导致在狭窄的动脉粥样硬化动脉中形成富含血小板和白细胞的凝块[2]。
蛋白质髓样分化初级反应蛋白88(myeloid differentiation primary response 88,MyD88)是一种重要的衔接分子,通过下调TLR-4/MyD88/P65 表达,可减轻单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)及TNF-α 介导的内皮细胞凋亡和动脉粥样硬化进展[3-7]。因此,MyD88 信号通路在AS 发生发展过程中扮演着重要的调控作用。
AS 已经成为威胁人类生命健康的主要疾病之一,目前临床仍缺乏有效的治疗药物[8]。虽然应用他汀类为代表的调血脂药取得了一定疗效,但其严重的不良反应限制了其发展。因此,从天然产物中寻找治疗AS 的潜在药物具有重要意义。Corilagin 是一种从Phyllanthus urinaria L.中分离的天然化合物,具有多种药理作用[9]。研究发现Corilagin 在体内外均能抑制ox-LDL 诱导的血管平滑肌细胞的增殖和迁移[10],还可降低ox-LDL诱导的HUVECs 的LOX-1 表达水平[11-12],提示其具有良好的抗AS 作用。本研究将通过MyD88信号通路进一步探讨Corilagin 干预对ox-LDL 诱导损伤的HUVECs 细胞的保护作用。
1 材料与方法
1.1 研究材料
1.1.1 细胞人脐静脉内皮细胞(HUVECs),购自中国典型物保藏中心。
1.1.2 药物Corilagin 由中科院昆明植物研究所提供,结构式见图1,分子量为634.46,纯度为99.5%,黄褐色粉状物,避光密封4℃保存。辛伐他汀原料药(Q12VK-FO),购自Sigma,分子式C25H38O5,分子量418.57,纯度 >99%,防潮低温避光保存。维生素E(Vit E)原料药(T-438),购自Sigma,分子式为C29H50O2,分子量为430.71,纯度 >99%,白色粉末,-20℃保存。

图1 Corilagin 的化学结构式Fig.1 Chemical structure of Corilagin
1.1.3 主要试剂OX-LDL 购自广州奕源生物科技有限公司,MTT-705B054 购自Solarbio 公司,BCA 蛋白浓度测定试剂盒购自碧云天公司,TRNzol-A+总RNA 提取试剂裂解液,Golden Taq PCR 试剂盒,TIANScript M-MLV 第一链cDNA 合成试剂盒购自Fermentas 公司,一抗β-actin 购自SAB 公司,MYD88(1∶1 000),P65(1∶500),TNF-α(1:500),MCP-1(1∶1 000)购自爱博泰克生物科技有限公司。
1.2 研究方法
1.2.1 药液配制Corilagin 药液:用PBS 溶液配制成2 mmol/L 的Corilagin 母液。辛伐他汀药液:用PBS 溶液配制成10 000 µmol/L 的辛伐他汀母液。维生素E 药液:用PBS 溶液配制成10 000 µmol/L的维生素E 母液。药液均临用前稀释成所需浓度。
1.2.2 细胞鉴定(1)显微镜观察法:HUVECs 的细胞形态于倒置相差显微镜下观察并拍照;(2)免疫组织化学法:将消毒灭菌后的0.5 cm×0.6 cm盖玻片放置在6 孔培养板内,并将HUVECs 浓度调整为1×105个/mL,按2 mL/孔接种于6 孔板内。培养至HUVECs 融合80%~90%后,取出盖玻片。检测HUVECs 的VIII 因子、CD34的表达,分别分为实验组和阴性对照组2 组,每组设3 个复孔,按照免疫组化流程处理后,于荧光显微镜下观察,并拍照保存。
1.2.3 MTT 实验方法将计数后的上述HUVECs接种于96 孔板上,加入MTT(5 mg/mL)孵育4 h,再用三联液孵育8 h 后,测定570 nm 和630 nm处的OD 值。
1.2.4 复制ox-LDL 诱导HUVECs 细胞损伤用含EDTA 的胰蛋白酶消化HUVECs,经细胞计数调整浓度为5×104个/mL,100 µL/孔接种到96 孔板内,培养24 h。每次种板4 块,分别用于探索HUVECs 的损伤时间:6 h、12 h、24 h、48 h,实验重复3 次。每块板设正常对照组和ox-LDL 组。正常对照组:加入等量的PBS;ox-LDL 组:分别加入终浓度为10 mg/L、20 mg/L、30 mg/L、40 mg/L、50 mg/L、60 mg/L、70 mg/L、80 mg/L 的ox-LDL。应用改良MTT 法测定不同损伤浓度及时间条件下ox-LDL 对HUVECs 的损伤程度,以确定ox-LDL 损伤HUVEC 的适宜浓度及时间。
1.2.5 Corilagin 对ox-LDL 诱导损伤的人脐静脉内皮细胞HUVECs 保护作用观察用含EDTA 的胰蛋白酶消化HUVECs,经细胞计数调整浓度为5×104个/mL,并以100 µL/孔接种到96 孔板内,培养24 h。每次种板6 块,重复3 次,每块板上设9 个组:正常组;模型组;阳性药组:(Vit E:10 µmol/L、辛伐他汀:1 µmol/L);Corilagin 给药组(3.125、6.25、12.5、25、50 µmol/L)。按照分组进行实验,根据改良MTT 法测定细胞活力,评价Corilagin 对ox-LDL 损伤HUVECs 的保护作用及其量-效/时-效关系。
1.2.6 RT-qPCR 检测ox-LDL 损伤的HUVECs 中MyD88、P65、TNF-α、MCP-1 mRNA 的表达将细胞分成正常组,模型组,阳性药组(Vit E:10 µmol/L、辛伐他汀:1 µmol/L);Corilagin 组:Corilagin(3.125、6.25、12.5、25、50 µmol/L)一共9 个组。孵育24 h,收集细胞提取总RNA 进行RT-qPCR 定量检测,引物序列见表1。

表1 引物序列Tab.1 Primer sequences
1.2.7 Western blot 检测ox-LDL 损伤的HUVECs及VSMCs 中MyD88、P65、TNF-α、MCP-1 蛋白的表达实验分组同1.2.6,细胞培养24 h 后,按照分组加入对应的药物浓度,孵育24 h,所有给药组给予70 mg/L 的ox-LDL,刺激12 h,将各组细胞分别置于冰上充分研磨后提取总蛋白,总蛋白浓度用BCA 蛋白检测试剂盒测定。蛋白质样品用12%、15%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离,然后转移到聚偏二氟乙烯膜。用无蛋白快速封闭液封闭膜20 min。将PVDF 膜与一抗在4℃孵育过夜,用TBST 洗涤3 次后与二抗孵育2 h。TBST 洗涤3 次,用Bio-Rad 凝胶成像系统显影、收集和分析靶蛋白的图像,采用ImageJ 软件统计数据。
1.3 统计学处理
2 结果
2.1 HUVECs 的鉴定
2.1.1 形态学鉴定倒置显微镜下显示,HUVECs细胞呈扁平的卵圆形、梭形、多角形,细胞均匀透亮,边界清晰,胞核清晰,呈圆形或椭圆形,有2~3 个核仁。胞浆内含小颗粒,结构完整,符合血管内皮细胞的基本形态,见图2A~2B。

图2 HUVECs 形态学鉴定(A×100,B×400)Fig.2 Morphological identification of HUVECs(A×100,B×400)
2.1.2 免疫学鉴定内皮细胞的特异性蛋白CD34、Ⅷ因子既是胞浆蛋白也是胞膜蛋白。通过免疫化学鉴定结果表明,阴性对照细胞形态完整,背景清晰均匀,而阳性组细胞边界清晰,呈棕红色,胞浆和胞膜边缘颜色更深,细胞核明显,见图3A。HUVEC Ⅷ因子的阳性表达,见图3B;CD34 阳性表达,进一步证实培养的细胞为HUVECs,见图3D。

图3 免疫组化法检测HUVECs 细胞Ⅷ、CD34 因子表达(×400)Fig.3 Immunohistochemical detection of factor VIII.and CD34 expression in HUVECs cells(×400)
2.2 OX-LDL 刺激HUVECs 损伤模型
寻找最佳的ox-LDL 刺激HUVECs 损伤模型的条件。结果显示,随着ox-LDL 浓度的增加,OD 值下降,说明ox-LDL 对HUVECs 具有损伤作用。与正常对照组比较,刺激6 h,70 mg/L 和80 mg/L 浓度的ox-LDL 明显损伤了HUVECs(P<0.01);刺激12、24、48 h,60~80 mg/L 浓度的ox-LDL 明显损伤HUVECs(P<0.01)。因此,笔者最终选取终浓度为70 mg/L 的ox-LDL 刺激HUVECs 12 h 作为复制ox-LDL 损伤HUVECs 模型的最佳条件,见图4。

图4 ox-LDL 对HUVECs 损伤模型的复制(,n=6)Fig.4 Replication of HUVECs damage model by ox-LDL(,n=6)
2.3 Corilagin 对ox-LDL 损伤HUVECs 的保护作用
与正常对照组比较,ox-LDL 损伤模型组的细胞活力明显降低(P<0.01);与模型比较,孵育12 h,6.25~50 µmol/L 的Corilagin 处理组的细胞活力明显提高,25 µmol/L 的Corilagin 保护作用最明显,细胞活力较模型组提高50%,50 µmol/L 的Corilagin 组细胞活力与25 µmol/L 组基本持平(P<0.01);孵育24 h,3.125~50 µmol/L 的Corilagin处理组的细胞活力明显提高,25 µmol/L 的Corilagin组细胞活力最高,接近正常组水平(P<0.01);孵育48 h,仅25 µmol/L 和50 µmol/L 的Corilagin 处理组的细胞活力明显提高,较模型组提高30%(P<0.01),见图5。这表明,Corilagin 能对ox-LDL 损伤的HUVECs 具有保护作用,其中以25 µmol/L 和50 µmol/L 的浓度效果最显著。
2.4 Corilagin 对ox-LDL 损伤HUVECs 中MyD-88、P65、TNF-α、MCP-1 mRNA 表达的影响
与正常对照组比较,ox-LDL 模型组的MyD88、NF-kB、TNF-α、MCP-1mRNA 的表达量显著升高(P<0.01)。与ox-LDL 模型组比较,不同浓度Corilagin(12.5 µmol/L、25 µmol/L、50 µmol/L)组和阳性药组(辛伐他汀、维生素E)的MyD88、P65、MCP-1、TNF-α mRNA 的表达量均显著降低(P<0.05),见图6。以上结果表明,Corilagin 可抑制ox-LDL 诱导 HUVECs 的 HUVECs 损伤中的MyD88、P65、TNF-α、MCP-1 的mRNA 表达。
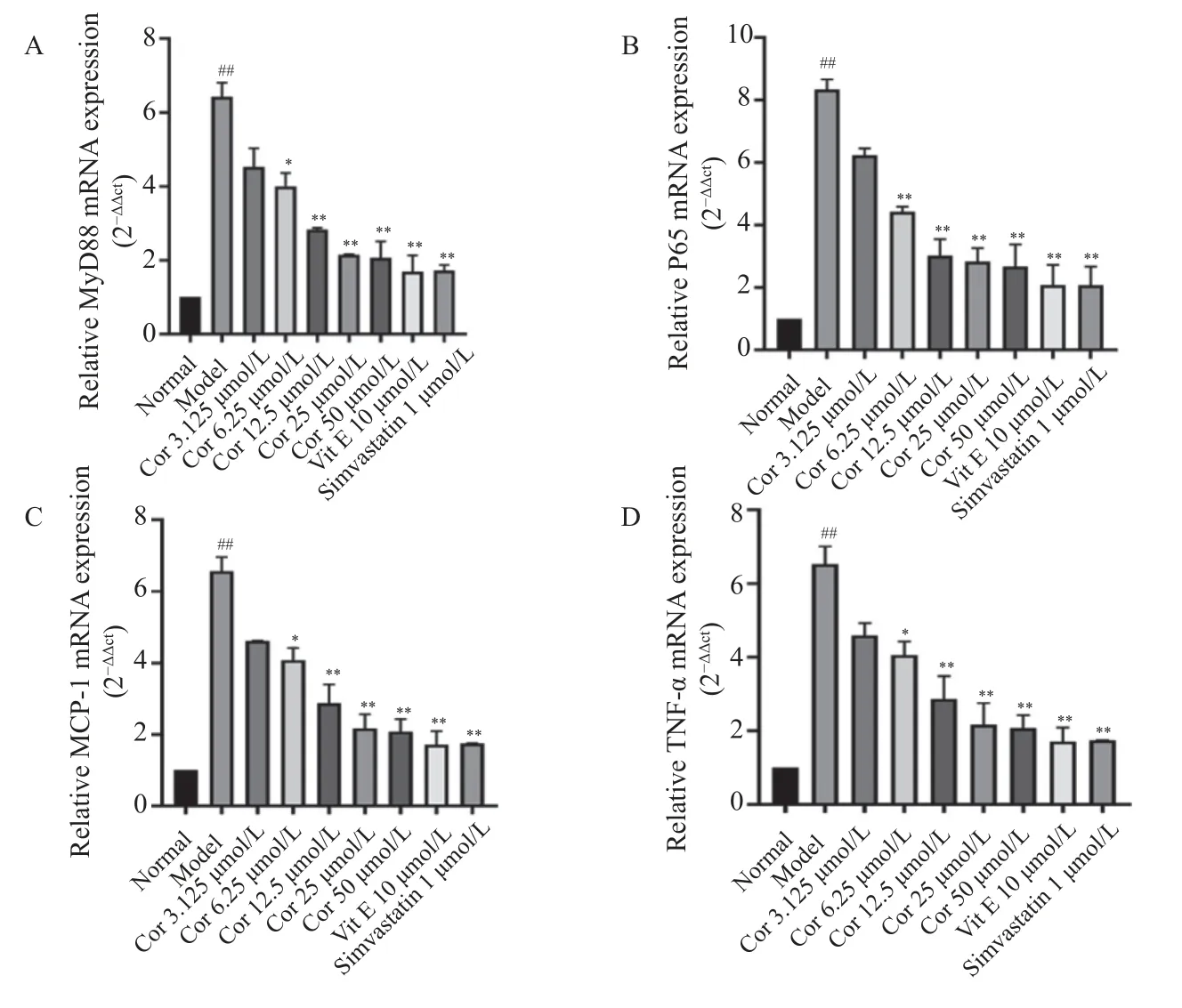
图6 Corilagin 对OX-LDL 诱导的HUVECs 中P65、MCP-1、MyD88 和TNF-α 的mRNA 表达的影响(,n=6)Fig.6 Effect of Corilagin on mRNA expression of P65,MCP-1,MyD88 and TNF-α in OX-LDL-induced HUVECs(,n=6)
2.5 Corilagin 对ox-LDL 损伤HUVECs 中MyD-88、P65、TNF-α、MCP-1 蛋白表达的影响
与正常对照组比较,ox-LDL 模型组MyD88、P65、TNF-α、MCP-1 蛋白表达均显著升高(P<0.01)。与模型组比较,Vit E 10 µmol/L、辛伐他汀1 µmol/L 组和不同浓度Corilagin(12.5 µmol/L、25 µmol/L、50 µmol/L)组MyD88、P65、TNF-α、MCP-1 蛋白表达均出现显著降低(P<0.05),见图7。以上结果显示,Corilagin 可抑制ox-LDL 损A:OX-LDL 刺激6 h 对HUVECs 细胞的影响;B:OX-LDL 刺激12 h 对HUVECs 细胞的影响;C:OX-LDL 刺激24 h 对HUVECs 细胞的影响;D:OX-LDL 刺激48 h 对HUVECs 细胞的影响。与正常组相比,**P<0.01。伤的HUVECs 中MyD88、P65、TNF-α、MCP-1蛋白表达。
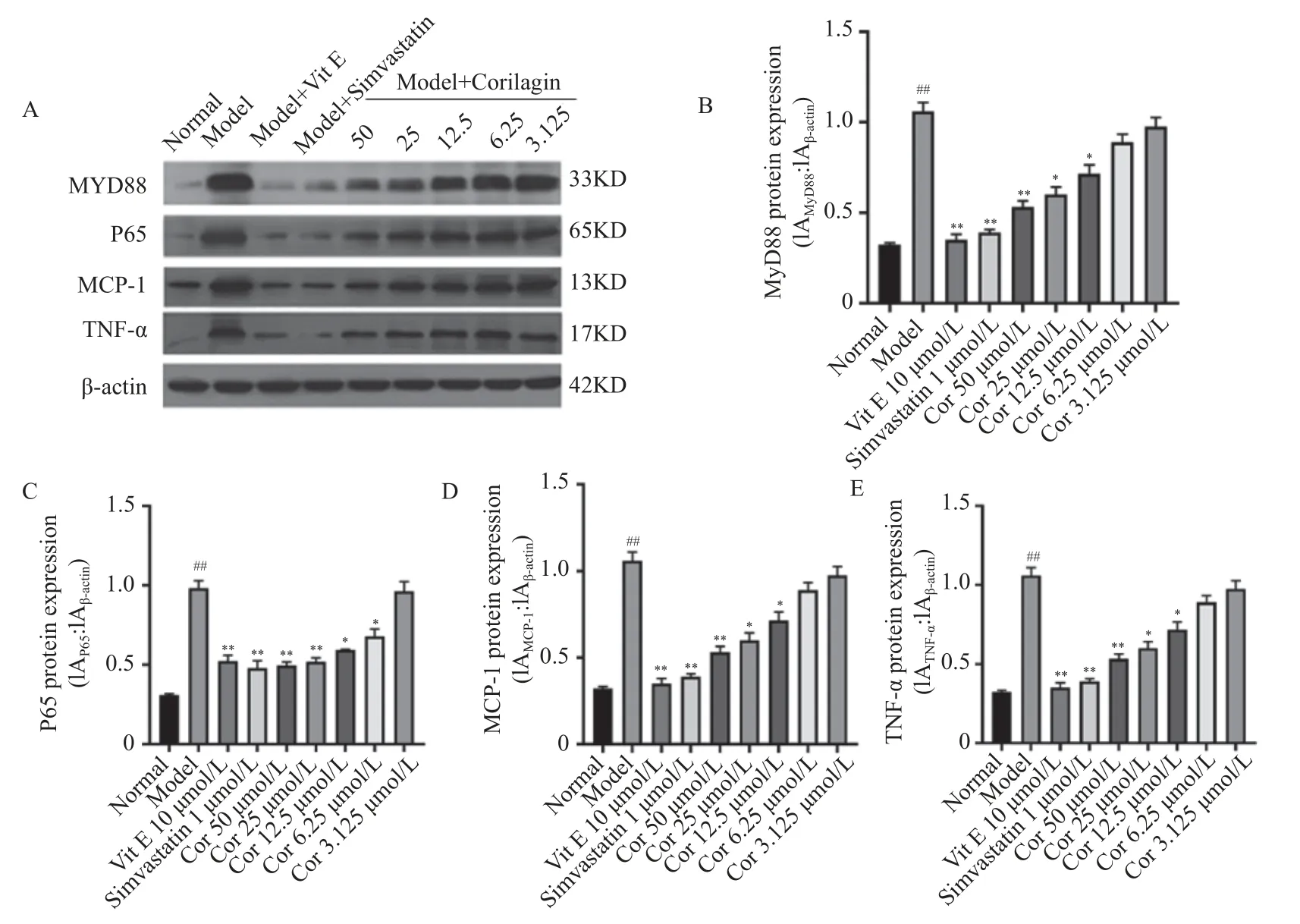
图7 Corilagin 对OX-LDL 诱导的HUVECs 中P65、MCP-1、MyD88 和TNF-α 的蛋白表达的影响(,n=3)Fig.7 Effect of Corilagin on protein expression of P65,MCP-1,MyD88 and TNF-α in OX-LDL-induced HUVECs(,n=3)
3 讨论
AS 病程复杂,涉及脂质代谢紊乱和免疫细胞向动脉壁募集等病理过程。他汀类药物是治疗血脂异常的一线药物,具有降低LDL-C 的功效,然而,部分人对他汀类药物不耐受,且不良反应较多,限制其使用[13],因此,寻找安全有效的抗AS 药物是医药学界急需解决的问题。
血管内皮细胞是参与AS 发生发展的关键细胞之一,研究选用HUVECs 细胞系,通过鉴定发现该细胞符合血管内皮细胞的形态特征并且高表达血管内皮细胞特异性蛋白CD34 和Ⅷ,提示该细胞系确为HUVECs。目前普遍认为血管内皮细胞的氧化损伤是AS 发展的始动环节,采用ox-LDL 诱导后笔者发现60~80 mg/L 浓度的ox-LDL作用12 h 可使HUVECs 损伤明显,因此本研究选择75 mg/L 浓度的ox-LDL 作用12 h 为造模条件。在前期研究中笔者已经发现了Corilagin 抗AS 的作用,本实验中进一步在细胞水平评价了不同时-效/量-效的Corilagin 对ox-LDL 损伤HUVECs 的保护作用,结果显示,Corilagin 在12、24、48 h以浓度依赖的方式(3.125、6.25、12.5、25、50 µmol/L)提高细胞活力,表明Corilagin 对ox-LDL 损伤HUVECs 具有保护作用。
炎性反应贯穿AS 发生发展的全过程,MyD88 是TLR 信号转导通路的关键靶标,在炎症反应中发挥着重要作用,它通过调控胞浆募集下游的肿瘤坏死因子受体相关因子-6(tumor-necrosis factor receptor associated factor,TRAF-6),诱导TNF-α 和MCP-1 等炎症因子的表达。Zhu 等[14]研究发现抑制巨噬细胞中TLR4/MyD88/P65 信号通路后小鼠AS 出现转归,表明以MyD88 衔接的炎症反应通路对AS 的进展具有重要调控作用。HUVECs 作为研究内皮细胞功能调节的模型系统,常应用于血管形成、AS 斑块的研究[15]。本研究以MyD88、P65、TNF-α 和MCP-1 为研究靶标,通过RT-qPCR 和Western blot 技术检测Corilagin对ox-LDL 诱导的损伤HUVECs 模型中上述因子的表达的影响,在模型组中,MyD88、P65、TNFα 和MCP-1 的表达均明显上调,而Corilagin 组中这些指标的表达均得到了显著逆转。
综上所述,Corilagin 对ox-LDL 损伤的HUVECs的保护作用可能是通过下调MyD88 基因的表达,抑制p65、炎性因子TNF-α 和趋化因子MCP-1的表达来实现的。本研究没有采用MyD88 抑制剂佐证Corilagin 通过下调MyD88 信号通路发挥抗AS 作用,因此,在接下来的研究中,笔者将使用MyD88 抑制剂在动物-细胞水平进一步验证Corilagin 的作用机制,为Corilagin 临床用于防治AS 提供理论和实验依据。
