EZH2 抑制剂与膀胱癌GC 化疗药物联用增敏的作用研究
2023-10-24刘绍有施鸿金毛秋玉
谢 峻 ,刘绍有 ,施鸿金 ,毛秋玉 ,杨 宏
(1)昆明医科大学第二附属医院泌尿外科,云南 昆明 650101;2)云南省肿瘤医院泌尿外科,云南 昆明 650118)
膀胱癌是泌尿系统最常见的恶性肿瘤之一,在男性中,其发病率据统计位于第十位,且发病率和病死率根据调查结果显示在近几年也呈逐年攀升的趋势,情况不容乐观[1]。在膀胱癌中其最重要的病理类型经研究为尿路上皮癌,膀胱癌患者的预后较差的原因主要为其早期缺乏特异性症状,由于肿瘤的转移导致部分患者就诊时已进入中晚期,行手术及放化疗等治疗手段疗效较差。因此,开发靶向治疗药物是阻止膀胱癌病情恶化的关键。EZH2 经研究得知属于多梳蛋白抑制复合物家族成员,该基因主要参与调控多种靶基因沉默并催化组蛋白H3 的甲基化过程。研究表明,EZH2 与膀胱癌、前列腺癌、乳腺癌、肾细胞癌、肺癌、子宫内膜癌、胶质瘤等一系列肿瘤的恶性发生与发展关系极为密切[2-8]。并且越来越多的证据表明了EZH2 抑制剂在多种癌症中化疗增敏作用[9]。因此这些研究提示EZH2 抑制剂可以作为癌症化疗增敏新靶点,使得EZH2 抑制剂成为化疗方案中重要的辅助策略。但是目前EZH2 抑制剂在膀胱癌GC 化疗中的研究仍然较少。因此本研究首次探讨EZH2 抑制剂在尿路上皮癌(urothelial cell carcinoma,UCC)治疗与GC 化疗方法联合治疗时的重要作用,将为临床指导用药方面提供理论基础,并且对于UCC 患者的GC 化疗方案提供新的辅助,最终为膀胱癌的治疗提供新思路。
1 材料与方法
1.1 主要试剂和仪器
人膀胱癌T24 细胞,GC 化疗药物(1 µM 顺铂+1.56 µM 吉西他滨),5 种EZH2 抑制剂(GSK126,UNC1999,DZNep1,EI1 和EPZ005687),EZH2 抑制剂的溶媒缓冲液、吉西他滨、UNC1999 与顺铂均由细胞平台提供,引物设计为 Beacon Designer 7.90,引物合成为广州invitrogen RPMI 1640。谷氨酰胺、基础培养基、青链霉素(双抗)、胎牛血清、0.25%胰酶均购自Gibco 公司,30%过氧化氢溶液(西陇化工),TritonX-100(Vetec V900502),PBS 缓冲液(北京中杉ZLI-9061),DAB 显色试剂盒(北京中杉 ZLI-9018),恒温干燥箱与自动消毒锅均由SANYO 公司提供。兔抗人EZH2 单克隆抗体、GAPDH 抗体购自Abmart 公司;羊抗人HRP 标记IgG 二抗购自CST 公司。
1.2 实验动物
BALB/C 裸鼠30 只,雌,体重(18±4)g,购自斯贝福(北京)生物技术有限公司,动物许可证号SCXK(京)2019-0010。
1.3 实验方法
1.3.1 EZH2 siRNA 的设计合成及筛选该实验根据3 条不同的siRNA 分别为siEZH2-1/-2/-3。进行实验分组,分为T24 细胞正常培养、T24 细胞+si NC、T24 细胞+si-EZH2 1、T24 细胞 +siEZH2-2 和T24 细胞+siEZH2-3 5 个组。然后将T24 细胞用0.25%胰酶消化收集细胞,去上清后1 mL 完全培养基重悬细胞,按照每个孔接种5×104个细胞将细胞接种在6 孔板中,每组接种6 重复,当细胞融合度达到50%~60%时,按照分组转染si NC、siEZH2,以riboFECT™ CP 作为转染试剂,转染浓度为50 nM;稀释 riboTRACER™:用不含双抗的完全培养基将10X riboFECT™ CP Buffer(v1)稀释成1X 的riboFECT™CP Buffer(v2);按照每孔用120 µL v2 加20 µM 的riboTRACER™ Fluorescent Oligo(Green)储存液(v3)5 µL,轻轻混匀。合液制备:加入 12 µL riboFECT™ CP Reagent(v4),轻轻吹打混匀,室温孵育 0~15 min,制备 riboFECT™ CP 混合液。根据以上siRNA 转染方法转染24 h 后,收集细胞,每组3 重复提取RNA,进行后续qPCR 检测;每组剩余3 重复,提取蛋白,进行后续WB 检测。
1.3.2 RT-qPCR收集5 组细胞,分别为对照组(T24 细胞正常培养)、si-NC 组(T24 细胞+si NC)、si-EZH2 1 组(T24 细胞+siEZH2-1)、siEZH2-2 组(T24 细胞+siEZH2-2)与siEZH2-3组(T24 细胞+siEZH2-3),细胞总RNA 利用TRIzol 法提取,琼脂糖凝胶电泳鉴定,酶标仪测定RNA 浓度,待逆转录成cDNA 进行RT-qPCR反应,EZH2 引物序列见表1。按照试剂盒说明书设定20 µL 反应体系:反应条件主要为以下3 步:95℃预变性30 s;95℃变性10 s 与退火&延伸60 ℃ 30 s,共40~45 个循环,最终使用 2-ΔΔCT法计算目的基因的相对表达量。
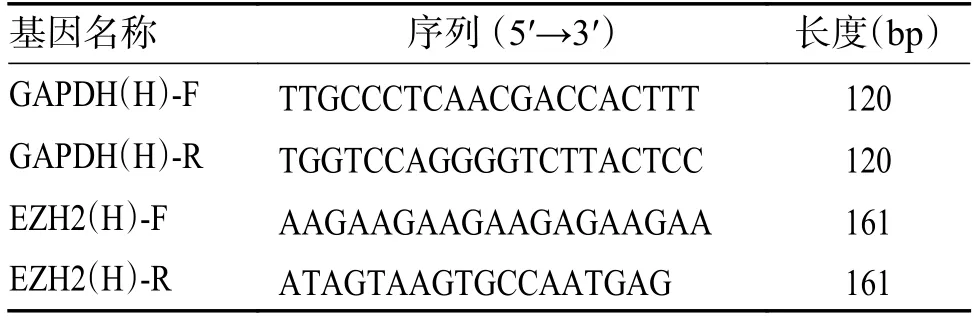
表1 EZH2 引物序列Tab.1 Primer sequences of EZH2
1.3.3 Western blot各组细胞加入细胞裂解液,蛋白样品即为离心所得上清液。用BCA 蛋白检测试剂盒用于测定各组蛋白浓度,待蛋白定量变性后进行SDS-PAGE 分离蛋白,电泳后迅速转至PVDF 膜上,使用5%脱脂牛奶TBST 溶液中室温封闭1 h,分别以抗EZH2(1∶1 000)和GAPDH 抗体(1∶4 000)为一抗,4 ℃处理过夜,TBST 洗涤3 次后,以HRP 标记IgG 为二抗(1∶4 000)室温处理2 h,之后加入ECL 显色剂显色,在暗室中通过胶片曝光,胶片显影及定影,最后用扫描仪扫描记录胶片上蛋白印迹的变化。
1.3.4 CCK-8 试验将细胞按5×103个/孔接种于96 孔板,每组设6 个复孔,培养 24~ 96 h;当细胞融合度达到50%~60%时,按照分组转染si EZH2 或加入抑制剂处理24 h 后,加入GC 化疗药物(1 µM 顺铂+1.56 µM 吉西他滨)处理2 h,之后更换不含GC 化疗药物培养基继续培养24 h和48 h 后进行CCK-8 检测。然后于每个设定的时间点每孔加入10 µL CCK-8 溶液孵育2 h;酶标仪于450 nm 波长处检测吸光度(OD)值。实验重复3 次。
1.3.5 平板克隆实验与Annexin V-FITC/PI 凋亡实验将转染细胞按1×103/孔接种于6 孔板培养,每组设3 个复孔。培养10 d 后,用4%多聚甲醛溶液固定,用结晶紫染色,倒置显微镜(×40)观察克隆形成情况并拍照。细胞接种于6 孔板,培养至对数生长期后,收集细胞,PBS 重悬,取(5~10)×104个重悬细胞,1 000 r/min 离心5 min,弃上清,加入195 µL Annexin V-FITC 结合液重悬细胞,加入5 µL Annexin V-FITC 混匀,室温避光孵育10 min,1 000 r/min 离心 5 min,弃上清,加入 10 µL PI,轻轻混匀,冷浴避光放置,上流式细胞仪(BD FACSVerse)检测。实验重复3 次。
1.3.6 移植瘤裸鼠模型的建立与观察按实验要求进行分组,将BALC/c 裸鼠随机分为5 组,每组6 只。5 组分别为对照组(T24 细胞正常培养)、溶媒缓冲液组(T24 细胞+100 µL UNC1999 溶媒缓冲液)、GC 化疗组(裸小鼠+T24 细胞+GC 化疗组)、UNC1999 组(裸小鼠+T24 细胞 +UNC1999)、UNC1999+GC 化疗组(裸小鼠+T24细胞+UNC1999+GC 化疗)在各组BALB/C 裸鼠适应性饲养1 周后,开始接种细胞,多次接种直到瘤体长出为止,瘤体长出后开始测量瘤体,培养至瘤体大小为50 mm3左右,开始给药处理。UNC1999 给药:腹腔注射50 mg/kg,每只给药量1 mg;吉西他滨:腹腔注射40 mg/kg,每只给药量0.8 mg;顺铂:腹腔注射60 mg/kg,每只给药量1.2 mg。第2 周与4 周时分别处死裸鼠,完整取出皮下肿瘤后称其质量。
1.3.7 免疫组化染色移植瘤组织的固定通过10%中性甲醛溶液,之后进行石蜡包埋、切片、脱蜡与水化,经过使用过氧化氢阻断其内源性过氧化酶活性后,分别加入鼠抗人 Ki67 与EZH2,4℃处理过夜。加入酶标羊抗小鼠/兔室温处理1 h,DAB 显色,苏木精复染,乙醇梯度脱水、二甲苯透明、中性胶封片。最后,在显微镜(×200)下镜检拍照。其中阳性染色为细胞核的棕色颗粒沉着。
1.4 统计学处理
以上主要实验均独立重复3 次。所有数据采用GraphPad Prism8.0 软件进行统计学分析,采用Shapiro-Wilk 正态性检验对检验数据进行正态性分析。采用单因素方差分析对组间差异进行比较分析,多重比较用Bonferroni 法,数据以平均值±平均值的标准误差(Mean±SEM)表示,P<0.05 为差异有统计学意义。
2 结果
2.1 si-EZH2 质粒转染于T24 细胞中对其EZH2 RNA 表达的影响
首先将实验分为T24 细胞正常培养、T24 细胞+si NC、T24 细胞+siEZH2-1、T24 细胞 +siEZH2-2 和T24 细胞+siEZH2-3 5 个组。然后将构建好的siEZH2-1、siEZH2-2、siEZH2-3 质粒转染至T24 细胞中,通过qPCR 实验及WB 实验检测EZH2 基因表达水平,结果显示:与对照组正常T24 细胞(1.238±0.121 0)相比,其余4 组中只有 siEZH2-1(0.624 3±0.031 35)、siEZH2-2(0.216 8±0.031 28)的EZH2 siRNA 表达量低于对照组(P<0.01),见图1。并且si EZH2-2 的Ct 值与对照组相比明显下降,说明siEZH2-1、siEZH2-2 可以作为EZH2 基因的siRNA,并且siEZH2-2 更为合适。

图1 qRT-PCR 检测EZH2 siRNA 的表达Fig.1 Expression of EZH2 siRNA via qRT-PCR**P <0.01。
2.2 si-EZH2 质粒转染于T24 细胞中对其EZH2 蛋白表达量的影响
上述5 组实验组之间WB 实验结果与EZH2的蛋白相对表达量结果,见图2。与正常T24 细胞相比,其余4 组实验组中只有siEZH2-1、siEZH2-2 的EZH2 蛋白表达量低于对照组(P<0.01),其中与对照组膀胱癌T24 细胞正常培养的EZH2 的相对蛋白表达量(1.076 0±0.059 31)相比,T24 细胞+siEZH2-2 实验组EZH2 的相对蛋白表达量(0.338 3±0.039 78)降低,且差异有统计学意义(P<0.01)。表明膀胱癌T24 细胞转染实验成功,同时提示,细胞中已转染的siEZH2 对EZH2 表达具有明显的抑制作用。

图2 5 组膀胱癌T24 细胞中EZH2 的蛋白相对表达量分析Fig.2 Analysis of relative protein expression of EZH2 in five groups of bladder cancer T24 cells
2.3 降低EZH2 表达对在GC 化疗中膀胱癌T24细胞的增殖与克隆能力的影响
为了检测不同的EZH2 抑制剂之间对于GC化疗中的膀胱癌T24 细胞增殖与凋亡是否存在差异,对照组(膀胱癌T24 细胞正常培养)、GC 化疗组(T24 细胞+GC 化疗药物)、si EZH2 转染组(T24 细胞+si EZH2 转染+GC 化疗药物)、GSK126 抑制剂组(T24 细胞+GSK126 5 µM+GC化疗药物)、UNC1999 抑制剂组(T24 细胞 +UNC1999 5 µM+GC 化疗药物)、EI1 抑制剂组(T24 细胞+EI1 5 µM+GC 化疗药物)、DZNep1抑制剂(T24 细胞+DZNep1 5 µM+GC 化疗药物)与EPZ005687 抑制剂(T24 细胞+EPZ005687 5 µM+GC 化疗药物)的24 h 与48 h CCK8 实验结果,见图3。研究结果表示,其中使用UNC1999 EZH2 抑制剂结合GC 化疗药物的膀胱癌T24 细胞活力在24 h 和48 h 均低于对照组与GC 化疗组,24 h [(48.63±2.958)%,(P<0.01)]、48 h[(43.56±1.709)%,(P<0.01)]差异均有统计学意义。平板克隆形成实验结果,见图4。与对照组(215.7±10.73)个相比,T24 细胞+DZNep1 5 µM +GC 化疗药物组[(84.46±6.066)个,(P<0.01)]与T24 细胞+EPZ005687 5 µM+GC 化疗药物组[(127.6±24.00)个,(P<0.05)]的细胞克隆形成数目减少,差异均有统计学意义。以上实验结果说明EZH2 抑制剂可以降低膀胱癌T24 细胞在GC 化疗药物中增殖与克隆能力。

图3 CCK-8 实验检测24 h 与48 h EZH2 抑制剂对膀胱癌T24 细胞增殖的影响Fig.3 CCK-8 assay to detect the effect of 24 h and 48 h EZH2 inhibitors on the proliferation of bladder cancer T24 cells

图4 平板克隆形成实验检测使用EZH2 抑制剂对膀胱癌T24 细胞增殖的影响Fig.4 Effect of using EZH2 inhibitor on the proliferation of bladder cancer T24 cells detected by plate clone formation assay
2.4 降低EZH2 表达对GC 化疗中膀胱癌T24 细胞周期与细胞凋亡能力的影响
为了进一步验证EZH2 抑制剂可以有效提高膀胱癌T24 细胞在GC 化疗药物的敏感性,进行PI 单染检测细胞周期与平板克隆形成实验检测细胞克隆形成能力。细胞周期结果见图5。与上述对照组相比,其余7 组实验组在细胞周期方面G1 期都有所上升而G2 期与S 期所占的比例却都有所下降,说明单独GC 化疗与EZH2 抑制剂和GC 化疗药物联用均能在G1 期水平上抑制膀胱癌T24 细胞增殖,并且EZH2 抑制剂与GC 化疗药物联用抑制膀胱癌T24 细胞增殖效果比单独GC 化疗药物的效果显著。其中与对照组(34.47±1.888)和GC 化疗组(43.00±1.128)相比,T24 细胞+UNC1999 5 µM+GC 化疗药物实验组中的G1 期在细胞周期中所占百分比(61.80±0.450 4)最高,差异有统计学意义(P<0.01)。另外,Annexin V-FITC/PI 检测结果显示,在早期凋亡比例中,与对照组(5.750±0.172 1)和GC 化疗组(9.830±0.197 0)相比,T24 细胞+UNC1999 5 µM+GC 化疗药物组的早期凋亡比例所占百分比(20.08±1.519)最高,且差异有统计学意义(P<0.01),见图6。
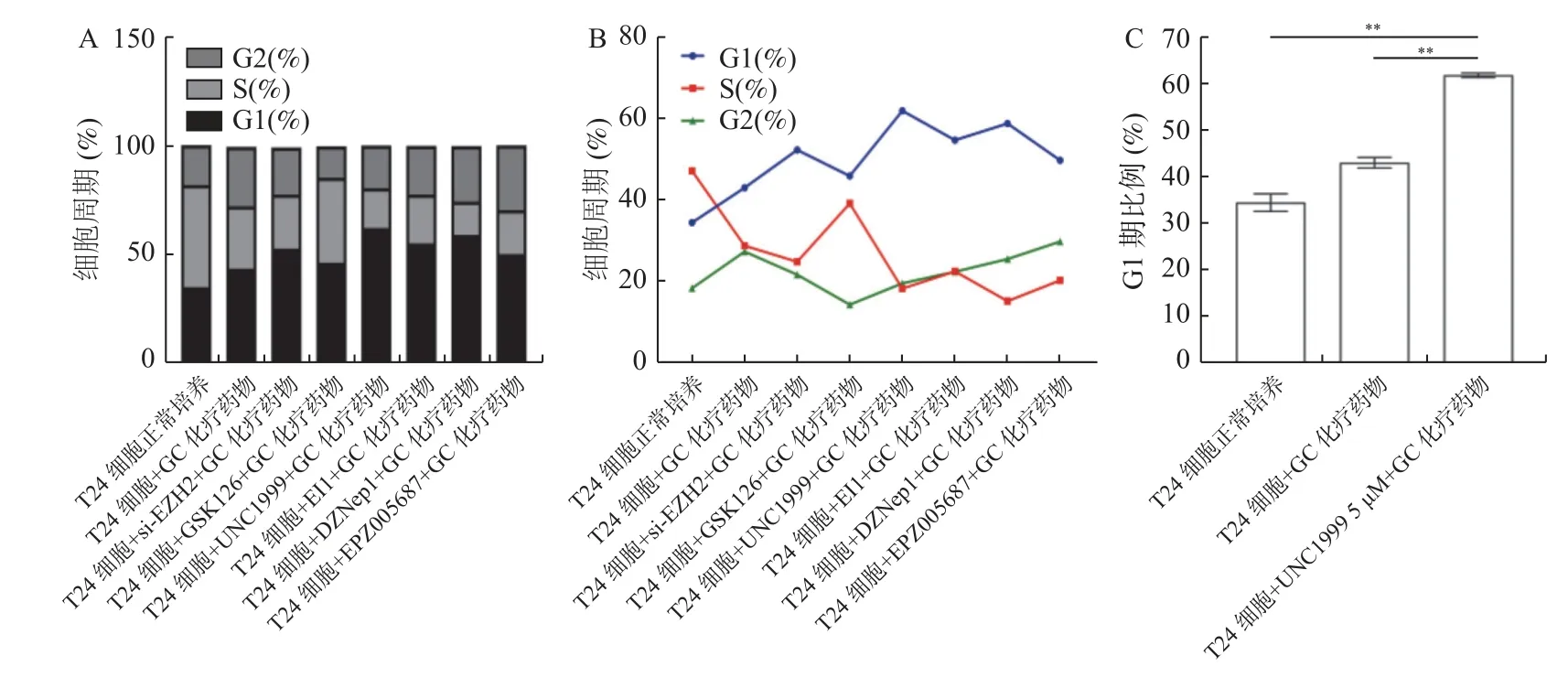
图5 PI 单染试验检测EZH2 抑制剂对膀胱癌T24 细胞其细胞周期的影响Fig.5 Effect of EZH2 inhibitor on bladder cancer T24 cells and their cell cycle detected by PI single staining assay

图6 Annexin V/PI 实验检测EZH2 抑制剂对GC 化疗中的膀胱癌T24 细胞凋亡的影响Fig.6 Annexin V/PI assay to detect the effect of EZH2 inhibitor on apoptosis of bladder cancer T24 cells in GC chemotherapy
2.5 EZH2 抑制剂对小鼠体内T24 细胞移植瘤生长与骨髓抑制毒副作用的影响
为了更加明确EZH2 抑制剂在体内可以提高膀胱癌T24 细胞在GC 化疗药物的敏感性,移植瘤图片,见图7A。实验分为5 组,分别为对照组(T24 细胞正常培养)、溶媒缓冲液组(T24 细胞 +100 µL EZH2 抑制剂的溶媒缓冲液)、GC 化疗组(T24 细胞+GC 化疗组)、UNC1999 EZH2 抑制剂组(T24 细胞+UNC1999)与UNC1999+和GC 化疗组联用组(T24 细胞+UNC1999+GC 化疗)。结果显示,与单纯GC 化疗组2 周(0.277 4±0.103 1)g与4 周(0.301 9±0.049 98)g 瘤体重量相比,GC 化疗与UNC1999 EZH2 抑制剂联用组2 周(0.209 9±0.044 83)g 与4 周(0.212 9±0.018 86)g 瘤体重量减小,差异有统计学意义(P<0.05),见图7B。免疫组化染色法检测结果,见图7C。血常规检测结果,见图7D。与单纯GC 化疗组相比,GC 化疗与UNC1999 EZH2 抑制剂联用组的红细胞2 周(7.687±0.456 4)×109/L 和4 周(7.277±0.402 4)×109/L、白细胞2 周(4.777±0.464 1)×109/L 和4 周(4.163±0.427 1)×109/L 与血小板2 周(675.2±39.58)×109/L 和4 周(524.2±36.73)×109/L 3 种血细胞数量均增加。以上实验结果表明,UNC1999 EZH2 抑制剂与GC 化疗药物联用可以相比于单用GC 化疗药物更有效的抑制其体内膀胱癌T24细胞的增殖与侵袭转移,与体外实验结果一致,并且可以有效减少骨髓抑制的毒副作用。

图7 EZH2 抑制剂对小鼠体内T24 细胞移植瘤生长的影响Fig.7 Effect of EZH2 inhibitors on the growth of T24 cell transplanted tumours in mice
3 讨论
膀胱癌是全球第十大最常见的癌症[10]。在膀胱癌中,UCC 是最常见的病理组织学类型[11],最终导致死亡的原因主要归功于其病灶转移和复发。近几年药物治疗方面使用基于铂类化疗药物顺铂的MVAC(甲氨喋呤、长春新碱、阿霉素、顺铂)化疗方案应用于临床以来,其治疗效果明显改善,并一直以来作为UCC 化疗的标准一线方案也是肌层浸润性膀胱癌(muscle-invasive bladder cancer,MIBC)围手术期治疗的首选治疗方案。此外,膀胱内卡介苗免疫疗法或化学疗法被用作经尿道切除术后非肌层浸润性膀胱癌(non-muscle-invasive bladder cancer,NMIBC)的辅助治疗选择,以防止进展与复发[11]。所以近年来,随着普及铂类化疗药物的使用以及广泛应用分子靶向药物,在膀胱癌患者总体生存率方面也有所改善,并且迅速成为其热点研究领域归结于其精准的靶向治疗[12-13]。自从新药GC 联合应用于临床,该方案将成为治疗UCC 的一线化疗方案,其逐渐取代MVAC 方案的主要原因在于临床毒副作用方面GC 要明显优于之前的MVAC 方案,但化疗效果基本一致,基本吻合于国外同行报道结果[14]。然而,化疗过程中经常产生的主要毒副作用众所周知则为骨髓抑制,其中2 种血细胞减少分别为白细胞与血小板较为容易发生。因此,进一步提升UCC 治疗GC 方案的敏感性,降低药物使用剂量,对于UCC 患者具有重要意义。
EZH2 是多梳抑制复合物(polycomb repressive complex 2,PRC2)的催化亚基,该催化亚基可使催化组蛋白 H3 赖氨酸(H3K27)甲基化[15],该基因也为调控表观遗传的主要因子之一,并参与了组蛋白甲基化、EMT 等过程[15-16]。EZH2 基因位于人类染色体 7q35 上,包含20 个外显子,并且EZH2 主要通过SET 结构域作为组蛋白甲基转移酶,以PRC2 依赖或独立的方式抑制或协同激活转录[15-16]。EZH2 所表达的蛋白具有促进细胞增殖和转移、抑制细胞凋亡以及参与耐药等功能[17]。EZH2 在乳腺癌正常黏膜组织、良性病变及腺癌中的阳性表达率呈逐渐增加,说明在乳腺癌变过程中EZH2 也发挥了一定作用[18],并且EZH2 基因突变可以增加乳腺癌细胞的易感性,促进乳腺癌细胞的侵袭与转移[19]。另外,抑制EZH2 基因在肌型浸润性膀胱癌的表达可以减少膀胱癌细胞的淋巴结转移能力,并且可以增加顺铂联合抑制的敏感性[2]。目前,多种EZH2 抑制剂已被用于抗肿瘤的基础和临床前期研究,并在非霍奇金淋巴瘤、肝细胞癌、结直肠癌、肺癌、乳腺癌、卵巢癌、宫颈癌、多发性骨髓瘤与自身性免疫性疾病中取得了令人满意的结果[20-28]。令人遗憾的是,至今尚未有EZH2 抑制剂在膀胱癌GC 化疗中的研究。
因此,本研究在细胞水平验证下调EZH2 的表达对GC 方案治疗UCC 细胞的影响,结果显示与对照组相比,各EZH2 抑制剂处理组在24 h 与48 h 的细胞增殖与克隆能力均比对照组低,并且在细胞周期方面显著滞留在G1 期,细胞凋亡方面比对照组多,且抑制剂UNC1999 效果尤为明显,阐明EZH2 与膀胱癌细胞活性密切相关,其中表现在EZH2 可有效抑制T24 细胞的增殖与迁移能力。另外,本研究通过裸鼠皮下成瘤实验动物模型中验证EZH2 抑制剂对于GC 方案治疗UCC 的影响,结果发现与对照组相比,GC 化疗组(T24细胞+GC 化疗组)、UNC1999EZH2 抑制剂组(T24 细胞+UNC1999)与UNC1999+和GC 化疗组联用组(T24 细胞+UNC1999+GC 化疗)在2 周与4周内的瘤体体积与重量显著降低。Ki67 为一种核抗原,可以反映细胞其增殖活性,在正常膀胱组织中低表达[29]。本实验中通过免疫组化检测T24细胞中Ki67 水平与EZH2 水平发现与空白组相比,其余3 组实验处理组也明显降低,最后通过血常规检测发现GC 药物与EZH2 抑制剂联用可以提升白细胞、红细胞及血小板数量从而有效减少GC 化疗药物的毒副作用。
综上所述,本研究采取使用不同的EZH2 抑制剂与膀胱癌GC 化疗药物联用对于膀胱癌 T24细胞的增殖能力均呈抑制作用,证实了EZH2 抑制剂可以增加膀胱癌GC 化疗药物的敏感性,在膀胱癌的临床精准治疗方面提供了一种新的思路。然而,此实验对于EZH2 抑制剂与膀胱癌GC 化疗药物联合增敏的作用机制研究尚浅,本课题组将进一步对EZH2 抑制剂在膀胱癌GC 化疗方案中增敏作用及其调控机制进行深入研究,为其成为膀胱癌细胞的治疗靶点提供新的方法与思路。
