二甲双胍通过AMPK/PPAR-γ 通路诱导自噬抑制高糖对血管平滑肌细胞的增殖作用
2023-10-24张紫微郑甲林许晓宇
张紫微 ,郑甲林 ,许晓宇 ,王 红
(1)云南省阜外心血管病医院冠心病中心,云南 昆明 650032;2)昆明医科大学研究生院,云南 昆明 650500)
糖尿病显著增加了心血管疾病的发病率和病死率,深入研究糖尿病合并冠心病的分子机制并在此基础上寻找新的治疗靶点,对防治糖尿病合并血管病变具有重要的意义。糖尿病高糖环境下血管平滑肌细胞(vascular smooth muscle cell,VSMCs)的异常增殖、迁移及表型转换等[1-2],可促进高血压、脑卒中、冠状动脉粥样硬化性心脏病等心脑血管疾病的发生发展。高血糖是最常见的糖尿病合并慢性血管并发症的危险因素之一,其能通过多种机制影响动脉硬化的进展。
自噬即细胞对自身的吞噬作用,指细胞通过形成自噬溶酶体消化自身大分子蛋白及细胞器的降解过程,从而维持细胞稳态[3]。有证据显示自噬可参与多种因素引起的VSMCs 增殖[4]、细胞表型转换[5]、细胞内钙离子浓度调节[6],炎性反应、脂质沉积[7]等活动,从而参与动脉硬化的发生发展。目前有关高糖环境下对血管平滑肌细胞自噬的调节以及自噬如何参与调节VSMCs 生物功能学的报道甚少。
二甲双胍(Metformin)是临床上常用降糖药,除了降糖作用以外,其还具有调节血脂、抗炎等多重广泛机制抗动脉粥样硬化的作用[8-9],其中,二甲双胍通过调节细胞自噬抗动脉粥样硬化的作用也越来越受到重视,如其可通过促进Krueppel样因子2(krueppel-like factor 2,KLF2)介导的自噬抑制泡沫细胞的形成[10],还可通过调节 Runt 相关转录因子2(runt-related transcription factor 2,Runx2)的自噬降解抑制血管钙化起到抗动脉硬化作用[11]。本文以小鼠血管平滑肌细胞为研究对象,观察自噬是否参与高糖促进VSMCs 的增殖,二甲双胍能否通过干预自噬影响高糖促进VSMCs 增殖作用,进一步探讨自噬在高糖对VSMCs 的作用及可能治疗方向,为临床糖尿病心血管并发症的防治提供新的手段及依据。
1 材料与方法
1.1 实验材料
小鼠主动脉平滑肌细胞(北纳生物,批号:BNCC338213),高糖型DMEM 培养基(葡萄糖浓度25 mmol/L)、低糖型DMEM 培养基(葡萄糖浓度5.6 mmol/L)(HyClone,USA),15%胎牛血清(Gibco,USA),0.25% EDTA 胰蛋白酶(Sigma,USA),PVDF 膜(广锐生物,中国),细胞裂解液(碧云天生物,中国),EDU 检测试剂盒(碧云天生物,C0078S),单克隆抗体:LC3B 单抗(Abcam,ab51520),Becline-1(Proteintech,USA),p-AMPK/AMPK(Proteintech,USA),PPAR-γ(Proteintech,USA),β-actin(Proteintech,USA),二甲双胍(Medchemexpress,USA),雷帕霉素(Sigma,USA),Compound C(Abcam,USA),GW9662(Abcam,USA),二抗IgG-HRP(碧云天生物,中国),BCA法蛋白定量检测试剂盒(碧云天生物,中国),ECL 显色试剂盒(碧云天生物,中国)。
1.2 实验方法
1.2.1 VSMCs 培养及分组将小鼠主动脉血管平滑肌细胞重悬于15%胎牛血清、1% 双抗的DMEM/F12 完全培养基中。轻柔操作重悬细胞,转入25 cm2细胞培养瓶中,置于 37 ℃、5% CO2培养箱中进行培养,2~3 d 更换1 次培养液,细胞融合至80%~90%用0.25%胰蛋白酶消化传代,按1∶2~1∶4 比例传代,共传 3~5 代,选处于对数生长期的的细胞分为不同处理组进行相应处理。
1.2.2 细胞增殖实验EDU 染色法检测小鼠血管平滑肌细胞增殖,接种细胞于24 孔板培养24 h并同步化细胞,按不同处理分为8 组:对照组、高糖组、二甲双胍组、高糖+二甲双胍组、高糖+雷帕霉素组、高糖+二甲双胍组+Compound C 组、高糖+二甲双胍组+GW9662 组、高糖+二甲双胍组+雷帕霉素组。二甲双胍浓度为10 mmol/L,作用24 h,雷帕霉素浓度为100 nmol/L,Compound C 浓度为10 µmol/L,GW9662 浓度为10 µmol/L,作用24 h。按1 000∶1 的比例稀释EDU 溶液,细胞干预结束后加入200 µL 浓度10 µmol/L 的EDU培养液孵育2 h 时,余按 EdU 细胞增殖检测试剂盒说明书继续操作,荧光显微镜下每组随机选5个视野拍照观察。
1.2.3 Western blot 检测蛋白表达Western blot检测LC3-Ⅱ/LC3-I、Becline-1、p-AMPK/AMPK、PPAR-γ 蛋白表达,将各组细胞分别处理,每个处理组3 个样本,加入100 µL RIPA 裂解液,30 min;4℃,12,000 r/min 离心5 min;取上清,BCA 法定量检测蛋白,取等量蛋白于10% SDSPAGE 进行电泳分离、转膜。5%的脱脂奶粉室温下摇床封闭,加入一抗以1∶1 000 稀释,4℃孵育过夜;加入二抗1∶5 000 稀释,室温孵育2 h,漂洗,配制ECL 显影剂于凝胶显影仪上曝光显影,用Bio-Rad Quantity One 软件定量分析。
1.2.4 透射电子显微镜观察不同处理组细胞自噬体收集对照组、高糖组、高糖+二甲双胍组血管平滑肌细胞,使用2.5%戊二醛在4 ℃过夜,然后用ddH2O 漂洗,锇酸固定1 h,乙醇及丙酮梯度脱水;再经渗透、树脂包埋、聚合后,制备70 nm 厚度的切片;使用醋酸铀-柠檬酸铅染色,MORADA G2 电镜下观察3 组平滑肌细胞自噬小体的数量并摄片。
1.3 统计学处理
用SPSS 13.0 进行统计分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采取Tukey 法,P<0.05 为差异有统计学意义。
2 结果
2.1 二甲双胍、雷帕霉素逆转高糖抑制VSMCs自噬的作用
将小鼠VSMCs 分为对照组(5.6 mmol/L 葡萄糖)、高糖组(25 mmol/L 葡萄糖)、高糖+二甲双胍(10 mmol/L)、高糖+雷帕霉素(100 nmol/L)四组,观察不同组VSMCs 自噬蛋白表达情况,结果显示高糖培养下VSMCs LC3-Ⅱ/LC3-I、Becline-1 蛋白较对照组表达水平降低(P<0.001),提示高糖培养抑制VSMCs 自噬水平,而二甲双胍及自噬促进剂雷帕霉素可促进高糖培养下的VSMCsLC3-Ⅱ/LC3-I、Becline-1 表达水平升高(P<0.001),提示二甲双胍、雷帕霉素可作为自噬诱导剂,促进VSMCs 发生自噬,并逆转高糖抑制VSMCs 自噬的作用。电镜显示高糖培养下VSMCs 自噬小体计数较对照组降低,而二甲双胍可显著增加高糖培养下VSMCs 自噬小体的数量,证实二甲双胍可逆转高糖培养的VSMCs 受抑制的自噬,见图1。

图1 二甲双胍对高糖培养下的VSMCs 自噬水平的影响Fig.1 Effect of metforin on autophagy in HG-cultured VSMCs
2.2 AMPK、PPAR-γ 抑制剂增加高糖抑 制VSMCs 自噬的作用
将小鼠VSMCs 分为对照组、高糖组、AMPK抑制剂Compound C(10 µmol/L)+高糖组,PPARγ 抑制剂GW9662(10 µmol/L)+高糖组共4 个处理组,用Western blot 检测自噬蛋白LC3 及Becline-1 表达水平,Western Blot 结果显高糖抑制VSMCs LC3-Ⅱ/LC3-Ⅰ、Becline-1 表达(P<0.001),而AMPK 抑制剂、PPAR-γ 抑制剂可进一步抑制高糖培养下VSMCs 相关自噬蛋白的表达(P<0.05),见图2。

图2 AMPK、PPAR-γ 抑制剂对VSMCs 自噬的影响Fig.2 Effect of AMPK or PPAR-γ inhibitor on autophagy in VSMCs
2.3 二甲双胍逆转高糖对AMPK/PPAR-γ 通路的负调控
将小鼠VSMCs 分为对照组、高糖组、MET+高糖组,Compound C+高糖组4 个处理组,检测不同组p-AMPK/AMPK 表达情况,结果显高糖抑制VSMCs p-AMPK/AMPK 表达(P<0.001),二甲双胍可逆转高糖抑制AMPK 通路激活(P<0.001),而使用AMPK 抑制剂后进一步增强高糖抑制AMPK 通路激活的作用(P<0.01)。用高糖、MET+高糖,GW9662+高糖预处理,检测不同组PPAR-γ 表达情况,结果显高糖抑制VSMCs PPAR-γ 表达(P<0.001),二甲双胍可逆转其作用(P<0.01),而使用PPAR-γ 抑制剂后进一步增强高糖抑制 PPAR-γ 表达的作用(P<0.05),见图3。
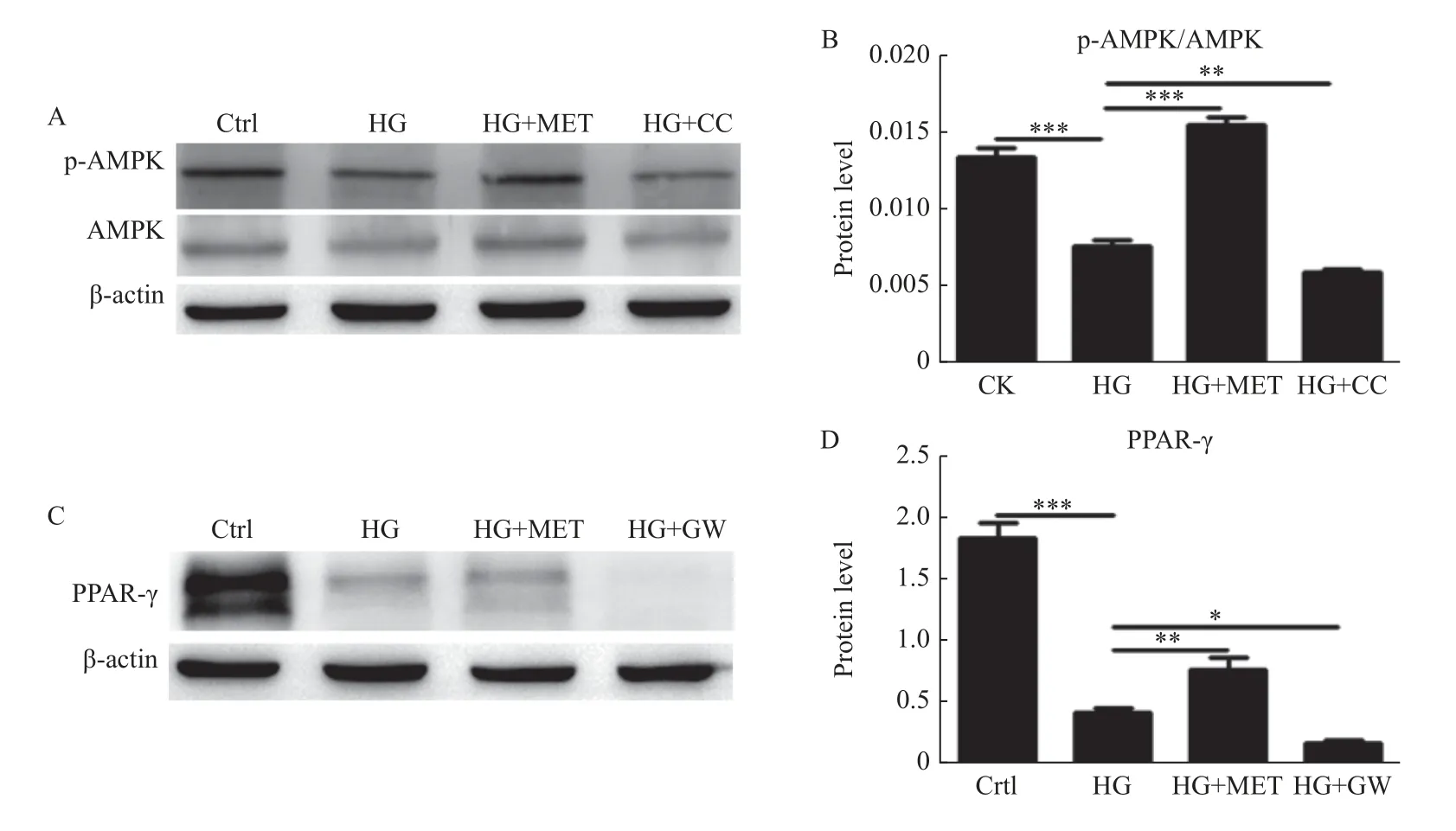
图3 二甲双胍对高糖培养下VSMCs p-AMPK/AMPK、PPAR-γ 表达的影响Fig.3 Effect of metformin and high glucose on p-AMPK/AMPK、PPAR-γexpression of VSMCs
2.4 二甲双胍抑制高糖促进的VSMCs 增殖
将小鼠VSMCs 分为对照组、高糖组、二甲双胍组、高糖+二甲双胍组、高糖+雷帕霉素组、高糖+二甲双胍组+Compound C 组、高糖+二甲双胍组+GW9662 组、高糖+二甲双胍组+雷帕霉素组8个处理组,EDU 染色细胞检测不同组细胞增殖情况,结果显示高糖促进VSMCs 增殖(P<0.05),MET 及RAP 抑制高糖促进的VSMCs 增殖作用,且MET 可进一步增强RAP 抑制高糖促进的VSMCs 增殖作用(P<0.001)。而使用AMPK 抑制剂Compound C 及PPAR-γ 抑制剂GW9662 后可逆转MET 抑制HG 促进VSMCs 增殖的作用(P<0.05),见图4。

图4 二甲双胍抑制高糖诱导的VSMCs 增殖Fig.4 Effect of metformin on high glucose-induced proliferation of VSMCs
3 讨论
高血糖是最常见的糖尿病合并慢性血管并发症的危险因素之一,能通过多种机制影响动脉硬化的进展,如可能促进糖基化终末产物的形成,进一步促进炎症反应诱发VSMCs 增殖[12-13],脂质代谢紊乱[14],影响各种生长因子的分泌及表达,氧化应激等[15]。多项研究发现高糖还可通过调节自噬参与多种心血管疾病病理生理。如Liu 等[16]报道高糖可通过AMPK 通路介导血管内皮细胞自噬促进其凋亡,而Xu 等[17]报道高糖抑制心肌细胞自噬并促进其凋亡,可能导致糖尿病心肌疾病的发生。研究证实VSMCs 的自噬可通过多种形式参与动脉粥样硬化的进程发展,本课题组前期工作也发现自噬参与血管紧张素II 诱导的VSMCs细胞表型转换[5],但高糖是否通过自噬参与VSMCs 增殖及其相关机制尚不明确。
二甲双胍作为目前临床最常用的降糖用药之一,既往研究显示其还有改善内皮功能[18]、改善胰岛素抵抗[19],减少平滑肌细胞向泡沫细胞转换[20],抗氧化应激等[21]抗动脉粥样硬化作用。近年来有研究显示二甲双胍通过调节自噬抗动脉粥样硬化,如其可通过调节长链非编码RNA 牛磺酸上调基因1 诱导自噬,抑制血管壁细胞增殖从而起到抗动脉粥样硬化作用[22],还可通过上调Kruppel 样因子2 介导的自噬抑制APOE 基因敲除的小鼠动脉硬化进程及斑块易损性[10]。本研究通过检测LC3、Becline-1 等自噬相关蛋白及电镜检测自噬小体等方法发现高糖培养显著抑制VSMCs自噬水平,使用二甲双胍、自噬诱导剂雷帕霉素促进自噬水平并抑制高糖诱导的VSMCs 增殖,笔者推测高糖培养可通过抑制自噬调控促进VSMCs增殖。与自噬激动剂雷帕霉素一样,二甲双胍亦可通过促进自噬并抑制高糖培养的VSMCs 增殖。本研究还发现雷帕霉素促进自噬并抑制高糖促进VSMCs 增殖的作用,二甲双胍联合雷帕霉素可进一步增强其抑制VSMCs 增殖的作用,见图4,提示不同机制自噬激活剂的联合可进一步增强抑制高糖促VSMCs 增殖的作用。
AMPK/PPAR-γ 通路广泛参与细胞代谢和糖代谢过程,也参与调节自噬[23-24],本研究证实高糖环境下可抑制VSMCs AMPK/PPAR-γ 通路的激活,二甲双胍则可激活APMK/PPAR-γ 通路,并逆转高糖抑制AMPK/PPAR-γ 通路的作用。是否AMPK/PPAR-γ 通路参与高糖抑制的VSMCs自噬,为进一步证实自噬参与二甲双胍抑制的VSMCs 增殖并探究其机制,笔者使用PPAR-γ抑制剂GW9662 及AMPK 抑制剂Compound C 后发现其可进一步增强高糖抑制VSMCs 自噬的作用,见图2,并削弱二甲双胍抑制细胞增殖的作用,提示自噬可能参与高糖诱导的VSMCs 增殖,高糖可能通过抑制AMPK/PPAR-γ 通路抑制VSMCs自噬,从而进一步促进VSMCs 增殖,这可能是自噬参与的机制之一。
综上所述,本实验发现高糖环境下促进VSMCs增殖可能是自噬依赖性的,高糖可通过抑制VSMCs 自噬促进其增殖,而使用而二甲双胍可通过激活AMPK/PPAR-γ 通路上调VSMCs 自噬水平,抑制高糖促进的VSMCs 异常增殖,这为糖尿病合并血管病变提供了一个新的治疗方向。
