妊娠期糖尿病与正常足月儿母亲胎盘菌群DNA 的差异
2023-10-26阳情姚张卫权李湛华熊晶晶黄永坤
阳情姚,曾 洁,张卫权,宁 月,李 檬,李湛华,刘 梅,熊晶晶,黄永坤
(昆明医科大学第一附属医院儿科,云南 昆明 650032)
微生物群是特定环境中所有微生物的集合,在人体不同部位各不相同,研究发现人体微生物群在代谢、免疫和内分泌等系统中发挥重要作[1-4]。胎盘是母亲与胎儿之间重要的纽带,研究发现当产妇合并妊娠期糖尿病(gestational diabetes mellitus,GDM)时,胎盘组织中的菌群组成和结构可能会发生改变[5-6],而这种菌群的改变可能会导致不良的结果[7-8]。
近年来,GDM 的发生率逐渐升高,预防GDM 的发生、防治其并发症已成为临床研究的重要任务。本研究通过16S rDNA 技术检测和分析足月儿母亲的胎盘菌群DNA,探讨妊娠期糖尿病与正常足月儿母亲之间的胎盘菌群的差异,为研究和防治妊娠期糖尿病提供新思路和参考数据。
1 资料与方法
1.1 研究对象
收集了30 例2018 年2~9 月期间在昆明医科大学第一附属医院产科分娩的足月孕妇胎盘组织。严格按照以下入组标准,根据产妇妊娠期间是否伴有妊娠期糖尿病进行分组后得到妊娠期糖尿病组(A 组)4 例(A1~A4)与正常足月儿组(B 组)6例(B1~B6)。
(1)产妇的纳入及排除标准[9]:纳入标准:规律产检,年龄为20~45 岁。排除标准:①伴有多胎妊娠、慢性高血压、内分泌失调、链球菌感染、胎膜早破、肿瘤和其他严重母体疾病;②伴有吸烟、饮酒、滥用药物等不良习惯等。(2)新生儿的纳入及排除标准[10]:纳入标准:37 周≤胎龄 <42 周。排除标准:①胎龄 <37 周或≥42 周;②伴有出生重度窒息、败血症等严重疾病史。
本研究通过昆明医科大学第一附属医院伦理委员会批准[伦理批号:(2023)伦理L 第38 号],所有研究对象均签署了知情同意书。
1.2 研究方法
1.2.1 临床资料收集由专人收集母婴的临床数据特征。包括母婴病史、年龄和孕前BMI、胎龄、出生体重、出生方式、出生时的身长及头围、新生儿评分和脐动、静脉PH 及乳酸等实验室检查结果等。
1.2.2 胎盘标本的采集由专人收集标本,胎盘娩出后,将近脐端的羊膜用无菌剪剪除,另换一把无菌剪剪取下方的绒毛状胎盘膜约1 cm3,随后放入无菌试管中,并立即保存到-80℃冰箱。所有操作在产后/剖宫产术后1 h 内完成,整个过程遵循无菌操作原则。
1.2.3 胎盘组织中细菌DNA 的提取及测序见图1。

图1 细菌DNA 的提取及illumina 测序实验流程图Fig.1 Experimental flow chart of bacterial DNA extraction and illumina sequencing
1.2.4 对测序序列进行生物信息学处理按97%相似度进行聚类,得到代表物种的OTU,随后使用Qiime 软件进行分析,通过与16S 数据库(RDP,http://rdp.cme.msu.edu)进行比对、分类后得到OTU 丰度表,分别在门(Phylum)水平选取丰度前十五、属(Genus)水平选取丰度前二十的物种进行统计绘制菌落结构柱状图并根据丰度表进行样本及组间物种的分析。
1.3 统计学处理
2 结果
2.1 一般情况
符合纳入标准的对象基本特征,见表1。2 组间婴儿性别、分娩方式、脐动脉pH 及乳酸、脐静脉pH 及乳酸、母亲年龄、胎龄、出生体重、身长及头围间的差异无统计学意义(P>0.05);妊娠期糖尿病组(A 组)母亲孕前BMI 高于正常足月儿组(B 组),组间母亲孕前BMI 差异有统计学意义(P<0.05)。
表1 A 组与B 组母婴一般情况比较()Tab.1 Comparison of maternal and infant general conditions between group A and B()
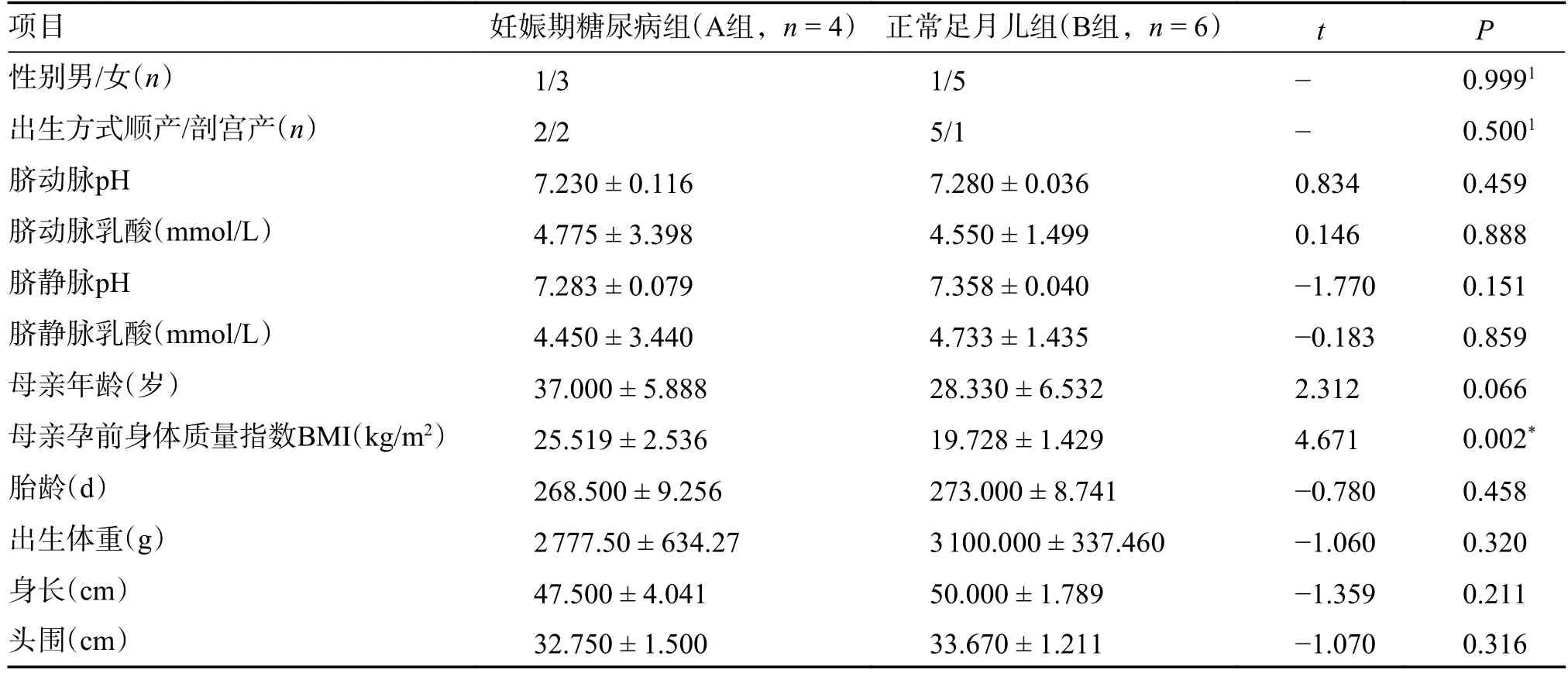
表1 A 组与B 组母婴一般情况比较()Tab.1 Comparison of maternal and infant general conditions between group A and B()
1为Fisher确切概率法计算的P值,*P <0.05。
2.2 测序数据结果
经过16S rDNA 基因高通量测序,10 个样本共得到601 794 条有效序列(Clean Reads),平均有效序列数为60 179.4 条,其中最大序列数为64 431 条,最少序列数为55 961 条。
2.3 胎盘菌群OTU 聚类及物种注释分析
2.3.1 OTU 聚类分析按97%相似度进行聚类,各样本OUT 数量柱状图,平均每个样本含有171.4 个OTU 数,2 组OTU 数量,差异无统计学意义(P>0.05),见图2a。所有样本共检测出783个OTU,其中妊娠期糖尿病组有427 个OTU,特有OTU 数为154 个,而正常足月儿组有576 个,特有的OTU 为303 个,2 组共有OUT 数量为273 个,见图2b。

图2 OTU 数据统计图(a)和OTU Venn 图(b)Fig.2 Statistical chart of otu data(a)and OTU Venn chart(b)
2.3.2 物种丰度分析(1)门水平上的物种丰度分析:在门水平上,全样本丰度明显占优势的菌门有Proteobacteria(变形菌门)、Actinobacteria(放线菌门)、Firmicutes(厚壁菌门)、Bacteroidetes(拟杆菌门)、Verrucomicrobia(疣微菌门)、Fusobacteria(梭杆菌门)、Deinococcus-Thermus(异常球菌-栖热菌门)等,其中变形菌门、放线菌门、厚壁菌门、拟杆菌门的丰度占总样本丰度的95%以上,见图3。

图3 门水平菌落结构柱状图Fig.3 Barplot of colony structure at phylum level
(2)属水平上的物种丰度分析 在属水平上,全样本丰度明显占优势的菌属有Arthrobacter(节细菌属)、Pseudomonas(假单胞菌属)、Bacteroides(多形杆状菌属)、Deiftia、Brevundimonas(短波单胞菌属)、Lactobacillus(乳杆菌属)、Chryseobacterium、Acinetobacter(不动杆菌属)、Klebsiella(克雷伯氏杆菌属)、Stenotrophomonas(单胞菌属)、Sphingobacterium(鞘氨醇杆菌属)、Escherichia/Shigella(埃希氏菌属/志贺氏菌属)等,见图4。

图4 属水平菌落结构柱状图Fig.4 Barplot of colony structure at genus level
2.3.3 物种丰度聚类热图根据物种丰度信息,选取丰度前二十的物种,对样本和物种进行聚类,并绘制成热图。2 组间物种组成及丰度相似,每个物种在各样本中的丰度如下图所示,见图5。
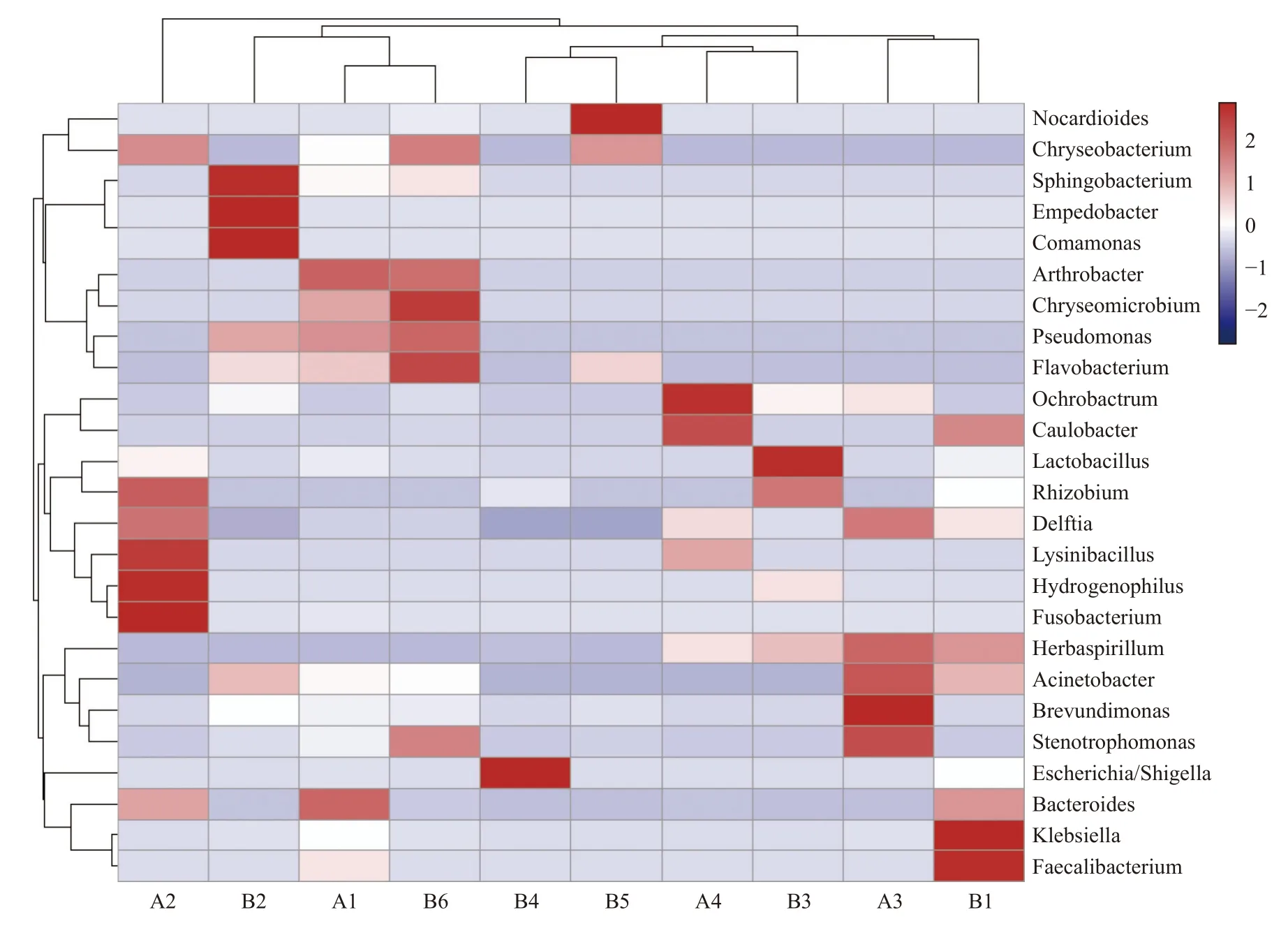
图5 属水平物种丰度热图Fig.5 Heatmap of species abundance at genus level
横向聚类表示该物种在各样本中的丰度相似情况,纵向聚类表示所有物种在不同样本间表达的相似情况,距离越近,枝长越短,说明越相似;2 到-2 对应颜色变化表示物种丰度逐渐降低。
2.4 胎盘组织菌群多样性分析
2.4.1 测序量的评估根据曲线跨度和下降趋势可知,每个样品中物种的丰富度和均匀度,见图6;物种积累曲线急剧上升后趋于平缓,说明研究中样本测序量已经能够反映样品中绝大多数的微生物信息,见图7。

图6 Rank-abundance 曲线Fig.6 Rank-abundance curves

图7 物种累积曲线Fig.7 Species accumulation curves
物种的丰富度越高,曲线在横轴上的跨度越大;曲线下降越平缓,物种分布越均匀。
2.4.2 Alpha 多样性分析A 组与B 组之间的Alpha 多样性指数差异无统计学意义(P>0.05),见图8。

图8 组间Alpha 多样性指数差异图Fig.8 Difference diagram of Alpha diversity index between groups
2.4.3 Beta 多样性分析(1)NMDS 分析A 组与B 组之间胎盘菌群的物种组成有一定差异,但差异无统计学意义(P>0.05),见图9。

图9 Shepard 图(a);NMDS 图(b)Fig.9 Shepard diagram(a);NMDS diagram(b)
R^2 越大越好/2 个R^2 值越一致越好;Stress <0.2 说明有一定可靠性。
(2)PCoA 分析 A 组与B 组之间胎盘菌群的物种组成有差异,但差异无统计学意义(P>0.05),见图10。

图10 主坐标分析PCoA 图Fig.10 Principal Coordinate Analysis Diagram
2.5 组间物种LEfSe 差异分析
组间具有显著性差异的物种的进化情况,见图11a;具有显著性差异的物种有Propionibacteriaceae(丙酸杆菌科)、Propionibacterium(丙酸杆菌属)、Thermales(栖热菌目)、Thermaceae(栖热菌科 )、Thermus(栖热菌属)、Collinsella(柯林斯菌属)、ClostridiumIV(梭状芽胞杆属)、Rikenellaceae、Alistipes(另枝菌属)、Anaerostipes(厌氧棒状菌属)(LDA >2),见图11b。

图11 物种进化树图(a);组间 LDA 分值分布图(b)Fig.11 Phylogenetic tree diagram(a);Distribution chart of LDA scores between groups(b)
3 讨论
GDM 是妊娠期最常见的代谢紊乱疾病,近年来中国GDM 患病率呈急剧上升趋势(8.1%~24.2%)[11]。GDM 的发生受到产妇体重、年龄、遗传和环境等多方面影响[12-13],Sun 等[14]发现孕前BMI 是GDM 的相关风险因素,本研究同样发现伴有GDM 与正常妊娠相比较,母亲孕前BMI差异有统计学意义。GDM 妊娠与正常妊娠相比,胎盘大小增加,绒毛不成熟和一系列血管病变[15],还可能导致胎盘菌群发生改变[5],给母体、胎儿及后代带来严重的短期和长期健康危害[16-18],然而母亲的GDM 状态如何影响胎盘微生物群的相关机制尚不清楚,可能通过炎症和氧化应激与GDM 诱导的高血糖状态相互作用,或通过口腔-胎盘途径影响胎盘菌群[5]。目前饮食+身体活动干预是预防GDM 的主要方法[19],也有许多针对GDM 的药物治疗,但越来越多的证据表明,孕期使用二甲双胍这类降糖药物可能对胎儿生后产生长期的不良后果[20-21]。近年来,益生菌作为一种新的干预措施,在预防妊娠期糖尿病上崭露头角[22-24],它能使胰岛素抵抗(HOMA-IR)和HOMAB 标记物减少并促进胰岛素的分泌[25],影响GDM 孕妇的葡萄糖代谢和体重增加[26],通过调节孕期的微生物组成从而改善产妇健康和妊娠结局[27]。虽然目前大量研究表明服用益生菌对GDM 有一定预防作用,但仍有研究指出益生菌的应用会增加先兆子痫的风险[28]。因而,目前仍然需要个更多的研究来揭示在GDM 中起关键作用的菌群、载量及其在诱导疾病中的作用机制,以及需要更高质量、大规模的临床试验来评估益生菌的最佳剂量和理想细菌组成,从而促进孕期母婴的健康。
本研究检测的胎盘组织中的微生物群主要由变形菌门、放线菌门、厚壁菌门、拟杆菌门等菌门组成,其中变形菌门的相对丰度最高,这与Zheng 等[29]、Bassols 等[30]研究结果一致。属水平上以节细菌属、假单胞菌属、多形杆状菌属、Deiftia、短波单胞菌属、乳杆菌属、Chryseobacterium、不动杆菌属、克雷伯氏杆菌属、单胞菌属、鞘氨醇杆菌属、埃希氏菌属/志贺氏菌属等菌属为主的菌群,Zakis 等[31]、Tang 等[6]及本课题前期研究[10]发现的菌属大致相同。
本研究2 组菌群的物种丰度在门、纲水平上无显著差异,而在目至属水平上,发现栖热菌目、丙酸杆菌科、栖热菌科、Rikenellaceae、丙酸杆菌属、栖热菌属、柯林斯菌属、梭状芽胞杆属IV、另枝菌属、厌氧菌属的丰度在妊娠期糖尿病组中较正常足月儿组显著升高,暂未发现有显著丰度降低的菌类。Bassols[30]等发现GDM 妇女的胎盘微生物群中假单胞菌目和不动杆菌属的相对丰度较低,另一研究[7]发现双歧杆菌属,Duncaniella,及瘤胃球菌属在GDM 中显著升高,Tang 等[6]发现GDM 妇女的胎盘菌群多样性增加,其中Anaerotruncus 瘤胃球菌属、粪球菌属、副普雷沃菌属及乳酸杆菌属的丰度在GDM 中升高,然而韦荣氏菌属丰度降低。综上,多个学者证实GDM 妇女的胎盘菌群与正常妇女对比存在差异,但具体显著性差异的菌类各不相同,一方面可能样本量相对较小,也有可能是胎盘菌群本身的个体差异。
本研究通过Illumina MiSeq 测序系统对胎盘组织的菌群DNA 进行检测和分析,严格执行无菌操作,从胎盘组织中成功分离和鉴定了微生物序列,证明了胎盘组织中存在着一定量的细菌群落DNA,而胎盘菌群的组成、丰度在妊娠期糖尿病与正常足月儿中有显著性差异,而这些显著性差异的菌类可能是妊娠期糖尿病的潜在致病菌并长期影响母婴的健康。本研究也为全面、准确地获得胎盘菌群的信息做出了贡献,为妊娠期糖尿病妇女的胎盘宏基因组研究奠定了重要的理论基础。
