做好题型分类突破Ksp 计算
2023-10-23河南省鄢陵县第一高级中学冯存良
■河南省鄢陵县第一高级中学 冯存良
溶度积常数反映了难溶电解质在水中的溶解能力,在化工流程题中考查溶度积常数是近年高考的热点。化工流程中常常需要控制条件进行离子的分离或除杂,通过溶度积常数计算溶液中金属离子的浓度、离子完全沉淀时的pH,判断废水排放是否符合标准,以及沉淀完全转化时所需离子浓度。
类型一:计算难溶电解质的Ksp
例1从化工厂铬渣中提取硫酸钠的工艺如下:
已知:①铬渣含有 Na2SO4及少量
②Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH 分别为3.6和5。
请计算 Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=____。
解析:pH =5 时,Cr3+完全沉淀,c(Cr3+)=1.0×10-5mol·L-1,c(OH-)=10-9mol·L-1,Ksp[Cr(OH)3]=c(Cr3+)·c3(OH-)=1.0×10-5×(10-9)3=1.0×10-32。
答案:1.0×10-32
类型二:计算沉淀转化反应的平衡常数及其完全转化时所需浓度
依据沉淀的转化反应和Ksp,计算该反应的平衡常数,K值越大,转化反应越易进行,转化程度越大,例如,对于Cu2+(aq)+,该反应的平衡常数
例2软锰矿的主要成分为MnO2,还含有Fe2O3、MgO、Al2O3、CaO、SiO2等杂质,工业上用软锰矿制取MnSO4·H2O 的流程如下:

已知:①部分金属阳离子完全沉淀时的pH 如表1所示。

表1
②温度高于27 ℃时,MnSO4晶体的溶解度随温度的升高而逐渐降低。
第2步除杂,主要是将Ca2+、Mg2+转化为相应氟化物沉淀除去,写出MnF2除去Mg2+的离子方程式:_____,该反应的平衡常数为_____。
已知:MnF2的Ksp=5.3×10-3,CaF2的Ksp=1.5×10-10,MgF2的Ksp=7.4×10-11。
解析:第2步除杂,主要是将Ca2+、Mg2+转化为相应的氟化物沉淀除去,MnF2除去Mg2+的离子方程式是+MgF2;该反应的平衡常数
答案:7.2×107
类型三:由溶度积计算溶液中某离子的浓度
(1)已知溶度积,求溶液中的某种离子的浓度,如Ksp=a的饱和AgCl 溶液中,
(2)已知溶度积、溶液中某离子的浓度,求溶液中的另一种离子的浓度,如某温度下AgCl的Ksp=a,在0.1 mol·L-1的NaCl溶液中加入过量的AgCl固体,达到平衡后c(Ag+)=
例3污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
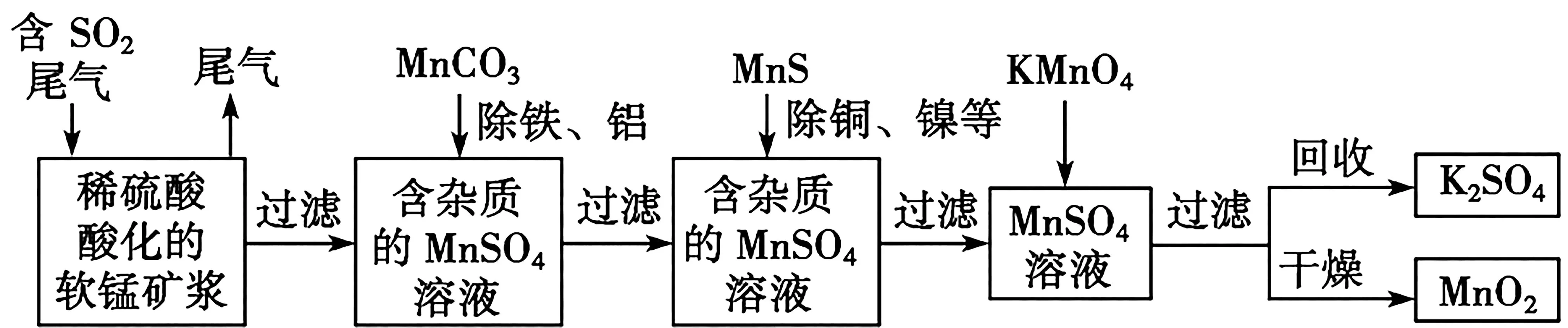
已知:Ksp(CuS)= 8.4 × 10-45,Ksp(NiS)=1.4×10-24。
在除铜、镍的过程中,当Ni2+恰好完全沉淀时[此时c(Ni2+)=1.0×10-5mol·L-1],溶液中Cu2+的浓度是_____mol·L-1。
解析:Ksp(NiS)=c(Ni2+)·c(S2-),即1.4×10-24=1.0×10-5×c(S2-),c(S2-)=1.4×10-19mol·L-1;Ksp(CuS)=c(Cu2+)·c(S2-),即8.4×10-45=1.4×10-19×c(Cu2+),c(Cu2+)=6.0×10-26mol·L-1。
答案:6.0×10-26
类型四:判断离子是否开始沉淀
表2
例4高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含Fe2+、Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
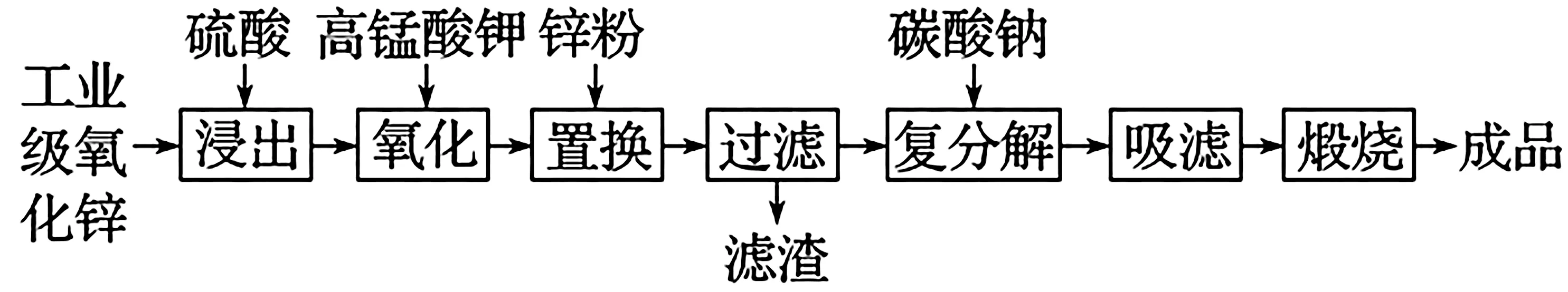
加入KMnO4溶液反应一段时间后,溶液中c(Fe3+)=0.56 mg·L-1,若溶液pH=3,则此时Fe3+_________(填“能”或“不能”)生成沉淀。已知:Ksp[Fe(OH)3]=4.0×10-38。
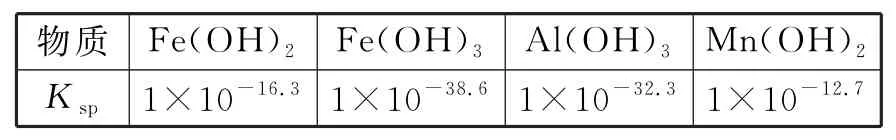
解析:溶液中c(Fe3+)=0.56 mg·L-1,其物质的量浓度为1.0×10-5mol·L-1,若溶液pH=3,此时溶液中c(OH-)=1.0×10-11mol·L-1,1.0×10-5× (1.0×10-11)3=1.0×10-38 答案:不能 例5用软锰矿(主要成分为MnO2,含少量Fe3O4、Al2O3)和BaS制备高纯MnCO3的工艺流程如下: 已知:MnO2是一种两性氧化物;25 ℃时相关物质的Ksp如表3所示。 表3 净化时需先加入的试剂X为____(填化学式),再使用氨水调溶液的pH,则pH 的理论最小值为_____(当溶液中某离子浓度c≤1.0×10-5mol·L-1时,可认为该离子沉淀完全)。 解析:软锰矿中含有的Fe3O4、Al2O3杂质与硫酸反应生成FeSO4、Fe2(SO4)3、Al2(SO4)3,要除去Fe2+,应先将Fe2+氧化为Fe3+,为了不引入其他杂质,加入的氧化剂X可选用H2O2。因Fe(OH)3和Al(OH)3的组成相似,且 Fe(OH)3的Ksp小于Al(OH)3的,因此当Al3+完全沉淀时,Fe3+也完全沉淀,由Ksp[Al(OH)3]=1×10-32.3可知,c(Al3+)·c3(OH-)=1×10-32.3,由题意知,当c(Al3+)≤1.0×10-5mol·L-1时沉淀完全,可求得c(OH-)≥1×10-9.1mol·L-1,即c(H+)≤1×10-4.9mol·L-1,pH 的理论最小值为4.9。 答案:H2O24.9 (1)pH 控制的范围:杂质离子完全沉淀时pH~主要离子开始沉淀时pH。 (2)一般情况下,当溶液中剩余离子的浓度小于1.0×10-5mol·L-1时,化学上通常认为生成沉淀的反应进行完全了。 例6铝氢化钠(NaAlH4)是重要的还原剂。以铝土矿(主要成分Al2O3,含少量SiO2、Fe2O3等杂质)为原料制备NaAlH4的一种流程如下: 已知:碱浸中SiO2转化成难溶的Na2Al2SixO8,常温下,Ksp[Fe(OH)3]=8.0×10-38,Al3+开始沉淀的pH 为4(溶液中离子的浓度小于1.0×10-5mol·L-1为沉淀完全),从滤液中先分离出Fe3+,应调节pH 范围为_____(lg2≈0.3)。 解析:要使Fe3+完全沉淀,即c(Fe3+)<1.0×10-5mol· L-1,故c(OH-)>2×10-11mol·L-1,利用常温下水的离子积常数10-4mol·L-1,故pH>3.3,而Al3+开始沉淀时的pH 为4,故pH 范围为3.3≤pH<4。 答案:3.3≤pH<4 例7钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程如下: “结晶”前需向滤液中加入Ba(OH)2固体以除去。若滤液中当BaMoO4开始沉淀时,的去除率是____%[已知:Ksp(BaCO3)=1.0×10-9,Ksp(BaMoO4)=4.0×10-8,溶液体积变化忽略不计]。 解析:Ksp(BaMoO4)=4.0×10-8,由可知,当BaMoO4开始沉淀时,c(Ba2+)=1.0×10-7mol·L-1,由Ksp(BaCO3)=可知,此时溶液中=0.01 mol·L-1,所以,的去除率为90%。 答案:90类型五:计算离子开始沉淀时的pH 及完全沉淀时的pH
类型六:调pH 除杂——计算pH 范围
类型七:去除率

