化学反应与能量变化热点题型分类例析
2023-10-23陕西省永寿县中学马亚楼
■陕西省永寿县中学 马亚楼
能源问题是社会热点问题,是近年来高考必考知识,其中与化学反应的能量变化、反应热有关的判断与计算是高考考查的重点,也是难点。现就高考试题中化学反应与能量变化的热点题型进行分类例析,以期对读者有所帮助。
题型一:化学反应中能量变化的图像分析
例1反应物(S)转化为产物(P 或P·Z)的能量与反应进程的关系如图1所示。下列有关四种不同反应进程的说法正确的是( )。
A.进程Ⅰ是吸热反应
B.平衡时P的产率:Ⅱ>Ⅰ
C.生成P的速率:Ⅲ>Ⅱ
D.进程Ⅳ中,Z没有催化作用
解析:由图中信息可知,进程Ⅰ中S的总能量大于产物P 的总能量,因此进程Ⅰ是放热反应,故A 项错误。进程Ⅱ中使用了催化剂X,但是催化剂不能改变平衡产率,因此平衡时进程Ⅰ和进程Ⅱ中P 的产率相同,故B项错误。进程Ⅲ中由S·Y 转化为P·Y 的活化能高于进程Ⅱ中由S·X 转化为P·X的活化能,由于这两步反应分别是两个进程的决速步骤,因此生成P的速率为Ⅲ<Ⅱ,故C项错误。由图中信息可知,进程Ⅳ中S 吸附到Z表面生成S·Z,然后S·Z 转化为产物P·Z,由于P·Z没有转化为P+Z,因此,Z没有表现出催化作用,故D 项正确。
答案:D
例2自由基是化学键断裂时产生的含未成对电子的中间体,活泼自由基与氧气的反应一直是科研人员的关注点。HNO 自由基与O2反应过程的能量变化如图2所示,下列说法正确的是( )。
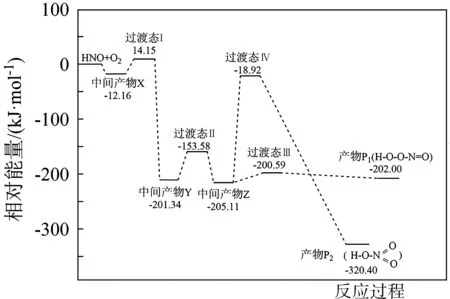
图2
A.反应物的键能总和大于生成物的键能总和
B.产物P1与P2的分子式、氧元素的化合价均相同
C.该历程中最大正反应的活化能E正=186.19 kJ
D.相同条件下,Z 转化为产物的速率:v(P1)>v(P2)
解析:由图可知,反应物总能量大于生成物总能量,该反应为放热反应,则参与反应的反应物总键能小于生成物的总键能,故A 项错误。产物P1与P2的分子式均为HNO3,但产物P1结构中存在“—O—O—”,则产物P1中部分氧元素的化合价为-1 价,而产物P2氧元素的化合价为-2 价,两者氧元素的化合价不同,故B 项错误。最大的正反应的活化能出现在由中间产物Z 到过渡态Ⅳ时,即最大正反应的活化能E正=-18.92 kJ·mol-1-(-205.11 kJ·mol-1)=186.19 kJ·mol-1,故C 项错误。相同条件下,反应所需的活化能越小,则反应的速率越快,由于到产物P1所需活化能更小,故反应速率更快,故v(P1)>v(P2),故D 项正确。
答案:D
题型二:热化学方程式的书写与正误判断
例3298 K 时,1gH2燃烧生成H2O(g)放热121 kJ,1 mol H2O(l)蒸发吸热44 kJ,表示 H2燃烧热的热化学方程式为_____。
解析:由298 K 时,1gH2燃烧生成H2O(g)放热121 kJ,可知1 mol H2燃烧生成H2O(g)放热242 kJ。1 mol H2O(l)蒸发吸热44 kJ,则1 mol H2O(g)→H2O(l)放热44 kJ,故1 mol H2燃烧生成1 mol H2O(l)放热242 kJ+44 kJ=286 kJ,表示H2燃烧热的热化学方程式为H2O(l) ΔH=-286 kJ·mol-1。
答案:ΔH=-286 kJ·mol-1
例4标准状况下,气态分子断开1 mol化学键的焓变称为键焓。已知H—H、H—O 和 O═ O 键的键焓 ΔH分别为436 kJ·mol-1、463 kJ·mol-1、495 kJ·mol-1,下列热化学方程式正确的是( )。
B.H2O(g)══H2(g)+ΔH=+485 KJ·mol-1
C.2H2(g)+O2(g)══2H2O(g) ΔH=+485 kJ·mol-1
D.2H2(g)+O2(g)══2H2O(g) ΔH=-485 kJ·mol-1
解析:由于水分解是吸热反应,应该ΔH>0,故A 项错误。H2O(g)══H2(g)+的ΔH=2×463 kJ· mol-1-242.5 kJ·mol-1,故B 项错误。氢气燃烧放热,应该ΔH<0,故C 项错误。2 mol H2和1 mol O2完全反应生成2 mol H2O(g)产生的焓变是436 kJ·mol-1×2+495 kJ·mol-1×1-463 kJ·mol-1×4=-485 kJ·mol-1,所以该过程的热化学方程式为2H2(g)+O2(g)══2H2O(g) ΔH=-485 kJ·mol-1,D 项正确。
答案:D
评注:此类试题考查了热化学方程式的书写、反应热的计算,题目难度中等,注意掌握热化学方程式的书写原则,明确化学键与化学反应中能量变化的关系是解题关键。
题型三:利用盖斯定律进行计算
例5已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)══2SO2(g)+2H2O(g) ΔH1=+103 kJ·mol-1
②4H2S(g)+2SO2(g)══3S2(g)+4H2O(g) ΔH2=+94 kJ·mol-1
③2H2(g)+O2(g)══2H2O(g) ΔH3=-484 kJ·mol-1
计算H2S 热分解反应④2H2S(g)══S2(g)+2H2(g)的ΔH4=_____kJ·mol-1。
解析:根据盖斯定律,(①+②)×即得到2H2S(g)══S2(g)+2H2(g)的ΔH4=(-1 036+94)kJ· mol-1×484 kJ·mol-1=+170 kJ·mol-1。
答案:+170
例6“世上无难事,九天可揽月”,我国的航空航天事业取得了举世瞩目的成就。碳酰肼类化合物[Mn(L)3](ClO4)2是一种优良的含能材料,可作为火箭推进剂的组分,其相关反应的能量变化如下所示,已知ΔH2=-299 kJ·mol-1,则ΔH1(单位:kJ·mol)为( )。
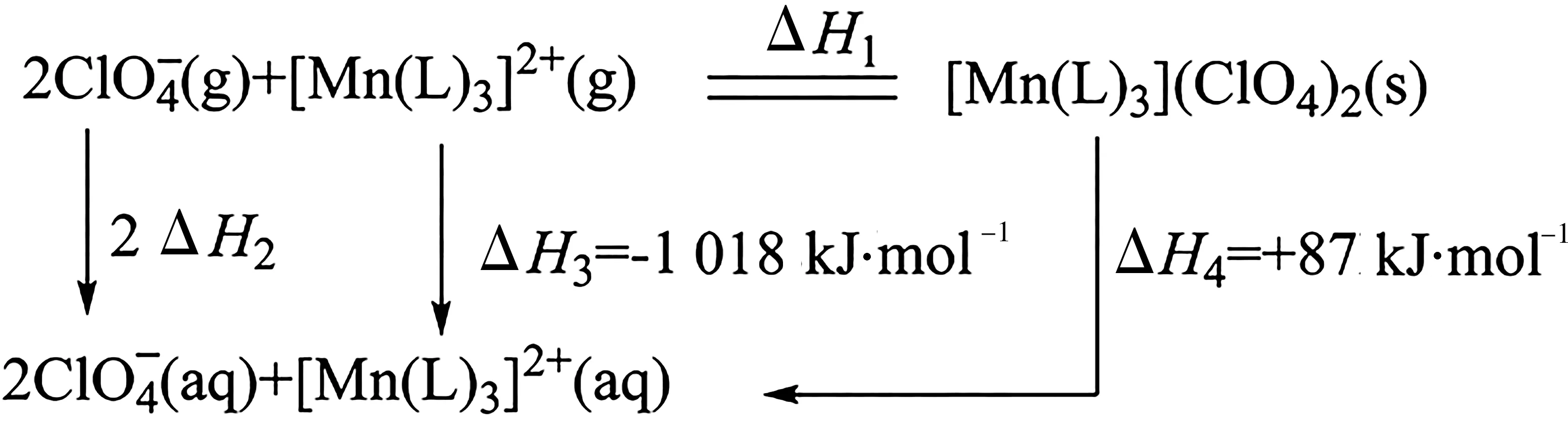
A.-1 703 B.-1 389
C.-1 334D.-1 160
解析:由盖斯定律可知,ΔH1=2ΔH2+ΔH3-ΔH4=2× (-299 kJ·mol-1)+(-1 018 kJ·mol-1)-(+87 kJ·mol-1)=-1 703 kJ·mol-1。
答案:A
题型四:利用键能计算反应热
例7已知共价键的键能与热化学方程式信息如表1所示。

表1
则2O(g)══O2(g)的ΔH为( )。
A.+428 kJ·mol-1B.-428 kJ·mol-1
C.+498 kJ·mol-1D.-498 kJ·mol-1
解析:根据ΔH=反应物的键能总和-生成物的键能总和计算。反应2H2(g)+O2(g)══2H2O(g)的ΔH=2(H—H)+(O—O)-4(H—O),即-482 kJ·mol-1=2×436 kJ· mol-1+ (O—O)- 4 ×463 kJ·mol-1,解得 O—O 键的键能为498 kJ·mol-1,2个氧原子结合生成氧气的过程需要释放能量,因此2O(g)══O2(g)的ΔH=-498 kJ·mol-1。
答案:D
例8白磷与氧气可发生反应P4+5O2══P4O10。已知断裂下列化学键需要吸收的能量分别为 P—PakJ· mol-1、P—ObkJ·mol-1、P═ OckJ· mol-1、O═ OdkJ·mol-1。根据图3所示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )。
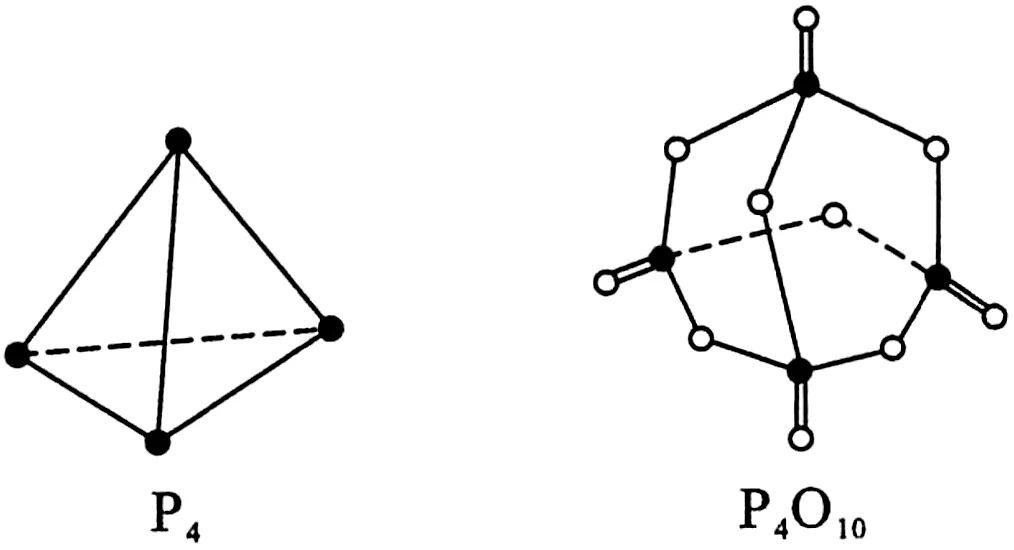
图3
A.(6a+5d-4c-12b)kJ·mol-1
B.(4c+12b-6a-5d)kJ·mol-1
C.(4c+12b-4a-5d)kJ·mol-1
D.(4a+5d-4c-12b)kJ·mol-1
解析:由题给结构图可知P4中有6 个P—P 键,P4O10中有12 个P—O 键和4 个P═ O 键,反应热=反应物的键能-生成物的键能,所以ΔH=(6a+5d)-(12b+4c)=(6a+5d-12b-4c)kJ·mol-1。
答案:A
题型五:根据反应热计算键能
例9已知反应2HI(g)══H2(g)+I2(g)的ΔH= +11 kJ· mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为____kJ。
解析:该题主要考查根据反应热计算键能的问题,难度不大,解答时根据反应热与键能的关系进行计算即可。设1 mol HI(g)分子中化学键断裂吸收的能量为xkJ,由反应热与键能的关系可知,2x=436+151+11,解得x=299,故1 mol HI(g)分子中化学键断裂时需吸收的能量为299 kJ。
答案:299
题型六:已知一定量的物质参加反应计算放出的热量
例10已知丙烷的燃烧热ΔH=-2 215 kJ·mol-1,若一定量的丙烷完全燃烧后生成1.8 g 水,则放出的热量约为( )。
A.55 kJ B.220 kJ
C.550 kJD.1 108 kJ
解析:由丙烷分子式是C3H8,燃烧热为ΔH=-2 215 kJ·mol-1,可知1 mol丙烷完全燃烧会产生4 mol水,放热2 215 kJ。丙烷完全燃烧产生1.8 g 水,物质的量为0.1 mol,消耗丙烷的物质的量为0.025 mol,所以反应放出的热量是Q=0.025 mol×2 215 kJ·mol-1=55.375 kJ,因此大约数值与选项A 接近。
答案:A
题型七:反应热大小的比较
例11相同温度和压强下,关于反应的ΔH,下列判断正确的是( )
A.ΔH1>0,ΔH2>0
B.ΔH3=ΔH1+ΔH2
C.ΔH1>ΔH2,ΔH3>ΔH2
D.ΔH2=ΔH3+ΔH4
解析:一般的烯烃与氢气发生的加成反应为放热反应,但是,由于苯环结构的特殊性决定了苯环结构的稳定性,苯与氢气发生加成反应生成1,3-环己二烯时,破坏了苯环结构的稳定性,因此该反应为吸热反应。即环己烯、1,3-环己二烯分别与氢气发生的加成反应均为放热反应,因此,ΔH1<0,ΔH2<0,故A 项不正确。苯分子中没有碳碳双键,其中的碳碳键是介于单键和双键之间的特殊的共价键,因此,其与氢气完全加成的反应热不等于环己烯、1,3-环己二烯分别与氢气发生的加成反应的反应热之和,即ΔH3≠ΔH1+ΔH2,故B项不正确。环己烯、1,3-环己二烯分别与氢气发生的加成反应均为放热反应,ΔH1<0,ΔH2<0,由于1 mol 1,3-环己二烯与氢气完全加成后消耗的氢气是等量环己烯的2 倍,故其放出的热量更多,其ΔH1>ΔH2;苯与氢气发生加成反应生成1,3-环己二烯的反应为吸热反应(ΔH4>0),根据盖斯定律可知,苯与氢气完全加成的反应热ΔH3=ΔH4+ΔH2,因此ΔH3>ΔH2,故C项正确。根据盖斯定律可知,苯与氢气完全加成的反应热ΔH3=ΔH4+ΔH2,因此ΔH2=ΔH3-ΔH4,故D 项不正确。
答案:C
题型八:燃烧热、中和热的判断、求算及测量
例12已知热化学方程式:
则氢气的燃烧热为( )。
A.241.8 kJ·mol-1
B.483.6 kJ·mol-1
C.285.8 kJ·mol-1
D.571.6 kJ·mol-1
解析:燃烧热指1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,根据热化学方程式的含义,H2的标准燃烧热的热化学方程式为ΔH=-285.8 kJ·mol-1。
答案:C
题型九:根据已知的热化学方程式,进行有关的计算(求放出的热量、参加反应的物质的量等)
例13已知:2H2+O2(g)══2H2O(l)ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)══CO2+2H2O(l)ΔH=-890 kJ·mol-1
现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3 695 kJ。则原混合气体中H2与CH4的物质的量之比是( )。
A.1∶1 B.1∶3
C.1∶4 D.2∶3
解析:设原混合气体中H2的物质的量为xmol,CH4的物质的量为ymol,单位物质的量的 H2和 CH4放 出 热 量 分 别 为285.8 kJ·mol-1、890 kJ·mol-1。依题意有:
解得x=1.25,y= 3.75,故
答案:B
题型十:综合性判断
例14通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是( )。
①C(s)+H2O(g)══CO(g)+H2(g)ΔH1=akJ·mol-1
②CO(g)+H2O(g)══CO2(g)+H2(g)ΔH2=bkJ·mol-1
③CO2(g)+3H2(g)══CH3OH(g)+H2O(g) ΔH3=ckJ·mol-1
④2CH3OH(g)══CH3OCH3(g)+H2O(g) ΔH4=dkJ·mol-1
A.反应①②为反应③提供原料气
B.反应③也是CO2资源化利用的方法之一
D.反应 2CO (g)+ 4H2(g)══CH3OCH3(g)+H2O(g)的ΔH=(2b+2c+d) kJ·mol-1
解析:本题是有关反应热的综合性判断。由反应①中的产物CO 和反应②中的H2可知A项正确。反应③中将CO2转化为CH3OH,因此B项正确。根据盖斯定律,结合题给热化学方程式,可知2×②+2×③+④即可得2CO(g)+4H2(g)══CH3OCH3(g)+H2O(g),故D 项正确。C 项貌似正确,实则产物中的H2O 为液态形式,而反应④生成物中的H2O为气态,因而最终的
答案:C
巩固与练习:
1.工业上常用磷精矿[Ca5PO4)3F]和硫酸反应制备磷酸。已知25 ℃,101 kPa时:
CaO(s)+H2SO4(l)══CaSO4(s)+H2O(l) ΔH=-271 kJ·mol-1
5CaO(s)+3H3PO4(l)+HF(g)══Ca5(PO4)3F(s)+ 5H2O (l) ΔH=-937 kJ·mol-1
则Ca5(PO4)3F 和硫酸反应生成磷酸的热化学方程式是____。
2.已知下列反应:
3.通过以下反应均可获取H2。下列有关说法正确的是( )。
①太阳光催化分解水制氢:2H2O(l)══2H2(g)+O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+H2O(g)══CO(g)+H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)══CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)══C(s)+2H2(g)的ΔH=+74.8 kJ·mol-1
答案:1.Ca5(PO4)3F(s)+5H2SO4(l)══5CaSO4(s)+3H3PO4(l)+HF(g)ΔH=-418 kJ·mol-1
2.ΔH1+ΔH2-ΔH3
3.D
