例谈基于“守恒关系”的水溶液中的离子平衡问题
2023-10-23黑龙江省宾县第一中学刘成宝正高级教师田香云
■黑龙江省宾县第一中学 刘成宝(正高级教师) 田香云
电荷守恒关系式和物料守恒关系式是水溶液中微粒间存在的重要的定量关系式,结合平衡常数表示式,可以建立微粒间的新型定量关系式。
例1当雨水中含有来自大气的CO2,溶于水中的CO2进一步和水反应,发生电离:
溶液中CO2的浓度与其在空气中的分压值成正比(分压=总压×物质的量分数),比例系数为ymol·L-1·kPa-1,当大气压为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+浓度为____mol·L-1(写出混合溶液中的电荷守恒关系式为c(Na+)+c(H+)=c(CN-)+c(Cl-)+c(OH-),等体积混合后的物料守恒关系式为,其中由溶液呈中性可知c(OH-)=c(H+)=1×10-7mol·L-1,且c(CN-)=由物料守恒关系可知表达式,考虑水的电离,忽略的电离)。
解析:反应②的平衡常数K=因此Kh=,由题可知溶液中CO2的浓度c(CO2)=pxymol·L-1,则解题的关键在于的确定。由试题所给的考虑水的电离,忽略的电离这一条件可知,溶液中的电荷守恒关系为,因此K=由HCN 电离平衡常数和CN-水解平衡常数的关系,可知HCN 的电离平衡常数Ka=(a-0.01)×10-5。
例3HA 是一元弱酸,难溶盐MA 的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解。实验发现,298 K 时c2(M+)~c(H+)为线性关系,如图1 中实线所示。下列叙述错误的是( )解 得c(H+) =
例2在25 ℃下,将amol·L-1的NaCN 溶液与0.01 mol·L-1的盐酸等体积混合,反应后测得pH=7,则该温度下CN-的水解常数Kh=_____。HCN 的电离平衡常数Ka=_____。
解析:CN-水解平衡常数表达式为Kh=
A.溶液pH=4 时,c(M+)<3.0×10-4mol·L-1
B.MA 的溶度积Ksp(MA)=5.0×10-8
C.溶液pH=7 时,c(M+)+c(H+)=c(A-)+c(OH-)
D.HA的电离常数Ka(HA)≈2.0×10-4
解析:本题解析的关键在于如何理解c2(M+)~c(H+)为线性关系。由M+不发生水解及HA 是一元弱酸可知,难溶盐MA 的饱和溶液中存在c(M+)=c(A-)+c(HA)。则由Ksp(MA)=c(M+)·c(A-)=c(M+)·[c(M+)-c(HA)]=c2(M+)-c(M+)·c(HA ) =c2(M+) -由图可知当c(H+)=0 时,c2(M+)=Ksp(MA)=5.0×10-8。将图中任意一点坐标代入c2(M+)=Ksp(MA)+c(H+)×解得Ka(HA)=2.0×10-4。同时应注意的是c(H+)增大的原因不能是增大c(HA)所引起的变化,因为增大c(HA)时,c(A-)增大,则c(M+)减小,不符合c2(M+)~c(H+)的线性变化关系,故C项错误。
例4t℃时,向蒸馏水中不断加入NaA 溶液,溶液中c2(OH-)与c(A-)的变化关系如图2所示,下列叙述错误的是( )。
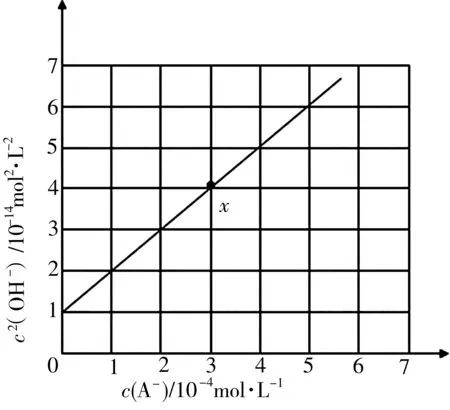
图2
A.当溶液中c(A-)=2.0×10-4mol·L-1时,有c(H+)>5.0×10-8mol·L-1
B.该温度下,A-的水解常数Kh的数量级为10-11C.溶液中:c(HA)+c(H+)=c(OH-)D.x点溶液中:c(Na+)>c(A-)>c(HA)>c(H+)
解析:由NaA 溶液存在的电荷守恒关系c(Na+)+c(H+)=c(A-)+c(OH-)及物料守恒关系c(Na+)=c(HA)+c(A-)可知溶液中的质子守恒关系为c(OH-)=c(HA)+c(H+),则c2(OH-)=c(OH-)·[c(HA)+=Kh·c(A-)+Kw。因此依据图像中的变化关系解得Kh=1.0×10-10,Kw=1.0×10-14,进而结合电荷守恒关系确定出x点溶液中离子浓度的关系为c(Na+)>c(A-)>c(HA)>c(H+)。故答案为B。
例5SrF2属于难溶于水、可溶于酸的盐。常温下,用HCl调节SrF2浊液的pH,测得不同pH 条件下,体系中-lg(X)(X 为Sr2+或F-)与的关系如图3 所示。下列说法正确的是( )
A.L1表示-lg(Sr2+)与的变化曲线
B.Ka(HF)的数值为10-2.2
C.a、c两点溶液中均存在2c(Sr2+)+c(H+)=c(F-)+c(OH-)
D.c点的溶液中存在c(Cl-)>c(F-)
解析:由可知,因此确定L1表示-lg(F-)与的变化曲线,则Ka(HF)的数值为10-3.2。加入HCl后存在的电荷守恒关系为2c(Sr2+)+c(H+)=c(F-)+c(OH-)+c(Cl-),c点时溶液中c(Sr2+)=c(F-),结合存在的物料守恒关系2c(Sr2+)=c(F-)+c(HF)可知c(Sr2+)=c(F-)=c(HF),此时溶液的pH=3.2,再由电荷守恒关系可知c(Cl-)>c(F-),正确答案为D 项。
