葡萄铁蛋白基因Ferritin的鉴定、克隆及其在果实发育不同时期对氨基酸铁复合肥喷施的响应
2023-10-23宋志忠王建萍史圣朋曹晶雯刘万好徐维华肖慧琳唐美玲
宋志忠,王建萍,史圣朋,曹晶雯,刘万好,徐维华,肖慧琳,唐美玲
葡萄铁蛋白基因的鉴定、克隆及其在果实发育不同时期对氨基酸铁复合肥喷施的响应
宋志忠1,2,3,王建萍1,2,史圣朋3,4,曹晶雯2,刘万好1,徐维华1,肖慧琳,唐美玲
1烟台农业科学研究院葡萄研究所,中国山东烟台 264000;2鲁东大学农林工程研究院/山东省高等学校重点实验室(作物高产抗逆分子模块育种实验室),中国山东烟台 264025;3剑桥大学植物系,英国剑桥 CB2 3EA;4剑桥大学沃尔森学院,英国剑桥 CB3 9BB)
【目的】铁蛋白Ferritin在植物生长发育过程中发挥重要作用,其在果树中的生物学功能尚未见报道。克隆葡萄Ferritin家族基因并揭示其在果实发育不同时期的表达模式及其对叶面喷施氨基酸-铁(Fe)复合肥处理的响应差异,可为研究果树铁素营养与代谢的分子机制提供理论依据。【方法】通过同源克隆法从‘马瑟兰’中克隆Ferritin家族基因,利用生物信息学手段分析葡萄及其编码蛋白的详细特征;设置叶面喷施氨基酸-Fe复合肥处理,利用荧光实时定量PCR技术分析在葡萄果实发育不同时期的表达特征及其对叶面喷施处理的差异响应。【结果】在葡萄基因组中检索并克隆获得4个Ferritin家族基因,命名为—,分布于第6、8和13号三条染色体上,均含有7个长度不一的内含子,且主要定位于叶绿体和细胞核。本文所选16种植物Ferritin蛋白序列的一致性高达61.48%,系统发育树分析表明同一属的Ferritin同源蛋白如十字花科的拟南芥和芜菁,茄科的烟草和马铃薯,豆科的大豆、落花生和鹰嘴豆,大戟科的橡胶树、木薯和蓖麻,蔷薇科的苹果、桃和草莓,遗传进化关系较近,葡萄VvFer3和茄科同源蛋白遗传关系最近。葡萄VvFer基因在五年生‘马瑟兰’果实发育不同时期、不同组织中的表达水平差异较大,其中,在不同组织中的表达量均最高,最大值出现在硬核期至成熟期的果实中,其次是和。‘马瑟兰’葡萄发育不同时期果实中的Fe含量略有差异,从幼果期开始逐渐增加,并在转色期果实中达到最高值,从转色期到成熟期略有下降,但仍高于幼果期和硬核期果实中的Fe含量,叶面喷施处理显著提高了成熟期果实中的Fe含量、乌头酸酶ACO(aconitase)、硝酸还原酶NIR(nitrite reductase)和琥珀酸脱氢酶SDH(succinate dehydrogenase)的酶活性。—在转录水平易受叶面喷施铁肥的诱导而显著增强,且与葡萄组织/器官分布和果实发育的不同时期密切相关,在葡萄发育整个周期仅在果实中对叶面喷施铁肥处理比较敏感,在所有组织中仅从幼果期至转色期对叶面喷施铁肥有响应,在葡萄发育整个周期的韧皮部和叶片中持续受叶面喷施铁肥的诱导,而在果实中仅从幼果期至转色期对叶面喷施铁肥有响应;在本文所选组织中的表达量相对较低,但很均匀,且在转录水平对叶面喷施铁肥没有响应。【结论】从葡萄中克隆并鉴定了4个铁蛋白基因,其在葡萄发育不同时期、不同组织中的表达水平差异较大,并在转录水平易受叶面喷施铁肥的诱导;在葡萄所有组织中的整体表达量最高(特别是果实中最为突出),且在幼果期至转色期易受铁肥叶面喷施的调控。
葡萄;Fe的储藏与封存;Fe蛋白;氨基酸-Fe复合肥;叶面喷施
0 引言
【研究意义】铁(Fe)是植物细胞中含量较为丰富的矿物元素之一,参与多种代谢途径和生命过程[1-3],土壤缺铁导致作物减产和品质降低[4-6]。铁蛋白Ferritin参与Fe的储藏和封存过程,在植物的生命过程中具有至关重要的作用。鉴定和克隆果树Ferritin家族基因,为研究果树Fe的转运与分配机制提供参考,并为解析果树Fe素营养和高效利用奠定理论基础。【前人研究进展】果树学中,Fe肥施用与果树的生长、发育、果实品质形成和产量密切相关,土壤缺Fe不利于果树的生长和发育,造成作物严重减产或品质降低[4-7]。高等植物为适应缺Fe胁迫而进化出的两种根际Fe吸收策略[7-10]:双子叶植物和非禾本科单子叶植物的吸收策略Ⅰ,通过铁还原酶FRO(ferric reduction oxidase)将根系周围的Fe3+被还原为Fe2+,再通过铁调节转运蛋白IRT(iron-regulated transporter)进入根系被植物吸收利用[7,10-11];禾本科植物的吸收策略Ⅱ,通过将Fe3+与麦根酸MA(mugineic acid)成Fe3+-MA螯合物,由载体PS(phytosiderophore)途径转运吸收Fe3+[9-12]。当Fe进入细胞后,NRAMP(natural resistance associated macrophage proteins)、PIC(permease in chloroplast)和VIT(vacuolar iron transporter)等转运蛋白参与Fe在植物细胞内的转运和分配[7,10-14]。通常,细胞内的Fe储存在液泡中,也可能被螯合成铁蛋白Ferritin,用于各种依赖于Fe的代谢途径和生理过程。Ferritin对于微调代谢所需的多种金属元素的含量至关重要[13-14]。质体可充当细胞中Fe池的作用,能感知和维持细胞中Fe的浓度以适应外界不同Fe素供应的变化。Ferritin是一类由核基因编码的24聚体,其结构在真核生物中高度保守[13-14]。拟南芥中已鉴定出4个Ferritin家族基因(—),在转录水平受过量铁毒害、H2O2、脱落酸ABA(abscisic acid)等非生物胁迫的调控[13-15]。AtFER定位于叶绿体中并与Fe形成复合物,参与调控细胞内Fe的储藏和封存,并维持植物耐受干旱[16]、失水胁迫[17]、活性氧ROS(reactive oxygen species)[13,18-19]等外界不利环境的胁迫。近年来,Ferritin家族基因在梨[20]、月季[17]、大豆[21]、木薯[22]等植物中被陆续克隆和报道。钟晨等[20]从‘砀山酥梨’中克隆了一个,其在叶片中的表达水平受轻度缺铁的诱导而增强,且随着缺铁程度的增加,其表达量显著下降。Liu等[17]从月季花瓣中克隆了一个参与花瓣失水胁迫耐性和衰老进程的铁蛋白基因,其表达水平受ABA和失水胁迫的诱导,沉默和分别降低了月季花瓣的失水胁迫耐性,进一步研究表明在失水胁迫过程中转录水平的调节依赖。【本研究切入点】国内外学者对植物Fe吸收、转运和分配的分子机制研究主要集中在拟南芥、水稻等一年生模式植物[8-14],有关果树Fe素营养与高效利用的分子机制研究较少。葡萄(L.)是一种全球性的水果作物,其基因组序列已公布[23]。在维持植物生长和发育所必需的诸多微量元素中,葡萄对Fe的需求量最大,Fe与葡萄品质和产量密切相关[4-6]。然而,葡萄对Fe吸收、转运和分配的分子机制尚不清楚,葡萄铁蛋白Ferritin的生物学功能依然未知。【拟解决的关键问题】本研究以‘马瑟兰’葡萄为材料,克隆葡萄Ferritin家族基因并鉴定其生物信息学特征,明确其在葡萄不同发育时期、不同组织部位的表达特征及其对叶面喷施氨基酸-铁复合肥的响应差异,为研究葡萄Ferritin和果树铁素营养与高效利用的分子机制提供基因资源。
1 材料与方法
试验于2020年5月至2023年2月在“十三五”山东省高等学校重点实验室—作物高产抗逆分子模块育种实验室和剑桥大学植物系离子运输实验室合作完成。
1.1 试验材料与处理
供试材料为山东省烟台市葡萄酒产区主栽品种‘马瑟兰’,由山东省烟台市农业科学研究院果树所提供,种植在国家产业体系烟台葡萄试验站,树体健壮,南北行向,常规田间管理。参照张璐等[24]与房经贵等[25]的描述,分别采集五年生‘马瑟兰’盛花后35 d(35 DAFB,属于幼果期)、50 d(50 DAFB,硬核期)、70 d(70 DAFB,转色期)、85 d(85 DAFB,第二次膨大期)和115 d(115 DAFB,成熟期)的果实、结果枝中间部分的叶片及韧皮部材料,用液氮冷冻并保存于-80℃低温冰箱中备用。
根据含氨基酸水溶性肥料(微量元素型)液体产品国家农业标准(NY1429—2007)配制氨基酸-铁水溶性液体肥料[26-27],FeSO4的终浓度为1 000 mg∙kg-1。参照Song等[26]和Sheng等[27]的描述,分别于幼果期、转色期和第二次膨大期前的第7天进行氨基酸-Fe水溶性液体肥料叶面喷施处理,6棵葡萄树一组,共喷施3组,以叶片上喷施的液体能均匀滴落为准,喷施蒸馏水的树体作为对照,分别于35 DAFB(幼果期)、50 DAFB(硬核期)、70 DAFB(转色期)、85 DAFB(第二次膨大期)和115 DAFB(成熟期)采集喷施铁肥处理后的果实、结果枝中间部分的叶片及韧皮部材料,用于实时荧光定量PCR分析,其中果实材料进一步用于Fe含量测定。
1.2 生理指标分析
参照Song等[24,28-29]和Sheng等[27]的描述,葡萄果实材料烘干后利用HNO3-HClO4法消解,通过电感耦合等离子体原子发射光谱仪ICP-AES(IRIS Advantage, Thermo Electron, USA)测定发育不同时期果实中的Fe含量。参照Song等[24,28-29]和Sheng等[27]描述的方法测定葡萄果实中乌头酸酶(aconitase,ACO)的活性,利用中国南京建成生物工程研究所研发的检测试剂盒测定葡萄果实中硝酸还原酶(nitrite reductase,NIR)和琥珀酸脱氢酶(succinate dehydrogenase,SDH)的活性[24,25-29]。
1.3 葡萄VvFer克隆
以拟南芥的氨基酸序列为参考序列[13,15],在Phytozome Grape Genome Database(http://www.phytozome.net)中检索葡萄基因组中相对应的Ferritin家族基因,检索结果在Pfam(http://pfam.xfam.org/search)在线服务器预测功能结构域。根据Phytozome获得的葡萄的CDS(coding sequence)电子序列,分别设计上、下游引物(表1),利用Prime STARTMHS DNA聚合酶(TaKaRa,大连)从‘马瑟兰’整株组培苗中扩增目的基因,送生工生物工程(上海)股份有限公司进行测序验证。

表1 葡萄Ferritin家族基因CDS扩增所需引物
1.4 葡萄VvFer的生物信息学分析
利用‘马瑟兰’中克隆并测序验证的编码区CDS序列和编码氨基酸序列,在Phytozome葡萄基因组数据库中获得VvFer家族基因的基因组DNA序列,利用Gene Structure Display(http://gsds.cbi.pku.edu.cn/index.php)在线服务器进行基因结构分析;通过在线工具Expasy(http://web.expasy.org/program/)预测VvFer蛋白的理论等电点、稳定性、总平均亲水性GRAVY(grand average of hydropathicity)等理化性质;通过MEME(v4.8.1)在线服务器(http://meme- suite.org/tools/meme)预测VvFer蛋白的保守结构域;利用TMpredict在线软件(http://ch.embnet.org/ software/TMPRED_form.html)预测VvFer蛋白的跨膜结构域;借助在线软件SignalP4.0(http://www.cbs. dtu.dk/services/SignalP-4.0/)预测葡萄VvFer蛋白的信号肽情况;利用PSORT在线服务器(http://psort.hgc. jp/form.html)预测VvFer蛋白的亚细胞定位;借助Phyre2在线服务器(http://www.sbg.bio.ic.ac.uk/phyre2/ html/page.cgi?id=index)预测VvFer蛋白的三级结构。根据施富超[22]的描述,在NCBI基因数据库中下载拟南芥AtFer1—4(Gene ID: 818622、820276、824775、831720)、落花生AdFer1—4(107485043、107475384、107469395、107478374)、油茶BnFer1—4(106433816、106452550、106382764、106391722)、芜菁BrFer1—3(103855410、103870409、103830031)、鹰嘴豆CaFer1 —3(101503152、101498435、101510209)、陆地棉GhFer1—3(107943203、107960065、107904058)、大豆GmFer1-4(547824、547988、547476、547477)、橡胶树HbFer2—4(110640712、110645561、110638947)、苹果MdFer3—4(103406424、103450693)、木薯MeFer1—4(110619691、110622202、110624811、110619936)、烟草NtFer1—2(107789800、107832545)、桃PpFer3-4(18787640、18773611)、蓖麻RcFer2—3(8263108、8272083)、马铃薯StFer1—2(102577492、102581985)、草莓FvFer3—4(101293015、105353074),根据王壮伟等[30]的描述,利用分子进化遗传分析软件MEGA 8.0中的最大相似法(Maximum-likelihood)构建不同植物物种Ferritin蛋白的系统进化树。
1.5 总RNA提取与实时荧光定量PCR分析
采集五年生‘马瑟兰’树体不同发育时期的果实和叶片,通过RNAprep Pure多糖多酚植物总RNA提取试剂盒(DP441)(Tiangen,北京)提取葡萄样品的总RNA,并利用Fast Quant cDNA第一链合成试剂盒(去基因组)100rxn(TIANGEN,北京)合成第一链cDNA作为模板,采用Perfect Start Green qPCR Super Mix(TransGen,北京)进行实时荧光定量PCR。利用NCBI/PrimerBLAST在线服务器,设计的特异性表达引物(表2)。以葡萄(GenBank No. MH114011)[24,30-31]为内参,通过BIO-RAD实时荧光定量PCR仪检测在不同组织部位的表达特征。反应体系参照说明书的描述,反应程序为95℃ 30s;95℃5s,60℃34s(40个循环);72℃10 s。每个样品进行3次生物学重复,不同样品在实时荧光定量PCR仪获得相应的Ct值,经内参基因均一化处理后,采用2-ΔΔCT法计算的相对表达量[24,25-31]。根据Deng等[32]的描述,通过Log2计算法分析叶面喷施前后表达量的变化倍数,通过HemI软件制作表达差异变化的热图,分别以对照条件下的表达值设定为1,若叶面喷施处理条件下的表达值<1,表示基因表达水平被下调;表达值>1,则表示基因表达水平被上调。

表2 本文所用特异性表达引物
1.6 数据分析
利用SPSS 19.0(SPSS Chicago,美国)对数据进行显著性分析,在叶面喷施铁肥处理与对照条件下两个独立样品间进行检验(<0.05)。
2 结果
2.1 葡萄VvFer检索与鉴定
以拟南芥的氨基酸序列为参考序列[12,15],在葡萄基因组数据库中检索到4个潜在的同源蛋白,检索结果在Pfam在线服务器均检测到Ferritin-like diiron domain(PF00210)功能结构域,属于典型的铁蛋白Ferritin。下载同源基因的CDS电子序列,以起始密码子ATG和终止密码子TAG所在位置20 bp左右的序列作为上、下游引物,以‘马瑟兰’组培幼苗整株RNA反转录获得的cDNA为模板,通过高保真酶扩增葡萄Ferritin家族基因的CDS,测序验证后分别命名为(图1、表3)。

图1 VvFer氨基酸序列比对分析
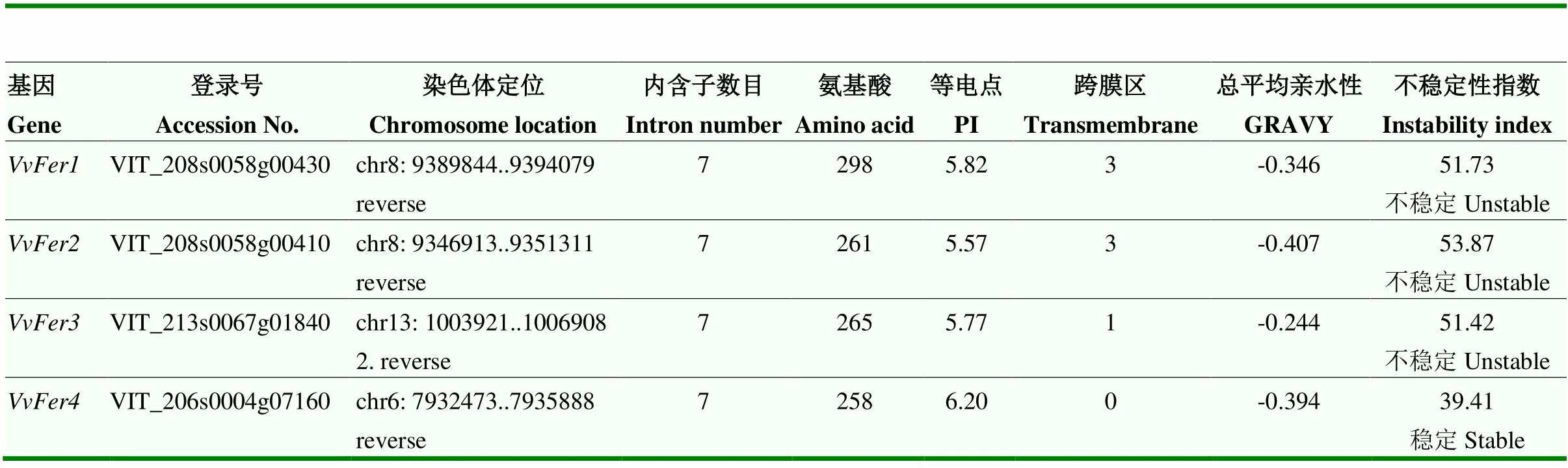
表3 VvFer及其编码蛋白信息
2.2 植物Ferritin同源蛋白的系统发育树
测序验证后,获得的编码蛋白,同时,在NCBI数据库中分别下载拟南芥(十字花科)、芜菁(十字花科)、油茶(山茶科)、鹰嘴豆(豆科)、大豆(豆科)、落花生(豆科)、陆地棉(棉葵科)、橡胶树(大戟科)、木薯(大戟科)、蓖麻(大戟科)、马铃薯(茄科)、烟草(茄科)、苹果(蔷薇科)、桃(蔷薇科)、草莓(蔷薇科)等植物Ferritin同源蛋白序列,氨基酸序列比对结果表明16种不同科属植物Ferritin蛋白之间具有较高的同源性(图1),在氨基酸水平的一致性为61.48%(数据未显示),同源关系较近的两者之间的序列一致性均高于66.50%。此外,4个VvFer蛋白在氨基酸水平的一致性为71.17%(图1)。系统发育树分析结果表明:16种不同科属植物的Ferritin家族蛋白可分为2个亚族:Group I和Ⅱ,其中,葡萄VvFer3属于Group I,而其他3个成员属于Group Ⅱ(图2)。
16种植物Ferritin家族蛋白在遗传进化关系上有差异,属于同一科属植物的同源蛋白倾向于聚在一起,如拟南芥和芜菁同属于十字花科,烟草和马铃薯同属于茄科,其Ferritin同源蛋白分别紧密地聚在一起;同样地,大豆、落花生和鹰嘴豆同属于豆科植物,橡胶树、木薯和蓖麻同属于大戟科植物,苹果、桃和草莓同属于蔷薇科植物,其同源蛋白成员之间的遗传距离相较于其他科属的植物也较近,在系统发育树上倾向于紧密聚在一起(图2)。但VvFer3倾向于和茄科(烟草和马铃薯)同源蛋白的遗传进化距离更近,而属于Group Ⅱ的3个葡萄VvFer紧密聚集在一起,但与其他植物的遗传进化关系稍远(图2)。
2.3 VvFer基因及其编码蛋白特征
VvFer基因主要定位于6号()、8号(和)和13号()染色体上(表3),均含有7个长度不一的内含子(图3)。保守基序分析结果表明VvFer1含有所有Motif基序(Motif 1—7),其特征序列见图4,其中,VvFer2缺失Motif 4,VvFer4缺失Motif 5,而VvFer3缺失Motif 4和Motif 5(图3);葡萄VvFer的等电点PI均<7.00,说明含有的酸性氨基酸较多;VvFer1和VvFer2含有3个跨膜区,VvFer3含有1个跨膜区,VvFer4不含有典型的跨膜区,且葡萄VvFer均不含有信号肽;VvFer1—3的不稳定指数均>40,为不稳定蛋白,而VvFer4的不稳定指数<40,为稳定蛋白(表3)。此外,葡萄VvFer蛋白具有相似的蛋白质三级结构(图5)。
2.4 VvFer蛋白亚细胞定位预测
亚细胞定位预测结果表明VvFer主要定位在细胞核和叶绿体中。其中,VvFer1和VvFer2主要定位在细胞核,其次是叶绿体和线粒体;VvFer3和VvFer4主要定位在叶绿体,其次是细胞核(VvFer4除外)和线粒体。此外,VvFer2在细胞质中也有少量的定位分布(表4)。
2.5 VvFer在果实发育不同时期的表达特征
—在成年‘马瑟兰’果实发育不同时期各组织中的表达量存在差异(图6)。在葡萄发育不同时期各组织中的整体表达水平均最高,其次是和,而在葡萄果实发育不同时期各采样组织中的表达量相对较低。具体表现为,‘马瑟兰’果实发育的整个时期(即从幼果期到成熟期),和在果实中的表达量高于叶片和韧皮部,且在不同组织中的表达量随着发育时期的推进逐渐增加,在果实中的表达量于转色期达到最高水平并持续到成熟期,在果实中的表达量于硬核期便达到最高水平并维持到成熟期;在叶片中的表达量高于果实和韧皮部,且随着发育时期的推进而逐渐降低,在叶片中的表达量于幼果期至硬核期达到最高水平(图6)。
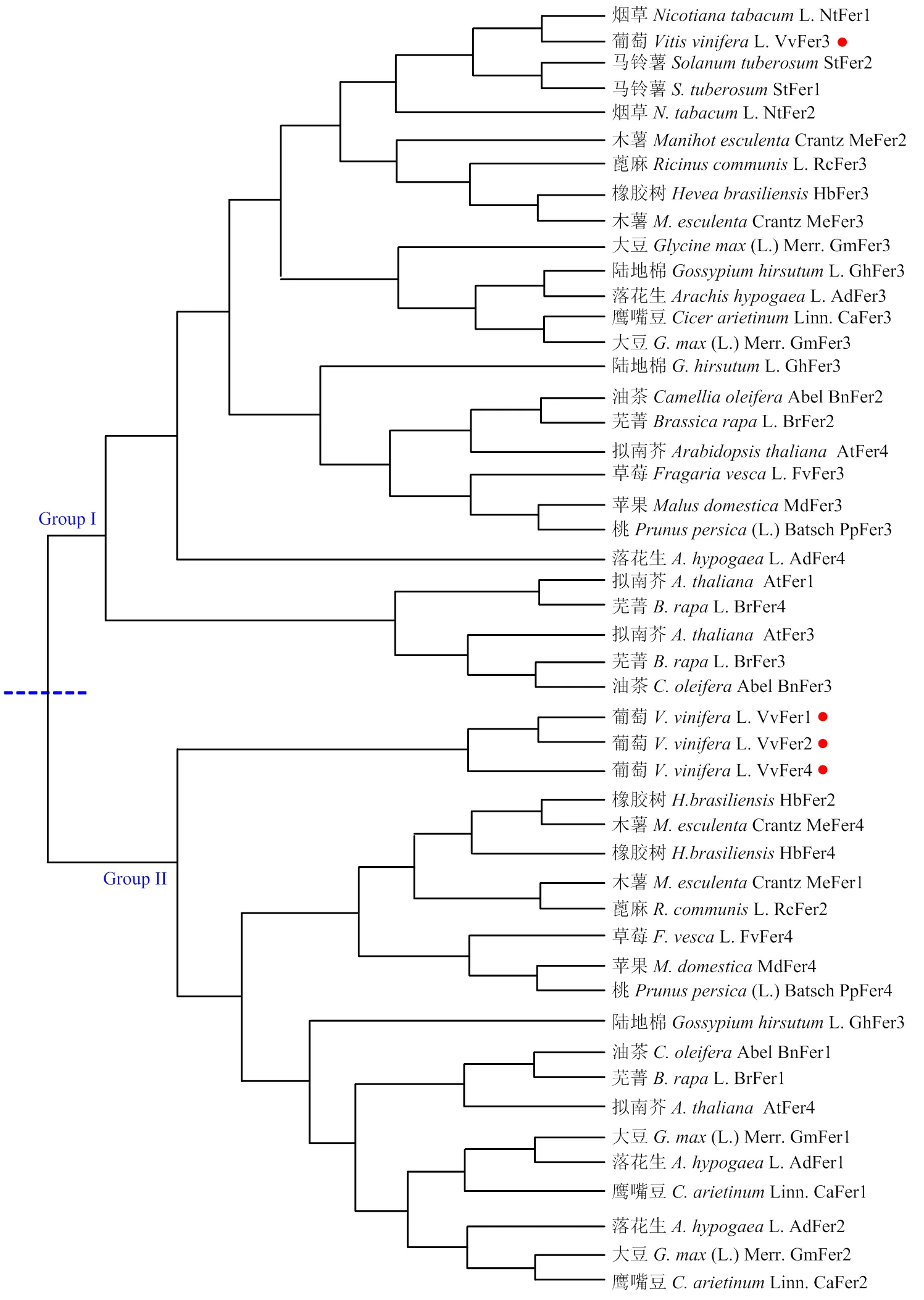
图2 植物Ferritin同源蛋白系统发育树
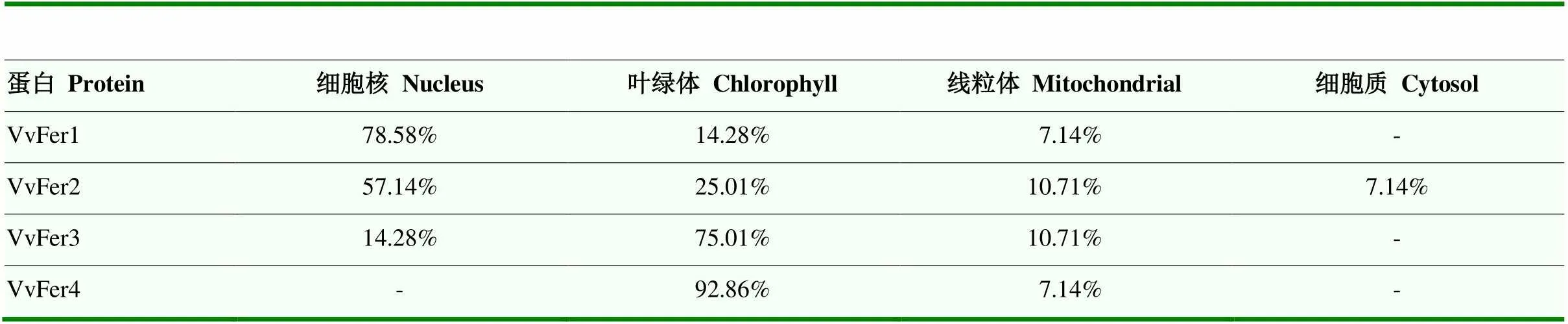
表4 VvFer亚细胞定位预测

图3 基序和基因结构分析

图4 不同基序的特征序列
图5 VvFer蛋白三级结构预测

YFS:幼果期;HCS:硬核期;VS:转色期;SES:第二次膨大期;MS:成熟期。下同
2.6 VvFer对叶面喷施铁肥处理的响应差异
‘马瑟兰’发育不同时期果实中的Fe含量略有差异:从幼果期开始逐渐增加,并在膨大期果实中达到最高值,从膨大期到成熟期略有下降,但仍高于幼果期和硬核期果实中的Fe含量(图7);与对照相比,叶面喷施铁肥处理显著提高了幼果期至第二次膨大期果实中的Fe含量(图7)。此外,叶面喷施铁肥处理显著提高了成熟期果实中ACO、NiR和SDH 3种Fe-S蛋白的酶活性(表5)。
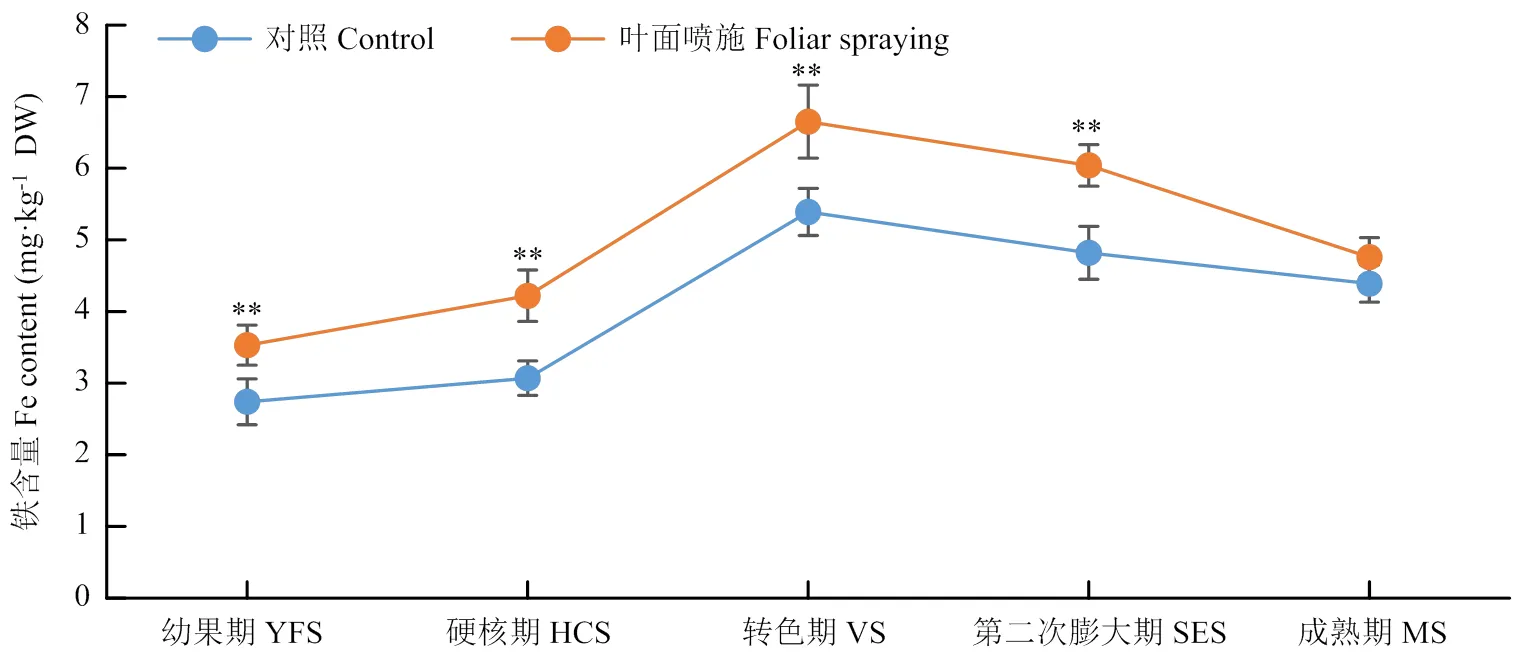
*:差异显著(P<0.05);**:差异极显著(P<0.01)。下同
在‘马瑟兰’果实发育不同时期,—在转录水平对叶面喷施铁肥的响应存在差异(图8)。在整个葡萄果实发育过程中,和在果实中高表达。其中,在整个发育期果实中的表达水平倾向于受叶面喷施铁肥的诱导而显著增强;从幼果期至硬核期,在所有检测组织中的表达水平倾向于受叶面喷施处理的诱导而显著增加;此外,在转色期叶片和韧皮部的表达也受叶面喷施铁肥的诱导而显著增强。虽然整体表达量相对较低,但在转录水平易受叶面喷施铁肥的影响,从幼果期至成熟期,在所有检测组织中的表达水平显著被诱导而上调;此外,从第二次膨大期至成熟期,在韧皮部和叶片中的表达量持续被诱导而增加。整个葡萄果实发育过程中,在采样组织中的表达量极低,且在转录水平对叶面喷施铁肥处理没有任何响应(图8)。
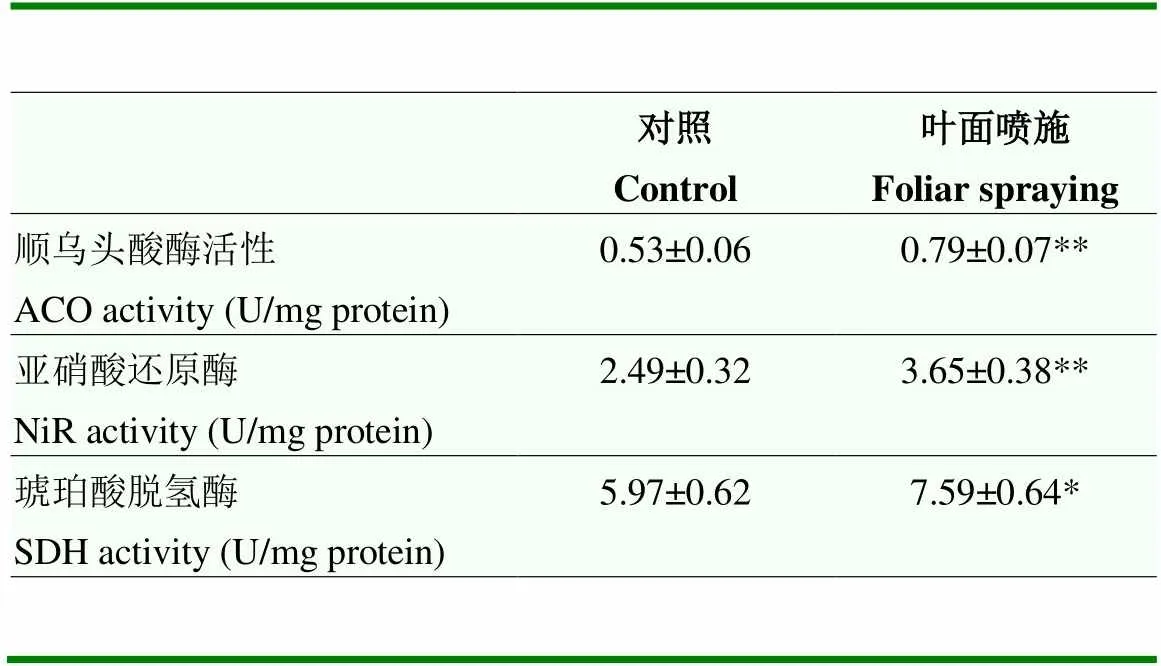
表5 叶面喷施铁肥对成熟期果实Fe-S蛋白酶活性的影响
*:差异显著(<0.05);**:差异极显著(<0.01)
*: Significant difference (<0.05); **: Extremely significant difference
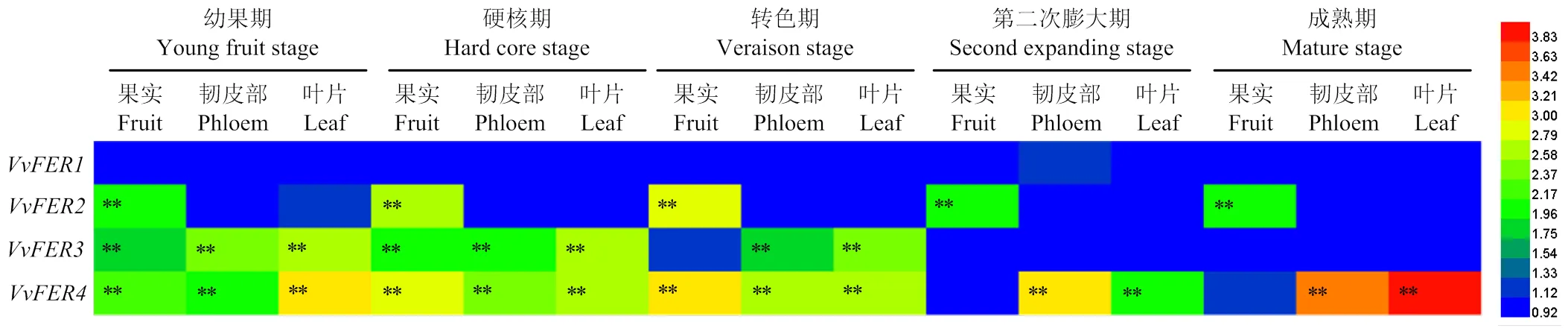
图8 VvFer在转录水平对叶面喷施铁肥的响应差异
3 讨论
果园中,Fe肥施用与果实品质和产量密切相关,然而,果树中Fe营养与高效利用的分子机制尚未见报道,本研究从葡萄中克隆并鉴定了4个铁蛋白Ferritin家族基因,为解析葡萄Fe的储藏和封存机制提供了参考。
3.1 VvFer蛋白的定位特征及VvFer的组织特异性表达差异
拟南芥AtFer1、AtFer3和AtFer4主要定位于叶绿体中,调控细胞内Fe的储藏和封存,并维持植物耐受干旱[16]、失水胁迫[18]、活性氧ROS[13,18-19]等不利环境的胁迫。本研究预测结果表明VvFer3和VvFer4主要定位于叶绿体上,这两个葡萄铁蛋白可能具有与AtFer相似的生物学功能。
在幼果期至硬核期的葡萄叶片中高量表达,暗示该基因倾向于在果实发育初期的叶片中发挥铁蛋白的作用,这些结果与拟南芥、和[12-15]、砀山酥梨[33]和月季[17]在植株叶片中高量表达的报道相吻合,表明植物Ferritin倾向于在地上部发挥储藏和封存Fe2+的功能。本研究发现和在发育初期的果实中高量表达,特别是在葡萄发育不同时期果实中的表达水平远高于其他检测组织,且VvFer3仅定位于液泡膜和细胞质膜,说明该基因可能在葡萄果实发育过程中(特别是硬核期至果实成熟这一关键发育时期)参与果肉细胞质体中Fe2+的储藏,进而在调节或维持果肉细胞Fe2+和其他金属元素的动态平衡过程中发挥重要作用。
3.2 叶面喷施铁肥提升葡萄果实的Fe素营养状况
果树在秋季发生养分回流,以实现果树体内养分的循环利用[33-34]。秋冬季节,桃树叶片开始衰老,叶片中的Fe含量逐渐降低[27],叶面喷施Fe肥可有效促进桃叶片的发育和果实品质的提升,并增强桃叶片和果实中的Fe含量及Fe-S簇装配机制相关基因的表达[26-27,33]。本研究发现葡萄果实中的Fe含量在果实发育初期逐渐升高,在果实形成最终大小时达到最高值,并在进入夏末秋初(第二次膨大期至成熟期)开始降低,暗示葡萄成熟后(或达到经济采收期)果实体内的各种代谢活动将变缓,此时所需的Fe可能向叶片或韧皮部、枝干进行回流。另外,叶面喷施有效增强了膨大期果实中的Fe含量,并提升了依赖于Fe的关键Fe-S蛋白(如ACO、NiR和SDH)的活性,这些发现与SONG等[26-27]在桃上的报道一致,再次证实合理的喷施铁肥可有效改善果实中Fe的营养状况和增强依赖于Fe的生命代谢活动。
3.3 叶面喷施铁肥调控VvFer的表达
在转录水平,对叶面喷施铁肥处理的响应特征存在差异,且与葡萄组织/器官分布和果实发育的不同时期密切相关:除对叶面喷施铁肥处理没有任何响应外,其他3个基因(、和)对叶面喷施铁肥处理较为敏感,其表达水平倾向于被诱导而显著增强;此外,仅在果实中对叶面喷施铁肥比较敏感,且贯穿整个果实发育周期,而和倾向于在幼果期至转色期对叶面喷施铁肥有响应,暗示这两个基因在果实发育至最大后不再发挥作用。在葡萄形成最终果实大小之前的关键发育时期,需要更多的Fe2+用于果实发育和果实品质的形成[25,35]。当进行叶面喷施铁肥处理后,在转录水平的表达倾向于受叶面喷施的诱导而增强发挥铁蛋白的功能,储存更多的Fe2+用于维持果实发育及其他组织或器官中依赖于Fe的代谢活动或生理途径,在一定程度上解释了为何膨大期果实中的Fe含量及ACO、NiR和SDH酶活性受叶面喷施的诱导而显著增强。
在正常土壤营养状况和常规栽培条件下,当果实发育进入第二次膨大期,葡萄体内表达丰度已经足够满足葡萄发育后期对铁蛋白的需求。与此同时,—从葡萄幼果期至转色期的表达水平逐渐达到最高值,充分保证葡萄树体在果实发育前期积累了足够多的Fe2+。特别是(在果实发育整个时期不同检测组织中的表达量为其他基因的7—30倍),进入硬核期后,其果实、韧皮部和叶片中持续稳定的高量表达,能够保障发挥其铁蛋白的活性,因此,在第二次膨大期至成熟期不再受叶面喷施铁肥的影响。后续将进一步开展田间试验,深入探讨叶面喷施铁肥对葡萄果实品质、产量及后期葡萄酒发酵的影响,并通过分子生物学试验进一步揭示关键在葡萄果实发育过程中的具体生物学功能。
4 结论
从葡萄中克隆并鉴定了4个Ferritin家族基因,其在葡萄果实发育不同时期、不同组织中的表达水平差异较大,并在转录水平易受叶面喷施铁肥处理的诱导;在葡萄所有组织中的整体表达量最高(特别是果实中最为突出),且在幼果期至转色期易受叶面喷施铁肥的调控;VvFer3和茄科同源蛋白之间的遗传进化距离最接近,研究结果为解析葡萄铁蛋白Ferritin的生物学功能奠定了理论基础。
[1] 李俊成, 于慧, 杨素欣, 冯献忠. 植物对铁元素吸收的分子调控机制研究进展. 植物生理学报, 2016, 52(6): 835-842.
LI J C, YU H, YANG S X, FENG X Z. Research progress of molecular regulation of iron uptake in plants. Plant Physiology Journal, 2016, 52(6): 835-842. (in Chinese)
[2] BARTON L L, ABADIA J. Iron Nutrition in Plants and Rhizospheric Microorganisms. Dordrecht: Springer Netherlands, 2006.
[3] LILL R. Function and biogenesis of iron-sulphur proteins. Nature, 2009, 460(7257): 831-838.
[4] JIMÉNEZ S, GOGORCENA Y, HÉVIN C, ROMBOLÀ A D, OLLAT N. Nitrogen nutrition influences some biochemical responses to iron deficiency in tolerant and sensitive genotypes of. Plant and Soil, 2007, 290(1/2): 343-355.
[5] PESTANA M, BEJA P, CORREIA P J, DE VARENNES A, FARIA E A. Relationships between nutrient composition of flowers and fruit quality in orange trees grown in calcareous soil. Tree Physiology, 2005, 25(6): 761-767.
[6] TAGLIAVINI M, ABADÍA J, ROMBOLÀ A D, ABADÍA A, TSIPOURIDIS C, MARANGONI B. Agronomic means for the control of iron deficiency chlorosis in deciduous fruit trees. Journal of Plant Nutrition, 2000, 23(11/12): 2007-2022.
[7] KOBAYASHI T, NISHIZAWA N K. Iron uptake, translocation, and regulation in higher plants. Annual Review of Plant Biology, 2012, 63: 131-152.
[8] 张妮娜, 上官周平, 陈娟. 植物应答缺铁胁迫的分子生理机制及其调控. 植物营养与肥料学报, 2018, 24(5): 1365-1377.
ZHANG N N, SHANGGUAN Z P, CHEN J. Molecular physiological mechanism and regulation of plant responses to iron deficiency stress. Journal of Plant Nutrition and Fertilizer, 2018, 24(5): 1365-1377. (in Chinese)
[9] ISHIMARU Y, SUZUKI M, TSUKAMOTO T, SUZUKI K, NAKAZONO M, KOBAYASHI T, WADA Y, WATANABE S, MATSUHASHI S, TAKAHASHI M, NAKANISHI H, MORI S, NISHIZAWA N K. Rice plants take up iron as an Fe3+-phytosiderophore and as Fe2+. The Plant Journal, 2006, 45(3): 335-346.
[10] ZHANG X X, ZHANG D, SUN W, WANG T Z. The adaptive mechanism of plants to iron deficiency via iron uptake, transport, and homeostasis. International Journal of Molecular Sciences, 2019, 20(10): 2424.
[11] FOURCROY P, TISSOT N, GAYMARD F, BRIAT J F, DUBOS C. Facilitated Fe nutrition by phenolic compounds excreted by theABCG37/PDR9 transporter requires the IRT1/FRO2 high-affinity root Fe2+transport system. Molecular Plant, 2016, 9(3): 485-488.
[12] MONDAL S, PRAMANIK K, GHOSH S K, PAL P, GHOSH P K, GHOSH A, MAITI T K. Molecular insight into arsenic uptake, transport, phytotoxicity, and defense responses in plants: a critical review. Planta, 2022, 255(4): 87.
[13] BRIAT J F, DUC C, RAVET K, GAYMARD F. Ferritins and iron storage in plants. Biochimica et Biophysica Acta (BBA)-General Subjects, 2010, 1800(8): 806-814.
[14] LÓPEZ-MILLÁN A F, DUY D, PHILIPPAR K. Chloroplast iron transport proteins-Function and impact on plant physiology. Frontiers in Plant Science, 2016, 7: 178.
[15] PETIT J M, BRIAT J F, LOBRÉAUX S. Structure and differential expression of the four members of theferritin gene family. The Biochemical Journal, 2001, 359: 575-582.
[16] 黄莹. FER2基因在拟南芥干旱胁迫响应中的功能研究[D]. 合肥: 合肥工业大学, 2018.
HUANG Y. Function ofgene in response to drought stress in[D]. Hefei: Hefei University of Technology, 2018. (in Chinese)
[17] LIU J T, FAN Y W, ZOU J, FANG Y Q, WANG L H, WANG M, JIANG X Q, LIU Y Q, GAO J P, ZHANG C Q. Amodule affects rose () petal dehydration tolerance and senescence by modulating iron levels. The Plant Journal, 2017, 92(6): 1157-1169.
[18] RAVET K, TOURAINE B, BOUCHEREZ J, BRIAT J F, GAYMARD F, CELLIER F. Ferritins control interaction between iron homeostasis and oxidative stress in. The Plant Journal, 2009, 57(3): 400-412.
[19] REYT G, BOUDOUF S, BOUCHEREZ J, GAYMARD F, BRIAT J F. Iron- and ferritin-dependent reactive oxygen species distribution: impact onroot system architecture. Molecular Plant, 2015, 8(3): 439-453.
[20] 钟晨, 苏军, 汤婷婷, 丁伟, 朱立武, 贾兵. ‘砀山酥梨’叶片中基因的克隆与表达分析. 南京农业大学学报, 2013, 36(5): 33-38.
ZHONG C, SU J, TANG T T, DING W, ZHU L W, JIA B. Cloning and differential expression analysis ofgene in leaf of ‘Dangshansuli’ pear. Journal of Nanjing Agricultural University, 2013, 36(5): 33-38. (in Chinese)
[21] 吕晨艳. 大豆铁蛋白吸收铁的途径及体外细胞吸收研究[D]. 北京: 中国农业大学, 2015.
LÜ C Y. Study on the ways of iron absorption by soybean ferritin and its cell absorption[D]. Beijing: China Agricultural University, 2015. (in Chinese)
[22] 施富超. 木薯Ferritin基因功能分析[D]. 南昌: 南昌大学, 2018.
SHI F C. Functional analysis of ferritin gene in cassava [D]. Nanchang: Nanchang University, 2018. (in Chinese)
[23] JAILLON O, AURY J M, NOEL B, POLICRITI A, CLEPET C, CASAGRANDE A, CHOISNE N, AUBOURG S, VITULO N, JUBIN C,. The grapevine genome sequence suggests ancestral hexaploidization in major angiosperm phyla. Nature, 2007, 449(7161): 463-467.
[24] 张璐, 宗亚奇, 徐维华, 韩蕾, 孙浈育, 陈朝晖, 陈松利, 张凯, 程杰山, 唐美玲, 张洪霞, 宋志忠. 葡萄Fe-S簇装配基因的鉴定、克隆和表达特征分析. 中国农业科学, 2021, 54(23): 5068-5082.doi: 10.3864/j.issn.0578-1752.2021.23.012.
ZHANG L, ZONG Y Q, YU W H, HAN L, SUN Y Z, CHEN C H, CHEN S L, ZHANG K, CHENG J S, TANG M L, ZHANG H X, SONG Z Z. Identification, cloning and expression characteristics analysis of Fe-S cluster assembly genes in grape., 2021, 54(23): 5068-5082.doi: 10.3864/j.issn.0578-1752.2021.23.012. (in Chinese)
[25] 房经贵, 刘崇怀. 葡萄分子生物学. 北京: 科学出版社, 2014.
FANG J G, LIU C H. Grape Molecular Biology. Beijing: Science Press, 2014. (in Chinese)
[26] SONG Z Z, MA R J, ZHANG B B, GUO S L, YU M L, KORIR N K. Differential expression of iron–sulfur cluster biosynthesis genes during peach fruit development and ripening, and their response to iron compound spraying. Scientia Horticulturae, 2016, 207: 73-81.
[27] SHENG Y T, CHENG H, WANG L M, SHEN J Y, TANG M L, LIANG M X, ZHANG K, ZHANG H X, KONG Q, YU M L, SONG Z Z. Foliar spraying with compound amino acid-iron fertilizer increases leaf fresh weight, photosynthesis, and Fe-S cluster gene expression in peach ((L.) batsch). BioMed Research International, 2020, 2020: 2854795.
[28] SONG Z Z, LIN S Z, FU J Y, CHEN Y H, ZHANG H X, LI J Z, LIANG M X. Heterologous expression ofgene fromenhances plant tolerance to Fe depletion in. Plant Physiology and Biochemistry, 2022, 184: 65-74.
[29] SONG Z Z, YANG Y, XU J L, MA R J, YU M L. Physiological and transcriptional responses in the iron–sulphur cluster assembly pathway under abiotic stress in peach (L.) seedlings. Plant Cell, Tissue and Organ Culture, 2014, 117(3): 419-430.
[30] 王壮伟, 王庆莲, 夏瑾, 王西成, 宋志忠, 吴伟民. 葡萄KEA家族基因的克隆、鉴定及表达分析. 中国农业科学, 2018, 51(23): 4522-4534. doi: 10.3864/j.issn.0578-1752.2018.23.011.
WANG Z W, WANG Q L, XIA J, WANG X C, SONG Z Z, WU W M. Cloning, characterization and expression analysis of K+/H+ antiporter genes in grape. Scientia Agricultura Sinica, 2018, 51(23): 4522-4534. doi: 10.3864/j.issn.0578-1752.2018.23.011. (in Chinese)
[31] 沈静沅, 唐美玲, 杨庆山, 高雅超, 刘万好, 程杰山, 张洪霞, 宋志忠. 葡萄钾离子通道基因VviSKOR的克隆、表达及电生理功能. 中国农业科学, 2020, 53(15): 3158-3168. doi: 10.3864/j.issn.0578-1752. 2020.15.015.
SHEN J Y, TANG M L, YANG Q S, GAO Y C, LIU W H, CHENG J S, ZHANG H X, SONG Z Z. Cloning, expression and electrophysiological function analysis of potassium channel gene VviSKOR in grape. Scientia Agricultura Sinica, 2020, 53(15): 3158-3168. doi: 10.3864/j.issn.0578-1752.2020.15.015. (in Chinese)
[32] DENG W K, WANG Y B, LIU Z X, CHENG H, XUE Y. HemI: a toolkit for illustrating heatmaps. PLoS One, 2014, 9(11): e111988.
[33] JEONG J, MERKOVICH A, CLYNE M, CONNOLLY E L. Directing iron transport in dicots: regulation of iron acquisition and translocation. Current Opinion in Plant Biology, 2017, 39: 106-113.
[34] 李志安, 王伯荪, 林永标, 曾友特. 植物营养转移研究进展. 武汉植物学研究, 2000, 18(3): 229-236.
LI Z A, WANG B S, LIN Y B, ZENG Y T. A review of study on nutrient resorption of plant. Journal of Wuhan Botanical Research, 2000, 18(3): 229-236. (in Chinese)
[35] 车艳芳, 曹花平. 葡萄高效栽培技术. 石家庄: 河北科学技术出版社, 2014.
CHE Y F, CAO H P. Efficient Cultivation Techniques of Grapes. Shijiazhuang: Hebei Science & Technology Press, 2014. (in Chinese)
Identification and Cloning ofFerritinFamily Genes in Grape and Response to Compound Amino Acid-Iron Spraying During Different Fruit Developmental Stages
SONG ZhiZhong1,2,3, WANG JianPing1,2, SHI ShengPeng3,4, CAO JingWen2, LIU WanHao1,XU WeiHua1, XIAO HuiLin1,2*, TANG MeiLing1,2*
1Institute of Grape, Yantai Academy of Agricultural Science, Yantai 264000, Shandong, China;2The Engineering Research Institute of Agriculture and Forestry, Universities of Shandong Ludong University/Key Laboratory of Molecular Module-Based Breeding of High Yield and Abiotic Resistant Plants, Yantai 264025, Shandong, China;3Department of Plant Science, University of Cambridge, Cambridge CB2 3EA, United Kingdom;4Wolfson College, University of Cambridge, Cambridge CB3 9BB, United Kingdom
【Objective】Ferritin plays an important role in plant growth and development, and its biological function in fruit trees are essentially unknown. Cloning of grape Ferritin family genes and revealing their expression patterns at different fruit developmental stages and their response differences to foliar spraying of amino acid iron (Fe) compound fertilizers could provide a theoretical basis for studying the molecular mechanisms of Fe nutrition and metabolism in fruit trees. 【Method】The Ferritin family genes were screened and identified in grape genome by homologous cloning. The detailed characteristics ofgenes and their encoded proteins were analyzed by using bioinformatical methods. The tissue-specific expression patterns of Ferritin family genes during distinct fruit developmental stages and differential response to foliar spraying of amino acid-iron compound fertilizer were determined by carrying out real-time fluorescent quantitative PCR. 【Result】In total, 4 Ferritin family genes were retrieved and cloned from grape, entitled with-, which were distributed on No. 6, 8 and 13 chromosomes, containing 7 introns with different lengths. VvFer proteins were mainly located in chloroplast and nucleus. The amino acid sequence identity of Ferritin homologs from 16 plant species was as high as 61.48%. Phylogenetic tree analysis indicated that Ferritin homologs belonging to the same genus, such asand turnip of, tobacco and potato of, soybeans, peanuts and chickpeas of, rubber trees, cassava and castor of, and apples, peaches and strawberries of Rosaceae, possessed a closer genetic distance during evolution. Grape VvFer3 was closely clustered withhomologs. The expression levels ofgenes were different among distinct tissues or organs of 5-year-old Mathelan grape trees during different fruit developmental stages. In particular, the expression level ofwas the most abundant, and the maximum expression was observed in fruits from hard core stage to mature stage, followed byand. The content of Fe Marselan fruits was slightly different among distinct grape developmental stages, which was gradually increased from young fruit stage, and reached the highest value at veraison stage, and then slightly decreased until mature stage, but still higher than that of young fruit stage and hard core stage. Foliar spraying treatment significantly enhanced Fe content of fruits at mature stage, accompanied by ACO (aconitase), NIR (nitrate reductase) and SDH (succinate dehydrogenase). Genes of-were significantly up-regulated by foliar spraying of amino acid-iron compound fertilizer, which was closely related to distinct grape tissues/organs and different fruit developmental stages. In details, the expression ofwas relatively low, but very uniform, and there was no response to foliar spraying treatment at the transcription level. 【Conclusion】Fourfamily genes were cloned and identified in grape, whose expression were significantly different among distinct tissues during different fruit developmental stages and were prone to be up-regulated under foliar spraying treatment of amino acid-iron compound fertilizer. The overall expression level ofgene was the highest in all tested tissues (especially in fruits) during the whole fruit development stage, and was up-regulated in fruits under foliar spraying treatment from young fruit stage to the verason stage.
grape; Fe storage and sequestration; Ferritin; compound amino acid-iron fertilizer; foliar spraying
2023-02-23;
2023-06-05
国家现代农业产业技术体系建设专项资金(CARS-29-17)、国家留学基金(202208370080)、山东省重点研发计划(重大科技创新工程)(2022CXGC010605)、烟台市科技计划(2020XCZX026)
宋志忠,Tel:0535-6664662;E-mail:szhzh2000@163.com。通信作者肖慧琳,Tel:0535-6352051;E-mail:1316959443@qq.com。通信作者唐美玲,Tel:0535-6352051;E-mail:tmling1999@163.com
10.3864/j.issn.0578-1752.2023.18.011
(责任编辑 赵伶俐)
