柑橘黄化花叶病毒的实时定量PCR检测及其在寄主植株中的时空分布规律
2023-10-23曹鹏许建建李楚欣王新亮王春庆宋晨虎宋震
曹鹏,许建建,李楚欣,王新亮,王春庆,宋晨虎,宋震
柑橘黄化花叶病毒的实时定量PCR检测及其在寄主植株中的时空分布规律
曹鹏,许建建,李楚欣,王新亮,王春庆,宋晨虎,宋震
西南大学柑桔研究所/国家柑桔工程技术研究中心,重庆 400712
【背景】柑橘黄化花叶病毒(citrus yellow mosaic virus,CYMV)是首先发现于印度并对其柑橘产业造成严重危害的一种杆状DNA病毒。目前,CYMV已被美国、日本、新西兰、欧洲和地中海地区列入检疫性有害生物名单,具有传入我国的潜在风险。【目的】建立CYMV的实时荧光定量PCR(real-time quantitative PCR,qPCR)检测体系;筛选CYMV敏感柑橘品种;明确CYMV在寄主植株中的时空分布规律,为该病毒的监控提供技术支持。【方法】根据NCBI中CYMV外壳蛋白(coat protein,CP)基因保守序列,利用软件Primer Premier 5设计qPCR检测引物8对,通过常规PCR筛选扩增效果好、特异性强的引物。通过对引物浓度、退火温度等反应条件优化,建立CYMV的qPCR检测体系,并进一步通过对不同柑橘病原的检测评价所建体系的特异性;以梯度稀释的1.98×109—1.98copies/μL的质粒标准品平行进行常规PCR及qPCR检测,评价所建方法的灵敏度;随机采集田间柑橘样品,平行进行常规PCR及qPCR检测,评价所建方法的适用性。将CYMV接种到玉环柚()、强德勒柚()、22号枳()等15个柑橘品种,进行症状观察和分子检测以筛选敏感指示植物。在接种后不同时间,分别自MV甜橙()植株不同组织部位取样,以柑橘生长因子1基因为内参基因,利用所建体系进行qPCR检测,从而明确CYMV在寄主植株中的时空分布规律。【结果】建立了CYMV的qPCR检测体系,其最佳引物为CYMV-qF7/R7,最佳引物浓度为200 nmol·L-1,最佳退火温度为63 ℃。该检测体系的特异性强,检测灵敏度是常规PCR的1 000倍。对来自不同地区的660个田间柑橘样品的检测结果表明,qPCR检测与常规PCR检测结果一致,除阳性对照外均未检测到CYMV阳性植株。不同柑橘品种接种试验结果表明,15个柑橘品种中,玉环柚和强德勒柚最早表现出强烈的黄化花叶典型侵染症状,可以作为敏感指示植物。qPCR检测结果表明,老叶中的CYMV滴度最高,老皮和根病毒滴度较高,嫩皮中的滴度较低。CYMV在植株中的相对含量,7—9月最高,此后逐月下降,并在次年1月达到最低值,从次年2月开始,CYMV的相对含量开始上升,与环境温度变化趋势一致。【结论】建立了特异性强、灵敏度高的CYMV实时荧光定量PCR检测方法,利用该方法明确了CYMV在寄主植株中的时空分布规律。此外,玉环柚和强德勒柚可作为CYMV敏感指示植物。
柑橘黄化花叶病毒;实时荧光定量PCR;时空分布
0 引言
【研究意义】柑橘黄化花叶病毒(,CYMV)是逆转录病毒目()花椰菜花叶病毒科()杆状DNA病毒属()的一种dsDNA病毒[1-3],采用Class VII复制策略[4]。自1975年在印度Anantapur地区发现以来[1],已经广泛分布于印度中部和南部地区,并对当地柑橘产业造成了严重危害[5]。目前,CYMV已被新西兰、美国、日本和欧盟等国家和地区列入检疫管制对象[6-7],但我国尚未见相关报道。因此,为降低CYMV对我国柑橘产业的生物安全风险,有必要建立CYMV的高效实时荧光定量PCR(real-time quantitative PCR,qPCR)检测体系;筛选CYMV敏感柑橘品种;明确CYMV在寄主植株中的时空分布规律,从而为该病毒的监控提供技术支持。【前人研究进展】CYMV主要通过嫁接传播[8]。Ahlawat等[9]对不同柑橘品种进行嫁接传毒,将其成功传染到13种柑橘植株上,包括甜橙()、柚()、酸橙()等,但不能传给墨西哥莱檬()。CYMV可能通过橘臀纹粉蚧()传播[10],但有待进一步验证。该病毒引起的寄主典型症状为出现花叶和沿叶脉扩散的黄色斑点[11-12],并导致柑橘果实产量和品质下降[13],缩短柑橘树体的生产寿命[14]。目前其检测方法主要有常规PCR[15-19]、环介导等温扩增[20]、qPCR[14,21]和核酸特异性杂交[22]等。【本研究切入点】尽管Johnson[21]和Motghare[14]等已建立了CYMV的qPCR检测方法,但前者的灵敏度仍较低。后者进一步提高了检测灵敏度,可检测出2.3×103copies/μL的样品。不过,这两种qPCR检测体系在本实验室应用的效果不佳。因此,本研究根据NCBI中CYMV外壳蛋白(coat protein,CP)基因保守区域设计引物,期望建立快速、准确且更为灵敏的CYMV qPCR检测体系,从而更好地应用于CYMV的检测和监控。【拟解决的关键问题】构建快捷、准确的CYMV实时定量PCR检测方法,明确CYMV在寄主植株中时空分布规律,为田间柑橘黄化花叶病的早期监测和预警提供技术支持和理论依据。
1 材料与方法
试验于2020—2023年在西南大学柑桔研究所国家苗木脱毒中心实验室完成。
1.1 材料与试剂
供试柑橘黄龙病菌(Liberibacter asiaticus)、柑橘溃疡病菌(subsp.)、柑橘褪绿矮缩病毒(citrus chlorotic dwarf-associated virus,CCDaV)、柑橘黄化脉明病毒(citrus yellow vein clearing virus,CYVCV)、柑橘叶斑驳病毒(citrus leaf blotch virus,CLBV)和CYMV等感染材料,玉环柚、MV甜橙等柑橘品种均保存于西南大学柑桔研究所脱毒中心温网室。田间叶片样品于2021年10月采集于湖南、广西和重庆地区。
1.2 引物设计
根据NCBI中已报道的CYMV保守区域,利用Primer Premier 5软件设计8对qPCR检测引物(表1)。用引物CYMV-CP-F/R[23]扩增序列用于构建质粒标准品,根据文献[14]合成引物EF-1F/R用于内参基因的扩增。各引物均经Primer-BLAST比对,保证引物的特异性,所有引物送重庆擎科公司合成。
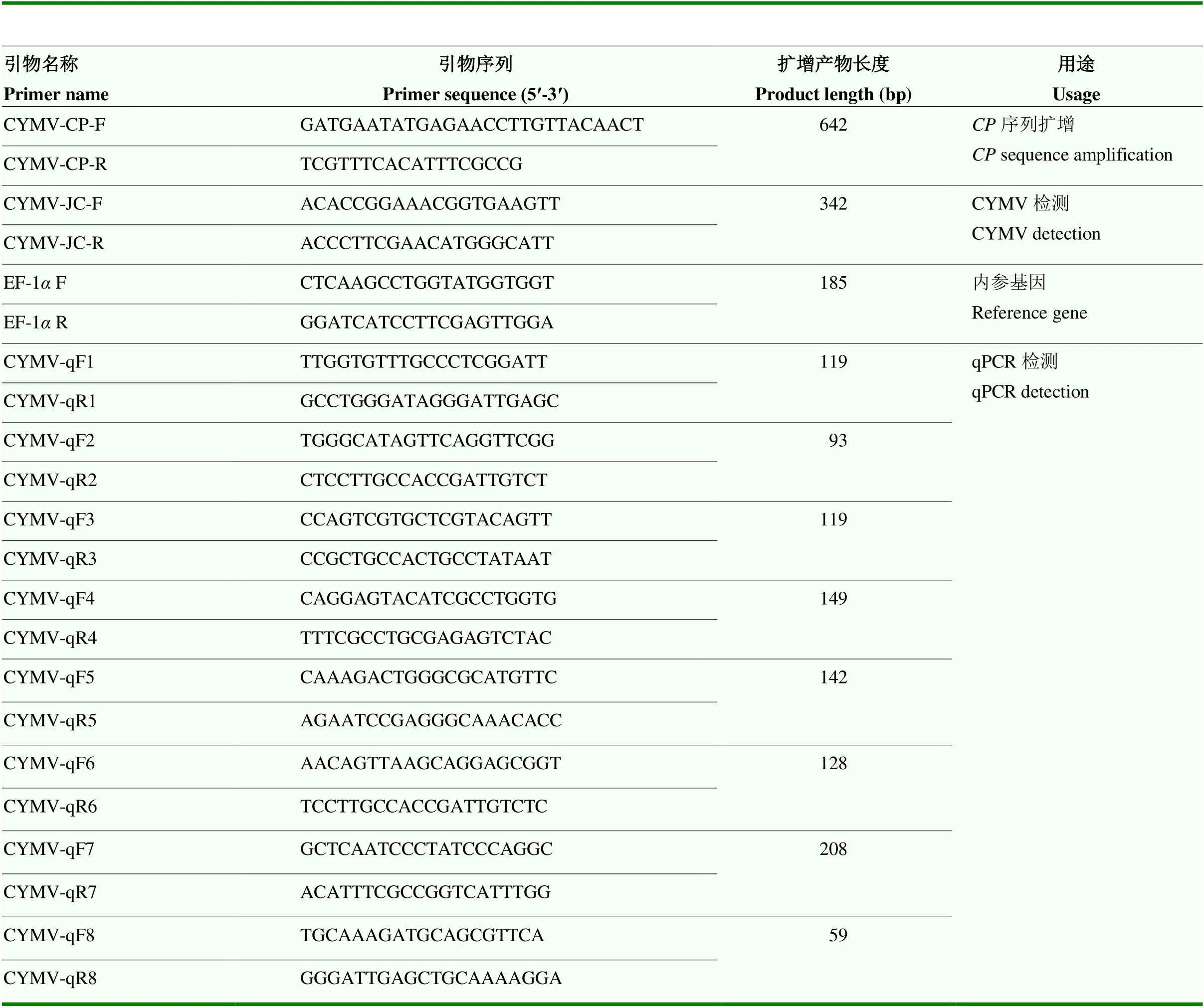
表1 本研究使用的引物信息
1.3 核酸提取
依据DNA提取试剂盒(康为世纪,CW0531S)说明书提取感染CYMV、CCDaV、柑橘黄龙病菌和柑橘溃疡病菌的柑橘叶片总DNA;用RNAiso Plus(TaKaRa,9109)并按照说明书提取感染CLBV、CYVCV柑橘叶片总RNA,按照试剂盒PrimeScriptTMOne Step RT-PCR Kit Ver.2(Takara,RR055A)进行反转录获取cDNA,并使用相应病原特异性引物检测确认阳性。
1.4 CYMV-CP质粒标准品制备
以1.3中提取的CYMV DNA为模板,CYMV-CP- F/R为上下游扩增引物,使用Primer STAR Max Premix(Takara)进行常规PCR扩增并通过琼脂糖凝胶DNA回收试剂盒(天根,DP219)回收。将基因序列连接到pCE2 TA/Blunt-Zero载体上,连接产物转化大肠杆菌DH10B感受态细胞(上海唯地生物),挑选单克隆菌检,阳性单克隆送重庆擎科测序并比对。使用质粒小提试剂盒(天根,DP103)提取测序结果阳性克隆菌液质粒,测定其浓度计算质粒拷贝数[24]并以10倍梯度稀释,作为定量的标准品。
1.5 qPCR检测体系的建立
1.5.1 引物筛选 参照文献[20],以不同病原阳性DNA(cDNA)样品为模板,利用所设计的8对引物分别进行常规PCR,观察扩增条带和扩增产物含量,测序比对后,筛选最佳实时引物。
1.5.2 引物浓度的优化 以1.98×108copies/μL的质粒标准品为模板,设定7个引物浓度(10、50、100、150、200、400、1 000 nmol·L-1)进行qPCR,观察各引物浓度下的扩增效率和熔解曲线。
1.5.3 退火温度的优化 以1.98×108copies/μL的质粒为模板,退火温度设置56.3—64.7 ℃,进行qPCR,观察退火温度对荧光信号的影响,选取Ct值最小且只具有单一峰值的熔解曲线的温度作为最优退火温度。
1.5.4 标准曲线的建立 以1.98×109—1.98 copies/μL的质粒标准品为模板,在优化条件下进行qPCR,设置3个技术重复。反应体系:质粒1 µL,GoTaq® qPCR Master Mix(Promega,A6001)10 µL,CYMV-qF7/R7各1 µL,ddH2O 7 µL。qPCR扩增条件:95 ℃预变性10 min;95 ℃ 15 s,63 ℃ 15 s,72 ℃ 15 s,40个循环。仪器:德国耶拿qTOWER3G,后期涉及qPCR试验均在此仪器完成。
1.6 qPCR检测体系的评价
1.6.1 特异性 分别以柑橘黄龙病菌、柑橘溃疡病菌、CCDaV、CYVCV、CLBV、CYMV感染植株总DNA(cDNA)为模板,进行qPCR,观察熔解曲线是否为单一峰。
1.6.2 灵敏度 以梯度稀释的1.98×109—1.98 copies/μL的质粒标准品为模板,分别进行常规PCR和qPCR,比较两种方法的检测灵敏度。
1.6.3 适用性 对来源湖南、广西和重庆的柑橘叶片样品,以建立的CYMV qPCR进行检测。
1.7 敏感指示植物筛选
1.7.1 CYMV接种不同柑橘品种 将感染CYMV的甜橙通过嫁接接种到半年生健康的尤力克柠檬()、马水橘()、3号椪柑()、22号枳、哈姆林甜橙()、玉环柚、晚白柚()、金橙蜜柚()、大果甜橙()、威尔金柳叶橘()、摩洛哥酸橙()、粗柠檬()、强德勒柚、邓肯葡萄柚()和MV甜橙15种柑橘植株各10株。
1.7.2 症状观察和分子检测 在嫁接90 dpi时提取不同品种柑橘叶片DNA进行常规PCR检测;在接种后持续开展症状观察,并于接种后一年取老熟叶片进行qPCR检测。采用2-ΔΔCt法计算病毒相对含量。
1.8 CYMV在寄主植株中的时空分布规律
利用所建立的CYMV qPCR检测体系,以作为内参基因,对接种CYMV一年后的MV甜橙植株(保存于隔离网室)进行不同组织部位(根、幼嫩枝皮(嫩皮)、老熟枝皮(老皮)、幼嫩叶片(嫩叶)、老熟叶片(老叶))和相同部位(老叶)周年的病毒相对含量检测,每组样品设3个技术重复和3个生物学重复。
2 结果
2.1 qPCR检测体系的建立
根据保守序列设计实时引物8对,常规PCR检测结果发现CYMV-qF7/R7只能从CYMV阳性样品中扩出条带且扩增条带单一,扩增产物含量高。测序表明所获片段与CYMV的序列同源性100%。选其进行后续CYMV qPCR检测体系的建立。
设置不同引物浓度梯度进行qPCR,结果发现随着引物浓度的增加,其荧光强度呈先上升后下降的趋势,引物浓度偏高或偏低都影响反应的效率。当引物浓度在200 nmol·L-1时荧光吸收值最高,且Ct值最小,因此确定其为该体系引物最优浓度(图1-a)。
设置退火温度梯度56.3—64.7 ℃进行qPCR,结果表明退火温度在63 ℃时荧光值最高,Ct值最小且熔解曲线为单一峰(图1-b),因此确定该体系的退火温度为63 ℃。
引物CYMV-qF7/R7浓度设为200 nmol·L-1,退火温度设为63 ℃,构建标准曲线,发现质粒标准品浓度1.98×102—1.98×109copies/μL对数与Ct值呈现良好线性关系,=-3.6073+46.356,相关系数(2)为0.9902,扩增效率为89.3%(图1-c)。这表明CYMV qPCR检测体系初步构建成功。
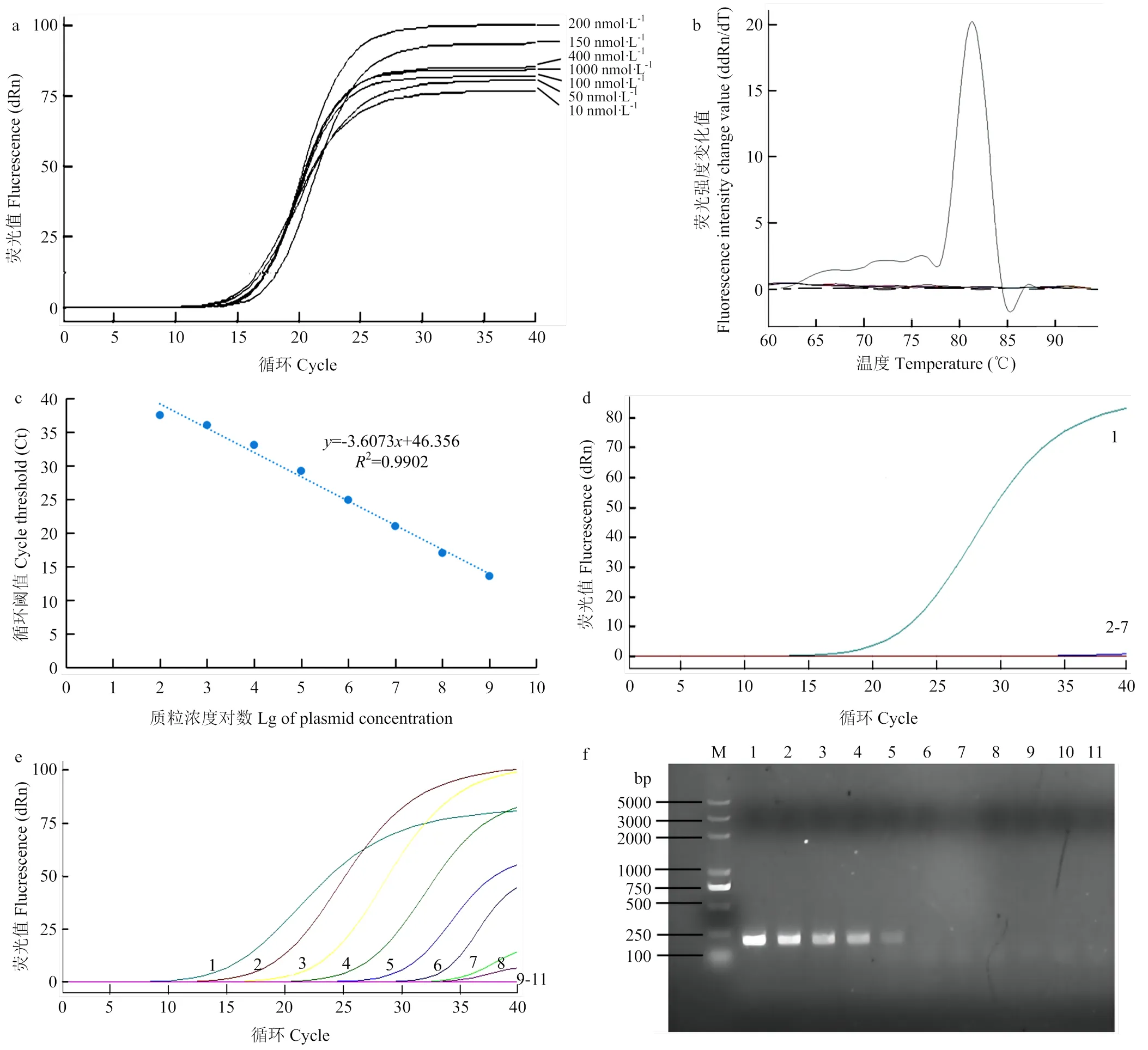
a:不同检测引物浓度条件下的CYMV qPCR扩增曲线qPCR amplification curve of CYMV with different primer concentrations。b:退火温度为63 ℃的CYMV qPCR扩增熔解曲线The melting curve of CYMV qPCR at annealing temperature of 63 ℃。c:CYMV的qPCR检测标准曲线The standard curve of qPCR for CYMV。d:特异性检测Specific detection。1:CYMV;2:柑橘黄龙病菌Candidatus Liberibacter asiaticus;3:柑橘溃疡病菌Xanthomonas citrisubsp.citri;4:CCDaV;5:CYVCV;6:CLBV;7:阴性对照Negative control。e:qPCR的CYMV灵敏度检测CYMV sensitivity detection of qPCR。1—10:1.98×109—1.98copies/μL质粒1.98×109-1.98 copies/μL plasmid;11:ddH2O。f:常规PCR的CYMV灵敏度检测CYMV sensitivity detection of conventional PCR。M:5 kb Marker;1—10:1.98×109—1.98 copies/μL质粒1.98×109-1.98 copies/μL plasmid;11:H2O
2.2 qPCR检测体系的评价
2.2.1 特异性 分别以柑橘黄龙病菌、柑橘溃疡病菌、CYVCV、CCDaV、CLBV和CYMV感染植株叶片总DNA(cDNA)为模板,利用所建立的qPCR体系进行检测,结果如图1-d所示,除CYMV外,其他5种病原均无特异性扩增,表明该体系特异性好。
2.2.2 灵敏度 以梯度稀释的1.98×109—1.98copies/μL的CYMV为模板,分别进行常规PCR和qPCR。结果显示qPCR能够检测到1.98×102copies/μL的质粒浓度(图1-e),而常规PCR只能检测到1.98×105copies/μL的质粒浓度(图1-f),qPCR的灵敏度是常规PCR的1 000倍。
2.2.3 适用性 应用所建立的CYMV qPCR体系,对来自不同地区的田间样品分别进行常规PCR和qPCR检测,检测部位为老熟叶片。qPCR和常规PCR检测结果一致,除阳性对照外,所有田间样品均为阴性,表明均暂未在田间检测到CYMV。在阳性对照样品中,qPCR的检出率为100%,常规PCR的检出率为83.3%(表2)。

表2 不同地区田间柑橘样品的CYMV检测
2.3 CYMV敏感指示植物的筛选
2.3.1 CYMV嫁接接种不同柑橘品种的常规PCR检测 通过嫁接接种CYMV至15个柑橘品种(各10株),在90 dpi提取总核酸进行常规PCR检测。结果表明尤力克柠檬、22号枳、哈姆林甜橙、玉环柚、晚白柚、金橙蜜柚、威尔金柳叶橘、摩洛哥酸橙、粗柠檬、强德勒柚、邓肯葡萄柚和MV甜橙的阳性率分别为10%、100%、10%、100%、50%、30%、40%、90%、90%、70%、70%和70%,平均侵染率为60.8%;马水橘、3号椪柑和大果甜橙的侵染率为0。
2.3.2 CYMV接种后症状观察 在接种后进行持续症状观察,结果显示玉环柚出现沿叶脉扩散的黄化花叶症状(图2-a、2-b),强德勒柚叶片出现轻微花叶症状(图2-c、2-d),22号枳出现沿叶脉黄化,其余植株无症或症状轻,其中强德勒柚最早出现症状,玉环柚出现的症状最严重,所以玉环柚和强德勒柚可以作为敏感指示植物。
接种一年后对成功侵染的12个柑橘品种进行qPCR检测,结果显示出现明显症状的玉环柚和强德勒柚病毒相对含量比其他症状不明显柑橘品种的病毒相对含量低(图2-e),这表明CYMV病毒的相对含量可能与症状强弱无关联。
2.4 CYMV在MV甜橙中的时空分布
2.4.1 空间分布 2022年9月,在MV甜橙植株不同部位进行取样和DNA提取,利用所建立的CYMV qPCR检测体系测定植株中CYMV的相对含量。结果表明CYMV的相对含量在不同组织部位存在较大差异,由高到低依次为老叶、老皮、根、嫩皮、嫩叶(图3)。
2.4.2 周年分布 2022年7月10日至2023年6月10日,采集MV甜橙的老叶提取DNA后,以为内参基因,用建立的qPCR体系测定CYMV相对含量的周年变化。结果显示植株老叶中CYMV的相对含量从7月到9月呈上升趋势,病毒含量较高;10月至次年1月呈显著下降趋势,在次年1月达到最低值,并于次年2月开始逐月上升(图4-a)。病毒相对含量的变化趋势与重庆2022年7月至2023年6月气温(图4-b,来源于气象网)变化趋势基本一致,表明病毒滴度与温度呈正相关。

a:健康的玉环柚叶片Healthy Yuhuanyou leaf;b:接种CYMV的玉环柚叶片Yuhuanyou leaf inoculated with CYMV;c:健康的强德勒柚叶片Healthy Chandler pomelo leaf;d:接种CYMV的强德勒柚叶片Chandler pomelo leaf inoculated with CYMV;e:12种柑橘接种CYMV后的叶片病毒相对含量Relative content of virus in leaves of 12 citrus varieties inoculated with CYMV。尤力克柠檬C. limon;22号枳P. trifoliata;哈姆林甜橙C. sinensis;玉环柚C. grandis;晚白柚C. maxima;金橙蜜柚C. grandis;威尔金柳叶橘C. reticulata;摩洛哥酸橙C. aurantium;粗柠檬C. limonia;强德勒柚C. grandis;邓肯葡萄柚C. paradise;MV甜橙C. sinensis
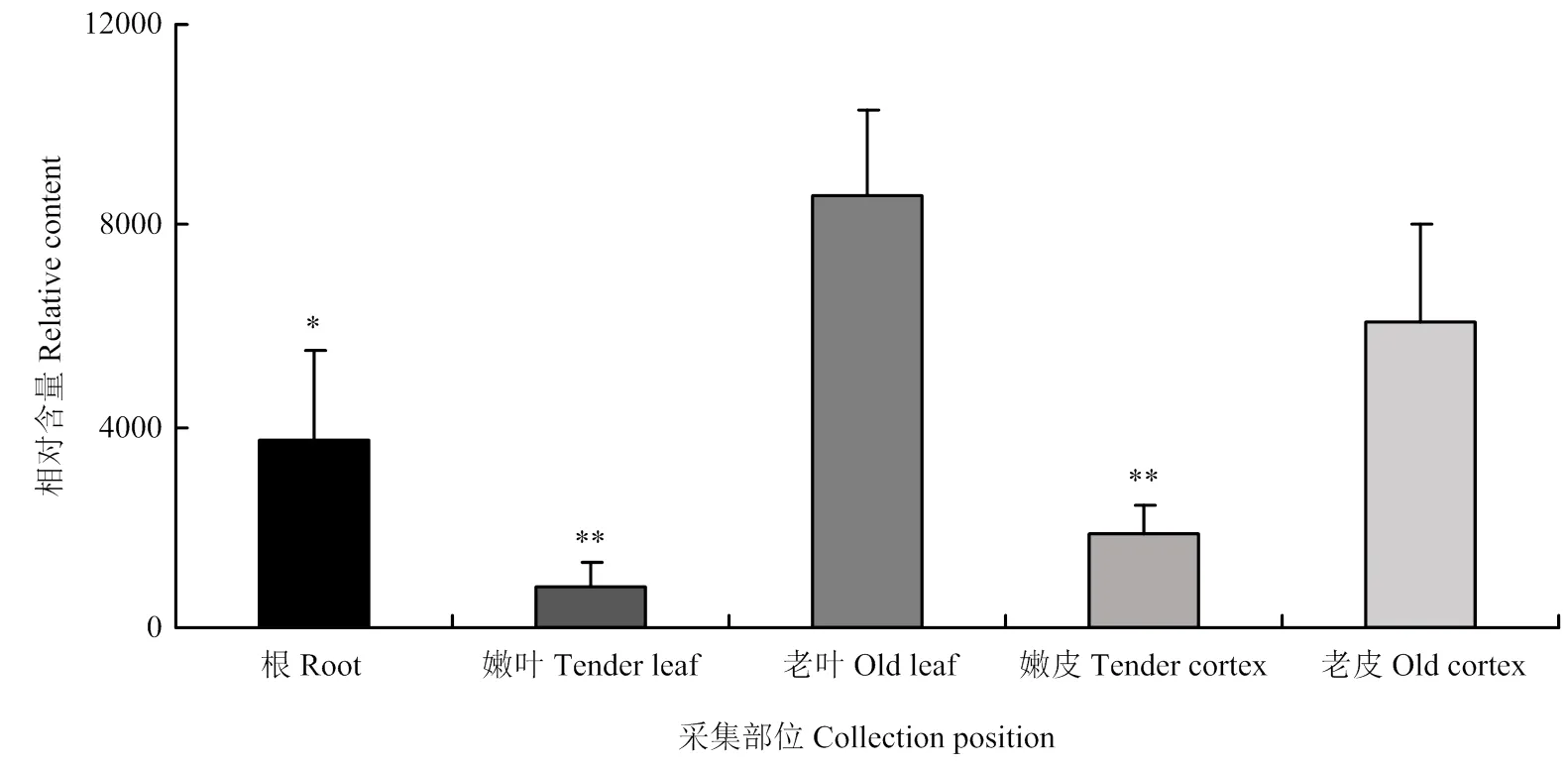
图3 CYMV在接种MV甜橙后不同组织部位的相对含量
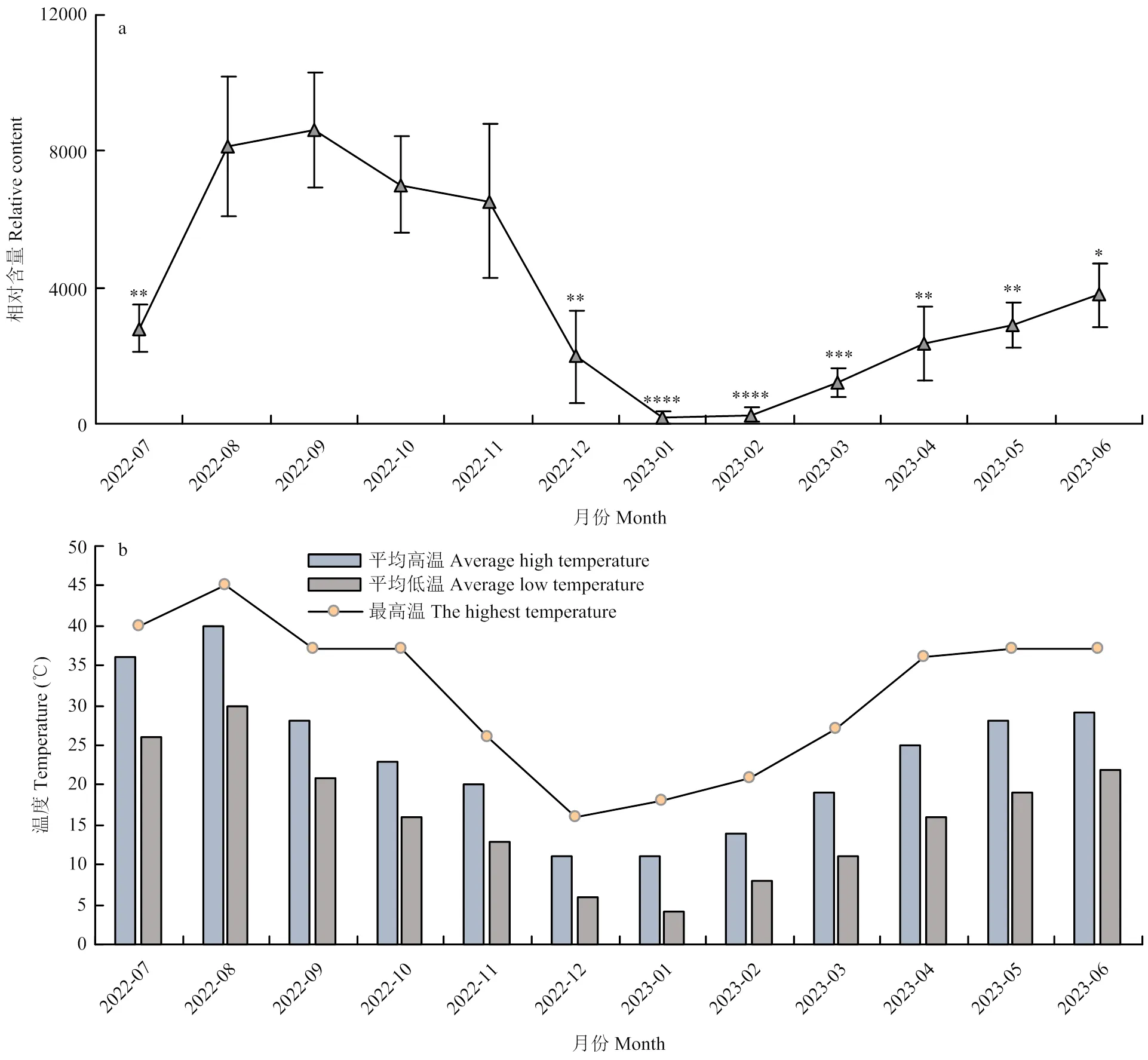
a:CYMV相对含量的周年变化Annual variation of CYMV relative content;b:重庆2022年7月至2023年6月气温图Air temperature in Chongqing from July 2022 to June 2023
3 讨论
3.1 CYMV特异性强、灵敏度高的qPCR检测体系建立
CYMV作为被多个国家和地区列入检疫名录的病毒可造成柑橘产量严重下降及品质劣变。我国目前尚未有CYMV的报道,因此有必要加强对此病毒的监控,尤其是对来自国外以及边境地区柑橘种植园的苗木,从而降低该病毒对我国柑橘产业的生物安全风险。近年来,研究者开发了一系列CYMV检测技术,如常规PCR、ELISA和环介导等温扩增检测等[19-20],但均无法对植株内的病毒滴度进行精确定量,且灵敏度低。qPCR技术作为一种核酸定量的新方法,具有简便、灵敏度高和特异性强等优点,已在植物病毒检测和监控中得到了广泛应用[25-26]。Motghare[14]和Johnson[21]等建立了CYMV的qPCR检测方法,但Johnson建立的检测方法能够检测出的CYMV质粒标准品最低浓度为1.42×109copies/μL,灵敏度较低,Motghare建立的CYMV qPCR检测方法灵敏度进一步提高,达到常规PCR的100倍,可检测出2.3×103copies/μL的样品。不过,这两种qPCR检测体系在本实验室应用的效果不佳。因此,本研究基于CYMV外壳蛋白基因保守序列设计了特异性引物CYMV-qF7/R7,利用该引物建立的qPCR体系具有较高的特异性,灵敏度达到1.98×102copies/μL,是常规PCR的1 000倍,为更好监测CYMV的发生和流行提供了技术支撑。
应用所建立的CYMV qPCR检测体系,对来自不同地区的样品进行qPCR检测,暂未在田间发现CYMV阳性植株。不过,由于目前检测的植株数量不足,且只有湖南、广西和重庆三地样品,结果缺乏全面性,需进一步对来源不同地区的更多柑橘样品进行检测,从而降低CYMV传入我国并大规模暴发的风险。
3.2 CYMV在甜橙中的时空分布规律
本研究进行了CYMV在寄主体内的周年分布监测,发现2022年9月CYMV的相对含量最高,此后病毒相对含量下降,在2023年2月病毒相对含量又上升,这与同期环境温度的变化趋势一致。这可能与植物-病毒相互作用受环境因素的调节,尤其是温度因素的影响有关[27]。有研究表明,温度对病毒-寄主相互作用具有不同的影响,其中一种是呈正相关性,如较高温度可使拟南芥植株中芜菁皱缩病毒(turnip crinkle virus,TCV)的复制增强[28];雀麦花叶病毒(brome mosaic virus,BMV)在25 ℃侵染大麦时,主要局限于韧皮部以及相关的细胞中,而在温度达到34 ℃时BMV可突破韧皮部,造成系统侵染,从而引起植株症状加重,植株体内的病毒相对含量增加[29]。另一种则与之相反,温度升高后病毒积累量降低,寄主症状减弱,如葡萄斑点病毒(grapevine fleck virus,GFkV),在7月出现高温后,其在‘阳光葡萄’中的病毒积累量显著降低[30];芜菁花叶病毒(turnip mosaic virus,TuNV)在侵染本氏烟后进行高温处理,发现高温(30 ℃)通过刺激RNA沉默及相关抗逆激素途径提高了植株对病毒的抗性,致使病毒侵染被抑制[31]。本研究中,CYMV在夏季高温下的病毒积累量更高,表明温度与CYMV-寄主相互作用呈正相关,这可能与CYMV来源于热带地区有关,但后续还需进一步试验验证。
CYMV在甜橙植株中存在分布不均的现象,根和枝皮中病毒含量低于老熟叶片,可能是由于病毒在寄主植株体内的移动和分布与寄主植株营养物质的运输、合成和贮藏机制关系紧密[32]。对CYMV感病株的不同部位和时期病毒相对含量检测明确了该病毒在植株中的分布特征,为CYMV的准确检测与诊断提供了理论依据,可用于指导样品采集,如优先采取夏季的老熟叶片,有利于达到更好的监测效果。
4 结论
建立了特异性强、灵敏度高的CYMV qPCR检测体系,明确了CYMV在寄主植株中的时空分布规律,可用于对CYMV的长期监测预警。此外,玉环柚和强德勒柚可作为CYMV敏感指示植物。
[1] Dakshinamurti V, Reddy G S. Mosaic: a transmissible disorder of sweet oranges. Indian Phytopathology, 1975, 28: 398-399.
[2] Pringle C R. The universal system of virus taxonomy of the International Committee on Virus Taxonomy (ICTV), including new proposals ratified since publication of the sixth ICTV report in 1995. Archives of virology, 1998, 143(1): 203-210.
[3] Huang Q, Hartung J S. Cloning and sequence analysis of an infectious clone of citrus yellow mosaic virus that can infect sweet orange via-mediated inoculation. The Journal of general virology, 2001, 82(10): 2549-2558.
[4] Mason W S, Taylor J M, Hull R. Retroid virus genome replication//Advances in Virus Research. Amsterdam: Elsevier, 1987: 35-96.
[5] Ahlawat Y S. Citrus decline: problems and prevention. Indian Phytopathology, 2007, 60: 1-12.
[6] JOHNSON A M, GOPAL D V R, Sudhakar C, Dasgupta I. Citrus yellow mosaic badnavirus infectingsp.: a threat to the citrus industry and a quarantine issue. Journal of General Plant Pathology, 2017, 83(2): 57-65.
[7] European Food Safety Authority. Pest risk assessment made by France on citrus yellow mosaic virus or citrus mosaic badnavirus considered by France as harmful in the French overseas departments of French Guiana, Guadeloupe, Martinique and Réunion - Scientific opinion of the panel on plant health. The EFSA Journal, 2008, 6(5): 686.
[8] Dakshinamurti V. Investigations on mosaic virus disease of Sathgudi ((L) Osb) in Andhra Pradesh[D]. Tirupati, India: Sri Venkateswara University, 1981.
[9] Ahlawat Y S, Pant R P, Lockhart B E L, Srivastava M, Chakraborty N K, Varma A. Association of a badnavirus with citrus mosaic disease in India. Plant disease, 1996, 80(5): 590-592.
[10] Bhat A I, Hohn T, Selvarajan R. Badnaviruses: the current global scenario. Viruses, 2016, 8(6): 177.
[11] Baranwal V K, Sharma S K. Emergence and diversity of badnaviruses in India//A Century of Plant Virology in India. Singapore: Springer, 2017: 49-73.
[12] 蒋琪琪, 许建建, 苏越, 张琦, 曹鹏, 宋晨虎, 李中安, 宋震. 柑橘黄化花叶病毒侵染性克隆构建及应用. 中国农业科学, 2022, 55(24): 4840-4850.doi: 10.3864/j.issn.0578-1752.2022. 24.005.
Jiang Q Q, Xu J J, Su Y, Zhang Q, Cao P, Song C H, Li Z A, Song Z. Construction and application of infectious clone of citrus yellow mosaic virus. Scientia Agricultura Sinica, 2022, 55(24): 4840-4850. doi: 10.3864/j.issn.0578-1752.2022.24.005. (in Chinese)
[13] Gaddam S A, Kotakad V S, Reddy M N, SAIGOPAL D. Survey and indexing of citrus yellow mosaic virus infecting citrus species in rayalaseema region of Andhra Pradesh. Archives of Applied Science Research, 2012, 4(4): 1821-1824.
[14] Motghare M, Dhar A K, Kokane A, Warghane A, Kokane S, Sharma A K, Reddy M K, Ghosh D K.Quantitative distribution of citrus yellow mosaic badnavirus in sweet orange () and its implication in developing disease diagnostics. Journal of Virological Methods, 2018, 259: 25-31.
[15] Singh R P, Dilworth A D, Baranwal V K, GUPTA K N. Detection of citrus exocortis viroid, iresine viroid, and tomato chlorotic dwarf viroid in new ornamental host plants in India. Plant Disease, 2006, 90(11): 1457.
[16] Borah B K, JOHNSON A M, GOPAL D V R, DASGUPTA I. A comparison of four DNA extraction methods for the detection of citrus yellow mosaic badna virus from two species ofusing PCR and dot-blot hybridization. Journal of Virological Methods, 2008, 151(2): 321-324.
[17] Baranwal V K, Majumder S, Ahlawat Y S, SINGH R P. Sodium sulphite yields improved DNA of higher stability for PCR detection of citrus yellow mosaic virus from citrus leaves. Journal of Virological Methods, 2003, 112(1/2): 153-156.
[18] Gopi V, Sankar T, Kuruba G, Lakshmi M. Molecular detection of citrus yellow mosaic virus (CYMV) and citrus greening bacterium (CGB) in Sathgudi sweet orange by duplex polymerase chain reaction (dPCR). International Journal of Current Microbiology and Applied Sciences, 2016, 5(12): 726-732.
[19] Gopi V, Gopal K, Sankar T G, Palanivel S. Detection of citrus yellow mosaic virus by PCR and nucleic acid spot hybridisation using non-radioactive probes in commercial citrus species. Archives of Phytopathology and Plant Protection, 2010, 43(9): 892-899.
[20] Kumar P V, Sharma S K, Rishi N, GHOSH D K, BARANWAL V K. An isothermal based recombinase polymerase amplification assay for rapid, sensitive and robust indexing of citrus yellow mosaic virus. Acta virologica, 2018, 62(1): 104-108.
[21] JOHNSON A M, Dasgupta I, GOPAL D V R. Development of loop-mediated isothermal amplification and SYBR green real-time PCR methods for the detection ofcitrus yellow mosaic badnavirus in citrus species. Journal of Virological Methods, 2014, 203: 9-14.
[22] Ghosh D K, Aglave B, Baranwal V K. Simultaneous detection of one RNA and one DNA virus from naturally infected citrus plants using duplex PCR technique. Current Science, 2008, 94(10): 1314-1318.
[23] JOHNSON A M. Genomics development of diagnostics of citrus yellow mosaic badnavirus (CMBV) infecting citrus species and partial characterization of zucchini yellow mosaic virus (ZYMV) isolates infecting Cucurbits in Andhra Pradesh[D]. India: Sri Venkateswara University, 2011.
[24] 王艳娇, 崔甜甜, 黄爱军, 陈洪明, 李中安, 周常勇, 宋震. 柑橘脉突病毒实时荧光定量RT-PCR检测体系的建立与应用. 园艺学报, 2016, 43(8): 1613-1620.
Wang Y J, Cui T T, Huang A J, Chen H M, Li Z A, Zhou C Y, Song Z. Development and application of a quantitative RT-PCR approach for quantification of citrus vein enation virus. Acta Horticulturae Sinica, 2016, 43(8): 1613-1620. (in Chinese)
[25] 李楠, 王亚迪, 杨军玉, 丁丽, 王亚南, 曹克强. 苹果褪绿叶斑病毒在苹果植株体内的分布. 北方园艺, 2018(13): 47-52.
Li N, Wang Y D, Yang J Y, Ding L, Wang Y N, Cao K Q. Spatial and temporal distribution of apple chlorotic leaf spot virus in apple plant. Northern Horticulture, 2018(13): 47-52. (in Chinese)
[26] 刘科宏, 周常勇, 宋震, 周彦, 李中安, 唐科志. 运用实时荧光RT-PCR技术检测柑橘碎叶病毒. 果树学报, 2009, 26(5): 748-751.
Liu K H, Zhou C Y, Song Z, Zhou Y, Li Z A, Tang K Z. Detection of citrus tatter leaf virus (CTLV) by real-time RT-PCR. Journal of Fruit Science, 2009, 26(5): 748-751. (in Chinese)
[27] 王莹. 高温抑制柠檬黄脉病症状表现的机理初探[D]. 重庆: 西南大学, 2022.
Wang Y. Preliminary study on the mechanism of high temperature inhibiting the symptoms of lemon yellow vein clearing disease[D]. Chongqing: Southwest University, 2022. (in Chinese)
[28] Zhang X, Zhang X, Singh J, Li D W, Qu F. Temperature- dependent survival of turnip crinkle virus-infectedplants relies on an RNA silencing-based defense that requires dcl2, AGO2, and HEN1. Journal of virology, 2012, 86(12): 6847-6854.
[29] Ding X S, Flasinski S, Nelson R S. Infection of barley by brome mosaic virus is restricted predominantly to cells in and associated with veins through a temperature-dependent mechanism. Molecular Plant-Microbe Interactions, 1999, 12(7): 615-623.
[30] 陶宁颖. ‘阳光玫瑰’葡萄病毒病原鉴定与脱毒技术研究[D]. 杭州: 浙江大学, 2019.
Tao N Y. The research of the virus identification and elimination techniques on ‘Shine Muscat’ grape[d]. Hangzhou: Zhejiang University, 2019. (in Chinese)
[31] 徐振鹏, 邱隆, 杨婷, 林宏辉, 席德慧. 高温对本氏烟抗病毒机制影响的研究. 四川大学学报(自然科学版), 2019, 56(4): 749-757.
Xu Z P, Qiu L, Yang T, Lin H H, Xi D H. The research on the interaction between high temperature and viral defense mechanism in. Journal of Sichuan University (Natural Science Edition), 2019, 56(4): 749-757. (in Chinese)
[32] 弟豆豆. 苹果坏死花叶病毒烟台分离物的鉴定与表达特性分析[D].烟台: 烟台大学, 2020.
Di D D. Identification and analysis of expression characteristics of apple necrosis mosaic virus Yantai isolate[D]. Yantai: Yantai University, 2020. (in Chinese)
Real-time quantitative PCR detection of citrus yellow mosaic virus and its spatial and temporal distribution in host plants
Cao Peng, Xu Jianjian, Li Chuxin, WangXinliang, Wang ChunQing, Song ChenHu, Song Zhen
Citrus Research Institute, Southwest University/National Citrus Engineering Research Center, Chongqing 400712
【Background】Citrus yellow mosaic virus (CYMV) is a member of badnaviruses that was first discovered in India and caused serious damage to its citrus industry. At present, CYMV has been listed as a quarantine pest in the United States, Japan, New Zealand, Europe and the Mediterranean region, which has the potential risk of being introduced into China.【Objective】The objective of this study is to establish a real-time quantitative PCR (qPCR) detection system for CYMV, screen sensitive citrus varieties to CYMV, elucidate the spatial and temporal distribution of CYMV in host plant, and to provide technical support for monitoring of the virus.【Method】According to the conserved sequences of CYMV coat protein (CP) gene in NCBI, eight pairs of qPCR primers were designed using software Primer Premier 5, and were screened by conventional PCR for primer pairs with good amplification effect and high specificity. The concentration and annealing temperature of the primers were optimized to establish the CYMV qPCR detection system. The specificity of the system was evaluated by detecting different citrus pathogens. Conventional PCR and qPCR were performed in parallel with 1.98×109-1.98 copies/μL of plasmid standards diluted in a gradient as template to evaluate the sensitivity of the established system. The field citrus samples were collected randomly and detected using conventional PCR and qPCR in parallel to evaluate the applicability of the method. Fifteen citrus varieties including Yuhuanyou (), Chandler pomelo (), No.22 karatachi (), etc., were inoculated with CYMV for symptom observation and molecular detection to screen sensitive indicator plants. Samples from different tissues of Madam Vinous orange () plants were collected at different times post inoculation, and qPCR assays were performed withelongation factor 1 alpha as an internal reference gene to clarify the spatial and temporal distribution patterns of CYMV in the host plants.【Result】The qPCR detection system for CYMV was established with the optimal primer of CYMV-qF7/R7, the optimal concentration 200 nmol·L-1and the optimal annealing temperature 63 ℃. The results of the evaluation experiments showed that the specificity of the established qPCR system is strong, and the detection sensitivity is 1 000 times that of the conventional PCR. The detection results of 660 field citrus samples from different regions showed that the qPCR assay was consistent with the conventional PCR assay, and no CYMV-positive plants were detected except for the positive control. Among the 15 citrus varieties in the inoculation experiment, Yuhuanyou and Chandler pomelo showed strong and typical yellowing mosaic symptoms of CYMV infection at the earliest, suggesting that both could be used as sensitive indicator plants. The detection results of qPCR showed that the titer of CYMV in old leaves was the highest, the titer of virus in old cortex and root was higher, and the titer in tender cortex was lower. The relative content of CYMV in plants was highest from July to September, then decreased month by month, and reached the lowest value in January of the next year. From February of the next year, the relative content of CYMV began to rise, which was consistent with the change trend of the environmental temperature.【Conclusion】A qPCR assay for CYMV detection with high specificity and sensitivity was established, and the spatial and temporal distribution pattern of CYMV in the host plants was determined. In addition, Yuhuanyou and Chandler pomelo can be used as CYMV-sensitive indicator plants.
citrus yellow mosaic virus (CYMV); real-time quantitative PCR (qPCR); spatial and temporal distribution
10.3864/j.issn.0578-1752.2023.18.007
2023-06-14;
2023-07-19
国家重点研发计划(2021YFD1400800)、重庆市自然科学基金(CSTB2022NSCQ-MSX0752)
曹鹏,E-mail:caopeng540@163.com。许建建,E-mail:swuxujj@foxmail.com。曹鹏和许建建为同等贡献作者。通信作者宋震,E-mail:songzhen@cric.cn
(责任编辑 岳梅)
