铁皮石斛梢枯病病原菌分离鉴定及淀粉酶产色链霉菌代谢产物对其防治效果
2023-10-21雷承泽俞晓平申屠旭萍
雷承泽,张 诺,宋 阳,俞晓平,申屠旭萍
(中国计量大学生命科学学院/浙江省生物计量及检验检疫技术重点实验室,杭州 310018)
铁皮石斛Dendrobiumofficinale隶属于兰科Orchidaceae 石斛属Dendrobium,是一种多年生附生草本植物,有着“九大仙草之首”的美誉[1]。铁皮石斛是远近驰名的中国传统名贵中草药材,主要药用部位是新鲜或干燥的茎,兼具保健功能和治疗效果。铁皮石斛的药用历史悠久,药用价值高,当属“药中黄金”,有助于生津养胃;清热滋阴;益肾润肺;强腰明目[2]。铁皮石斛喜好温湿气候和半阴环境中生长,在我国主要分布于浙江、云南省海拔超过1.6 km 的地区[3]。
浙江省金华市武义县是浙江省铁皮石斛主要产地,其本地品牌寿仙谷牌“铁皮石斛”在2011 年已被列入国家地理标志登记保护名单,该地铁皮石斛种植总面积达105 hm2,贡献率占全省的10%以上[4]。为了满足人民大众对铁皮石斛的需求,人工栽培技术广泛应用于铁皮石斛的产业化种植。然而铁皮石斛产业快速发展的同时也面临着诸多难题,如种植过程中温湿气候与半阴的环境往往容易滋生病害病原菌,加之铁皮石斛枝叶繁茂、茎叶幼嫩,更易招惹病虫侵袭,病虫害在空气流通性差、湿度高的种植基地中逐年加重,积重难返[5]。目前铁皮石斛病害防治方面仍存在较多不足,如缺乏病原菌系统鉴定、防治手段效果差、病害发生规律知之甚少等。铁皮石斛常见的病害主要有枯梢病、炭疽病、黑斑病、白绢病、根腐病、灰霉病等共计12 种类型[6,7]。目前已有根腐病、黑斑病、白绢病等病原菌鉴定和防治的有关报道,但涉及铁皮石斛梢枯病病原菌的鉴定方面相关报道极少,防治手段也尚未形成完整的科学研究体系[8]。
枯梢病在铁皮石斛整个生长周期内,均有不同程度的发生,在春季尤为常见,其田间病株表现为顶部嫩梢枯萎。染病初期顶部嫩叶生长速率变慢,逐渐褪去原本的绿色转变为枯黄色,枯黄部分在不断向下蔓延伸展,致使顶梢弯曲,最终形成枯梢状态。在病害严重时,铁皮石斛将停止生长[9]。可以说梢枯病对铁皮石斛的危害大大降低了铁皮石斛的产量,对铁皮石斛的品质也造成了恶劣影响。因此,明确浙产铁皮石斛梢枯病病原菌,建立行之有效的防治方法,对于铁皮石斛的增产提质有着重大意义。本研究铁皮石斛病株采集自武义县寿仙谷铁皮石斛种植基地,将病原菌分离纯化后用柯赫氏法则验证致病性,进一步结合形态学观察和分子生物学鉴定,确定梢枯病病原菌的分类地位。运用实验室拥有自主知识产权的淀粉酶产色链霉菌1628 代谢产物,探究其对浙产铁皮石斛梢枯病的室内及田间的防治效果,旨在明确浙产铁皮石斛梢枯病病原菌并为铁皮石斛梢枯病的生物防治提供理论依据和实际指导。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 浙产铁皮石斛梢枯病病原菌:从2019 年5—7 月自浙江省武义县寿仙谷铁皮石斛种植基地采集的具有典型梢枯病病症的病株上分离纯化获得;盆栽健康铁皮石斛:由浙江省武义县寿仙谷铁皮石斛种植基地提供;淀粉酶产色链霉菌Streptomycesdiastatochromogenes1628 代谢产物、脐孢木霉菌Trichodermabrevicompactum0248 代谢产物由浙江省生物计量及检验检疫技术重点实验室内保藏菌株发酵产生。
1.1.2 培养基 马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:蒸馏水1 L、马铃薯200 g、葡萄糖20 g、琼脂15 g,pH 调至7.0;淀粉酶产色链霉菌1628 发酵培养基:黄豆粉4.3%、可溶性淀粉2%、CaCO30.5%、NH4Cl 0.3%、KH2PO40.3%、FeCl20.1%;脐孢木霉菌0248 发酵培养基:1 L 蒸馏水,20 g 葡萄糖,5 g 蛋白胨,1 g 牛肉浸膏,0.01 g NH4Cl,0.001 g ZnSO4·7H2O,pH 调至7.0。
1.1.3 试剂与仪器 CTAB 提取液购于北京索莱宝科技有限公司;DNA 提取试剂盒、EXTaq聚合酶、DNA marker 购于上海生工生物工程(上海)股份有限公司;无水乙醇购于上海阿拉丁生化科技股份有限公司;76%井冈霉素可湿性粉剂购自上海阿拉丁生化科技股份有限公司;96%宁南霉素原药购自天津阿尔塔科技有限公司;50%多菌灵可湿性粉剂购自四川国光农化股份有限公司。PCR 仪、Sub-Cell GT 核酸电泳仪、Nanodrop2000 蛋白核酸定量分析仪(美国Thermo 公司);Gel Doc XR 凝胶成像仪(美国Bio-Rad 公司);MP Fast-prep-24 均质仪(北京优尼康生物科技有限公司);YS100 显微镜(日本Nikon 公司);GZX-9140-MBE烘干箱、恒温培养箱(上海博迅实业有限公司医疗设备厂);SW-CJ-1F 单人双面超净工作台(浙江苏净净化设备有限公司)。
1.2 方法
1.2.1 病原菌分离纯化 参照徐亦文等[10]通过平板分离方法对病原菌进行分离纯化。用75%酒精棉球对浙产铁皮石斛的带病组织进行擦拭,将患病组织梢枯的顶端叶片均匀切成1.0 cm×1.0 cm 的小块,在75%的酒精溶液内充分浸泡30 s,再用1% NaClO 表面消毒4 min,再用75 %的酒精漂洗30 s 以除去表面残留的NaClO,经无菌水漂洗3 次后,吸干组织水分放置于PDA 平板上,28 ℃恒温培养7 d 直至平板上长出单菌落,用接种环挑取单菌落接于灭菌过的新的PDA 培养基上进行纯化操作,28 ℃培养7~14 d 后, 观察记录菌落形态与色素的产生情况等,最后将纯化菌的孢子用25%的甘油保存于-80 ℃冰箱留作备用[11]。
1.2.2 致病性测定 采用柯赫氏法则对浙产铁皮石斛梢枯病病株上分离到的病原菌进行致病性测定[8,12]。将完成分离纯化的病原菌接种于PDA 培养基平板中央,28 ℃培养5 d 后,用无菌水清洗菌落表面,经稀释得到浓度为1.0×106孢子/mL 的孢子悬浮液。采用顶端部病害回接法进行接种试验,用灭菌针尖刺伤植株顶端叶片组织,于伤口处喷洒孢子悬浮液,并用塑料膜将其包裹罩住保湿48 h,无菌水处理为对照。该试验在(26±1)℃、光照周期16L: 8D、相对湿度70%~80%的人工气候室中培养,每组设置3 组重复。14 d 后观察植株染病情况,将病变组织进行分离纯化,分离步骤同1.2.1。对该组织进行鉴定比对是否与原始病原菌相同。
1.2.3 形态学鉴定 将已纯化的病原菌接种于PDA 培养基平板中央,28 ℃培养7 d。观察菌落的生长速率、颜色及形态等特征。孢子形态观察:用无菌水将孢子冲洗过滤后取20 μL 于玻片上在400 倍显微镜下观察,随机选择30 个大、小孢型分生孢子在光学显微镜下观察并记录孢子形态大小、有无横隔纵膈等。产孢链观察:将PDA 平板放置于200 倍显微镜下观察其产孢链[10,13-15]。
1.2.4 病原菌分子生物学鉴定 采用CATB 法进行DNA 提取,使用的引物见表1,分别扩增Alta1、EF-1α、RPB2、ATP与His3 基因序列片段[16,17]。PCR 反应总体积为50 μL,ExTaq25 μL,ddH2O 21.5 μL,上游引物1.5 μL,下游引物1.5 μL,DNA 模板0.5 μL。设定PCR 程序[10]:95 ℃(预变性)3 min;95 ℃(变性)30 s,51 ℃~62 ℃(退火)30 s,72 ℃(延伸)45 s,进行34 个循环,最后72 ℃(延伸)10 min。于1.0%琼脂凝胶电泳仪检测PCR 产物,并将PCR 产物送至杭州有康生物有限公司进行测序。测序所得序列在NCBI网站上进行BLAST 分析比对,以MEGA X 邻接法(Neighbor-joining,NJ)构建发育树[18,19]。
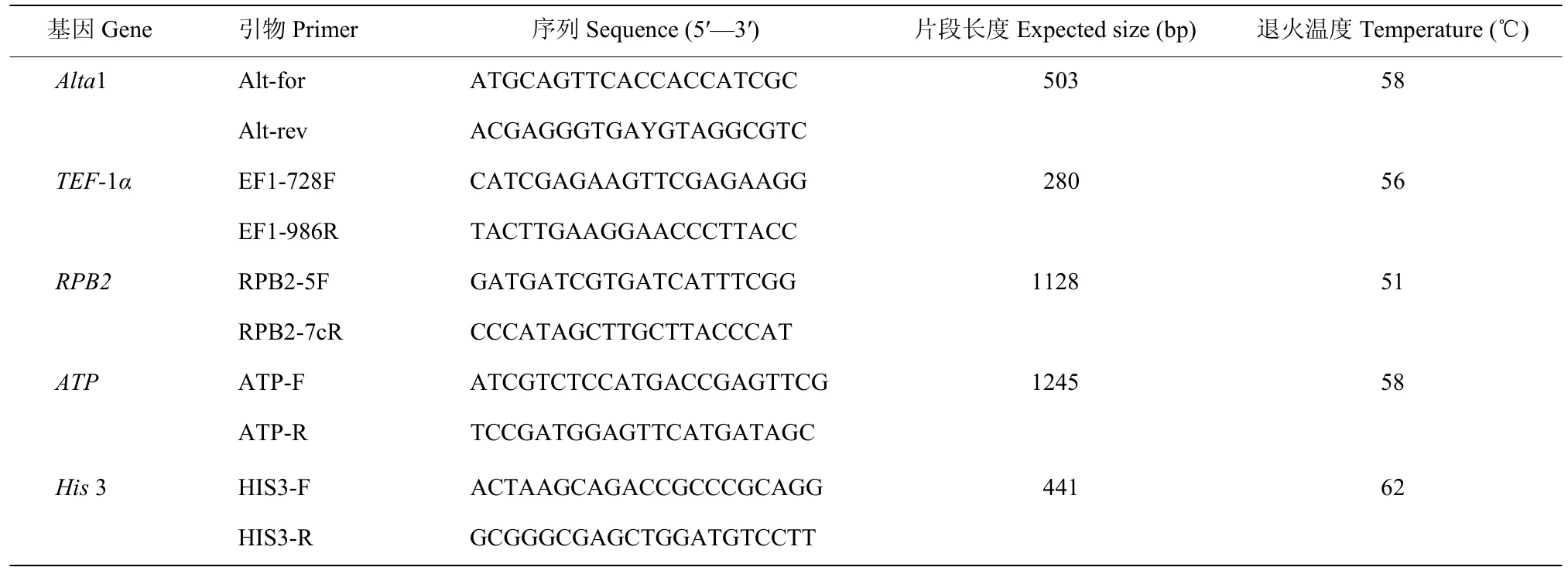
表1 本试验中所用的引物序列Table 1 Primers used in this study
1.2.5 抑菌活性测定 参照张祥丽等[8]方法,即按1.1.4 中制备菌株1628 和菌株0248 发酵液母液,并将粉剂(96%宁南霉素原药、76%井冈霉素可湿性粉剂)与无菌水按质量比1:1 制成液体药剂待用。配制PDA 培养基经121 ℃、15 min 高温灭菌待降温至50 ℃~60 ℃,将4 种供试杀菌剂与PDA 培养基按体积比1:9 分别制成含10% 1628 发酵液、10% 0248 发酵液、9.6%宁南霉素、7.6%井冈霉素、5%多菌灵的含药平板,按体积比1:99 分别制成含1% 1628 发酵液、1% 0248 发酵液、0.96%宁南霉素、0.76%井冈霉素、0.5%多菌灵的含药平板,接种铁皮石斛梢枯病病原菌S8-1 菌饼(直径为5 mm)于PDA 含药平板中央,28 ℃恒温培养5 d 后,采用十字交叉法测量菌落直径,每组3 个重复,取平均值计算抑制率,对照组为无菌水处理。抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100。
1.2.6 淀粉酶产色链霉菌1628 代谢产物对浙产铁皮石斛梢枯病菌的室内防效测定 将淀粉酶产色链霉菌1628 接种于GYM 培养基中,28 ℃、180 r/min 条件下培养发酵7 d 后,在6000 r/min 离心10 min 取上清制备获得淀粉酶产色链霉菌1628 代谢产物[20-22]。
菌丝生长抑制率测定[10]:将淀粉酶产色链霉菌1628 代谢产物按体积比稀释成10%、1%、0.33%三个浓度梯度,经0.22 μm 过滤器过滤后,吸取2 mL 加入至18 mL 的PDA 培养基中,二者混匀后倒平板。其他药剂同样稀释成目标浓度后,吸取2 mL 加入至18 mL 的PDA 培养基中,二者混匀后倒平板。将直径为5 mm的梢枯病病原菌菌饼小心置于PDA 平板中央区域,28 ℃培养5 d,无菌水处理为阴性对照,每个处理组设置3 个重复。菌丝生长抑制率的计算:十字交叉法测定培养5 d 后PDA 平板上菌落直径。抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100。
1.2.7 淀粉酶产色链霉菌1628 代谢产物对浙产铁皮石斛梢枯病田间防效测定 试验地点为浙江省杭州市中国计量大学温网室内的微型农田,试验面积约为16 m2。在2019 年7 月,采集“仙斛1 号”(浙江省武义县寿仙谷的铁皮石斛种植基地的一年生健康铁皮石斛植株),并于当天带回实验室随即在试验用田进行移栽。2020 年3 月份铁皮石斛进入发病期,及时对发病症状进行观察记录,并将病情指数统计汇总。依据发病症状的严重程度可将梢枯病病情分为4 个等级:0 级,健康苗;1 级,不足1/4 的叶片出现梢枯现象;2 级,1/4~1/2 的叶片出现梢枯现象;3 级,1/2~3/4 的叶片出现梢枯现象;4 级,超过3/4 的叶片出现梢枯现象。在发病前期,开始田间防效试验,将体积比为100%的淀粉酶产色链霉菌1628 代谢产物处理1 区,体积比为50%的淀粉酶产色链霉菌1628 代谢产物处理2 区,采用100%和50%的淀粉酶产色链霉菌1628代谢产物作为田间防效测定的供试药剂在浙产铁皮石斛高发期内进行田间防效测定,并用清水作为阴性对照,50%多菌灵作为阳性对照,且每块处理田之间都用阴性对照组作为间隔田,以免对试验产生不必要的影响。使用小型手动气压式喷壶对供试铁皮石斛整株进行均匀喷洒,将每个分区样本量设置为30 株,每组试验设置3 个重复[23]。施药后第7、14 d 调查记录样本发病情况,另外由于施药前的各个分区之间病情指数存在差异,故需统计每个分区施药前的发病情况,以此为基础对病情指数进行校正防效的计算。病情指数和校正防效的计算[8]:病情指数=∑(各级病株数×对应各级代表级数值)/(试验总株数×发病最高级的代表级数值)×100;校正防效(%)=100×[1-(处理药后病情指数×对照药前病情指数)/(处理药前病情指数×对照药后病情指数)][24]。所得数据使用SPSS 软件进行单因素方差分析,T-test 进行差异显著性分析。
2 结果与分析
2.1 浙产铁皮石斛梢枯病病害症状
该病原菌主要侵害部位为浙产铁皮石斛顶端叶片,发病初期可以观察到石斛顶梢部位生长速率变缓,而后叶片逐渐变黄,发病中期叶片上枯黄区域不断向下蔓延扩大,发病后期顶端染病部位叶片完全枯死(图1A),随着病害症状的不断发展,病斑上会产生黑色霉层,最终可导致顶端的3~6 片叶片死亡,进而引起整株铁皮石斛死亡。根据发病特征将其鉴定为梢枯病。

图1 浙产铁皮石斛的梢枯病病害特征及致病性测定Fig.1 The characteristics and the pathogenicity assay of die back in D.officinale
2.2 浙产铁皮石斛梢枯病病原菌的致病性测定
对分离自浙产铁皮石斛梢枯病病株的病原真菌(编号为S8-1)进行致病性测定。大约7 d 可以观察到初始发病症状与田间病原菌感染植株病害特征一致,在铁皮石斛顶端叶片开始出现枯黄现象,一周之后枯黄区域不断从顶端向下蔓延扩大,颜色也逐渐由浅变深(图1B)。从病株叶片感染处重新采集病原感染组织后通过再次分离纯化,得到的菌株与原始病原菌S8-1 形态一致,由此可以说明经柯赫氏法则验证S8-1为引起浙产铁皮石斛梢枯病的病原菌。
2.3 浙产铁皮石斛梢枯病病原菌形态学鉴定
病原菌S8-1 在PDA 平板上菌丝呈放射状生长,菌落中心呈深灰色,周围由浅灰至白色散开,菌丝呈现棉絮状覆盖在表面,初期菌丝呈现浅灰色,而后菌落逐渐向四周扩散,平板背面颜色呈现黑色,周围一圈呈现灰白色,菌丝生长速率为9.4 mm/d,在28 ℃下培养14 d 菌落直径为7.5 cm(图2A)。显微镜下单个孢子呈倒棒状或梨形,具有3~8 个横隔,1~4 个纵隔;小型分生孢子类似杆状但头部略膨大,大型分生孢子呈棒槌状或灯泡状大小,其孢子大小约为(20.1~78.2)μm×(11.0~35.5)μm,部分孢子顶部含有假喙,大小约为(0~33.5)μm×(2.5~9.0)μm(图2B,C)。菌丝有隔、细长型(图2D,E),初步鉴定该病原菌为链格孢菌A.alternata[9-11]。
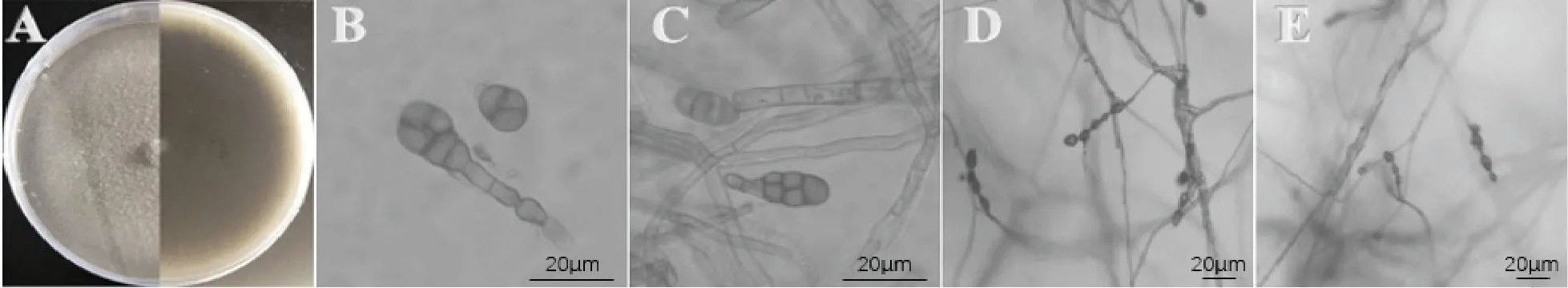
图2 S8-1 菌落与孢子形态学观察Fig.2 The morphological characteristics of S8-1 colony and conidiospore
2.4 浙产铁皮石斛梢枯病病原菌分子生物学鉴定
采用特异性引物对病原菌S8-1 进行分子鉴定,以病原菌S8-1 基因组DNA 为模板,对Alta1、TEF-1α、RPB2、ATP及His3 序列进行PCR 扩增,获得有效条带分别为503、280、1128、1245、441 bp,得到 5个基因部分序列片段的电泳图(图3)。将测序所得序列上传到Genebank,序列号分别为ALTa1(MW995953)、RPB2(MW995956)、TEF-1α(MW995955)、ATPase(MW995957)和His3(MW995954)。在NCBI 网站上进行BLAST 分析比对,Alta1、TEF-1α、RPB2、ATP和His3 序列与Genbank 中的登录号为MN894675.1、LC132709.1、MG873562.1、MW541760.1 和MN481961.1 的链格孢菌同源性分别为100%、100%、100%、100%和99.77%。综合形态学分析和致病性测定结果,确定浙产铁皮石斛梢枯病病原菌为链格孢菌A.alternata(图4)
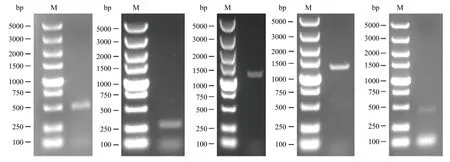
图3 Alta1、TEF-1α、RPB2、ATP 与His 3 PCR 扩增产物的电泳分析图Fig.3 Electrophoresis results of PCR amplification of Alta1, TEF-1α, RPB2, ATP and His 3

图4 基于Alta1、RPB2、TEF-1α、ATP 和His 3 序列构建S8-1 相似菌株的系统发育树Fig.4 Phylogenetic tree of S8-1 based on Alta1、RPB2、TEF-1α, ATP and His 3 sequences
2.5 铁皮石斛梢枯病病原菌S8-1 对供试杀菌剂的敏感性
10%的淀粉酶产色链霉菌1628 代谢产物对梢枯病菌株S8-1 的抑制作用最强,菌丝生长抑制率为96.88%,而1%的淀粉酶产色链霉菌1628 代谢产物的抑制率也达到了63.93%。10%与1%的脐孢木霉菌0248 代谢产物对菌株S8-1 的菌丝抑制率分别为75.96%和34.15%,10%与1%的宁南霉素对菌株S8-1 菌丝抑制率分别为49.33%和13.73%,说明脐孢木霉菌0248 代谢产物和宁南霉素对S8-1 的抑制效果均低于同浓度下的淀粉酶产色链霉菌1628 代谢产物的抑制效果。5%和0.5%的多菌灵对菌株S8-1 的菌丝抑制率分别为3.94%和2.97%。而井冈霉素不论是高浓度还是低浓度处理对S8-1 均无明显抑制作用(表2)。综上,表明淀粉酶产色链霉菌1628 代谢产物对梢枯病病原菌S8-1 具有较强抑制作用。
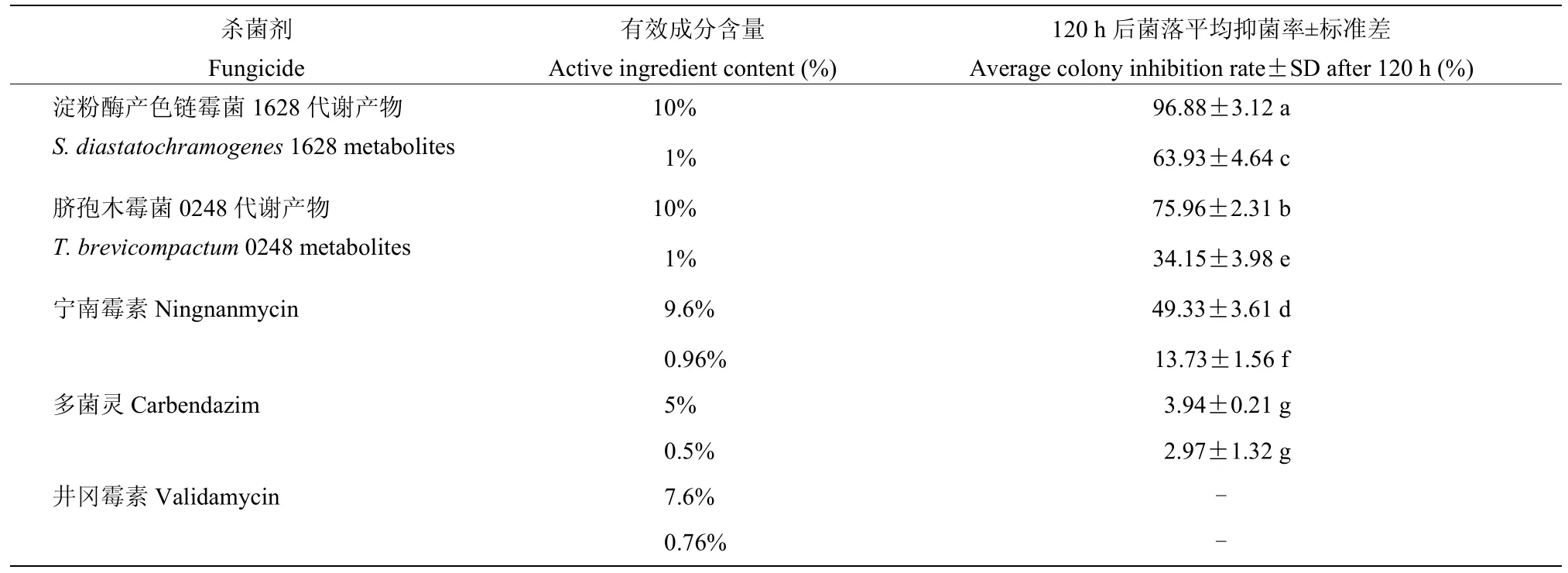
表2 供试杀菌剂对铁皮石斛根腐病致病菌菌丝生长的影响Table 2 Effects of fungicides on mycelial growth of D.officinale die back pathogen
2.6 淀粉酶产色链霉菌1628 代谢产物对浙产铁皮石斛梢枯病病原菌室内防效
淀粉酶产色链霉菌1628 代谢产物对浙产铁皮石斛梢枯病病原菌菌丝生长有较强的抑制作用。药剂终浓度为10%的淀粉酶产色链霉菌1628 代谢产物对浙产铁皮石斛梢枯病病原菌菌丝生长抑制率很高,可达96.88%。药剂终浓度为1%淀粉酶产色链霉菌1628 代谢产物对浙产铁皮石斛梢枯病病原菌菌丝生长抑制率也可达63.93%。药剂终浓度为0.33%的菌丝抑制率为27.47%。并且不同浓度药剂组的菌丝抑制率间存在显著性差异,随着药剂浓度降低抑制效果减弱。由毒力回归方程可得,其IC50为0.461%(表3)。

表3 淀粉酶产色链霉菌1628 代谢产物对浙产铁皮石斛梢枯病菌丝生长的影响Table 3 Effects of Streptomyces diastatochromogenes 1628 metabolites on mycelial growth of D.officinale die back pathogen
2.7 淀粉酶产色链霉菌1628 代谢产物对浙产铁皮石斛梢枯病病原菌田间防效
100%的淀粉酶产色链霉菌1628 代谢产物在7 d 时对浙产铁皮石斛梢枯病的校正防效可达68.35%,与50%浓度的淀粉酶产色链霉菌1628 代谢产物相比,差异性不显著,但100%、50%的1628 代谢产物均显著性高于50%的多菌灵可湿性粉剂对浙产铁皮石斛梢枯病的田间防效。试验结果显示,防治时间在14 d 时,不同浓度的淀粉酶产色链霉菌1628 代谢产物对梢枯病的防治效果均显著高于50%多菌灵。由此表明,淀粉酶产色链霉菌1628 代谢产物能能有效防治铁皮石斛梢枯病(表4)。
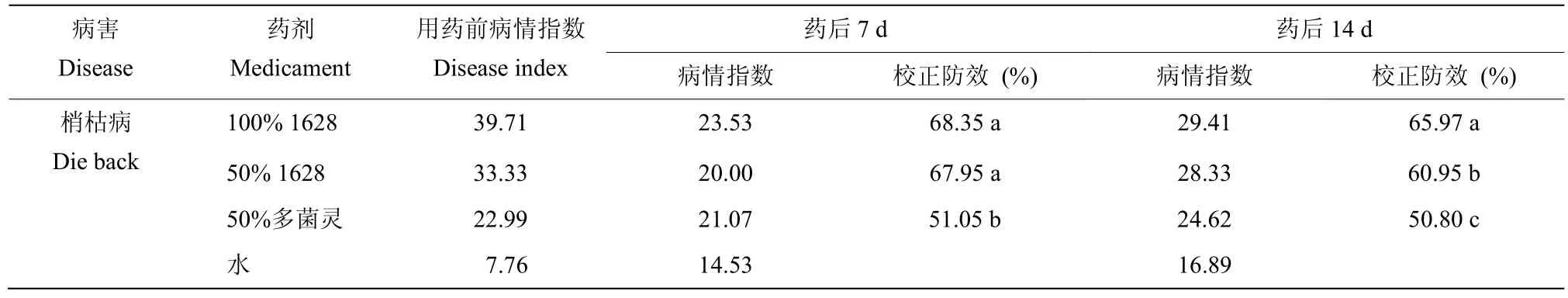
表4 供试药剂对浙产铁皮石斛的田间防效Table 4 Control effects of fungicides on the D.officinale in the field experiment
3 讨论
梢枯病是浙江省武义县寿仙谷铁皮石斛种植基地内发生在铁皮石斛上常见的病害,铁皮石斛潮湿半阴的种植环境加重了梢枯病的为害程度。梢枯病病原菌主要为害铁皮石斛的顶端叶片部分,致使嫩梢与叶片枯死,严重影响浙产铁皮石斛的品质与产量。本研究中通过病原菌分离和柯赫氏式法则验证明确了铁皮石斛梢枯病病原菌为链格孢菌。链格孢菌是自然界常见的一类分生孢子真菌,其环境适应性强,具有典型形态特征,在形态学上易分类至属,但菌落变异幅度大,仅靠形态学无法准确鉴定到种[15]。为了更准确地鉴定病原菌S8-1 的分类地位,本研究结合链格孢菌的孢子和菌丝形态,对Alta1、EF-1α、RPB2、ATP及His3 五个常见的链格孢菌序列进行PCR 扩增比对,结合病原菌形态学结果明确了浙产铁皮石斛梢枯病病害的主要病原真菌为链格孢菌A.alternata,该研究为后续链格孢菌分类鉴定提供新的思路。
目前针对铁皮石斛梢枯病的生物防治报道少之又少,化学防治作为主要的防治手段,滥用所带来的农残高、污染大、环保性差等问题严重影响中药材质量安全,危害人民健康。生物防治是利用微生物及其代谢产物对病虫害进行防治的一种手段,相较于化学防治具有农残少、低毒性、环境友好等优点,在植物病害防治中应用前景广阔[25]。因此,本研究采用化学农药多菌灵和多种生物农药对铁皮石斛梢枯病病原菌菌丝生长速率进行对比,结果发现淀粉酶产色链霉菌代谢产物对该梢枯病病原菌具有更好抑制作用。田间试验进一步证明淀粉酶产色链霉菌是有效防治铁皮石斛梢枯病的生防菌。淀粉酶产色链霉菌1628 代谢产物主要由核苷类抗生素和多烯大环内酯类抗生素构成[8,10]。在前期研究中,发现10%淀粉酶产色链霉菌1628代谢产物能够对铁皮石斛的根腐病病原菌菌丝生长抑制效果达到98.22%、浙麦冬黑斑病病原菌抑菌效果达到98.00%,与本研究中的铁皮石斛梢枯病病原菌抑菌效果96.88%相近,说明10%淀粉酶产色链霉菌1628代谢产物对多种植物病原菌菌丝生长均具有良好的抑菌作用。本研究表明淀粉酶产色链霉菌1628 代谢产物可以用作浙产铁皮石斛梢枯病的生物防制剂,这为后续铁皮石斛梢枯病的生防菌的探究打开了新思路,提供了可靠的理论依据。
浙产铁皮石斛梢枯病的相关研究报道较少,本论文开展了浙产铁皮石斛梢枯病病原菌分离鉴定研究,并提出了梢枯病的生物防治办法,为铁皮石斛种植基地常发的梢枯病的高效防治提供了有力依据,能够助力浙产铁皮石斛产业的可持续发展。
