1 株新的变形杆菌噬菌体的分离、鉴定与生物学特性分析
2023-10-21苏雅航侯忠余寇肖迪朱成林刀筱芳唐俊妮
苏雅航,侯忠余,寇肖迪,刘 爽,朱成林,陈 娟,刀筱芳,唐俊妮,,*
(1.西南民族大学食品科学与技术学院,四川 成都 610041;2.西南民族大学青藏高原研究院,青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041)
变形杆菌属(Proteus)是肠杆菌科的一个种属,革兰氏阴性菌,广泛存在于爬虫、鸟类、哺乳动物和人类肠道内。目前已鉴定出5 种:普通变形杆菌(Proteus vulgaris)、奇异变形杆菌(P.mirabilis)、产黏变形杆菌(P.myxofaciens)、潘氏变形杆菌(P.penneri)和豪氏变形杆菌(P.hauseri)[1]。此外,根据表型、化学分类学和基因型分析,国内外学者提出了6 个新定义菌种:土壤变形杆菌(P.terrae)、卡氏变形杆菌(P.cibarius)、爱满变形杆菌(P.alimentorum)、天鸽变形杆菌(P.columbae)、矢米变形杆菌(P.faecis)和食物变形杆菌(P.cibi)[2-3],其中普通变形杆菌和奇异变形杆菌与临床关系最为密切[4]。变形杆菌可引发创伤感染、膀胱炎、婴儿腹泻、食物中毒等。长期接受抗生素、激素、免疫抑制剂、抗肿瘤药物治疗的抵抗力下降的病人容易感染变形杆菌[5]。普通变形杆菌是常见的细菌性感染与食物中毒的病原菌[6]。据报道,1962—2007年国内发生变形杆菌属食物中毒事件264 起,中毒人数达1.7万 人[7]。近年来由奇异变形杆菌造成动物发病率和死亡率逐年增加[8],给养殖业造成的经济损失及公共卫生威胁越来越严重。鸭[9]、犬[10]、牦牛[11]、熊猫[12]等动物感染奇异变形杆菌的报道屡见不鲜。在牦牛屠宰过程中,如未及时清除变形杆菌的污染,人们接触或误食也会对健康造成一定的威胁。
目前,多用抗生素防控变形杆菌引起的疾病,但细菌耐药性的问题越来越严重,新种类抗生素出现短缺现象,在治疗严重的细菌感染方面产生了大量的未得到满足的医疗需求[13]。如果不采取有效措施解决细菌耐药性问题,到2050年,将可能导致全球每年约1 000万 人的死亡和60~100万亿 美元的生产力损失[14]。
噬菌体是细菌的天然“杀手”,不会被细菌的耐药性制约,能特异性识别并杀灭病原菌,不会破坏其他菌群[15]。同时,噬菌体分布广泛且具有自我繁殖能力强、专一性高等优点,噬菌体生物控制是处理食物生产链中致病菌污染的理想方法[16]。为了保障食品安全和消费者健康,噬菌体已获得美国农业部食品及药物管理局和食品安全与美国农业部的批准,作为食品原料和加工产品的抗生素代替物[17-19]。关于变形杆菌噬菌体的研究,目前还处于起步阶段,Wirjon等[20]对从污水中分离出的奇异变形杆菌噬菌体pPM_01的生物学特性与基因组进行分析研究,表明分离的噬菌体对奇异变形杆菌具有高度溶解能力,基因组中无毒力基因,可用于开发噬菌体治疗。周祥莹等[21]以貉源奇异变形杆菌为宿主菌,分离出裂解性噬菌体,为貉奇异变形杆菌病的治疗提供了参考。宋军等[10]从泌尿系统结石反复发作犬的尿液中分离到的奇异变形杆菌为宿主菌,分离到3 株奇异变形杆菌噬菌体,为奇异变形杆菌及其引起的泌尿系统感染的治疗奠定基础。多项研究和患者实验证明,噬菌体能够抑制导管表面奇异变形杆菌生物被膜形成[22-25]。以上研究说明对变形杆菌噬菌体的探究非常有意义。关于变形杆菌噬菌体基因组的研究较少,NCBI GenBank数据库中保存的变形杆菌噬菌体基因组序列不到30 个[26],少数变形杆菌噬菌体在形态、基因组序列长度、寄主范围和基因含量方面差异很大[27-28]。对变形杆菌噬菌体进行分离鉴定及分析非常必要。
本研究通过对牦牛屠宰场采集污水中的细菌进行16S rRNA鉴定,发现在牦牛屠宰场存在变形杆菌污染,对食品安全造成潜在的威胁。为了更好地防治该细菌污染,减少抗生素使用,本研究以变形杆菌为宿主菌,从牦牛屠宰场采集的污水中分离得到1 株裂解型噬菌体,通过研究该噬菌体的生物学特性,以及进行噬菌体基因组分析,旨在丰富变形杆菌的噬菌体库,为进一步开发新型噬菌体抗菌剂提供基础。
1 材料与方法
1.1 材料与试剂
宿主菌来自于牦牛屠宰场分离后经16S rRNA测序鉴定到的变形杆菌,其他受试菌株均为本实验室分离保存;污水样品来源于四川省成都市某牦牛屠宰场。
肉汤培养基(lysogeny broth,LB)、LB琼脂培养基、SM缓冲液、Phage DNA Isolation Kit试剂盒加拿大N o r g e n B i o t e k 公司;胰蛋白胨大豆琼脂(trypticase soy agar,TSA)培养基、胰酪胨大豆肉汤(trypticase soy broth,TSB)培养基、聚合酶链式反应(polymerase chain reaction,PCR)引物 生工生物工程(上海)股份有限公司;Master Mix 北京擎科新业科技有限公司;1×TAE缓冲溶液、1×TE缓冲液、REGULARAGAROSEG-10型琼脂糖 西班牙Biowest公司;含药纸片 美国Oxiod Limited公司。
1.2 仪器与设备
WD800B型微波炉 顺德市格兰仕微波炉电器有限公司;SW-CJ-2FD洁净工作台 苏净集团苏州安泰空气技术有限公司;UV-6100分光光度计 上海美普达仪器有限公司;GHP-9080水式恒温培养箱 上海齐欣科学仪器有限公司;HZQ-F160全温振荡培养箱 江苏省太仓市实验设备厂;MLS-3020电热自动灭菌锅 日本Sanyo公司;5804R型冷冻离心机 Eppendorf中国有限公司。
1.3 方法
1.3.1 分离菌株的16S rRNA鉴定
将实验室从牦牛屠宰场多次分离纯化保存的菌株接种到T S B 培养基中,3 7 ℃恒温振荡培养18~24 h,参照文献[29]报道的方法快速提取菌株DNA。以16S rRNA通用引物27F与1492R对67 株菌株进行P C R 扩增,具体引物序列为:上游引物:5’-AGAGTTTGATCCTGGCTCAG-3’;下游引物:5’-GGYTACCTTGTTACGACTT-3’[30]。引物由生工生物工程(上海)股份有限公司合成。
PCR体系为20 μL,包含Taq1.1×T3 Super PCR Mix 17 μL,上、下游引物各1 μL,DNA模板1 μL。PCR程序:98 ℃预变性2 min;98 ℃变性20 s;56 ℃退火10 s;72 ℃延伸30 s;共35 个循环,72 ℃延伸2 min。
1.3.2 菌株耐药表性分析
药敏实验根据美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)推荐的K-B纸片扩散法进行操作,实验结果按照CLSI 2019的标准进行判定[31]。
1.3.3 噬菌体的富集
参照汤婷婷[32]的方法,将采集的污水样品充分混合均匀后,用4 层纱布过滤,再用2 层滤纸过滤,将过滤的液体在10 000 r/min离心10 min,用0.22 μm微孔滤膜过滤除菌,最终得到混合液体100 mL。将滤液接种到100 mL LB液体培养基,加入变形杆菌的菌悬液各2 mL,在37 ℃、160 r/min摇床中过夜培养得到1 次富集液。将过夜培养的1 次富集液10 000 r/min离心10 min,用0.22 μm微孔滤膜过滤除菌后,取100 mL过滤液再次加入100 mL LB液体培养基和变形杆菌的菌悬液各2 mL进行2 次富集,共富集3 次后,将富集液过滤除菌于4 ℃冰箱保存备用。
1.3.4 噬菌体的分离与纯化
取将放置于冰箱保存的噬菌体原液100 μL分别加入到10 mL无菌EP管中,在每个管中分别加入10 株菌的菌悬液各100 μL,充分混匀后静置15 min,使噬菌体和宿主菌充分吸附。采用双层琼脂平板法[32]进行过夜培养,观察平板生长情况。选出能够产生噬菌斑的宿主菌接种到5 mL LB液体培养基中,37 ℃、160 r/min摇床培养6 h后,于4 ℃冰箱中保存备用。
在上述形成噬菌斑的双层平板上,挑取形态大小一致的单个噬菌斑,用10 μL枪头穿刺目的噬菌斑,将穿刺后带有噬菌体的枪头伸入2 mL宿主菌悬液中充分混匀,并于37 ℃、160 r/min摇床培养6 h。将混合液于8 000 r/min离心10 min,用0.22 μm微孔滤膜过滤除菌后得到噬菌体液。取噬菌体液进行适当稀释,将100 μL处对数期生长的宿主菌与100 μL噬菌体稀释液加入5 mL半固体培养基中充分混匀后制成双层平板,待凝固后倒置,于37 ℃恒温箱中培养过夜,重复双层平板纯化操作5 次后得到纯噬菌体。
1.3.5 噬菌体的透射电镜观察
噬菌体纯化后测定其效价[33],得到效价为1010PFU/mL的噬菌体液。将其送检进行透射电镜观察,具体方法为:将样本滴于碳支持膜正面,等待2 min,取出碳支持膜吸干水分,再用磷酸钨室温下染色2.5 min,吸干水分,使用JEM-1400PLUS型透射电镜观察[34]。
1.3.6 噬菌体裂解谱测定
应用点斑法[35]测定噬菌体的裂解谱,将受试菌:29 株粪肠球菌(Enterococcus faecalis)、10 株变形杆菌、16 株沙门氏菌(Salmonellasp.)、16 株大肠杆菌(Escherichia coli)、47 株阪崎克罗诺杆菌(Cronobacterspp.)培养至OD600nm约为0.3,取100 μL新鲜菌液涂布于LB固体平板,待完全干燥后,于平板中央滴加5 μL噬菌体上清裂解液,室温静置至干燥后倒置于37 ℃温箱中过夜培养后,观察有无噬菌斑产生,以不添加噬菌体作为对照。
1.3.7 噬菌体最佳感染复数(multiplicity of infection,MOI)
参照并改良Lu等[36]的测定方法,按照不同感染比例(MOI=0.001、0.01、0.1、1、10、100)将噬菌体与生长期的宿主菌混合,37 ℃、160 r/min振荡培养,培养6 h后取上清液于8 000 r/min离心10 min,收集噬菌体上清液,经0.22 μm滤膜过滤后,稀释成不同的梯度与宿主菌混合进行双层平板法培养,次日计算噬菌体效价,重复3 次,计算平均值。
1.3.8 噬菌体一步生长曲线
参考Lu等[36]的方法,将宿主菌菌悬液与噬菌体菌悬液按照MOI=0.1混合均匀后,37 ℃孵育15 min,将培养物于8 000 r/min离心10 min,用LB液体培养基洗涤3 次,加入5 mL 37 ℃预热的LB液体培养基,快速置于37 ℃、160 r/min振荡培养,在0~100 min内每隔10 min取样,在100~240 min每隔20 min取样,测定噬菌体效价。以时间为横坐标,效价为纵坐标,绘制噬菌体的一步生长曲线。裂解量=裂解末期噬菌体效价/裂解初期宿主菌浓度。
1.3.9 理化因素对噬菌体活性的影响
温度对噬菌体活性的影响[10]:取1 mL噬菌体分别于25、35、45、55、65 ℃和75 ℃中孵育1 h后,双层平板法测其效价,每组重复3 次。
pH值对噬菌体活性的影响[10]:将噬菌体按体积比1∶9分别添加到pH值为2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0和13.0的SM缓冲液中,37 ℃孵育1 h后测其效价,每组重复3 次。
有机试剂对噬菌体活性的影响:将1 mL噬菌体液(6.4×109PFU/mL)分别加入到1 mL 75%乙醇、80%丙酮、氯仿和50%二甲基亚砜(dimethyl sulfoxide,DMSO)溶液中,室温作用30 min后,双层平板法测定噬菌体效价[32],将噬菌体接种于SM缓冲液中作为对照组,每组重复3 次。
紫外照射对噬菌体活性的影响:为评价噬菌体对紫外线的敏感性[37],取7 mL噬菌体液(1010PFU/ml)于无菌培养皿中,将培养皿置于距紫外灯10 cm处照射,在0~60 min内每隔10 min取样一次,双层平板法测定其效价,每组重复3 次。
1.3.10 不同MOI噬菌体对宿主菌的裂解效果
将噬菌体与宿主菌按照不同的MOI(0.1、10、100、1 000)各取100 μL加入96 孔板中[37]。另设空白为200 μL的LB液体培养;对照组为100 μL宿主菌与100 μL LB培养基,将其置于37 ℃培养箱中孵育,每隔1 h测定其在600 nm波长处的吸光度,共测定10 h。
1.3.11 噬菌体基因组提取与全基因组测序
对纯化后的噬菌体测序,进行基因组分析。具体的步骤为:使用Phage DNA Isolation Kit试剂盒提取噬菌体总DNA,采用Illumina测序技术完成噬菌体的基因组扩增及深度测序,构建了Illumina PE文库,将去除污染序列后得到的reads进行de novo组装。使用SPAdes和MEGAHIT软件对二代数据进行组装。同时可以选取不同的k-mer长度进行组装。根据提取序列病毒结果,统计测序相关深度和覆盖度;根据实际测序深度计算每100 bp区间的平均深度。将提取到的序列选用prokka进行注释,将注释结果与NCBI NT、NR库比对。
1.4 数据处理
16S rRNA测序结果在NCBI进行比对,将比对结果用MEGA 7.0构建系统发育树进行分析。噬菌体的生物学特性实验数据采用Excel 2010和Origin 2021软件进行分析绘图。噬菌体的基因组测序、组装、拼接与注释由北京擎科生物有限公司完成,用CGView Comparison Tool绘制基因图谱,用MEGA 7.0完成系统发育树的构建。
2 结果与分析
2.1 分离菌株的16S rRNA鉴定
分离菌株用16S rRNA基因通用引物扩增后,将67 株菌PCR产物送检测序得到菌株的核酸序列,在NCBI数据库上进行BLAST,发现菌株29与粪肠球菌同源性较高,10 株与变形杆菌同源性高达98%~99%,1 株与葡萄球菌同源性99%。选取同源性较高的变形杆菌菌株序列,用MEGA X的Neighbor-Joining法构建系统发育树(图1)。结果显示,2、7、8、12、22、23、29、65、66菌株和普通变形杆菌(P.vulgaris)在同一分支上,亲缘关系较近,从分子水平确定10 株菌株为普通变形杆菌。

图1 分离菌株16S rRNA基因的进化树分析Fig.1 Phylogenetic tree of the isolated strains based on 16S rRNA gene sequences
2.2 宿主菌的耐药表型分析
临床上普通变形杆菌与奇异变形杆菌关系较密切[2,4],本研究选取1 株与普通变形杆菌同源性较高的菌株66为代表,探究其药物敏感性。结果发现菌株66对头孢曲松、头孢他啶、诺氟沙星、苯唑西林等6 种抗生素敏感,对阿米卡星、卡那霉素、链霉素等6 种抗生素中度敏感,对头孢西丁、青霉素、氨苄西林、红霉素、万古霉素等9 种抗生素耐受(表1)。

表1 药敏分析Table 1 Antibiotic susceptability of host bacteria
2.3 分离噬菌体的噬菌斑形态与透射电镜结构
以变形杆菌为宿主菌,经3 次富集后分离的到1 株烈性噬菌体。选取的噬菌体经3 次纯化后,经培养可在双层琼脂平板上形成清晰、透亮、大小均一的噬菌斑(图2A、B),将其命名为Proteusphage PV66。将纯化噬菌体液进行磷钨酸负染后透射电镜观察,结果显示,噬菌体由1 个棒状的头部和可伸缩尾部组成(图2C、D)。头部长(140±1)nm、宽(54±1)nm,尾部长为(36±1)nm,从形态上初步判断噬菌体属于短尾噬菌体,与C3形态的噬菌体较为接近[37-38]。
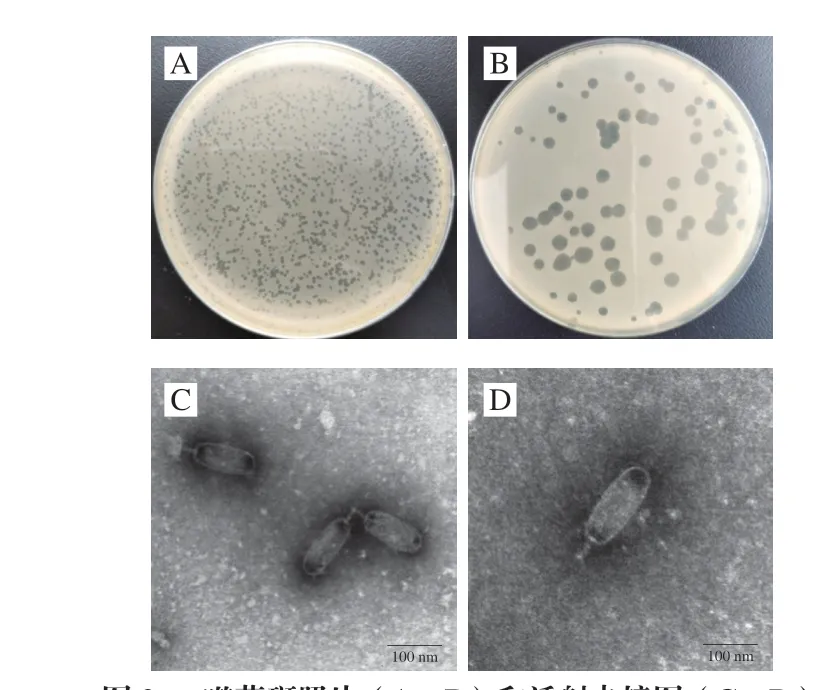
图2 噬菌斑照片(A、B)和透射电镜图(C、D)Fig.2 Plaques (A and B) and TEM morphology (C and D) of phage PV66
2.4 噬菌体裂解谱
通过点斑实验测定裂解谱,结果显示该噬菌体可裂解10 株变形杆菌中的4 株,对实验室分离的沙门噬菌、粪肠球菌、大肠杆菌和阪奇克罗诺杆菌未表现出裂解活性(表2)。表明噬菌体可裂解部分变形杆菌,其裂解效力将在后续实验中进一步研究。

表2 噬菌体PV66的裂解谱Table 2 Lytic spectrum of phage PV66
2.5 噬菌体的最佳MOI测定结果
从图3可以看出,在6 组不同的MOI中,当MOI为0.1时,噬菌体效价最高为3.18×1011PFU/mL,MOI为0.001、1和10时效价次之,MOI为0.01和100效价最低,表明噬菌体PV66最佳MOI为0.1。
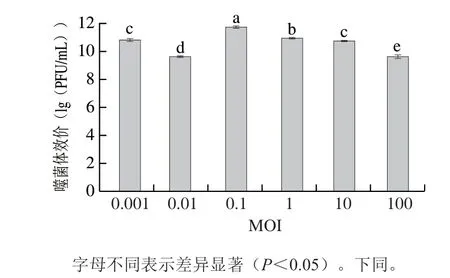
图3 噬菌体PV66最佳MOI测定结果Fig.3 MOI of phage PV66
2.6 噬菌体的一步生长曲线测定结果
如图4所示,噬菌体的潜伏期为10 min,这段时间噬菌体量基本没有增加;爆发期为100 min,在感染后0~80 min内,噬菌体持续增长,在80 min后趋于平稳,因此噬菌体感染期的时间约为80 min。裂解末期噬菌体效价为12.2×1010PFU/mL,感染初期宿主菌浓度为3.8×108CFU/mL,得到噬菌体PV66感染宿主菌的裂解量约为321 PFU/cell。

图4 噬菌体PV66的一步生长曲线Fig.4 One-step growth curve of phage PV66
2.7 理化因素对噬菌体的影响
通过对噬菌体PV66温度耐受的测定(图5A),在60 min处理时间下,随着温度升高,噬菌体活性受到显著影响,在温度高于55 ℃,噬菌体效价开始急剧下降,在温度高于75 ℃,噬菌体PV66失去活性。由图5B可知,噬菌体在pH 3~12范围内,其效价均值在108以上,具有稳定和良好的裂解活性。当pH值为2和13时,完全失去感染宿主的能力。结果分析表明噬菌体作用的pH值范围较广,可具有良好的运用价值,但对高温敏感,当温度达到55 ℃时噬菌体活性受到明显影响。

图5 PV66的热稳定性(A)和酸碱稳定性(B)测定结果Fig.5 Thermal (A) and pH (B) stability of phage PV66
由图6可知,噬菌体在60 min内被紫外照射后效价依然可达109PFU/mL,但对80%丙酮耐受性较低,对50%DMSO、75%乙醇与SM液耐受性较高。


图6 PV 66对紫外线的敏感性(A)和有机试剂的耐受性(B)测定结果Fig.6 UV susceptibility (A) and organic solvent tolerance (B) of phage PV66
2.8 不同MOI的噬菌体对宿主菌的裂解效果
如图7所示,在10 min内,阳性对照曲线保持上升状态,MOI为0.1的曲线在0~2 h内呈上升状态后稳定不变,随后呈下降趋势,MOI为10、100、1 000的曲线与阴性对照曲线在1 h基本保持一致,由此可知,不同MOI的噬菌体可以很好地抑制宿主菌的生长,且MOI越高,抑菌效果越好。
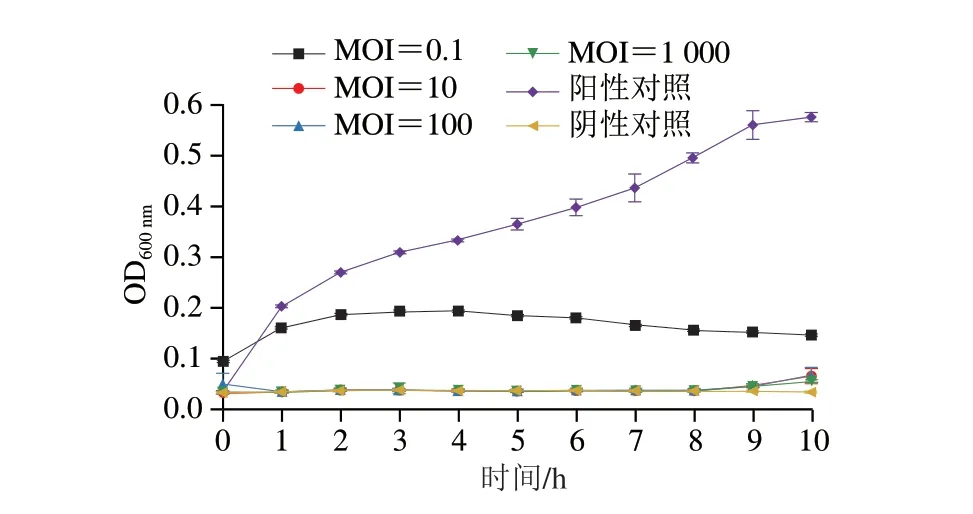
图7 不同MOI噬菌体对宿主菌的裂解效果Fig.7 Lytic effect of phages with different infection numbers on host bacteria
2.9 噬菌体全基因组测序分析
2.9.1 基因组特征
基于全基因组测序结果(表3),噬菌体PV66全序列长度为90 492 bp,基因组GC含量为38.28%。预测了143 个编码序列(coding sequence,CDS),129 个CDS为假想蛋白,其中9 个CDS具有潜在功能,分别为DNA聚合酶、DNA连接酶、核酸相关酶及结构蛋白,4 个tRNA。未发现毒力基因及细菌抗性基因,未预测出噬菌体的裂解酶蛋白与Holi系统,原因可能是数据库中关于变形杆菌噬菌体功能基因的信息量不足。

表3 噬菌体PV66基因组特征Table 3 Genomic characteristics of phage PV66
2.9.2 噬菌体PV66基因编码与同源蛋白比对分析
将噬菌体序列注释后的结果在NCBI的NT数据库中进行比对(表4),发现噬菌体与Cronobacterphage vB_CsaP_009和Proteusphage Privateer具有相似的蛋白,且均具有93%以上的核酸序列相似性。BLAST结果表明,与Cronobacterphage vB_CsaP_009相似的蛋白有111 种,与Proteusphage Privateer相似蛋白有17 种。vB_CsaP_009与Privateer均为C3形态噬菌体[39],由比对结果可知,PV66与vB_CsaP_009具有较高相似性。
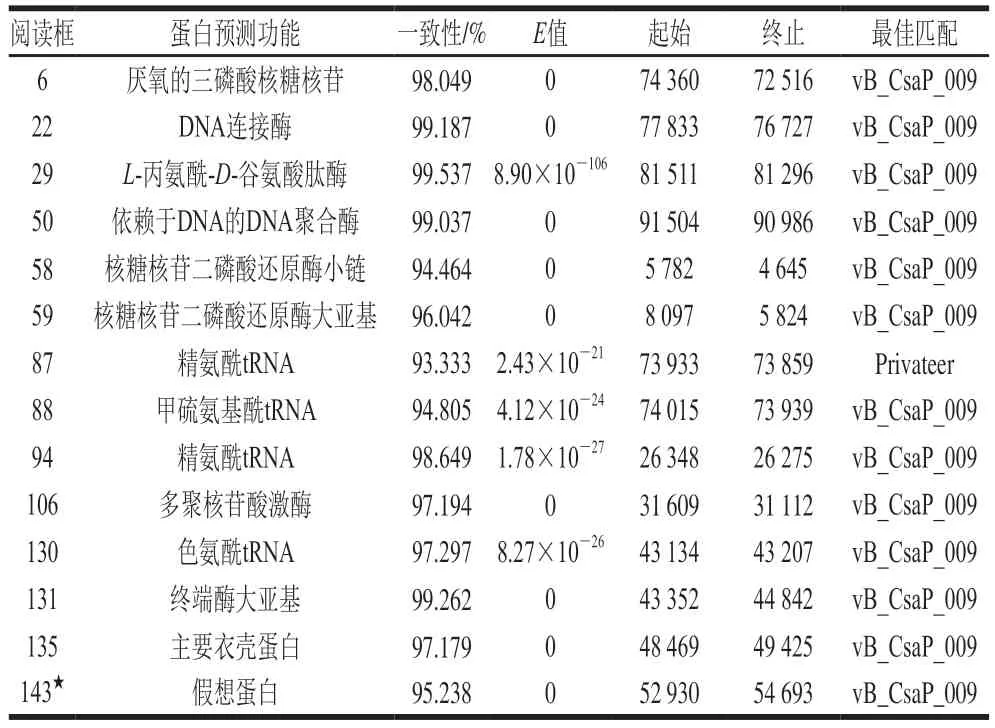
表4 噬菌体PV66 CDS的比对结果Table 4 Results of similarity alignment of CDS between phage PV66 and NT database
2.9.3 基因组比较分析
把噬菌体PV66的全基因组序列在NCBI进行BLAST比对,结果显示PV66与Proteusphage Privateer、Cronobacterphage vB_CsaP_009的同源性较高分别为89.34%、95.20%,与其他噬菌体基因同源性较低,将两条同源性较高的序列与PV66噬菌体系列进行基因比较,发现PV66与Proteusphage Privateer和Cronobacterphage vB_CsaP_009基因间存在缺失与插入的差异,显示PV66噬菌体可能为一个全新的噬菌体。
2.9.4 噬菌体的系统发育分析
通过观察噬菌体的电子结构发现,噬菌体为罕见的C3形态的噬菌体,检索相关噬菌体分类的记录,包括NCBI Taxonomy和International Committee on Virus Taxonomy中提出的许多未分类的噬菌体和数个Kuraviru属的记录,参照已有研究[39-40]描述C3形态的噬菌体,选择这些噬菌体的主要衣壳蛋白进行进化树分析。如图8所示,发现PV66与奇异变形杆菌噬菌体podophage Privateer和克罗诺杆菌噬菌体vB_CsaP_009均有83%的相似性,进化树分析发现PV66和vB_CsaP_009处于同一分支上,结合噬菌体的电镜形态特征与噬菌体宿主菌可判断PV66为C3形态、non-Kuravirus属的噬菌体。
3 讨论与结论
变形杆菌广泛存在于自然界中,不仅危害犬、猫、狐狸、熊猫、牛等动物的健康,对人类的安全也有很大威胁[6]。关于变形杆菌引起的食品中毒的事件屡见报道[7],因此对食品生产加工过程中细菌污染的防控也尤为重要。传统的细菌污染多采用抗生素和消毒剂进行控制,但由于抗生素的大量不合理使用,以及新种类抗生素的短缺,细菌产生耐药性现象广泛存在,细菌耐药性增长的问题越来越严重[17]。多项研究发现,普通变形杆菌和奇异变形杆菌均对多种抗生素表现为耐药[2,4,10-14]。
本研究从牦牛屠宰过程中分离纯化的菌株纯培养后进行16S rRNA测序鉴定,通过在GenBank比对发现有10 株菌与普通变形杆菌同源性为98%~99%,通过耐药表型的分析发现菌株对头孢西丁、青霉素、氨苄西林、红霉素、万古霉素等9 种抗生素耐受,如果在牦牛屠宰过程中变形杆菌未及时清除,可能会对人类和其他动物造成潜在的危险。随着抗生素监管措施越来越严格[18],促使人们不断寻找新型安全的抗菌剂。噬菌体是一种特异性强且裂解性高的对细菌具有杀灭作用的病毒,对噬菌体的分离鉴定及生理特性的研究,对治疗耐药细菌感染具有重要的意义[19]。
本研究从四川某屠宰场采集的污水中分离到1 株烈性噬菌体,透射电镜发现噬菌体为罕见的C3形态噬菌体[39-40]。最佳MOI为0.1,一步生长曲线表明噬菌体的潜伏期短,裂解量高,对温度的耐受值最高为65 ℃,pH值耐受范围2~13,对紫外线照射及有机试剂耐受性良好,且对细菌的裂解效果较好。这些性质与之前报道的变形杆菌噬菌体特性[10,38]相差不大,表明噬菌体PV66具有很好的应用价值。
基因组学是从分子水平了解噬菌体特性的有效方法之一。基因组的遗传多样性和相似性与噬菌体的裂解能力密切相关[41]。关于变形杆菌噬菌体的研究较少,尤其是C3形态的噬菌体,目前仅有一篇文献报道了1 株奇异变形杆菌噬菌体与本研究噬菌体极其相似[39],到目前为止,只有不到30 个变形杆菌噬菌体基因组被测序[26],未来还应对更广泛的变形杆菌噬菌体进行测序和研究。
本研究将提取到的序列选用prokka进行注释,注释出143 个CDS,预测出14 个CDS具有假定的功能,另外的129 个CDS功能未知。注释的蛋白为DNA连接酶、DNA聚合酶及核酸有关的酶和结构蛋白衣壳蛋白,含有4 个tRNA。RNA酶可确保tRNA在宿主体内保持稳定和足够的数量,以促进噬菌体蛋白质的快速产生,能够帮助噬菌体更好地适应不同的宿主菌或环境[42]。大部分CDS功能未知,主要是因为数据库中关于变形杆菌噬菌体功能基因的信息量仍然不足,目前关于变形杆菌噬菌体功能基因的研究结果仍然很有限。因此,在噬菌体功能基因组学的研究中,未知基因功能的鉴定仍然是比较迫切的工作。
本研究以牦牛屠宰场分离到的变形杆菌为宿主菌,从污水中分离到1 株烈性噬菌体PV66,是鲜少被报道感染变形杆菌宿主的短尾噬菌体,并表现出典型的尾状病毒感染特征,包括爆炸裂解行为,此种噬菌体宿主范围相对较窄,可感染与变形杆菌最接近且具有遗传亲缘关系的克罗诺杆菌[39]。分析其生物学特性发现其具有潜伏期短、爆发量大、pH值作用范围广、温度耐受性高等优点。基因组分析预测了形态发生、裂解、DNA复制和重组以及生物合成等蛋白质功能,未发现抗生素相关基因和毒力基因,因此,噬菌体PV66将具有较好的应用于变形杆菌生物防治的潜力。
