基于金@铂纳米酶的食品中过氧化氢残留快速检测试纸的研制
2023-10-21李博然成璐瑶曹智鸿罗云波
李博然,成璐瑶,曹智鸿,程 楠,2,*,罗云波,2,*
(1.中国农业大学食品科学与营养工程学院,食品质量与安全北京实验室,北京 100083;2.农业农村部农业转基因生物安全评价(食用)重点实验室,北京 100083)
过氧化氢是一种重要的无机化工材料[1-2]。随着我国食品级过氧化氢生产技术的提升,过氧化氢愈加广泛的应用在食品加工生产设备和包装的消毒以及水发牛百叶、泡椒凤爪等食品的漂白中[3-4]。自20世纪80年代起,国内外就有诸多研究表明过氧化氢进入到人体中会发生氧化应激反应产生大量自由基,导致细胞凋亡和病变、加速人体的衰老,引发阿尔兹海默症、癌症等[5-8],在国内也有多起由食品中过氧化氢残留引发中毒的报道[9-10]。在GB 2760—2014《食品添加剂使用标准》中规定过氧化氢作为食品加工助剂,应在食品中尽量除去,在GB 5009.226—2016《食品中过氧化氢残留量的测定》中,H2O2在食品中的含量被严格限制在3 mg/kg以下[11-13]。以化学分析法和仪器检测法为代表的传统过氧化氢检测方法存在仪器体积大、耗时长、需要专业人员操作等弊端,难以对食品样品的现场即时检测。试纸法因具有检测快速灵敏、操作简便、便于携带、价格低廉等优点,在现场即时食品安全检测领域展示出了较好的应用前景[14-16]。
目前,已广泛报道的过氧化氢残留快速检测试纸均采用辣根过氧化物酶(horseradish peroxidase,HRP)作为生物活性物质进行检测,但是其作为一种蛋白质存在稳定性较差的缺点,易受温度、pH值、无机离子等外界因素的影响变性失活,导致相应过氧化氢残留快速检测试纸稳定性差、货架期短。近年来,纳米材料模拟酶催化活性的研究发展迅速,引起了生物学、医学等学科的广泛研究兴趣。与天然酶不同的是纳米酶能够避免生物酶易失活的弱点,已被广泛证明能够在水或缓冲溶液中表现出较高的稳定性和良好的催化性能,使其在食品安全快速检测领域具有广泛的应用前景[17-18]。本研究分析几种纳米材料的类过氧化物酶活性,系统性优化显色剂成分与制备工艺,制备过氧化氢快速检测试纸并验证其分析检测性能。
1 材料与方法
1.1 材料与试剂
泡椒系列产品均购自北京五道口佳美乐购物超市。
四氯铂(I I)酸钾(K2P t C l4)、四氯金酸(H A u C l4)、抗坏血酸、聚乳酸纳米粒子(PluronicF127)与葡萄糖 美国Sigma-Aldrich公司;四氯钯酸钠(Na2PdCl4)、3,3’,5,5’-四甲基联苯胺(tetramethylbenzidine,TMB) 上海麦克林生化科技有限公司;二甲基亚砜 上海阿拉丁生化科技有限公司;盐酸、柠檬酸 北京化工厂;所用试剂均为分析纯。
过氧化氢快速检测试纸条 德国默克公司。
1.2 仪器与设备
YM-0405超声波清洗机 深圳方奥微电子有限公司;Varioskan Flash酶标仪 美国赛默飞世尔科技公司;D3024离心机、MX-S混匀仪、HB120-S金属浴 美国塞洛捷克公司;101-3BS电热鼓风干燥箱 天津市宏诺仪器有限公司;InPro3100 pH计 美国梅特勒-托利多公司;Tecnai G2 F30透射电子显微镜 美国FEI公司。
1.3 方法
1.3.1 纳米酶颗粒的制备
1.3.1.1 钯@铂纳米酶
取20 mg Pluronic F127超声溶解于含有1.8 mL 20 mmol/L的K2PtCl4、0.2 mL 20 mmol/L的Na2PdCl4以及44 μL 6 mol/L的HCl的水溶液中。随后加入2 mL 100 mmol/L的抗坏血酸超声处理4 h至溶液均匀分散[19]。
1.3.1.2 金@铂纳米酶
取20 mg Pluronic F127超声溶解于含有1.8 mL 20 mmol/L的K2PtCl4、0.2 mL 20 mmol/L的HAuCl4以及44 μL 6 mol/L的HCl水溶液中。随后加入2 mL 100 mmol/L的抗坏血酸超声处理4 h至溶液均匀分散。
1.3.1.3 金-钯-铂纳米酶
取20 mg Pluronic F127超声溶解于含有0.2 mL 20 mmol/L的HAuCl4、0.2 mL 20 mmol/L的Na2PdCl4、1.8 mL 20 mmol/L的 K2PtCl4以及44 μL 6 mol/L的HCl的水溶液中。随后加入2 mL 100 mmol/L的抗坏血酸超声处理4 h至溶液均匀分散。
1.3.2 纳米酶的类过氧化物酶动力学测试
部分纳米材料具有类过氧化物酶活性,可以催化H2O2产生羟自由基将TMB氧化为氧化态TMB(oxTMB),其在652 nm波长处有最大紫外吸收峰[20-21]。具有类过氧化物酶活性的纳米材料的酶活动力学遵循Michaelis-Menten方程:v=vmax[S]/(Km+[S]),其中,v表示反应速率,[S]表示底物浓度,vmax表示反应的最大速率;Km表示米氏常数。采用标准检测方法测试得到不同时间下反应溶液在652 nm的吸光度,进行非线性方程拟合,计算得到Km,以判断纳米酶与底物亲和力的大小。Km值小,表示用很低的底物浓度即可达到最大反应速度的一半,说明酶与底物亲和力大。
将1.3.1节中已制备好的3 种纳米酶材料超声1 h至均匀分散后进行百倍稀释。取10 μL百倍稀释的纳米酶溶液、32 μL 30%的H2O2和不同体积的20 mmol/L TMB的二甲基亚砜溶液溶于pH 4.6的醋酸缓冲液中,配制成200 μL反应体系,使体系TMB浓度分别为0.025、0.05、0.1、0.2、0.4、0.8、1.6、3.2、6.4、12.8 mmol/L。检测加入纳米酶后,反应体系在652 nm条件下吸光度在反应前后60 s的变化。应用GraphPad Prism 9.3.0软件拟合米氏方程得到两个关键参数米氏常数Km与反应的最大速度vmax以分析纳米酶的类过氧化物酶活性[22]。
1.3.3 纳米酶的类过氧化物酶活性测试
纳米酶的类过氧化物酶活性主要通过比色法分析。依据bnanozyme=V/(ε×l)×(ΔA/Δt),ananozyme=bnanozyme/[m]计算纳米材料类过氧化物酶活性。一个b单位定义为在37 ℃每分钟催化生成1 μmol产物的纳米酶量;V为反应溶液总体积(μL);ε为反应产物的摩尔吸收系数(39 000 L/(mol•cm));L为光程,本实验中为0.622 cm;ΔA为吸光度变化值,ΔA/Δt为652 nm处吸光度的初始变化率(min-1),以计算纳米酶活性ananozyme,[m]为换算的纳米酶质量(mg)。通过计算即可得到3 种纳米酶活性ananozyme[22]。
将3 种纳米酶材料超声1 h以混匀。分别取3 种纳米材料各1.5 mL,于15 000 r/min离心15 min,弃去上清液,干燥至呈干粉状,称量,测得3 种纳米材料的质量。
将32 μL 30%的H2O2、32 μL 20 mmol/L的TMB的二甲基亚砜溶液和不同体积的百倍稀释纳米酶溶液溶于pH 4.6的醋酸缓冲液中,配制成200 μL溶液,使纳米材料体积分数分别为0%、0.05%、0.1%、0.2%、0.4%、0.8%、1.6%。检测加入纳米酶后反应体系在652 nm波长处吸光度的变化,每10 s测一次,共检测400 s。
1.3.4 pH值对纳米酶催化活性的影响
经1.3.2节及1.3.3节两步骤筛选出一种类过氧化物酶活性最佳的纳米酶材料用于后续实验。将32 μL 30%的H2O2、32 μL 20 mmol/L的TMB的二甲基亚砜溶液,16 μL百倍稀释的催化效果最佳的纳米酶溶液、溶于pH值分别为2.6、3.6、4.6、5.6、6.6、7.6、8.6、9.6的醋酸盐缓冲液中,配制成200 μL溶液。检测加入纳米酶后反应体系在652 nm的吸光度变化,pH值对催化效果最佳的纳米酶材料活性的影响并筛选出最佳反应pH值。
1.3.5 温度对纳米酶催化活性的影响
将32 μL 30%的H2O2、32 μL 20 mmol/L的TMB的二甲基亚砜溶液,16 μL百倍稀释的催化效果最佳的纳米酶溶液、溶于120 μL pH 4.6的醋酸-醋酸盐缓冲液中,配制成200 μL溶液。检测加入纳米酶后反应体系在4、25、35、45、55、65 ℃,652 nm条件下反应60 s前后的吸光度的变化,温度对催化效果最佳的纳米酶材料活性的影响并筛选出最佳反应温度。
1.3.6 过氧化氢残留快速检测试纸的制备
首先,将纳米酶材料、TMB溶液及醋酸-醋酸盐缓冲溶液混合制成纳米酶显色溶液;其次,将Whatman No.1滤纸裁剪成10 cm×10 cm的小块浸泡在装有纳米酶显色液密闭培养皿中10 s后放入已预热至50 ℃烘箱中恒温烘干;最后,采用打孔器将烘干后的试纸打孔制成直径为6 mm的活性试纸片,制成呈现均匀白色的过氧化氢残留快速检测试纸。
1.3.7 显色液中TMB质量浓度对显色结果的影响
将25 μL催化效果最佳的纳米酶材料与不同体积20 mmol/L的TMB的二甲基亚砜溶液溶于pH 4.6的醋酸缓冲液中,制成TMB质量浓度分别为0、0.036、0.072、0.108、0.144、0.180、0.216 mg/mL的显色液。采用
1.3.6节中方法制备过氧化氢残留快速检测试纸。使用不同TMB质量浓度梯度的试纸片对10 μL 30%的H2O2标准液进行检测,以筛选出最佳的显色液TMB质量浓度。用智能手机拍摄得到试纸的显色情况进行定性分析,使用Image J软件进行灰度定量分析,通过定性定量分析选出显色液的最佳TMB质量浓度[23-24]。
1.3.8 显色液中纳米酶质量浓度对显色结果的影响
将不同体积催化效果最佳的纳米酶材料溶于60 μL 20 mmol/L的TMB溶液与pH 4.6的醋酸-醋酸盐缓冲液的混合溶液中,制成催化效果最佳的纳米酶质量浓度分别为0、0.004 5、0.013 5、0.018 0、0.022 5、0.027 0、0.031 5 mg/mL的显色液。采用1.3.6节中方法制备过氧化氢残留快速检测试纸。使用不同催化效果最佳的纳米酶质量浓度梯度的试纸片对10 μL 30%的H2O2标准液进行检测,以筛选出最佳的显色液纳米材料质量浓度。用智能手机拍摄得到试纸的显色情况进行定性分析,使用Image J软件进行灰度定量分析,通过定性定量分析选出显色液的最佳纳米酶质量浓度。
1.3.9 试纸在显色液中浸泡时间对显色结果的影响
以1.3.7节和1.3.8节两步骤所得最佳条件制备纳米酶显色液,将Whatman No.1滤纸裁剪成10 cm×10 cm小块纸片浸泡在装有纳米酶显色液密闭培养皿中,分别浸泡10、20、30、40、50、60 s后放入已预热至50 ℃烘箱中恒温烘干;采用打孔器将烘干后的试纸打孔制成直径为6 mm的活性试纸片,制成呈现均匀白色的过氧化氢残留快速检测试纸。使用不同显色液浸泡时间的试纸片对10 μL 30%的H2O2标准液进行检测,用智能手机拍摄得到试纸的显色情况进行定性分析,使用Image J软件进行灰度定量分析,通过定性定量分析选出显色液的最佳TMB浓度。
1.3.10 试纸检测时间对显色结果的影响
以1.3.7~1.3.9节所得最佳条件制备过氧化快速检测试纸片,使用10 μL 30%的H2O2标准液对其进行检测,使用智能手机拍摄记录试纸显色情况随检测时间的变化,每30 s记录一次,使用Image J软件进行灰度定量分析,通过定性定量分析选出最佳的试纸检测时间。
1.3.11 试纸检测灵敏度的测试
以1.3.7~1.3.9节所得最佳条件制备过氧化快速检测试纸片,配制浓度为0.1~10 mmol/L的过氧化氢标准溶液,测试试纸的灵敏度,同时建立一定过氧化氢浓度范围内过氧化氢浓度与试纸显色后灰度值的定量关系。
1.3.12 试纸检测特异性的测试
以1.3.7~1.3.9节所得最佳条件制备过氧化快速检测试纸片,选取过氧化氢检测中常见的几种干扰物质:柠檬酸、抗坏血酸、葡萄糖、山梨酸钾、Zn2+、Mn2+,均配制成1 mol/L溶液进行试纸的特异性测试,以1 mol/L过氧化氢标准溶液作为阳性对照,醋酸盐缓冲液作为阴性对照观察试纸的颜色变化,测试所制备试纸的特异性[25-27]。
1.3.13 试纸实际样品的检测
选取市面常见可能存在过氧化氢残留的泡椒类食品:A品牌脆嫩笋尖(泡椒味)、B品牌山椒笋尖、C品牌脆笋(泡椒味)、D品牌脆泡猪皮、E品牌野山椒凤爪、F品牌泡椒凤爪、G品牌山椒味凤爪进行实际样品检测。均称取各样品可食部位混合物5 g溶于50 mL水中制成实际样品提取液,在最佳实验条件下进行检测。
1.3.14 试纸阴性样品的加标回收实验
将过氧化氢标准溶液加到过氧化氢检测结果阴性的实际样品液中,配制成浓度分别等同于0.05、0.1、0.2 mmol/L的加标样品液。在最佳实验条件下测试其过氧化氢残留量。用智能手机拍摄得到试纸的显色情况进行定性分析,使用Image J软件进行灰度定量分析,与建立的过氧化氢浓度——试纸颜色(灰度值)定量数学模型进行比对,计算回收率。
2 结果与分析
2.1 纳米酶的制备与表征
制备钯@铂纳米酶、金@铂纳米酶、金-钯-铂纳米酶3 种纳米酶,通过电子显微镜观察其形貌(图1)。钯@铂纳米酶平均直径约为30 nm,金@铂纳米酶平均直径约为20 nm,金-钯-铂纳米酶平均直径约为35 nm。3 种纳米酶形态均具有高度枝状和介孔性质,均匀分布在纳米晶表面形成了特殊的分散结构。
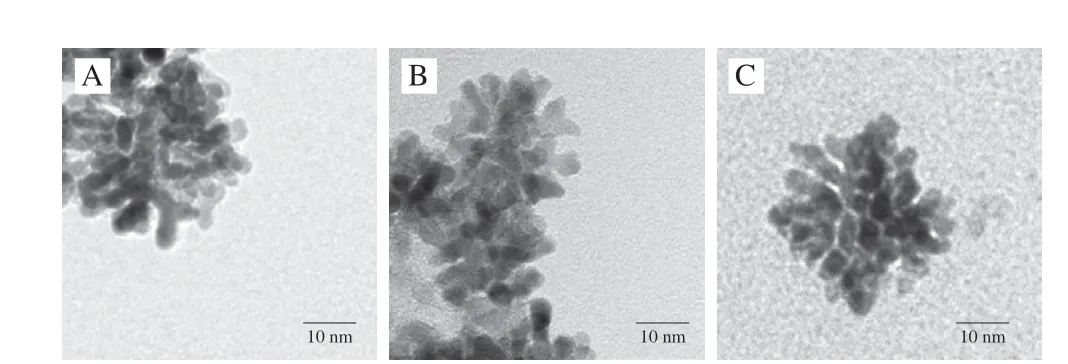
图1 纳米酶的电子显微镜图像Fig.1 Transmission electron microscopic images of nanozymes
2.2 纳米酶类酶动力学评价
测试钯@铂纳米酶、金@铂纳米酶、金-钯-铂纳米酶3 种纳米酶的类酶动力学,拟合得到3 种纳米酶的米氏常数曲线,综合比较3 种纳米材料的动力学常数可以得出,相同测试条件下钯@铂纳米酶与金@铂纳米酶的Km相近,高于金-钯-铂纳米酶,且金@铂纳米酶的vmax最大。表明钯@铂纳米酶与金@铂纳米酶类过氧化物酶活性较优(图2)。
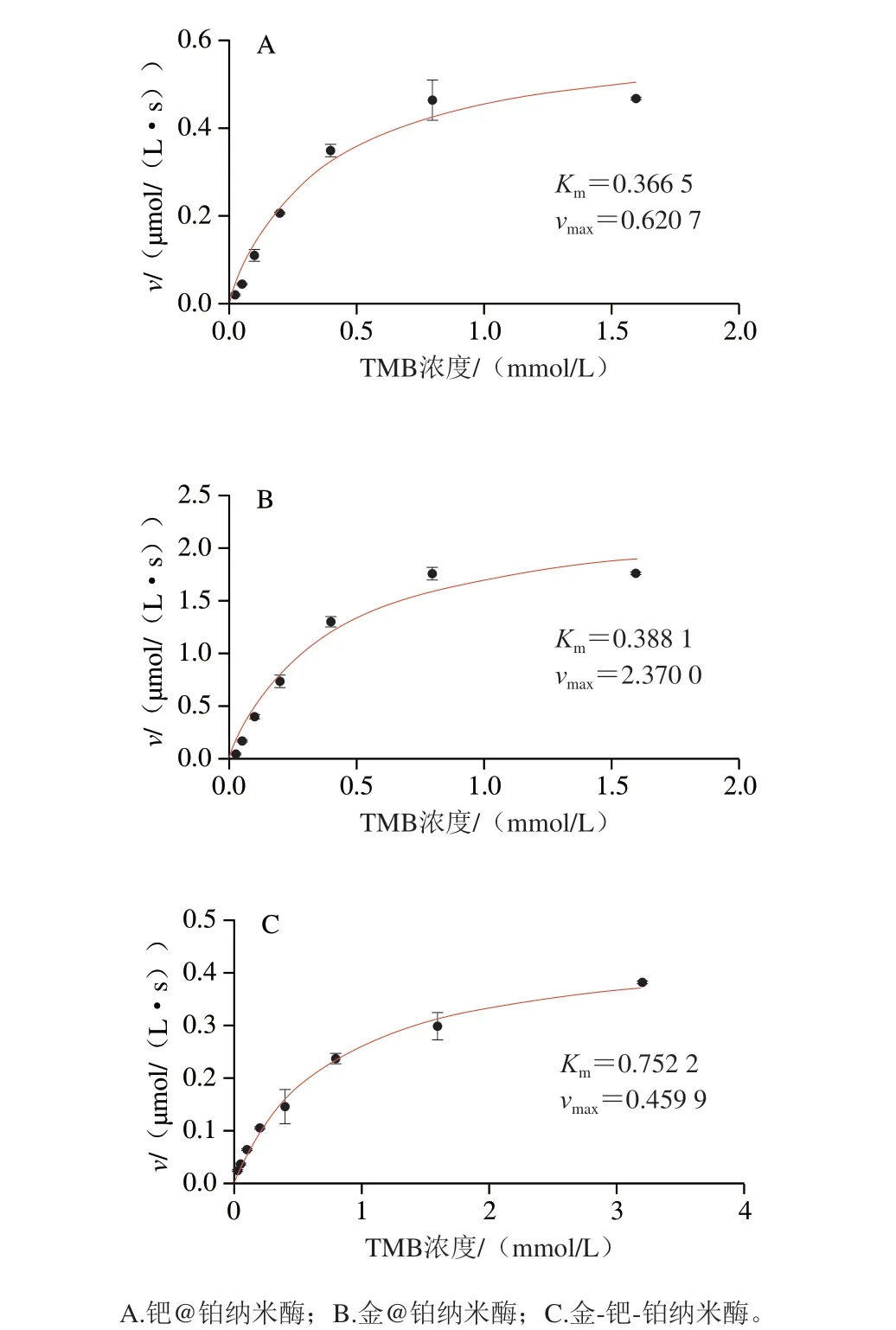
图2 纳米酶米氏方程拟合结果Fig.2 Michaelis-Menten plots of nanozymes
2.3 纳米酶类过氧化物酶活性测试
通过测定3 种纳米材料类酶活性可以得出,金@铂纳米酶活性为27.538 U/mg,钯@铂纳米酶和金-钯-铂纳米酶活性分别为4.233 U/mg和3.955 U/mg(图3C),金@铂纳米酶活性最强。综合米氏方程拟合结果选择出活性最优的纳米酶,即金@铂纳米酶用于后续过氧化氢快速检测试纸的制备。

图3 纳米酶类酶活性Fig.3 Catalytic activity of nanozymes
2.4 反应温度及pH值对纳米酶催化活性的影响
如图4所示,温度对纳米酶的活性影响较小,在所测温度范围内,纳米酶始终保持着较优的活性,均在60%~100%相对活性范围内波动,且在30~50 ℃间有最大催化活性,因此得出37 ℃为反应最适温度(图4A)。相较于温度对纳米酶催化活性的影响,pH值对纳米酶催化活性的影响更加显著,当pH 4.6时,金@铂纳米酶有最大的催化活性,当pH值高于6.6时,酶几乎失去催化活性,因此得出pH 4.6为反应最适pH值(图4B)。
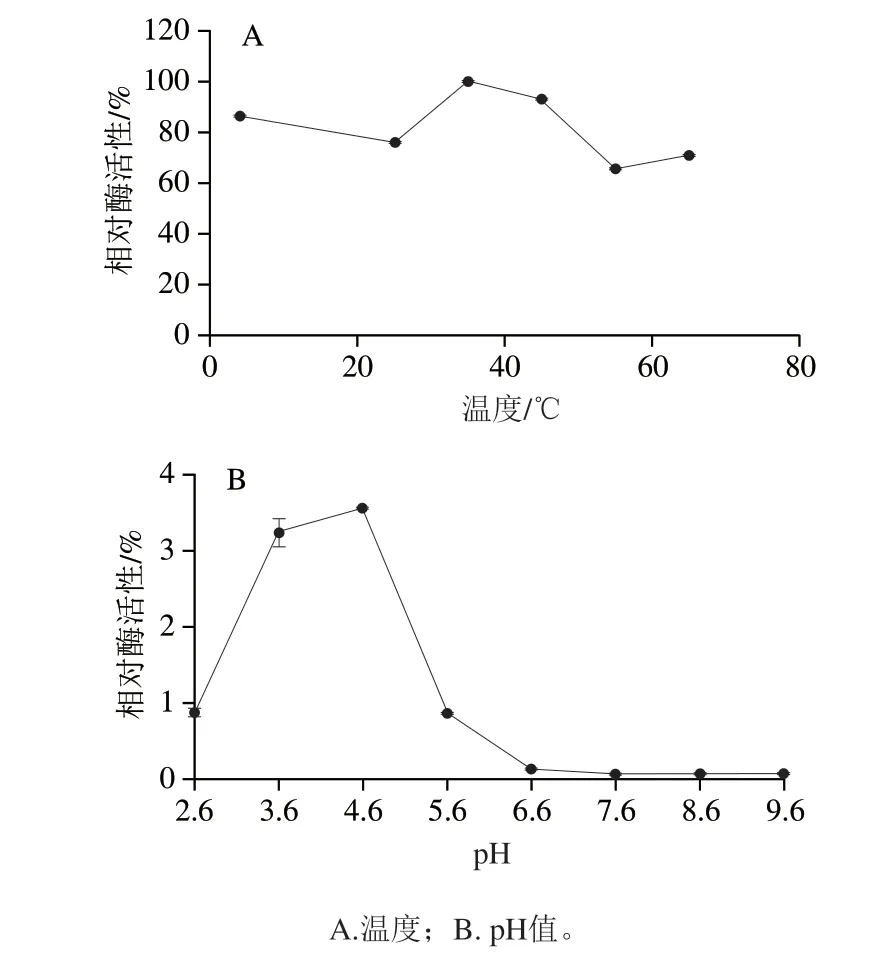
图4 环境因素对纳米酶催化活性的影响Fig.4 Effects of environmental factors on catalytic activity of nanozymes
2.5 显色液成分优化
随着TMB添加量的加大,显色效果更加明显,利于肉眼观察,但是高质量浓度TMB的试纸很容易被空气氧化变色而使试纸失去其使用效果(图5A)。综合考虑,TMB在显色液中的最佳质量浓度为0.18 mg/mL。此质量浓度制成的试纸为均匀的白色,且响应迅速,梯度明显。

图5 显色液组分对试纸显色结果的影响Fig.5 Effect of TMB and nanozyme concentrations on results of color development
随着金@铂纳米酶添加量的加大,在较低浓度条件下,试纸的显色程度会更加明显,但是当金@铂纳米酶大于0.018 mg/mL后,增加金@铂纳米酶浓度对试纸的显色程度几乎无影响,金@铂纳米酶此时浓度已经达到饱和(图5B)。综合考虑,金@铂纳米酶在显色液中的最佳质量浓度为0.018 mg/mL。
2.6 试纸工艺优化
试纸在显色液中浸泡时间超过10 s后,随着浸泡时间的延长,试纸显色程度无明显变化,无需再延长浸泡时间;当浸泡时间小于10 s时,肉眼观察到试纸未浸透(图6A)。因此,选择10 s为试纸在显色液中的最佳浸泡时间。

图6 试纸工艺优化结果Fig.6 Results of optimization of soaking and reaction time of test strip
随着过氧化氢与试纸反应时间的延长,在3 min内,试纸显色效果逐渐明显。当反应时间超过3 min后,显色深浅程度在一段时间内几乎不变,当反应时间超过8 min后显色效果随反应时间延长逐渐下降,确定3 min为试纸与过氧化氢反应的最快稳定时间(图6B)。后续检测中选择3 min为试纸与过氧化氢的反应时间。
2.7 试纸性能测试
2.7.1 灵敏度测试
当过氧化氢标准液浓度大于或等于0.01 mmol/L,即0.34 mg/kg时,肉眼可以很容易辨别试纸呈现的蓝色。因此,最终确定试纸的灵敏度为0.01 mmol/L(图7)。当过氧化氢标准液浓度为0.05~0.5 mmol/L时,试纸显色灰度值与过氧化氢浓度有较好的线性关系(R2=0.993 1),拟合得到过氧化氢浓度——试纸颜色(灰度值)定量数学模型:y=17 735x+3 028.4,可用来进行过氧化氢的定量检测,过氧化氢快速检测试纸的比色卡见图8。

图7 试纸灵敏度测试Fig.7 Sensitivity of test strip
2.7.2 特异性测试结果
柠檬酸、抗坏血酸、葡萄糖、山梨酸钾、Zn2+对试纸均无阳性响应,而Mn2+则会使试纸呈现灰色(表1)。

表1 试纸特异性测试结果Table 1 Specificity of test strip
2.8 试纸性能测试结果
7 种样品检验时与空白对照均无差异(表2),均未检出过氧化氢,对样品进行阴性加标实验,回收率为93.10%~108.63%(表3)。

表2 实际样品测试结果Table 2 Results of test strips for actual samples
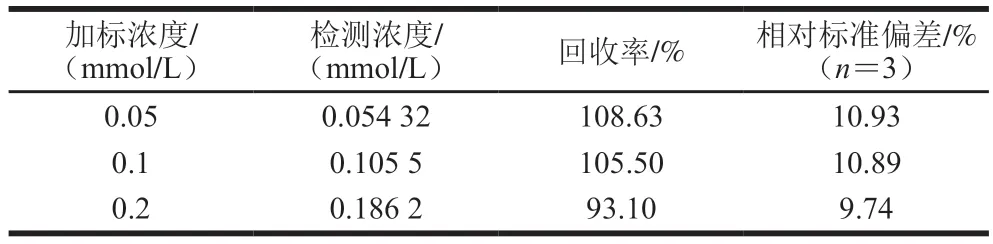
表3 泡椒凤爪实际样品阴性加标回收实验Table 3 Recoveries of spiked negative chicken feet with pickled pepper
3 讨 论
目前对于过氧化氢的检测方法主要包括滴定分析法、比色分析法、化学发光法和电化学分析法等[28-31]。常见的滴定分析法包括碘量法和高锰酸钾滴定法,其作为一种广泛应用的经典方法具有较为精确快捷等优点,碘量法是现行的国家标准中规定的食品中过氧化氢残留量的测定方法,但滴定分析法受操作人员及环境影响较大且操作繁琐[28-29]。传统的比色法如钛盐比色法同样是国标中规定的食品中过氧化氢残留量的测定方法,其检测精确,不易受钙铁离子及其他过氧化物的影响,但需要浓硫酸以提供强酸性环境、耗费时间较长、浓硫酸的使用会干扰某些体系的检测以及需要依靠分光光度计检测等弊端[28-29]。化学发光法本身的分析选择性较差,不适用于分析复杂样品和同时检测多种待测物,从而局限了其应用范围,常与毛细管电泳、高效液相色谱等联用以满足实际检测需要,仪器昂贵且操作也较为复杂[30-31]。相较于以上方法,试纸法具有灵敏、快速、便携、样品用量小且能够短时间批量检测等优点,本研究中的金@铂纳米酶过氧化氢残留快速检测试纸替代了传统HRP作为生物活性物质进行检测,对温度、pH值等外界因素影响的抗性提高,是一种稳定性更好的新型检测技术,适用于实验室的初筛及现场大样本测定监督,但多用于半定量和定性检测,检测精确度仍待提高。
4 结 论
本研究制备的试纸在具有类过氧化物酶活性的金@铂纳米材料作用下,检测过氧化氢时能够将无色物质TMB氧化成为蓝色物质oxTMB,从而实现过氧化氢的比色法检测。基于上述原理,本研究建立了一种以金@铂纳米材料类过氧化物酶活性为基础的可视化半定量过氧化氢快速检测试纸,该试纸可以在3 min内对样品中过氧化氢残留量进行快速检测,检出限为0.34 mg/kg。通过在泡椒鸡爪中加入不同浓度的过氧化氢测定其回收率,结果表明该试纸准确性高、检测速度快、无需复杂的样品处理,具有应用于食品残留过氧化氢快速现场检测中的潜力。
