GC-MS/MS法测定猪肉中二噁英及二噁英类多氯联苯
2023-10-21焦艳娜申甜甜朱绍华付善良
陆 静,焦艳娜,成 婧,申甜甜,朱绍华,付善良*
(长沙海关技术中心,食品安全科学技术湖南省重点实验室,湖南 长沙 410004)
二噁英属于多氯取代的芳香烃族化合物,是多氯代二苯并-对-二噁英(polychlorinateddibenzop-d i o x i n s,P C D D s)、多氯代二苯并呋喃(polychlomateddibenzofurans,PCDFs)和共平面多氯联苯的统称[1-3]。其中,2,3,7,8-四氯代苯并二噁英(2,3,7,8-tetrachlorinated dibenzo-p-dioxin,TCDD)是迄今为止发现毒性最强的化合物,比氰化钾要毒100 倍以上;TCDD已经被世界卫生组织判定为一级致癌物,具有生殖毒性、神经毒性、内分泌毒性和免疫毒性效应等[2,4]。二噁英类物质毒性的另一个特点是,二噁英为脂溶性化合物,易积累在生物体的脂肪组织中,不易被降解和排出,可以在人和动物体内不断蓄积达到较高浓度,在生物体表现出明显的症状之前有一个漫长的潜伏过程[5-7]。
近年来,我国肉类产品进口和消费快速增长,肉类进口来源也呈现多元化。湖南作为肉类产品消费大省,每年肉类消费都在80万 t以上,对进口的肉类需求也在逐年增加,每年需求量达到40万 t以上[8]。李云秀等[9]对我国部分地区的猪肉和猪肝中的二噁英污染状况进行调研和风险评估,肉类中二噁英的污染受到了不少专家学者的关注。目前,国内还没有二噁英类物质的限量标准,根据(EU)2022/2002欧盟食品污染物限量标准[10],猪肉中二噁英总和的最高限量值为1.0 pg/g(以脂肪计)。
二噁英分析属于超痕量、多组分分析,其分析测定必须具备有效的提取和净化技术、异构体的高效分离定性定量、良好的质量管理等技术条件[11-12]。且同位素稀释内标法是国际上通用的测定食品、饲料及环境样品中二噁英质量浓度的方法。自2014年6月起,气相色谱-串联质谱(gas chromatography-tandem mass spectrometry,GC-MS/MS)成为欧盟委员会(EU)规程2017/644中的一项确证方法[13]。目前,GC-MS/MS法已广泛用于食品、饲料及环境样品中二噁英(dioxins,PCDD/Fs)及二噁英类多氯联苯(dioxin like polychlorinated biphenyls,DL-PCBs)的检测[14-17]。同时,不少学者和专家对比研究了该2 种仪器在检测PCDD/Fs的区别。Sun Huizhong等[18]对鱼、牛肉以及玉米饲料3 种基质中的PCDD/Fs浓度进行GC-MS/MS和高分辨气相色谱-高分辨质谱(high resolution gas chromatography-high resolution mass spectrometry,HRGC-HRMS)仪器比对检测,检出含量为0.9~9.0 pg/g,2 种仪器的测定偏差为0.7%~14%。猪肉中的脂肪含量较高,而二噁英检测的一大难点是对脂肪的提取和去除,以降低背景检测干扰,提高检测的准确度[19]。凝胶渗透色谱(gel permeation chromatography,GPC)作为除脂的常用方法和手段,在肉类食品检测中发挥着重要作用[20-22],然而作为超痕量的二噁英检测,GPC的相关使用报道较少,我国也只是在相关标准中推荐使用[23-24]。本实验拟对猪肉基质中的二噁英相关检测前处理方法进行探讨和优化,开发一种适合肉类食品中PCDD/Fs和DL-PCBs检测的GC-MS/MS方法,对推动和保障动物源性食品的顺利出口具有重要意义。
1 材料与方法
1.1 材料、试剂与仪器
猪肉从当地市场购买。肉样搅碎后以冷冻干燥机干燥,计算含水量,混匀备用。
二氯甲烷、甲苯、乙酸乙酯、正己烷(均为农残级)iMagiLab公司;硅胶(农残级) 加拿大Silicycle公司;浓硫酸、无水硫酸钠(均为优级纯) 国药集团化学试剂有限公司;多层硅胶柱、碱性氧化铝柱、活性炭柱 美国FMS公司。
分离度检查标准溶液、回收率和精密度检查标准溶液、同位素标记定量内标标准溶液、回收率内标标准溶液、含有天然和同位素标记的系列校正标准曲线标准溶液(浓度同国家标准中规定[25])购于加拿大Wellington Laboratories公司;临用时取20 μL于进样小瓶中,备用。硅胶使用前分别用甲醇和二氯甲烷清洗,晾干后在180 ℃烘烤2 h,备用。然后以浓硫酸进行酸化,配制成质量分数为44%的酸化硅胶。
GC-MSTQ8050型气相色谱-三重四极杆串联质谱仪日本岛津公司;J2 GPC仪、Bio Beads S-X3净化柱(700 mm×25 mm) 美国Scientific公司;R-300旋转蒸发仪 瑞士步琦公司;JF-602全自动样品净化系统北京普立泰科公司;DC801冷冻干燥机 日本雅马拓公司。
1.2 方法
1.2.1 样品前处理
1.2.1.1 提取
提取前,在索氏提取器中装入一支空的玻璃纤维素提取套筒,以正己烷-二氯甲烷(1∶1,V/V)为提取溶剂,预提取8~12 h,浓缩上机测定,直至仪器未检测到本底值。
称取8.0 g冷冻干燥后的样品,加无水硫酸钠研磨,制成能自由流动的粉末。将粉末全部转移至处理好的提取套筒内,加入13C12-PCDD/Fs和13C12-DL-PCBs标记的定量内标溶液(GB 5009.205—2013《食品中二噁英及其类似物毒性当量的测定》附录B.2和B.8(稀释10 倍))各20 μL,用玻璃棉盖住样品,装入索氏提取器,以正己烷-二氯甲烷(1∶1,V/V)为提取溶剂提取18~24 h。提取完成后,将提取溶液转移至茄形瓶中,旋转蒸发至近干,恒质量,计算前后平底烧瓶质量差,得到脂肪含量。
1.2.1.2 净化
将提取液转移至圆底烧瓶中,旋转蒸发浓缩至近干,加入100 mL正己烷,50 g酸化硅胶,用旋转蒸发仪在70 ℃条件下旋转加热20 min。静置8~10 min后,将正己烷倒入圆底烧瓶中。再用50 mL正己烷清洗瓶中的酸化硅胶,合并上清液至茄形瓶中,重复3 次。用旋转蒸发仪浓缩至2~5 mL。将多层硅胶柱、碱性氧化铝柱和活性炭柱按顺序接在全自动样品净化系统上,按照洗脱程序顺序洗脱,对样品进行上样、净化、分离,分别收集含PCDD/Fs和DL-PCBs组分的洗脱液,用旋转蒸发仪浓缩至3~5 mL。
将上述浓缩液转移至氮吹浓缩管中,氮吹浓缩到1~2 mL,氮气流下转移至微量进样小瓶中,用正己烷洗涤氮吹管,一并转入进样瓶浓缩到约20 μL。加入PCDD/Fs回收率内标标准溶液(GB 5009.205—2013附录B.3)10 μL和DL-PCBs回收率内标标准溶液(GB 5009.205—2013附录B.10(稀释100 倍),异辛烷)40 μL,继续在微小氮气流下浓缩至约20 μL。先进行PCDD/Fs的测定,完成后将其和DL-PCBs的溶液合并,氮吹至约20 μL,进行DL-PCBs的检测。如果样品当日不进行仪器分析,则于-10 ℃下避光保存。
1.2.2 仪器分析条件
PCDD/Fs测定条件:S H-R x i-5 S i l M S 色谱柱(60 m×0.25 mm,0.25 μm);进样口温度280 ℃;柱升温程序:初始温度1 2 0 ℃,保持1.0 m i n,以43 ℃/min升温至220 ℃,保持15 min,再以2.3 ℃/min升温至250 ℃,以0.9 ℃/min升温至260 ℃,以20 ℃/min升温至310 ℃,保持9 min;接口温度290 ℃;载气为氦气(纯度不小于99.999%),流量为1 mL/min,恒流模式;电子电离源;温度230 ℃;电离能量70 eV。进样量2 μL;溶剂延迟时间4.5 min。
DL-PCBs测定条件:S H-R x i-5 S i l M S 色谱柱(60 m×0.25 mm,0.25 μm);进样口温度290 ℃;柱升温程序:初始温度8 0 ℃,保持2.0 m i n,以15 ℃/min升温至150 ℃,以2.5 ℃/min升温至270 ℃,保持3 min,以15 ℃/min升温至310 ℃,保持3 min;接口温度290 ℃;载气为氦气(纯度不小于99.999%),流量为1.2 mL/min,恒流模式;电子电离源;温度230 ℃,电离能量70 eV。进样量1 μL;溶剂延迟时间6.0 min。
采集方式:多反应离子监测模式,母离子/子离子对及其碰撞能量见表1,各化合物的总离子流图见图1。
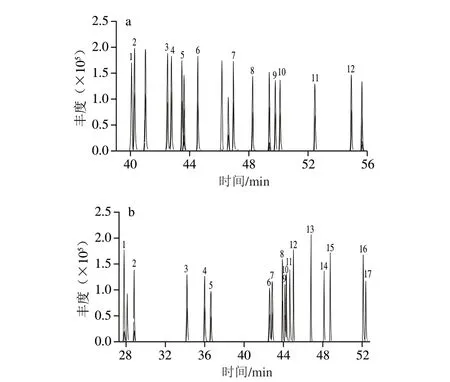
图1 二噁英类化合物校正标准溶液的总离子流图Fig.1 Total ion current chromatograms of DL-PCBs and PCDD/Fs standards
2 结果与分析
2.1 凝胶色谱除脂条件优化
先称取1 g的猪脂肪溶于5 mL的环己烷-乙酸乙酯(1∶1,V/V)溶液中,考察脂肪的出峰时间,见图2a。再于5 mL的环己烷-乙酸乙酯(1∶1,V/V)溶液中加入5 ng的DL-PCBs,考察目标物的出峰时间,见图2b。最后于含有猪脂肪的5 mL环己烷-乙酸乙酯(1∶1,V/V)溶液中加入5 ng DL-PCBs,考察目标物的收集时间段,见图2c。如图2所示,猪脂肪出峰时间为4~7.5 min,杂质峰出峰时间为7.5~10 min,DL-PCBs出峰时间为9.5~13 min,因此目标物的收集时间为8~13 min,则凝胶色谱条件为:上样量5 mL,流速5 mL/min,收集8~20 min的组分。
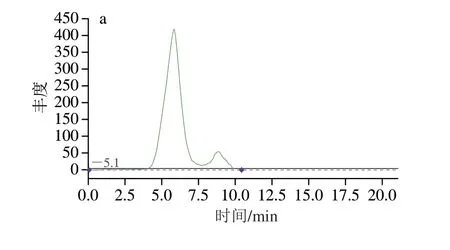
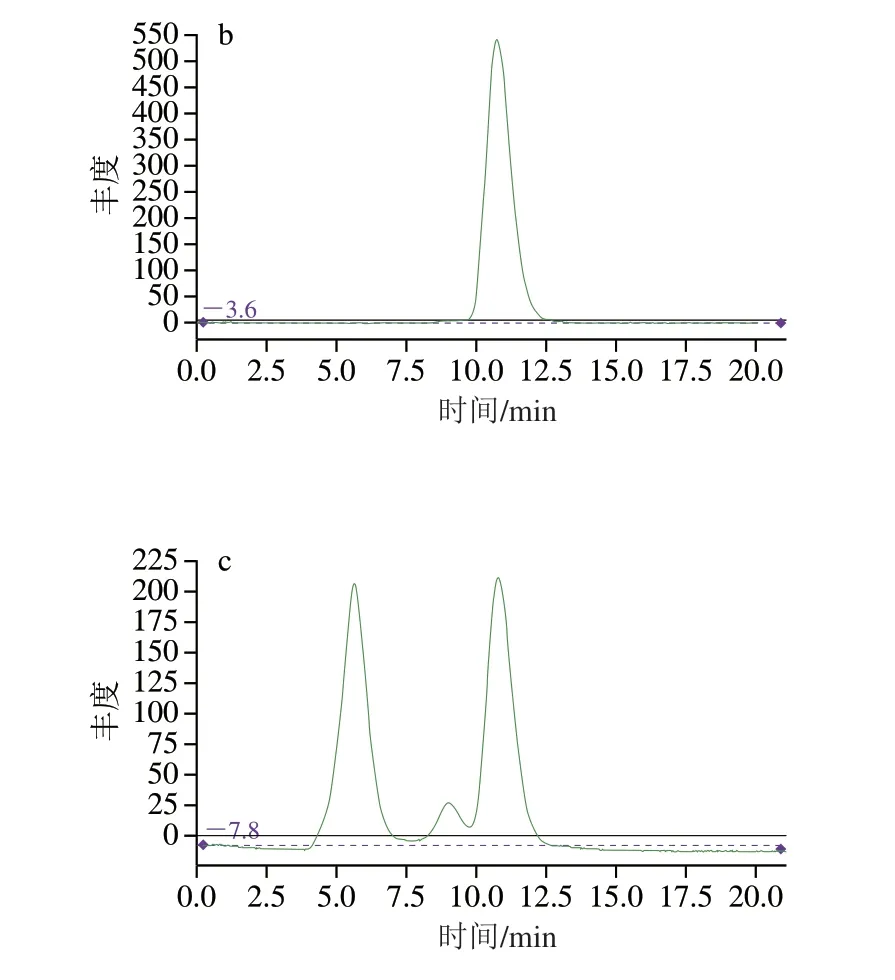
图2 猪脂肪样品GPC出峰图Fig.2 GPC chromatograms of pork fat
2.2 凝胶色谱在二噁英里的应用
取经索氏提取后的猪脂肪2 g,以5 mL的乙酸乙酯-环己烷(1∶1,V/V)溶解,加入DL-PCBs回收率和精密度检查标准溶液,13C12-DL-PCBs标记的定量内标溶液,用GPC净化除脂,收集8~20 min的组分,得到的GPC净化图(图3)。经旋转蒸发仪浓缩和氮吹浓缩后有约20 μL的肉眼可见油层,然后酸化硅胶净化1 次,浓缩后加入回收率内标溶液,进样测定。回收率情况见图4,DL-PCBs的回收率为88.3%~120.1%,而内标的回收率只有42.1%~48.5%。可见直接以GPC进行除脂净化,色谱柱容易出现饱和状态,目标物出现跟脂肪分子重叠交叉流出的情况,导致脂肪没有完全去除,从而干扰样品的结果测定,同时也说明后续必须以多层硅胶柱、碱性氧化铝柱和活性炭柱进一步净化,以减少基质干扰[26-27]。

图4 猪肉脂肪以GPC除脂时DL-PCBs的回收率情况(n=3)Fig.4 Recoveries of DL-PCBs removed from pork fat by GPC (n = 3)
2.3 凝胶色谱除脂和酸化硅胶除脂的选择和对比
取猪脂肪2 g,分别加入PCDD/Fs和DL-PCBs的回收率和精密度检查标准溶液,13C12-PCDD/Fs和13C12-DLPCBs标记的定量内标溶液。先以酸化硅胶除脂3 次,再用GPC除脂,样液浓缩后以净化仪净化,最后浓缩、进样测定。同时取另一份猪脂肪2 g,酸化硅胶除脂3 次后直接以净化仪净化,没有用GPC除脂,其他操作同前。考察各物质的回收率情况见图5。可知,脂肪以酸化硅胶除脂3 次基本能够满足要求,如果再以GPC除一次脂肪,目标物反而有所损失,降低待测物的回收率。因此,实际测定时以酸化硅胶进行除脂操作。

图5 凝胶色谱除脂和酸化硅胶除脂的对比Fig.5 Comparison of degreasing by gel chromatography and acidified silica gel
前期实验结果发现GPC容易产生饱和现象而不能完全去除脂肪,因此,考察脂肪含量对酸化硅胶以及净化仪除脂时的过载现象。结果发现,当脂肪含量超过5 g时,用酸化硅胶除脂3 次后,虽然再没有出现使硅胶变色的情况(判定酸化硅胶除脂步骤已经完成)。但是经过净化仪净化后,DL-PCBs收集管浓缩后仍有40 μL左右的脂肪层,说明此时酸化硅胶除脂和净化仪除去脂肪部分都出现过载现象。因此,建议称样量(以脂肪计)为2~5 g。
2.4 方法的线性、检出限和回收率
将PCDD/Fs和DL-PCBs校正标准溶液分别按浓度由低到高的顺序注入GC-MS/MS中,得到峰面积。以目标物的含量为横坐标,峰面积为纵坐标,根据内标法定量,绘制标准曲线,求出线性相关方程,各物质的线性方程见表2,线性相关系数R2大于0.999,表明该方法在较宽的浓度范围内色谱峰面积与含量呈较好的线性关系。从表2可知,仪器测定时,各化合物的相对保留时间为1.000~1.001,符合国家标准的要求。相对响应因子(relative response fact,RRF)的相对标准偏差(relative standard deviation,RSD)为3.39%~16.22%,小于20%,符合国家标准对其小于20%的要求[25]。本实验采用添加标准物质的方法获得方法检出限,以空白猪肉为样品进行方法学验证,检出限的测定方法为以工作曲线最低点的浓度加标,然后测定7 组平行样的偏差,其中检出限为3 倍标准差,得到方法检出限[28],本方法中各目标物的检出限为0.020~0.172 ng/kg。
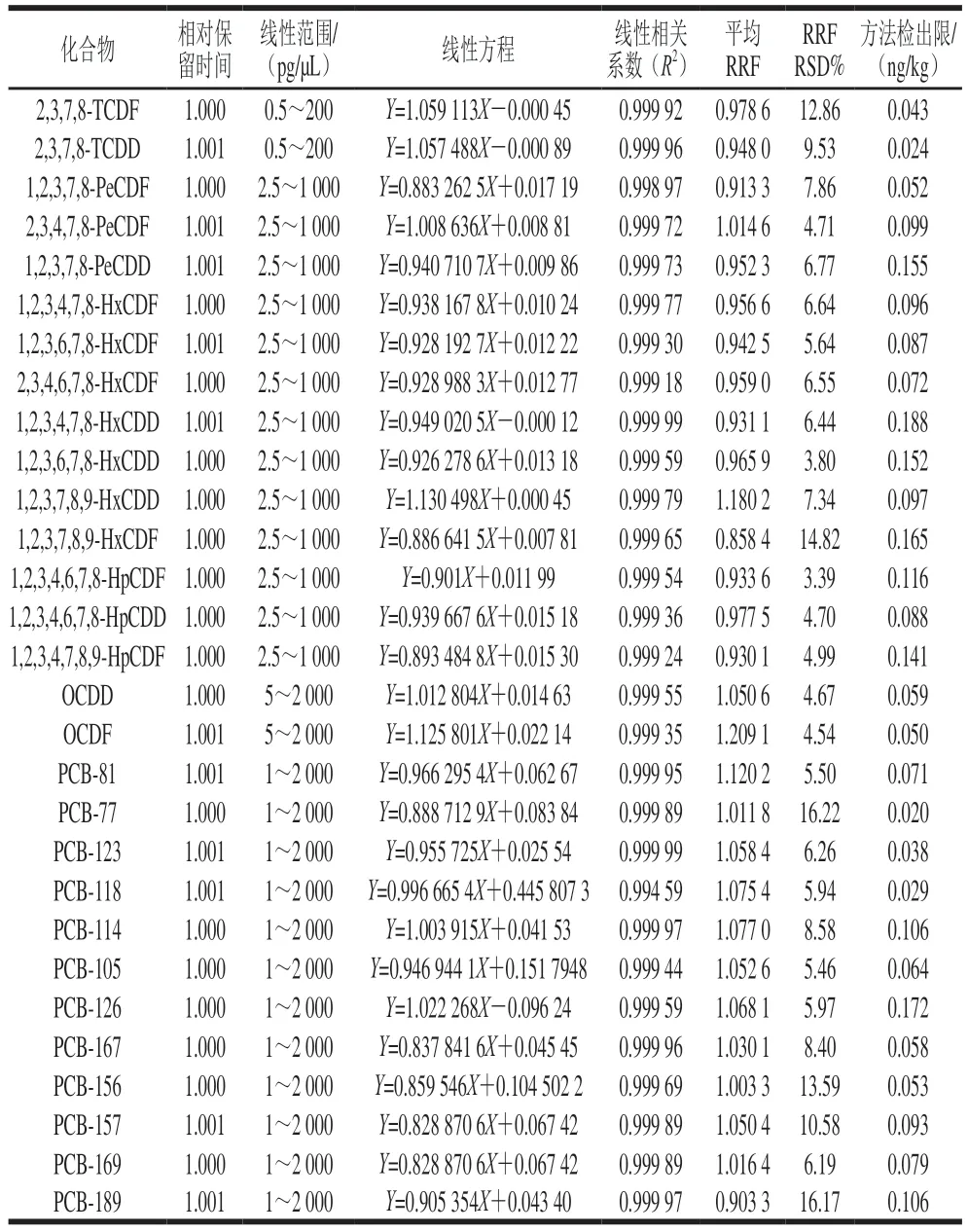
表2 PCDD/Fs和DL-PCBs的线性方程Table 2 Linear equations for quantitation of PCDD/Fs and DL-PCBs
以猪肉为例,进行分析过程的精密度和回收率实验,加入PCDD/Fs和DL-PCBs回收率和精密度标液(GB 5009.205—2013附录B.4(稀释10 倍)和B.11(稀释100 倍))各50 μL,按上述方法进行样品前处理并分析测定。同时将PCDD/F和DL-PCBs校正标准溶液分别按浓度由低到高的顺序注入GC-MS/MS中。以目标物的含量为横坐标,峰面积为纵坐标,绘制标准曲线,根据内标法定量。样品设3 组平行实验,得到的内标回收率结果见表3,目标物的回收率结果见表4。内标的回收率为45.3%~122.4%,RSD为1.0%~14.7%;目标物的回收率为64.9%~118.8%,RSD为1.1%~14.7%。因此,该方法准确可靠,符合标准的要求,可以满足实际猪肉样品中PCDD/Fs和DL-PCBs的测定要求。
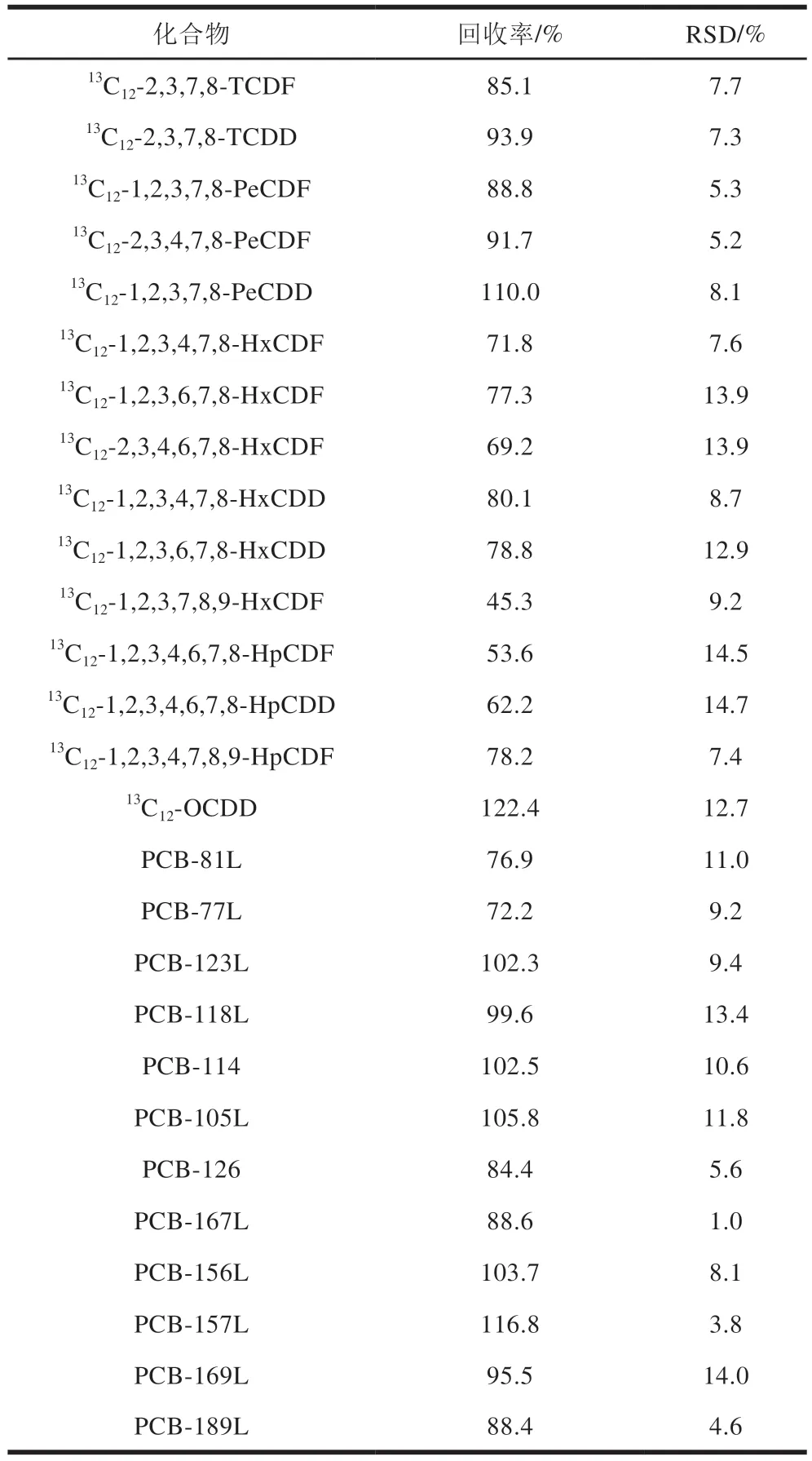
表3 猪肉样品中PCDD/Fs和DL-PCBs的内标回收率和RSD(n=3)Table 3 Recoveries and RSD of PCDD/Fs and DL-PCBs in pork (n = 3)
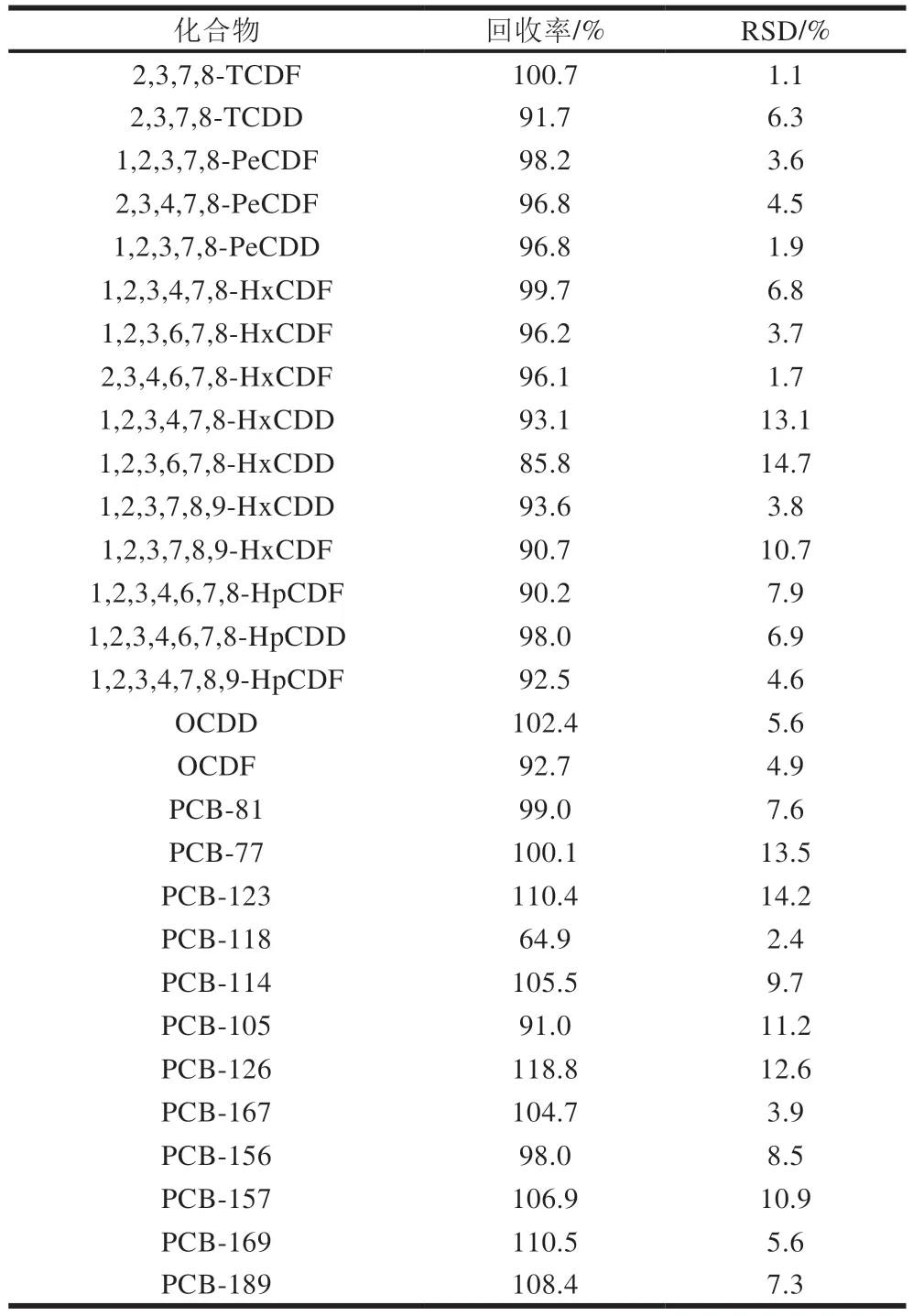
表4 猪肉样品中PCDD/Fs和DL-PCBs的回收率和RSD(n=3)Table 4 Recoveries and RSD of PCDD/Fs and DL-PCBs in pork (n = 3)
2.5 实验系统空白污染情况
二噁英检测属于超痕量分析,除了所用的试剂、耗材要保证符合要求外,实验所用的仪器、器皿都容易残留二噁英类物质,实验发现DL-PCBs较PCDD/PCDFs容易残留,这跟环境介质中普遍存在DL-PCBs有关[29],因而容易对实验过程造成污染。在样品测定前,需要对系统空白进行考察。二噁英检测前处理使用的仪器主要有快速溶剂萃取仪、索氏提取仪、全自动净化仪,以及旋转蒸发仪、氮吹仪等。快速溶剂萃取仪和全自动净化仪在样品测定后进行一次空白溶剂淋洗,基本可以将残留物去除。旋转蒸发仪在使用的过程中避免溶液爆沸;氮吹时避免氮吹针接触样液,且对氮吹管进行有机溶剂超声浸泡和常规清洗,针头现用现装,基本可以避免旋转蒸发仪和氮吹仪的污染。
玻璃器皿用完后当天进行清洗,先以洗涤剂进行清洗,自来水冲洗干净后,于超声波清洗器中超声5 min,取出分别以自来水、去离子冲洗干净,自然晾干。然后分别用丙酮、甲苯、正己烷、二氯甲烷各洗一遍,晾干备用。
在实验过程中发现,二噁英类化合物的残留主要集中在索氏提取仪,因此对其进行了较详细考察,实验选取索氏提取仪的4 个提取位置为对象。待进行一次常规样品提取后,首先以正己烷-二氯甲烷溶液(1∶1,V/V)加热循环80 次淋洗,浓缩后上机测定(编号分别为1-1、2-1、3-1、4-1),发现DL-PCBs有较高的残留。而PCDD/PCDFs残留较低,符合标准的检测要求。然后分别用丙酮、甲苯、正己烷、二氯甲烷进行洗涤,再以甲苯进行加热循环80 次淋洗,浓缩后上机测定(编号分别为1-2、2-2、3-2、4-2),DL-PCBs残留达到标准的检测要求,同时也说明上述的洗涤方法符合测定要求。具体检测结果见图6,DL-PCBs的残留主要集中在PCB-77、PCB-123、PCB-118、PCB-105、PCB-167、PCB-157、PCB-189这7 种物质,其他5 种物质的残留较少,而同位素标记的化合物残留也较少。因此,在日常检测中,要多关注以上7 种DL-PCBs的残留情况,当考察其在样品的回收率情况时,也要考虑其在实验中的系统空白残留情况。
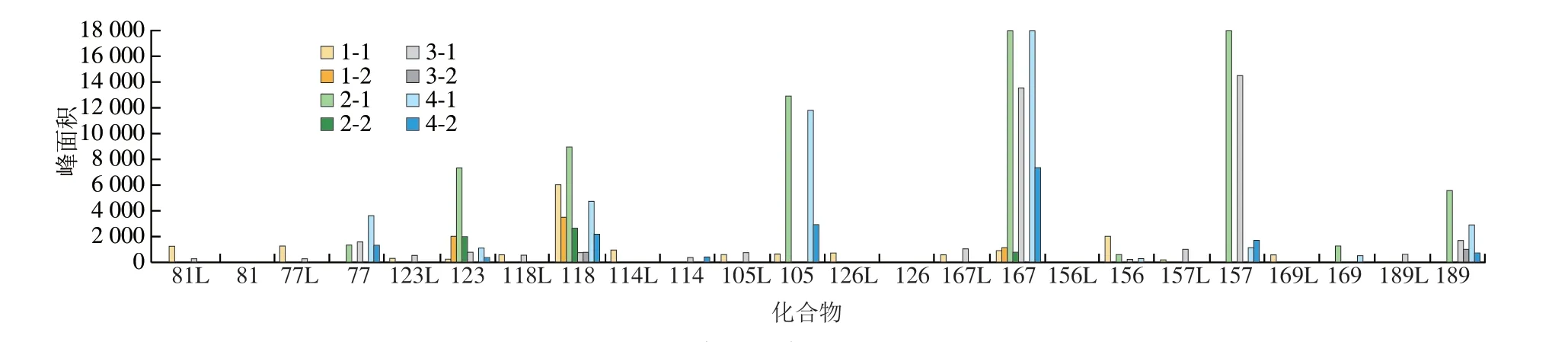
图6 索氏提取仪系统空白污染情况Fig.6 Blank pollution of Soxhlet extractor system
2.6 实际样品测定
应用本方法对一份送检猪肉样品进行G C-M S/M S 方法的检测,同时对其进行分包检测和比对,分包单位采用的检测方法为GB 5009.205—2013,检测仪器为H R G C-H R M S,得到的总毒性当量(toxicity equivalence,TEQ)值为0.319 ng/kg(WHO2005-TEQ-Upperbound),应用本方法得到的总TEQ值为0.363 ng/kg(WHO2005-TEQ-Upperbound),2 种方法得到的总TEQ值偏差为12.9%,小于15%,与相关文献[30]报道的GC-MS/MS和HRGC-HRMS仪器比对结果一致,2 种仪器的测定偏差为0.7%~14%。说明该方法检测结果准确,适用于猪肉中二噁英的定性和定量检测。同时应用本方法对市售的4 份猪肉进行二噁英含量测定,结果为0.047 8~0.305 ng/kg(WHO2005-TEQ-Upperbound),符合欧盟的限量要求。
3 结 论
对采用GC-MS/MS法测定猪肉样品中PCDD/Fs和DLPCBs的测定步骤进行了方法优化和探讨。猪肉为高脂肪含量样品,对比了GPC和酸化硅胶除脂2 种方式,结果发现,GPC除脂对PCDD/Fs和DL-PCBs的回收率影响较大,且容易存在除脂不完全的现象,后续还需要进一步以酸化硅胶进行除脂,降低了目标物的回收率,因此,酸化硅胶除脂更适合超痕量的二噁英类化合物的分析和检测。高脂肪含量的样品要减少称样量,避免净化步骤出现过饱和现象。实验对系统空白污染也提供了较为详细的探讨,在索氏提取仪的使用过程中要注意DL-PCBs的污染和残留。实验结果表明,该方法的回收率和精密度、RRF、各化合物的方法检出限等参数都符合国家标准要求,方法具有普适性,为保障食品安全提供了很好的技术支持。
