高密度培养对猪肌肉干细胞命运的影响
2023-10-21朱浩哲蒋翊宸郑燕燕吴中元丁世杰周光宏
林 玲,朱浩哲,蒋翊宸,郑燕燕,刘 政,吴中元,丁世杰*,周光宏*
(南京农业大学食品科学技术学院,肉品加工与质量控制教育部重点实验室,江苏 南京 210095)
细胞培养肉是指用畜禽干细胞通过体外培养生产出的肉类,是一种新兴肉类生产技术,其优势是低碳环保,未来可作为传统肉类的替代蛋白供应。2013年,荷兰科学家Mark Post教授研制出世界上第一块细胞培养牛肉。2019年11月18日,周光宏教授团队利用幼猪身上分离出来的肌肉干细胞,历时20 d创制了中国第一块细胞培养肉[1]。近年来,细胞培养肉的基础研究和产业化快速发展,但仍然有许多难题需要解决,其中包括如何获得大量优质的种子细胞用于后续培养肉的三维分化[2]。
肌肉干细胞是培养肉重要的种子细胞之一。肌肉干细胞是肌肉组织里的专能干细胞,当肌肉组织出现损伤时,肌肉干细胞可有效修复和再生肌纤维[3]。肌肉干细胞通常位于肌膜和基底膜之间,环绕于每根肌纤维周围,因此又被称为肌卫星细胞[4]。肌肉干细胞在正常成熟的肌肉中表现为静止状态,也是肌纤维生长过程中新肌核的主要来源[5-9]。肌肉干细胞的数目取决于动物的年龄、种类、骨骼肌类型。例如新生鼠肌肉干细胞数目约占肌细胞核总数的30%,成年后降到约4%,老年则下降到约2%(29~30 个月)[10]。又比如5 d的新生儿和5 个月婴儿的肌肉干细胞分别大约可分裂60 次和46 次,9 岁或者60 岁的人只能够分裂20~30 次[11]。无论在正常情况还是病理情况下,肌肉干细胞都要以自我更新的方式维持肌肉干细胞池[12]。
在肌肉干细胞的大规模培养过程中,由于细胞的贴壁生长特性,不管在2D培养皿还是3D微载体上,极易出现密度较高的情况。已有研究发现,体外培养7 d的牛肌肉干细胞增殖效率下降,且细胞也出现了一些融合的细胞肌管[13-14],增殖减缓和自发分化不利于培养后收获高品质的种子细胞。也有研究发现,胚胎干细胞在体外诱导分化为肌肉干细胞过程中,需要其在高密度条件下促进肌源性发育形成肌管[15],表明高密度对细胞的分化起到非常重要的作用。在高密度功能维持研究方面,Liu Zheng等[16]发现激活Hippo通路中的YAP蛋白可提高猪肌肉干细胞的增殖和干性维持能力。目前已有的猪肌肉干细胞高密度培养研究主要针对特定的信号通路和细胞命运,但仍缺少猪肌肉干细胞在高密度培养条件下细胞命运的系统性研究。近年来高通量转录组测序得到快速发展,转录组代表了细胞等样本整体的基因表达水平,能够全局反映细胞的命运变化,目前在包括猪等畜禽动物上也得到大量应用[17-19],因此本研究通过对猪肌肉干细胞转录组分析及验证并系统性地探究高密度培养对猪肌肉干细胞命运的影响,旨在为细胞培养肉研究在高密度条件下调节细胞增殖分化提供一定参考依据。
1 材料与方法
1.1 材料与试剂
1 周龄公猪(以下简称幼猪),提供自江苏某肉类屠宰加工工厂。
澳洲胎牛血清、Ham’s F-10营养培养基、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)美国GIBCO公司;I型鼠尾胶原 美国Corning公司;100×青链霉素混合液、0.25%胰蛋白酶溶液 上海贝博生物公司;Trizol总RNA提取试剂及培养细胞/细菌总RNA提取试剂盒 天根生化科技(北京)有限公司;RIPA裂解液(强) 上海碧云天生物技术有限公司;TB Green Premix ExTaqII、PrimeScript RT Master Mix(Perfect Real Time) 日本TaKaRa公司;二喹啉甲酸(bicinchoninic acid assay,BCA)蛋白质定量试剂盒美国Thermo公司;兔抗P44/42单克隆抗体、兔抗p-P44/42单克隆抗体 美国CST公司;鼠抗PAX7 美国DSHB研究院;鼠抗MYOG 美国BD公司。
1.2 仪器与设备
Centrifuge 5702 R低速冷冻离心机、Mastercycler nexus GSX1梯度聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Eppendorf公司;倒置荧光显微镜 德国Leica公司;二氧化碳恒温培养箱 美国Thermo公司;细胞计数仪Countess II 英潍捷基(上海)贸易有限公司;NanoDrop ND-2000微量紫外分光光度仪美国Thermo公司;酶标仪 美国Molecular Devices公司;QuantStudio 6 Flex实时荧光定量PCR系统德国Applied Biosystems公司;ImageQuant 4000分子成像仪 美国GE公司;eBlot L1快速湿转仪 金斯瑞生物科技股份有限公司。
1.3 方法
1.3.1 不同密度猪肌肉干细胞的培养
幼猪肌肉干细胞的分离纯化与传代培养参照Liu Zheng等[16]方法;取第5代肌肉干细胞分别以2.7×103、5.4×103、1.1×104、2.2×104cells/cm2的密度接种于胶原包被的直径10 cm培养皿中,生长培养基(在基础培养基中添加5 ng/mL bFGF)添加量为8~10 mL,十字摇匀,在37 ℃的CO2培养箱中孵育,第2天换液,第3天观察、拍照、收样进行分析。
1.3.2 转录组测序
将两组肌肉干细胞(对照组:以2.7×103cells/cm2密度接种培养3 d,编号L-D3;实验组:以2.2×104cells/cm2密度接种培养3 d,编号H-D3)各取3 个重复,用磷酸盐缓冲液(phosphate buffered saline,PBS)清洗,培养皿中加入1 mL Trizol,常温裂解5 min,收集裂解液至1.5 mL离心管,进行转录组测序。
1.3.3 总RNA的提取
收样:将基础培养基吸掉后用PBS清洗一遍,加入1 mL Trizol裂解5 min并收集至1.5 mL离心管中。
RNA提取:向细胞Trizol裂解液中加入200 μL氯仿溶液,涡旋振荡15 s后静置2 min,12 000 r/min离心15 min,吸取380 μL上清液至RNase-free离心管中,加入同等体积70%乙醇溶液,混匀后加入CR3吸附柱,静置2 min,12 000 r/min离心1 min;加入350 μL去蛋白液RW1,静置1 min,12 000 r/min离心1 min;加入80 μL DNaseI,静置15 min;再加入350 μL去蛋白液RW1,静置1 min,12 000 r/min离心1 min;加入500 μL漂洗液RW,静置2 min,12 000 r/min离心1 min;再次加入500 μL漂洗液RW,静置2 min,12 000 r/min离心1 min,离心3 min,静置3 min;加入30 μL RNase-free水,12 000 r/min离心2 min到新离心管中,即RNA水溶液。
总RNA浓度以及纯度的测定:利用超微量分光光度计进行测定,若OD260nm/OD280nm值大于1.8,则提取的RNA纯度较好。
1.3.4 反转录合成cDNA
使用TaKaRa反转录试剂盒进行反转录,按照试剂盒说明书操作,根据测得RNA浓度计算10 μL反应体系所用总RNA体积,按表1组分配制反转录反应液(反应液配制在冰上进行);用旋涡振荡器将混合液混合均匀并离心至管底,反转录程序设置为37 ℃反应15 min,85 ℃反应5 s,后降温至4 ℃,取出后可-20 ℃保存待用。

表1 总RNA的反转录反应体系(10 μL)Table 1 Reverse transcription system of RNA (10 μL)
1.3.5 引物设计
在NCBI上查找相关基因的mRNA序列,利用Pick Primers设计如表2所示的上下游引物序列。

表2 猪肌肉干细胞实时PCR(real-time PCR)所用引物Table 2 Primers used for real-time PCR analysis of porcine muscle stem cells
1.3.6 real-time PCR
以cDNA为模板对目标基因和内参基因进行real-time PCR,使用TaKaRa的TB Green Premix ExTaqII试剂盒进行操作,将反转录得到的cDNA模板稀释适当倍数后使用,real-time PCR 20 μL反应混合液配制见表3(反应液配制在冰上进行);PCR设置为 95 ℃预变性30 s、95 ℃变性5 s和60 ℃延伸34 s PCR重复40 个循环,95 ℃变性15 s、60 ℃延伸1 min和95 ℃变性15 s溶解曲线分析。其中扩增效率的测定如下:将反转录后的cDNA采用RNasefree水依次进行10×梯度稀释,制作5 个浓度梯度(即原始cDNA浓度、×10-1、×10-2、×10-3和×10-4)。所有基因均按照上述PCR步骤进行扩增,得到标准曲线。根据斜率(k)计算扩增效率(e)。斜率k在-3.0~-3.5之间,PCR扩增效率e在90%~110%之间效果较好。相关系数R2越接近于1,结果越可信。当目的基因的扩增效率和管家基因的扩增效率相同时,以GAPDH作为内参,目的基因相对表达量用2-ΔΔCt法计算,其中:ΔΔCt=(Ct处理组目标基因-Ct处理组内参基因)-(Ct对照组目标基因-Ct对照组内参基因)。

表3 real-time PCR体系(20 μL)Table 3 Real-time PCR system (20 μL)
1.3.7 猪肌肉干细胞总蛋白提取和蛋白质量浓度测定
总蛋白提取:根据细胞量加入适量体积的RIPA裂解液(提前加入金属蛋白酶抑制剂、磷酸酶抑制剂和EDTA),冰上裂解30 min后用细胞刮收集裂解液,-20 ℃存放待用。
蛋白质量浓度测定:12 000×g离心5 min,收集上清液,使用BCA试剂盒测定蛋白质量浓度,根据操作说明进行实验,步骤如下:将牛血清白蛋白标准品稀释为2 000、1 500、1 000、750、500、250、125、25、0 μg/mL梯度溶液,用以绘制标准曲线。配制工作液(50 份试剂A与1 份试剂B混合),取96 孔板,每个实验孔加入200 μL工作液和10 μL样品或者梯度质量浓度标准品,振荡混匀后37 ℃孵育30 min,冷却至室温。酶标仪设562 nm波长测定并计算样品蛋白浓度,样品用ddH2O稀释至统一蛋白浓度。蛋白液和5×样品缓冲液以4∶1体积比混合,95 ℃煮5 min,-20 ℃冷冻备用。
1.3.8 蛋白质免疫印迹实验
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳:提前配好电泳缓冲液和转印液,选用4%~20%的SurePAGE蛋白预制胶,每孔加15 μg蛋白。设置电泳程序:先80 V、30 min后120 V、90 min。
转膜:将聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜放入甲醇中活化3~5 s,泡入转印液里待用。从下往上按照海绵、2 层滤纸、活化的PVDF膜、凝胶、2 层滤纸、海绵的顺序依次放好,放入电泳槽,加入预冷过的转印液,90 V运行1.5 h。
封闭:用1×Tris含吐温-20缓冲盐溶液(tris buffered saline with Tween-20,TBST)配制5%脱脂奶粉,待膜转印好时,取出放入5%脱脂奶粉中,室温摇床封闭2 h后用1×TBST清洗1 次。
一抗和二抗孵育:用1×TBST稀释一抗,4 ℃孵育14~16 h,回收一抗。1×TBST洗膜3 次,每次5 min。加入稀释后的二抗孵育2 h,孵育结束后用1×TBST清洗3 次,每次5 min。
显影后使用Quantity One软件进行灰度分析。本实验使用的内参蛋白为GAPDH。
1.4 数据处理与分析
使用GraphPad Prism 8.0软件统计分析和作图,进行单因素方差分析,所有处理组均与对照组(低密度组)进行比较,然后进行Dunnett多重比较检验,P<0.05,差异显著。
2 结果与分析
2.1 高密度培养对猪肌肉干细胞增殖能力的影响
为探究不同接种密度短期培养对肌肉干细胞的影响,将分离得到的猪肌肉干细胞传至第5代后以不同密度接种至细胞培养皿。从图1A可以看到,肌肉干细胞大部分呈梭状,部分刚完成分裂的肌肉干细胞呈圆形。随着接种密度提高,细胞相互接触程度逐渐增强,最高密度组细胞完全接触,细胞表现出融合分化的趋势。将细胞消化计数,结果显示终密度分别为1.780×104、3.226×104、5.066×104、6.264×104cells/cm2(图1B),细胞分别增殖了6.59、5.97、4.60、2.85 倍(图1C)。3 组细胞扩增倍数相比对照组分别减少了9.3%、28.8%、56.0%。
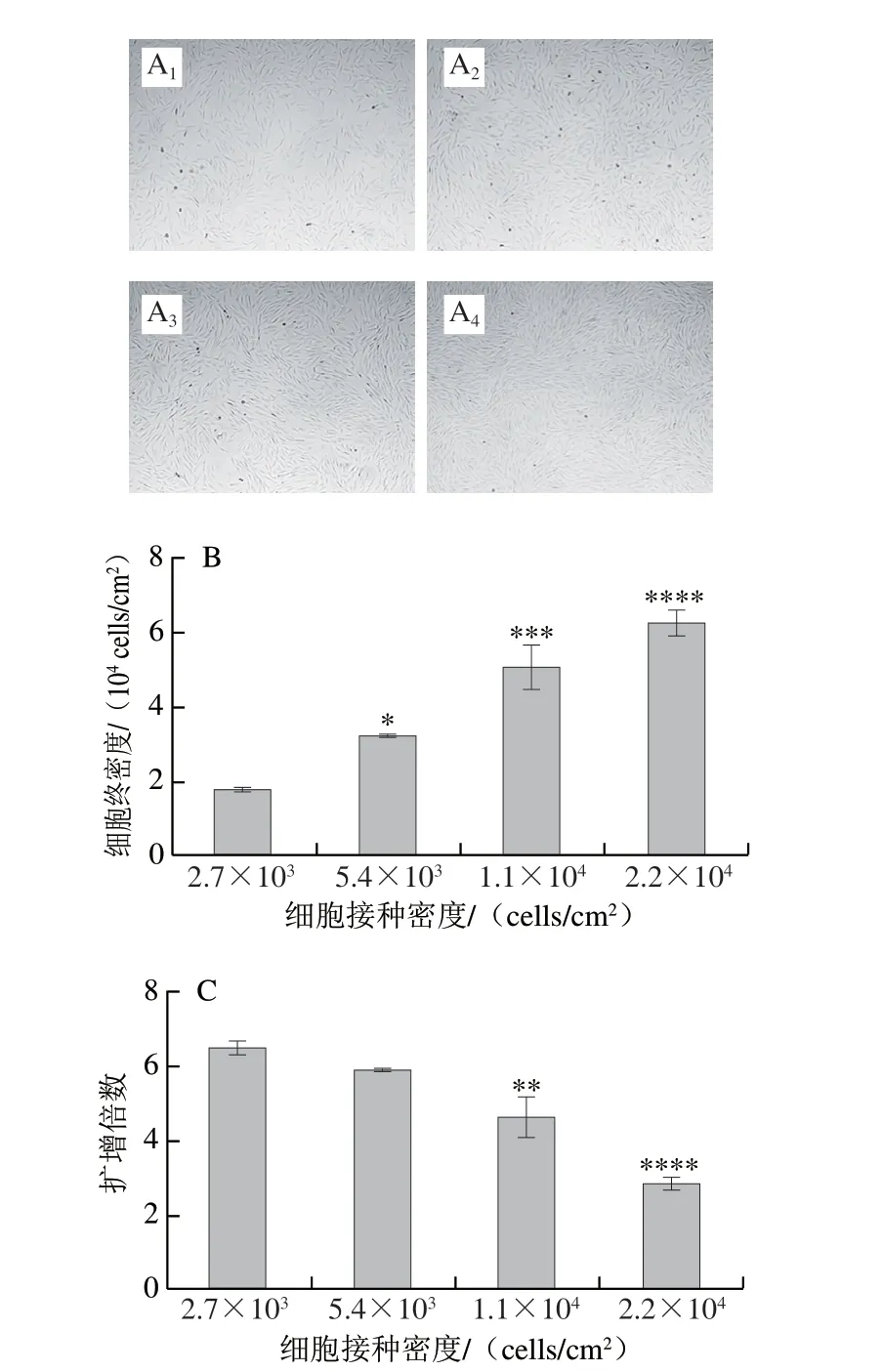
图1 以4 种不同密度接种的猪肌肉干细胞培养3 d后细胞形态(A)与计数结果(B、C)(n=3)Fig.1 Cell morphology (A) and count (B and C) of porcine muscle stem cells seeded at four different densities after three days of culture (n = 3)
细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)是一种丝氨酸/苏氨酸激酶,有ERK-1和ERK-2两种亚型[20],其在细胞生长的信号级联反应中起核心作用,活化的ERK催化许多下游蛋白磷酸化,从而调节多种细胞过程,包括细胞增殖、分化和肿瘤发生[21-22]。研究发现在未转化的成纤维细胞[23]、上皮细胞[24]和血管内皮细胞[25]中,细胞间接触会导致ERK的下调和细胞周期蛋白D1的下降。因此,为了从分子水平进一步了解高密度对猪肌肉干细胞增殖的影响,本研究以磷酸化ERK1/2(p-ERK1/2)蛋白的表达情况进一步分析。如图2所示,不同密度接种培养3 d后的细胞ERK蛋白水平在前3 个密度下无明显变化,最高接种密度组p-ERK1下调为对照组的58.6%(图2B)。类似的,最高密度组p-ERK2下调为对照组的57.7%(图2C)。综上所述,猪肌肉干细胞在3 d内的扩增倍数随接种密度升高而逐渐下降,且下降幅度随接种密度升高而加大。同时高密度培养下p-ERK蛋白的表达量下调,进一步证实高密度培养抑制猪肌肉干细胞增殖。
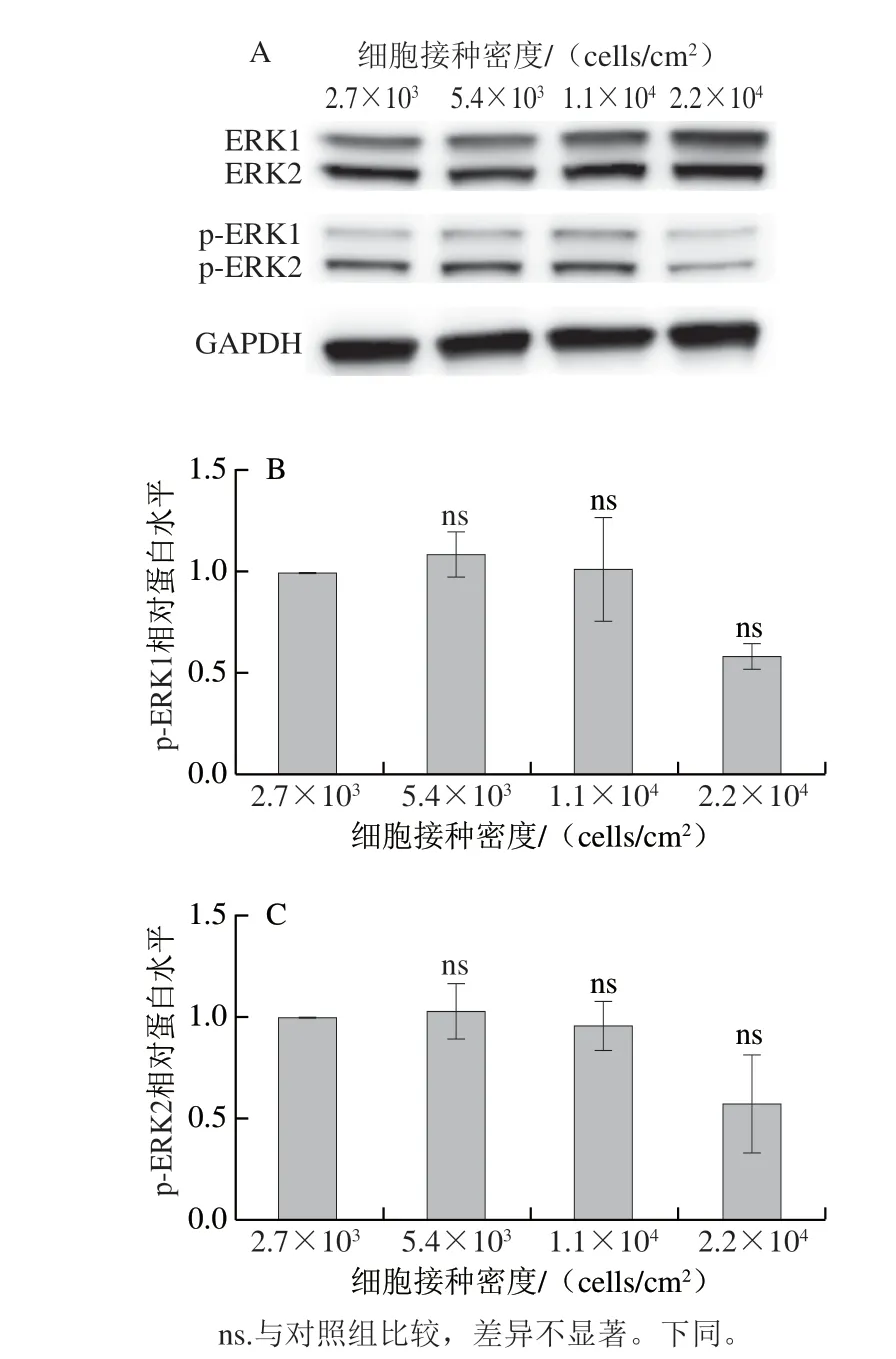
图2 以4 种不同密度接种的猪肌肉干细胞培养3 d后p-ERK1/2蛋白Western Blot条带显影图(A)及p-ERK1(B)、p-ERK2(C)蛋白表达水平(n=3)Fig.2 Western blot of p-ERK1/2 protein in porcine muscle stem cells seeded at four different densities after three days of culture and expression levels of p-ERK1 (B) and p-ERK2 (C) (n = 3)
2.2 高密度培养对猪肌肉干细胞转录组的影响
上述结果表明,高密度培养的猪肌肉干细胞增殖受到显著抑制,为了系统性了解高密度接种条件下细胞基因表达谱的变化[26],对2.7×103cells/cm2(对照组,L-D3)和2.2×104cells/cm2(实验组,H-D3)两组细胞样品进行转录组测序,将测序结果进行主成分分析(principal component analysis,PCA)、基因差异表达分析、差异基因京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路分析。如图3A所示,实验组与对照组的离散程度较大,表明两组样品的差异性较大。据测序结果,选取log2Fold change绝对值大于1,即细胞的基因表达在处理组和对照组中表达量上调/下调超过2 倍的基因进行差异表达分析[27-28]。如图3B所示,和对照组相比,H-D3组显著上调超过2 倍的基因共1 301 个,显著下调2 倍的基因共824 个。如图3C所示,H-D3与L-D3两组中差异表达基因主要富集在细胞衰老、PI3K-Akt信号通路和细胞周期等通路。这些结果表明,高密度培养更易发生细胞衰老、细胞周期蛋白表达异常变化,这些信号通路的变化可能是造成高密度下猪肌肉干细胞增殖减缓以及干性衰退的重要原因之一,有待于进一步研究。

图3 高密度接种猪肌肉干细胞培养3 d后的转录组测序分析Fig.3 Transcriptome sequencing results of porcine muscle stem cells inoculated at high density after three days of culture
2.3 高密度培养对猪肌肉干细胞命运基因的基因分析
转录组分析表明细胞高密度接种会导致细胞衰老以及周期蛋白表达异常等基因表达变化,然而富集在细胞的干性和分化等命运相关通路的显示较少。为了进一步探究高密度对细胞命运的影响,本研究在转录组结果中筛选了与干性、分化和衰老相关的基因表达情况。在肌肉干细胞中,核转录因子PAX7是最重要的标志基因,对肌肉干细胞功能至关重要[29],部分亚群同时也表达PAX3[30],这两个转录因子是肌肉干细胞在出生前和出生后最重要的标志物[31]。通过筛选每千碱基外显子的序列片段数(number of sequenced fragments per kilobase of exon per million fragments mapped,FPKM)发现,对照组PAX3和PAX7的FPKM较低,而高密度条件下PAX3和PAX7的表达量有一定上调(图4A、B)。另外,Sprouty1(SPRY1)是酪氨酸激酶受体信号传导抑制基因,通常在静息状态下PAX7阳性的肌肉干细胞中高表达,随着肌肉干细胞的激活,表达量逐渐下调。肌肉干细胞在修复损伤后,SPRY1是一部分肌肉干细胞重新变成静息状态下,维持干细胞池稳态必不可少的基因[32-33]。SPRY1基因的FPKM结果显示,高密度条件下该基因也出现了上调表达(图4C),表明高密度条件下部分猪肌肉干细胞可能转变成了静息状态下的干细胞。
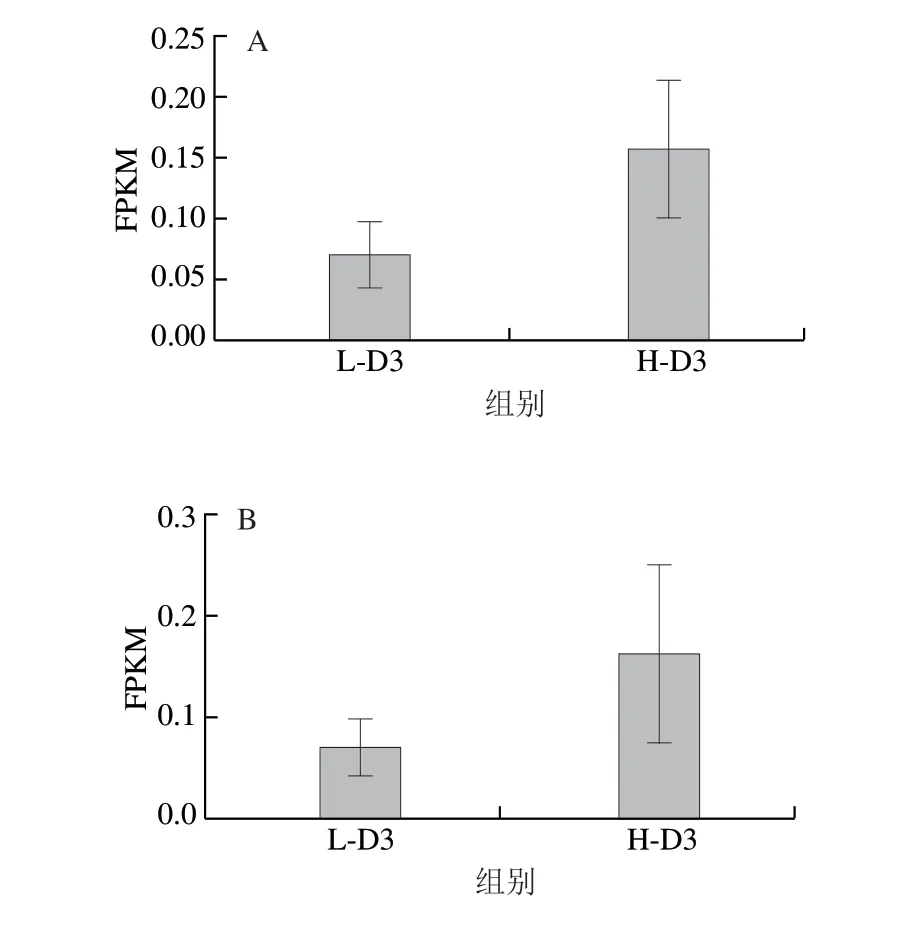
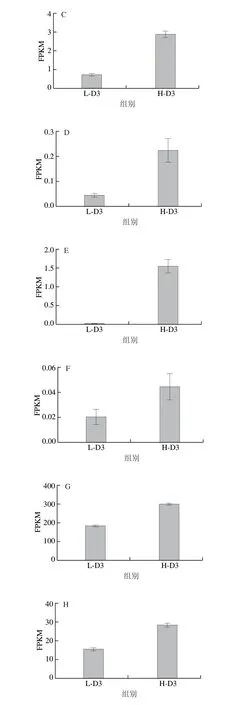
图4 高密度接种的猪肌肉干细胞培养3 d后各基因转录组测序结果(n=3)Fig.4 Transcriptome sequencing results of several genes of highdensity seeded porcine muscle stem cells cultured for three days (n = 3)
针对分化相关基因MYOD和MYOG的转录组学数据分析结果显示(图4D、E),表征分化起始的基因MYOD和表征分化进程中后期的标志性基因MYOG在高密度培养3 d条件下上调。另外,胚胎骨骼肌肌球蛋白重链3(MYH3)表征细胞分化形成新生肌管[34],其随着密度升高而上调表达进一步表现了分化进程(图4F)。以上结果表明,高密度可能推动了肌肉干细胞的分化进程。
转录组学信号通路分析结果显示,高密度条件下细胞发生了衰老,对标志性的衰老基因进行了分析。Zheng Quanhui等[35]研究发现P21参与甲基化介导的生物体衰老过程。Helmbold等[36]研究显示P53是细胞衰老的主要调节因子。Liu Shuang等[37]研究发现敲除P15等能有效抑制人类真皮干细胞的衰老。因此P21、P53和P15作为经典的衰老相关基因,被选为分析衰老基因表达变化的目标基因。P21、P53和P15基因的FPKM的结果显示(图4G~I),3 个衰老基因的表达都出现了上调,表明高密度条件下部分猪肌肉干细胞可能出现了衰老。
2.4 高密度培养对猪肌肉干细胞干性、分化以及衰老关键基因蛋白表达的影响
在成年肌肉中,卫星细胞在静止时表达PAX7、SPRY1、P57、Notch3和CD34等[32,38]。PAX7是肌肉干细胞的特征性转录因子,一般通过免疫学标记PAX7的方法鉴定肌肉干细胞[39]。缺少PAX7表达的小鼠在出生时具有大量肌肉干细胞,但随着细胞周期停滞和细胞凋亡增加,肌肉干细胞数量逐渐减少,在极少数活到成年期的小鼠中,其肌肉再生能力受到损害[40-41]。经过蛋白免疫印迹检测,如图5A所示,与对照组相比,5.4×103、1.1×104、2.2×104cells/cm2组PAX7的蛋白表达水平分别上调到1.70、2.66、2.70 倍,高密度培养显著上调PAX7的蛋白表达(P<0.01)。本研究结果显示,SPRY1在转录水平上随着接种密度的升高而升高,和对照组相比,5.4×103、1.1×104、2.2×104cells/cm2组分别上调到1.07、1.25、1.81 倍,最高密度组的SPRY1表达显著升高(P<0.01)(图5B)。结果表明,猪肌肉干细胞在一定的高密度培养条件下,可能是通过SPRY1的作用,让一部分肌肉干细胞由激活状态重新变成静息状态,从而上调了PAX7的表达。以上结果表明在相同的培养时间内,猪肌肉干细胞的干性随接种密度升高而升高。

图5 不同密度接种猪肌肉干细胞培养3 d后的蛋白及转录水平(n=3)Fig.5 Transcript and protein levels of porcine muscle stem cells with different seeding densities cultured for three days (n = 3)
在转录组学分析中,还发现细胞的分化基因也出现了上调。MYOG是肌生成过程中的关键转录调控因子,当细胞分化时开始表达,并随着分化进程逐渐上调,当形成肌管时再次下调[42]。为了检测高密度培养对肌肉干细胞分化能力的影响,利用real-time PCR和Western Blot检测了分化关键基因MYOG的表达。如图5C所示,realtime PCR结果显示,和对照组相比,5.4×103、1.1×104和2.2×104cells/cm2组的MYOG在转录水平分别上调到2.08、10.68、68.35 倍,最高密度组比对照组有显著上调(P<0.05)。在蛋白水平,5.4×103、1.1×104、2.2×104cells/cm2组的MYOG蛋白水平分别上调到1.42、1.36、4.13 倍,最高密度组显著上调(P<0.001),以上结果说明在高密度培养条件下,部分肌肉干细胞进入了细胞的分化进程。
转录组学研究显示,高密度培养抑制肌肉干细胞增殖,且高密度下衰老相关通路中的P21等基因显著上调,为了验证转录组学的研究结果,检测了衰老相关基因P21的表达。如图5D所示,培养3 d后P21的转录水平随着接种密度的升高而升高,5.4×103、1.1×104、2.2×104cells/cm2组分别上调为对照组的1.72、3.25、4.29 倍,高密度两组显著上调(P<0.01)。因此,在高密度条件下,细胞周期蛋白的表达变化可能是细胞增殖能力变化的潜在原因,但其上游通路中基因的表达情况还需要进一步研究。
以上结果表明,高密度培养条件一方面促使部分细胞进入静息状态维持干细胞池;另一方面推动部分细胞肌源分化,同时还导致了一定数目细胞的衰老。
3 讨 论
已有大量研究表明,动物细胞在高密度培养条件下会发生“接触抑制”现象,即细胞的增殖能力显著下降。Nakatsuji等[43]证明I型星形胶质细胞在增殖过程中产生明显的接触抑制,但并未指出其中的机制。之后Nakatsuji等[44]又在研究中发现p27Kip1上调、cyclin A下调是星形胶质细胞增殖产生接触抑制的原因。加入外源性表皮生长因子(epidermal growth factor,EGF)能提高高密度下的细胞增殖并形成多个细胞层。但EGF的加入并不能很大程度地改变p27Kip1和cyclin A的水平,而是提高了cyclin D1的水平。在FH109人胚胎成纤维细胞中[45],接触抑制仅通过相邻细胞上两种细胞蛋白的相互作用介导,即通过糖蛋白接触抑制素与之结合[46],受体称为接触抑制素受体[47]。肿瘤抑制因子p16lnk4和Cdk4之间缔合的增加[48]以及p27Kip1和Cdk2/cyclin E复合体的缔合增加[49]会产生抗增殖信号,从而导致细胞阻滞在G1期。最后的结果是视网膜母细胞瘤基因产物保持低磷酸化状态,从而抑制其进入细胞周期S期的进程[48-50]。因此,密度引发的细胞周期通路变化是细胞接触抑制最直接的原因。Leontieva等[51]研究发现,细胞衰老分两步发生,首先是细胞周期停滞,这部分可由高密度引起并且可逆,第二步是衰老转化,将可逆的停滞变为不可逆的衰老,这部分与mTOR信号通路相关。本研究结果显示,在高密度条件下,猪肌肉干细胞也出现了明显的接触抑制现象,相关细胞衰老和周期基因出现了上调。另外,本研究转录组学也揭示了相关差异蛋白富集到了PI3K-Akt信号通路,与前人的结果吻合。
PAX7是肌肉干细胞的干性标志基因,结果表明细胞干性随接种密度升高而增加。进一步研究调节肌肉干细胞可逆的静止激活状态的基因SPRY1发现,SPRY1随着密度的上升逐渐升高。SPRY1通常在静息状态下PAX7阳性的肌肉干细胞高表达,随着肌肉干细胞的激活表达量逐渐下调[32]。若降低SPRY1的表达,则会显著减少静息状态下的肌肉干细胞并且提高了凋亡的细胞比例。另外,研究发现SPRY1的作用可能是通过抑制ERK信号通路实现[32]。本研究也发现了高密度培养下磷酸化ERK蛋白的表达量下调。但在高密度条件下,SPRY1调节猪肌肉干细胞的PAX7的表达还需要深入研究。
高密度培养条件还会影响细胞的分化。例如,在角质细胞分化方案中增加初始hPSC接种密度会增加分化终末K18+/p63+简单上皮细胞的数量,提高细胞纯度[52]。Hsiao等[53]研究发现,在贴壁情况下,hPSC分化为神经上皮祖细胞和神经元的动力学水平和分化程度以YAP依赖的方式受细胞接种密度影响,细胞接种密度越高,分化程度越高。Singh等[54]研究了胚胎干细胞向FLK1+血管祖细胞的分化转变与细胞密度和细胞代谢的关系,发现这种转变依赖于较高的接种密度,且与代谢物的转变有关。在间充质干细胞中,有研究得到基质弹性和细胞密度是驱使人间充质干细胞增殖和分化的重要微环境因素[55]。高密度培养后的骨髓间充质干细胞,其成骨分化程度更高并伴随着ERK蛋白表达的下降[56]。高密度培养也改变了牙髓干细胞的特性,并通过整合素信号的传导产生了更多致力于成骨分化的细胞[57]。在本研究中,也发现了高密度条件会促进成肌细胞的分化进程。
4 结 论
肌肉干细胞在高密度培养条件下产生接触抑制,增殖减缓。本研究通过转录组学和后续的验证,发现高密度培养一方面促进部分细胞进入静息状态维持干细胞池,表现为干性基因上调;另一方面,高密度促进细胞分化进程,表现为分化相关基因上调;此外,高密度还导致了细胞衰老,表现为衰老基因上调。本研究结果有助于理解高密度下细胞命运决定机制,为细胞培养肉研究在高密度条件下调节细胞增殖分化提供一定的理论基础。
