利用体外模型分析解淀粉乳杆菌L6发酵豆乳对肠道菌群和短链脂肪酸的影响
2023-10-21费永涛黄一鹤刘功良白卫东
费永涛,黄一鹤,黄 力,刘功良,*,白卫东
(1.仲恺农业工程学院 广东省岭南特色食品科学与技术重点实验室,广东 广州 510225;2.农业农村部岭南特色食品绿色加工与智能制造重点实验室,广东 广州 510225;3.广东省标准化研究院,广东 广州 510240)
随着消费者对功能性食品兴趣的日益浓厚,对功能性豆制品的发展提出了更高要求。发酵豆乳是益生菌利用豆乳中的营养物质进行生长代谢,产生多种代谢产物,对豆乳中营养及风味组分进行转化,从而制成的大豆饮品[1-2]。有研究表明,豆乳经发酵后,营养成分、大豆低聚糖消化率、风味及稳定性提高,并能改善人体肠道微生物组成,促进人体健康[3]。近年来,益生菌对豆乳的发酵及益生作用已成为研究热点之一[4-5]。
豆乳既可以给乳酸菌提供合适的营养环境条件,也可作为载体保护益生菌,提高其在胃肠道中的存活率[6]。乳酸菌发酵豆乳过程中会产生大量乳酸和乙酸,降低发酵豆乳的pH值,将蛋白质和降解后的氨基酸、肽类物质沉淀,形成具有弹性的凝乳,从而使人体胃肠道更易吸收[7];发酵过程中产生的多种生物活性酶,如蛋白酶、糖苷酶和脂肪酶等,有助于将不利于人体吸收的大分子物质分解成小分子,避免人体无法消化从而产生胃胀[8]。发酵豆乳中未被利用的大豆低聚糖水苏糖和棉子糖,能作为益生元,选择性富集肠道有益菌群[9];结肠内未消化的碳水化合物经肠道菌群发酵产生乳酸和短链脂肪酸(short-chain fatty acid,SCFAs),可向结肠上皮提供能量,调节胆固醇和脂质代谢,抑制肠道致病菌,调节免疫系统[10-12]。
目前我国的豆乳发酵剂选择面较窄,一般使用的牛乳发酵剂在豆乳环境中适应性差,营养利用率低,缺乏自研豆乳发酵剂[13-14]。在本课题前期研究中,从豆制品加工副产物豆腐酸浆水中分离得到的解淀粉乳杆菌(Lactobacillus amylolyticus)L6,具有开发成为益生菌并作为豆乳发酵剂的潜力[15-18]。首先,L.amylolyticusL6不具有耐药性,不会分泌有毒代谢产物,安全性较好,并在豆制品环境如豆腐黄浆水中具有优良的发酵特性[16]。其次,该菌在人工合成胃液中具有较高的存活率,并能够抑制致病菌、分泌细菌素、黏附CaCO2细胞,具有良好益生功能特性[17]。在基因水平和转录水平对该菌在豆乳中的适应性机制进行研究,发现该菌具有α-半乳糖苷酶和β-葡萄糖苷酶的编码基因并且在豆乳环境中进行高效表达,帮助L.amylolyticusL6利用大豆低聚糖,转化大豆异黄酮,达到降低“胀气”反应,提高生物活性的效果[17-19]。虽然L.amylolyticusL6是良好的豆乳益生菌发酵剂,但是该菌制备的发酵豆乳对人体肠道菌群的影响仍未知,因此本研究通过发酵豆乳携带的L.amylolyticusL6在模拟胃肠转运中的存活率,确定L.amylolyticusL6在胃肠转运中的存活状态,将模拟消化后的发酵豆乳进行体外结肠发酵,观察发酵豆乳对肠道菌群以及SCFAs含量的影响,探究L.amylolyticusL6发酵豆乳的肠道益生功效。
1 材料与方法
1.1 材料与试剂
大豆购自德州市绿色食品有限公司阳光豆坊。L.amylolyticusL6分离自豆腐酸浆水,现保存于中国普通微生物菌种保藏管理中心,保存编号为CGMCC NO.9090。
MRS培养基 广东环凯微生物科技有限公司;乳酸、乙酸、丙酸、异丙酸、丁酸、异丁酸(均为色谱纯) 阿拉丁试剂(上海)有限公司;猪胃蛋白酶(1∶10 000)、猪胰蛋白酶(1∶250)、α-淀粉酶(≥5 U/mg)、脂肪酶(30 000 U/g) 上海源叶生物科技有限公司;磷酸盐缓冲液(phosphate buffer solution,PBS) 北京兰杰柯科技有限公司;细菌基因组DNA提取试剂盒 艾基生物技术有限公司;5 U/μL LATaq、12 U限制性内切酶HaeIII、2×SYBR Green PCR Master Mix 日本TaKaRa公司。
1.2 仪器与设备
7890气相色谱仪 美国安捷伦公司;7900 HT实时聚合酶链式反应仪、3100毛细管电泳自动序列分析仪美国ABI公司。
1.3 方法
1.3.1 发酵豆乳的制备
配制MRS液体培养基,121 ℃灭菌20 min,取保存于-80 ℃冰箱中的L.amylolyticusL6菌液,以5%接种量活化,至试管底部出现大量沉淀。取活化后的菌液以5%接种量接种于MRS液体培养基中,37 ℃培养12 h,使用无菌生理盐水洗涤3 次待用,重悬调整菌液浓度到108CFU/mL。
发酵豆乳的制备方法参考已报道文献[14],首先用0.5% NaHCO3溶液浸泡大豆14 h,倒去浸泡水后,按照1∶8(m/m)将大豆与饮用水混合,加入豆浆机打浆制备粗豆乳。使用100 目筛过滤豆渣,豆浆与饮用水以8∶2(V/V)混合,加入1.5 g/100 mL葡萄糖,于85 ℃加热15 min,冷却至37 ℃。以10 g/100 mL接种量接种生理盐水重悬后的菌液,于37 ℃发酵10 h。
1.3.2 胃肠转运耐受性
1.3.2.1 模拟胃肠液的制备
根据Wang Jie等[20]的方法稍作修改,制备模拟胃液与模拟肠液。调节PBS的pH值至2.5、3.0和8.0,随后以0.22 μm滤膜过滤除菌。向pH 2.5和pH 3.0的PBS中添加3 g/L胃蛋白酶和2 g/L NaCl,以制备模拟胃液。向pH 8.0 PBS中添加1 g/L胰蛋白酶制备模拟肠液。
1.3.2.2L.amylolyticusL6菌液及其发酵豆乳的胃肠转运耐受性
参考前期研究报道[17],将L.amylolyticusL6接种到MRS培养基中,37 ℃培养12 h后,使用无菌生理盐水洗涤3 次。将1 mL菌液接种至9 mL模拟胃液中(pH 2.5和pH 3.0),37 ℃处理3 h,每小时取样,通过平板计数法测定以生理盐水为载体时L.amylolyticusL6菌株在模拟胃液(pH 2.5和pH 3.0)中的耐受性。样品在模拟肠液中耐受性的测定,首先将样品在pH 3.0胃液中处理3 h后,取1 mL混合液加入到9 mL模拟肠液(pH 8.0)中,37 ℃放置8 h,于4 h和8 h通过平板计数法测定活菌数并计算存活率,得出以生理盐水为载体时L.amylolyticusL6的模拟胃肠转运耐受性。同时以L.amylolyticusL6发酵豆乳样品作为对照,重复上述实验,存活率计算公式如下:
式中:N1为处理后的L.amylolyticusL6菌落数;N0为处理前的L.amylolyticusL6菌落数。
1.3.2.3L.amylolyticusL6菌液及其发酵豆乳对胆盐的耐受性
在MRS肉汤中加入0.3 g/100 mL胆盐,将发酵豆乳和生理盐水清洗并重悬过的菌液接种到含有胆盐的MRS培养基中(10 g/100 mL接种量),在37 ℃下孵育4 h,每隔1 h取样进行计数,平行3 次。
1.3.3 发酵豆乳体外模拟消化实验
参考Bresciani等[21]方法,主要包括样品的模拟口腔及胃肠消化、粪便菌群的体外发酵、肠道菌群分析及SCFAs测定。本实验共设置4 组实验,分别是以生理盐水为样品的空白对照组(BCG)、以L.amylolyticusL6菌悬液为样品的对照组1(CG1)、以灭活发酵豆乳为样品的对照组2(CG2)和以活性发酵豆乳为样品的实验组(EG)。
1.3.3.1 试液的制备
模拟唾液:0.11 g/L CaCl2、1.3 g/Lα-淀粉酶溶于无菌去离子水中,调节pH 7.0。
人体粪便菌液:收集4 名志愿者(年龄20~25 岁,男女各2 名,饮食正常,近3 个月未服用抗生素及无消化道疾病)的新鲜粪便。搜集1 名志愿者粪便后,立即于超净台取20 g粪便于厌氧盒中,更换厌氧包及指示剂,将厌氧盒至于4 ℃冰箱,重复此操作,直至取完所有志愿者粪便。实验前,从厌氧盒中取50 g粪便混合物于烧杯中,加入500 mL PBS、刃天青0.5 mg,搅拌均匀,然后通过已灭菌的纱布过滤去除大颗粒物后转移至灭菌蓝盖瓶中,置于厌氧操作箱内,并于1 h内使用。
生长培养基:蛋白胨2 g/L,酵母提取物2 g/L,氯化钠0.1 g/L,K2HPO40.04 g/L,KH2PO40.04 g/L,MgSO4·7H2O 0.01 g/L,CaCl2·6H2O 0.01 g/L,NaHCO32 g/L,血红素0.02 g/L,盐酸半胱氨酸0.5 g/L,胆汁盐0.5 g/L,刃天青1 mg/L,吐温80 2 mL/L,VK110 μL/L,121 ℃灭菌20 min。
1.3.3.2 体外消化及发酵实验
模拟口腔阶段,取13.6 mL发酵豆乳样品与1.4 mL模拟唾液混合,调节pH 6.8,37 ℃、100 r/min振荡5 min,平行若干管,以作pH值调整测试及样品贮存之用;模拟胃阶段,经口腔阶段消化后,消化液与模拟胃液等体积混合。使用1 mol/L NaOH溶液调节pH 3.0,37 ℃、100 r/min振荡2 h。模拟小肠阶段,经过模拟胃阶段的消化后,取30 mL消化液,使用1 mol/L NaOH溶液调节pH 7.0。然后加入4 mL胆盐溶液和1 mL CaCl2溶液,使用1 mol/L NaOH溶液调节pH 7.0,再加入2.5 mL脂肪酶悬浮液。37 ℃、100 r/min振荡2 h。
体外发酵阶段,在无氧环境下于厌氧管内分装生长培养基及消化样品(1.5 mL粪便菌液+6.5 mL生长培养基+2 mL样品消化液),发酵0、6、12、24、48 h后分别取样,取样后将样品管立即插入冰中,10 000 r/min、4 ℃离心10 min。离心完毕后上清液转移用于测定pH值和SCFAs含量,放-20 ℃冰箱备用,将底部菌渣放-80 ℃冰箱备用。
1.3.4 肠道细菌多样性分析
从保存的样品中提取基因组DNA,用带有barcode的特异引物扩增1 6 S r D N A 的V 3 ~V 4 区。引物序列为341F:CCTACGGGNGGCWGCAG;806R:GGACTACHVGGGTATCTAAT。将纯化后的扩增产物(即扩增子)连接测序接头,构建测序文库,Illumina上机测序。
1.3.5 SCFAs含量的测定
S C FA s(乙酸、丙酸、异丙酸、丁酸、异丁酸、戊酸、异戊酸)的测定参考安捷伦官网方法,样液使用0.22 μm膜过滤,装入进样瓶待用。仪器参数及规格如下:7890B气相色谱系统:色谱柱WAX(30 m×0.25 mm,0.25 μm);载气:氮气,恒流模式;进样口250 ℃,分流比30∶1;柱温箱162 ℃恒温;氢火焰离子化检测器温度250 ℃,氢气流速40 mL/min,空气流速400 mL/min,尾吹气流速25 mL/min;进样量0.1 μL。乳酸的测定使用南京建成公司的乳酸测试盒(A019-2-1)。
1.4 数据分析
所有实验均3 次重复,使用SPSS(V23.0.0)进行分析。组间比较采用单因素方差分析(ANOVA),P<0.05,差异显著。
2 结果与分析
2.1 L. amylolyticus L6的模拟胃肠转运耐受性
2.1.1L.amylolyticusL6对模拟胃液的耐受性
分别以生理盐水和发酵豆乳作为载体,测定L.amylolyticusL6在pH 2.5和pH 3.0模拟胃液中的存活率,结果见表1。在pH 3.0模拟胃液中,L.amylolyticusL6在2 种载体中存活率均大于90%,但在pH 2.5模拟胃液中,发酵豆乳中L.amylolyticusL6在4 h后存活率为96.1%,但生理盐水中的L.amylolyticusL6在3 h后已无法检测出活菌,可见L.amylolyticusL6以发酵豆乳为载体可提高该菌在模拟胃液中的存活率,类似的现象也发生在干酪乳杆菌Zhang中,该菌以生理盐水为载体时,在pH 2.5的模拟胃液处理3 h后保持有70%存活率,若以发酵马乳、发酵豆乳和发酵牛乳为载体,则存活率均超过90%[20,22]。L.amylolyticusL6菌体对模拟胃液的耐受性不及干酪乳杆菌Zhang,但若以发酵豆乳作为载体,在pH 2.5模拟胃液中的耐受性与干酪乳杆菌Zhang相仿[20]。益生菌通常以食物为载体进入人体胃肠道,发酵豆乳可给L.amylolyticusL6提供缓冲环境保护菌体,主要由于外发酵豆乳可提高胃内容物的pH值[6],并且发酵豆乳中的蛋白质及氨基酸可作为人体肠道内消化蛋白酶的缓冲剂和抑制剂[23],从而在上消化道运输过程中保护摄入的L.amylolyticusL6,提高其存活率。
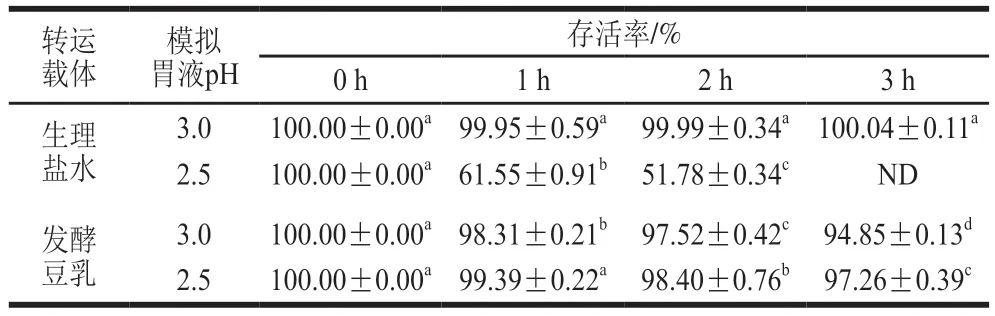
表1 L. amylolyticus L6对模拟胃液的耐受性Table 1 Tolerance of L. amylolyticus L6 to simulated gastric juice
2.1.2L.amylolyticusL6对模拟肠液的耐受性
发酵豆乳中的L.amylolyticusL6首先在pH 3.0模拟胃液消化3 h后,然后再接入模拟肠液消化8 h,其存活率均大于97%,相较于生理盐水作为载体,发酵豆乳中的L.amylolyticusL6存活率提高了7.89%(表2)。同时,发酵豆乳中L.amylolyticusL6在pH 2.5模拟胃液消化3 h后,接入模拟肠液消化8 h前存活率为95.59%(表2)。可知,发酵豆乳中的L.amylolyticusL6在模拟肠液中有良好的耐受性,这一特性有利于L.amylolyticusL6长期地在肠道内定植[24]。
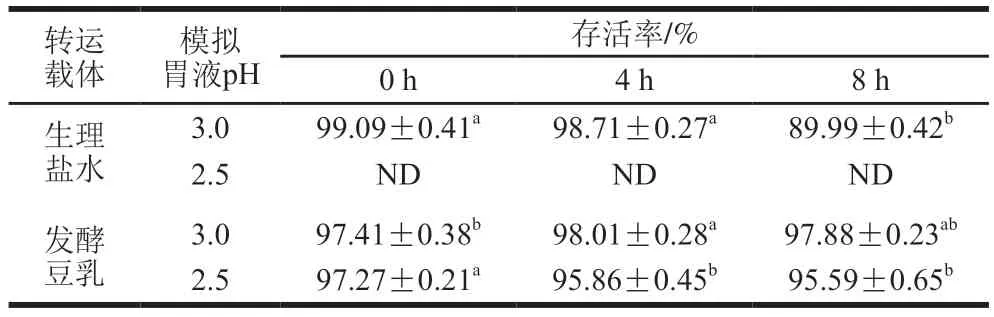
表2 L. amylolyticus L6对模拟肠液的耐受性Table 2 Tolerance of L. amylolyticus L6 to simulated intestinal juice
2.1.3L.amylolyticusL6对0.3 g/100 mL胆盐培养基的耐受性
在0.3 g/100 mL胆盐处理4 h后,2 种载体中的L.amylolyticusL6存活率均大于72%(表3)。正常人体小肠的胆盐范围为0.03~0.3 g/100 mL[25],L.amylolyticusL6理论上可耐受小肠中的高胆盐环境,顺利进入大肠。综上可知,以发酵豆乳作为载体,可提高L.amylolyticusL6在模拟胃肠道中的存活率,从而增加其进入大肠并定植的几率。

表3 L. amylolyticus L6对0.3 g/100 mL胆盐培养基的耐受性Table 3 Tolerance of L. amylolyticus L6 to 0.3 g/100 mL bile salt medium
2.2 体外发酵过程中肠道菌群的变化
通常人体的消化道由口腔、食道、胃、小肠和大肠构成,本研究首先分别对空白对照组(生理盐水,BCG)、对照组1(L.amylolyticusL6菌悬液,CG1)、对照组2(灭活L.amylolyticusL6发酵豆乳,CG2)及实验组(L.amylolyticusL6发酵豆乳,EG)4 个组别的样品进行体外消化(包括模拟口腔、胃、小肠),随即将消化液加入体外结肠发酵48 h,于12、24、48 h取样,通过16S rDNA V3~V5区高通量测序分析肠道细菌结构组成的变化。如图1所示,在门水平上,肠道菌群主要由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)和拟杆菌门(Bacteroidetes)组成,这与已有的报道类似[26-27]。相比BCG和CG1组,添加发酵豆乳的CG2和EG组在体外发酵48 h后,变形菌门细菌相对丰度显著提高(P<0.05),其次梭杆菌门相对丰度亦稍有提高,其余厚壁菌门、放线菌门和拟杆菌门细菌相对丰度均有不同程度的下降。

图1 体外发酵后肠道菌群的门水平物种组成丰度热图Fig.1 Heatmap of species composition and abundance of intestinal flora at the phylum level after in vitro fermentation
埃希氏菌属(E s c h e r i c h i a)中的大肠杆菌(Escherichia coli),为肠道内常见优势菌属之一[26],在体外发酵48 h后,相比于BCG及CG1组,CG2和EG组中埃希氏菌属相对丰度显著增加(图2),分别达到79.52%和80.31%,主要是由于发酵豆乳中有较多的碳源存在(尤其是葡萄糖),被作为优势菌属的埃希氏菌属快速代谢利用,大量繁殖,导致CG2和EG组中埃希氏菌属相对丰度高于BCG和CG1组。此外,EG组3 个时间点乳杆菌属(Lactobacillus)相对丰度都显著高于BCG和CG2组(P<0.05),CG1组直接添加菌悬液虽然在体外发酵12 h相对丰度(27.94%)远高于EG组,但是24 h和48 h后其相对丰度迅速下降到10%以下,低于EG组14.32%和13.86%,主要是由于发酵豆乳中既有益生乳酸菌L.amylolyticusL6也有益生元即棉子糖和水苏糖,选择性地为益生菌后期繁殖提供碳源。大量体内和体外研究也发现,摄入发酵乳品包括酸牛乳、酸豆乳等,能够显著提高肠道菌群中乳酸杆菌属的丰度,改善肠道菌群[28-29]。本研究还发现添加发酵豆乳的EG和CG2组中,多种有害细菌属水平相对丰度下降,包括Lachnoclostridium、假单胞菌属(Prseudomonas)、嗜胆菌属(Bilophia)、Erysipelatoclostridium、史雷克氏菌属(Slackia)、科林氏菌属(Collinsella)和多尔氏菌属(Dorea),它们是人体胃肠道中常见的与疾病相关联的菌属,可能由于肠道较低的pH值有助于抑制有害细菌活性,维持肠道健康(图3)[11]。史雷克氏菌属和假单胞菌属是常见的人体肠道微生物,已有实验证实其能引起食物中毒、器官感染等一系列的人体疾病[30-31]。肠易激综合征是一种常见的胃肠道疾病,常见症状有腹痛、腹胀和腹泻,已有多项研究表明该疾病与多尔氏菌属种群在肠道内增加相关[32]。嗜胆菌属中的沃氏嗜胆菌(Bilophila wadsworthia)具有较强的嗜胆盐特性,能在人体肠道内定植,是人体肠道内的常见致病菌之一,已被报道与阑尾炎及其他局部炎症以及大肠癌相关[33]。此外,研究发现Lachnoclostridium在人体肠道内丰度提高,与结直肠腺瘤和结肠癌直接相关[34]。综上可知,相比于直接摄入L.amylolyticusL6,通过豆乳作为载体携带L.amylolyticusL6进入肠道,能有效提高乳杆菌属的相对丰度,同时降低肠道有害细菌的丰度,防止病原菌的定植,改善肠道菌群结构。
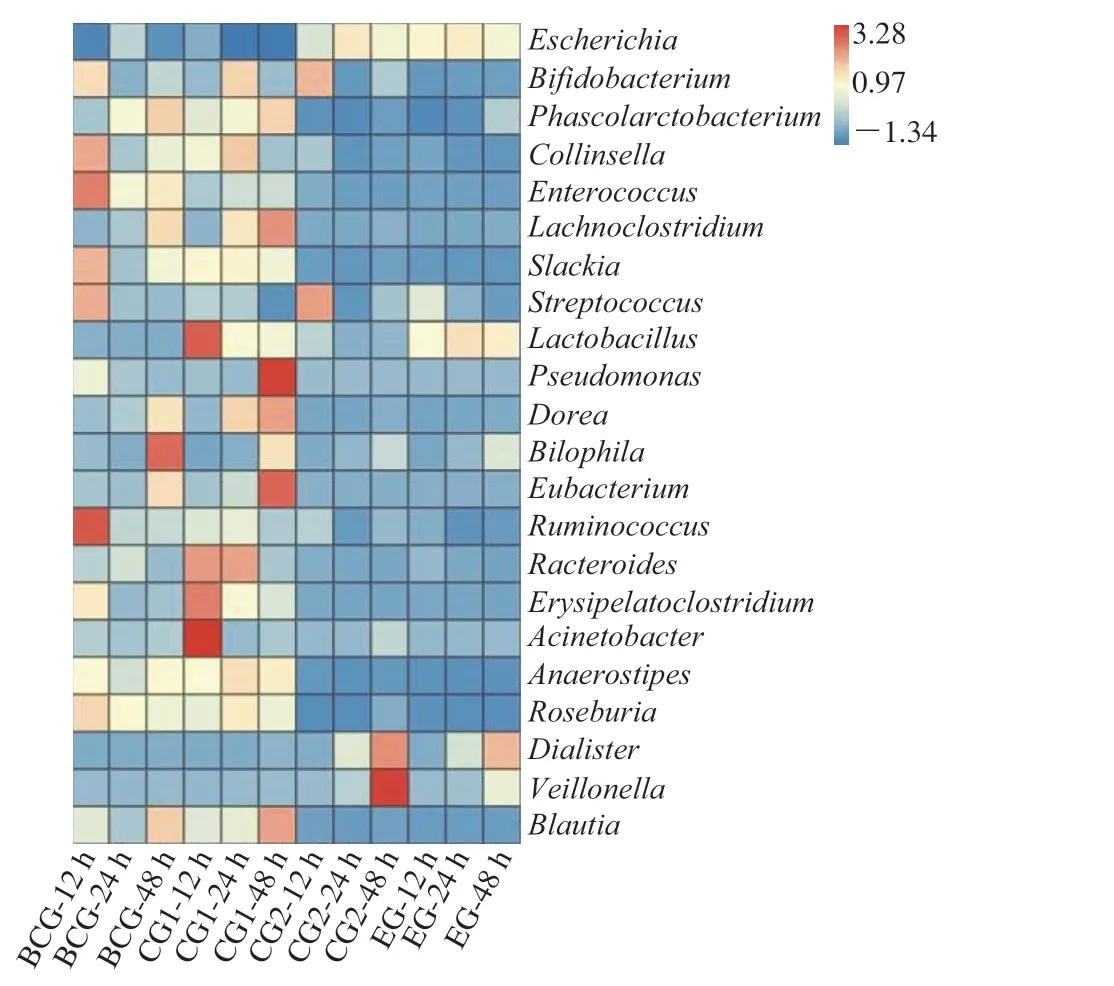
图2 体外发酵后肠道菌群的属水平物种组成丰度热图Fig.2 Heatmap of species composition and abundance of intestinal flora at the genus level after in vitro fermentation

图3 体外发酵过程中不同组别的pH值变化Fig.3 pH changes of different groups during in vitro fermentation
2.3 体外发酵过程中SCFAs变化及其与菌群的相关性分析
由图3 可知,经体外发酵后,相较于B C G 和CG1组,添加发酵豆乳的EG和CG2组pH值下降显著(P<0.05),研究发现结肠环境pH值的降低能提高钙、镁离子的生物利用度并抑制致病菌[35],肠道菌群变化的结果也证实EG和CG2组相较于BCG和CG1组,致病菌属的相对丰度较低。由图4可知,4 组样品中,添加带有L.amylolyticusL6活菌的发酵豆乳EG组,在体外发酵48 h后产生的SCFAs质量浓度最高,达到2.4 g/L,其次是添加灭活发酵豆乳CG2组,达到1.75 g/L,BCG及CG1组均不超过0.75 g/L。可知,摄入发酵豆乳可显著提升SCFAs含量从而降低结肠环境的pH值,抑制致病菌,SCFAs还可调节胆固醇和脂质代谢,调节免疫系统[36]。在Ahlborn等[37]的报道中,研究了牛乳和羊乳对婴儿粪便的体外发酵影响,发现它们均有助于SCFAs的生成。在本研究中,相比于灭活后的发酵豆乳,摄入携带有L.amylolyticusL6活菌的发酵豆乳,SCFAs含量提高了37%,L.amylolyticusL6活菌与发酵豆乳的协同作用能提高发酵豆乳的益生功效。

图4 体外发酵过程中不同组别的SCFAs变化Fig.4 Changes in total SCFAs content in different groups during in vitro fermentation
不同组别体外发酵过程中各种SCFAs含量变化见表4。BCG和CG1组的乳酸含量一直处于较低的水平,而CG2和EG组经体外发酵24 h后,乳酸含量显著提高(P<0.05),但在48 h后乳酸含量显著下降(P<0.05)。体外发酵48 h后,EG组的乙酸质量浓度最高,达到0.95 g/L,其次是CG2组达到0.81 g/L,BCG和CG1组均不超过0.27 g/L。乳酸和乙酸被认为是益生菌发酵后的产物,然而乳酸会被不同的菌属转化为其他SCFAs,这可能是发酵过程中乳酸下降的原因[38]。随着体外发酵的进行,丙酸的上升趋势与乙酸类似,48 h后EG组的丙酸质量浓度最高,达到0.82 g/L,其次是CG2组达到0.71 g/L,BCG和CG1组均不超过0.23 g/L。丙酸经肠道细菌产生后,可被人体吸收进入血液随后转运至肝脏,并能控制血糖并对肝癌细胞有抗增殖作用[10,39]。4 组实验中,异丁酸含量均处于低水平,体外发酵48 h后,EG组的丁酸质量浓度亦为最高,达到0.30 g/L,其次是CG2组0.27 g/L,BCG和CG组均不超过0.21 g/L。丁酸盐既可以由肠道细菌代谢未消化的碳水化合物产生,也可通过对乙酸及乳酸的转化产生[40],丁酸盐与结肠细胞的抗炎和抗肿瘤作用相关[41]。在4 组样品中,仅检测出较低含量的异戊酸,戊酸仅在EG组中检测出。综上,发酵豆乳作为能源物质可增加结肠内的SCFAs水平,L.amylolyticusL6活菌与发酵豆乳的协同作用能提高体外发酵后的SCFAs含量。这可能是由于L.amylolyticusL6活菌可在体外发酵过程中利用发酵豆乳中剩余的碳源,无氧环境下产生乳酸,乳酸经其他肠道微生物转化为各种SCFAs,从而提高了体外发酵过程中SCFAs的含量并降低pH值。在Lactobacillus caseiZhang的研究中,给不同年龄的24 位志愿者连续服用28 d该益生菌片剂,检测粪便样品中的微生物群落与SCFAs,发现SCFAs的代谢水平与该菌的存活率相关[42-43]。

表4 体外发酵过程中不同SCFAs含量的变化Table 4 Changes in contents of individual SCFAs in different groups during in vitro fermentation
EG体外发酵过程中,菌群和SCFAs的相关性分析结果显示,双歧杆菌属(Bifidobacterium)、嗜胆菌属、多尔氏菌属和考拉杆菌属(Phascolarctobacterium)与检测到的4 种主要SCFAs丙酸、异丙酸、丁酸和异丁酸呈显著正相关(图5),前期研究报道也显示双歧杆菌和多尔氏菌属能利用肠道环境中的多糖转化为SCFAs[44-45],同时考拉杆菌属能够利用肠道中的琥珀酸产生丙酸[46],但是嗜胆菌属能与高脂肪饮食协同促进更高炎症反应、肠屏障功能障碍和胆汁酸代谢异常[47],未发现与SCFAs产生相关的报道。与4 种主要SCFAs含量呈负相关的菌属包括拟杆菌属(Bacteroides)、肠球菌属(Enterococcus)、链球菌属(S t r e p t o c o c c u s) 和明串珠菌属(Leuconostoc)等。
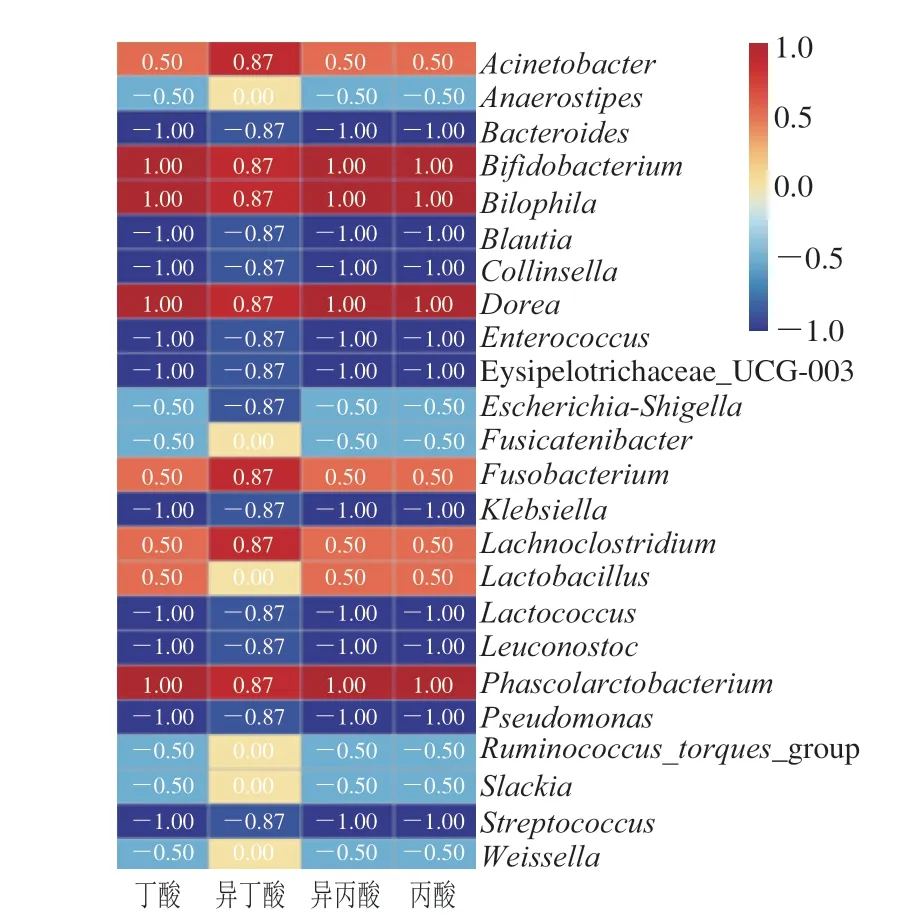
图5 EG样品体外发酵过程中菌群和主要SCFAs的相关性分析Fig.5 Correlation analysis between intestinal microbiota and major SCFAs during in vitro fermentation
3 结 论
本研究发现以L.amylolyticusL6发酵豆乳为载体,在低pH值模拟胃液、模拟肠液以及高胆盐环境中菌体均保持高存活率,随后对其进行体外模拟消化实验,进一步发现加入经模拟消化后的发酵豆乳体外发酵48 h后,多种有害肠道菌属丰度下降,同时体外发酵过程中SCFAs含量也有显著提高,并且携带L.amylolyticusL6活菌的发酵豆乳相较于灭活后的发酵豆乳,体外发酵48 h后SCFAs含量提高37%,L.amylolyticusL6与发酵豆乳的协同作用有利于提高发酵豆乳的益生功效,后续将开展体内实验,进一步确定酸豆奶对肠道菌群的改善作用。
