高效液相法测定海洋硅藻中5种叶黄素类化合物*
2023-10-21汪丽婷朱军旺周成旭张金荣
汪丽婷,朱军旺,肖 玉,周成旭,张金荣
(宁波大学 食品与药学学院,浙江 宁波 315832)
海洋硅藻是一类重要的海洋生物,其作为海洋生态环境最主要的初级生产者,参与到海洋生态系统的物质和能量循环,对维持海洋生态系统具有重要的作用[1-2]。海洋硅藻具有多种功能,已经广泛应用于现代农业、工业废水综合利用以及高价值商业产品可持续生产[3-4]。它具有光合效率高、可规模化培养、并且培养不受季节影响、不占用耕地的优势[5-6]。特别值得关注的是,海洋硅藻富含多种有益健康的活性成分,包括叶黄素类、多糖、蛋白质、不饱和脂肪酸等,具有巨大开发潜力,已经广泛应用于医药、食品、水产养殖等多个领域[7-8]。而且,它能产生特定的高价值化合物[9-10]。因此,近几十年来,硅藻的种质创新、培养模式和条件的优化,及硅藻中高值化成分的生物精炼均已获得了极大的关注[11-14]。
海洋硅藻中含有多种叶黄素类成分,包括新黄素、玉米黄素、岩藻黄素、硅甲藻黄素、硅藻黄素等[15-16],其中,岩藻黄素是自然界中最丰富的叶黄素类成分,约占所有类胡萝卜总产量的10%[17],硅甲藻黄素、硅藻黄素是海洋硅藻的特征色素[18],新黄素和玉米黄素广泛存在于海洋浮游藻类中[19],这5种叶黄素类成分均具有多种生物活性[20-23]。
高效液相色谱法具有分析速度快、灵敏度高、重复性高、适用范围广等优点,已经广泛应用于合成化学、生命科学、环境监测、食品检验等领域[24-25]。为了评估海洋环境中浮游藻类组成和物种多样性,Jayaraman等采用高效液相色谱法可一次运行达到有效分析60多种成分,实现了多组分的同时定量测定[26],但该测定方法需要过多的标准品。为了明确铜藻的漂浮生长机制,张恒等采用液质联用分析技术比较分析了不同来源铜藻中10种色素种类及分布规律[27]。为了比较不同海洋微藻之间色素组成及分布情况,郑立洋等采用液质联用分析技术测定了海洋微藻中叶绿素a、叶绿素b、β,β-胡萝卜素、叶黄素和岩藻黄素的含量[28]。然而,液质联用分析技术需要使用的设备昂贵、分析成本高、操作复杂[29]。因此,针对海洋硅藻中叶黄素类成分,需要建立一种简便、专属性强、灵敏度高的分析方法,为硅藻高值化利用的藻种筛选和生物精炼提供条件。现已发展多种用于HPLC分离的色谱柱,其中,反相色谱柱是以键合非极性基团的载体为填充剂的色谱柱,最常用的填充剂有十八烷基硅烷键合硅胶(C18),C18有较高的碳含量和较好的疏水性,适用于大多数化合物的分析,具有分离度高、重现性好、使用寿命长等优点,已在各国药典中广泛应用于大多数药品的分析测定[30-31]。为实现硅藻中叶黄素类组分高值化利用过程的表征及藻种的定性筛选,本文采用C18色谱柱作为固定相,建立了不同海洋硅藻中5种叶黄素类化合物(包括新黄素、硅藻黄素、硅甲藻黄素、玉米黄素及岩藻黄素)的定量分析方法,并利用该方法比较了8种海洋硅藻之间5种叶黄素类化合物的分布情况。
1 实验部分
1.1 仪器、试剂与材料
Waters 2695高效液相色谱仪(配备PDA检测器、柱温箱、自动进样器以及Empower数据处理系统),美国Waters公司;Agilent Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 μm),美国Agilent公司;Scientz-10N普通型冷冻干燥机,宁波新芝生物科技股份有限公司;GL-21M高速冷冻离心机,上海卢湘仪离心机仪器有限公司。
岩藻黄素、硅甲藻黄素、硅藻黄素、玉米黄素、新黄素5个标准品纯度均高于95%,美国Sigma-Aldrich有限公司;0.22 μm 聚四氟乙烯(PTFE)滤膜针筒过滤器、乙腈(色谱级)均购置于上海安谱科技股份有限公司;丙酮,分析纯,杭州高晶精细化工有限公司。
1.2 标准溶液的配制
新黄素、岩藻黄素、硅甲藻黄素、硅藻黄素和玉米黄素标准储备液的配制:分别精确称取新黄素、岩藻黄素、硅甲藻黄素、硅藻黄素和玉米黄素各 1.0 mg,分别置于 10 mL 棕色容量瓶中,用适量丙酮溶解、稀释并定容至 10 mL,分别配制成5种标准储备液,质量浓度均为 100 mg/L,标准储备液用锡箔纸包裹置于 -20 ℃ 冰箱中避光保存。
新黄素、岩藻黄素、硅甲藻黄素、硅藻黄素和玉米黄素混合标准溶液的配制:准确吸取5种标准储备液,配制得到质量浓度均为 20 mg/L 的5种混合标准溶液。
新黄素、岩藻黄素、硅甲藻黄素、硅藻黄素和玉米黄素混合标准系列工作液的配制:分别准确吸取适量混合标准溶液,用丙酮稀释得到混合标准系列工作液,质量浓度分别为:0.1、0.2、0.5、0.75、1.0、2.0、5.0、7.5、10.0、15.0、20.0 mg/L 。
1.3 藻株培养和生物质收集
表1所示的8株海洋硅藻均由宁波大学浙江省海洋生物重点实验室微藻种质库提供。用于海洋硅藻培养的海水均经脱脂棉过滤、煮沸消毒,所有容器均需高温灭菌。本实验选取的8株海洋硅藻均采用f/2培养基,在逐级扩大预培养基础上,将生长至指数期的海洋硅藻接藻种在 5000 mL 锥形瓶中进行定量培养,水体总体积 3000 mL,各3组平行。在温度为(23±1)℃、光照强度 50 μmol/(m2·s),光照周期为L∶D=12 h∶12 h 的条件下培养 8 d,每天人工摇瓶2次。从接种硅藻第一天开始,每隔一日取样用血球计数板检测藻细胞数。8种硅藻均在平台期收获,藻液在 4 ℃,8000×g离心 20 min,弃去上清液,获取硅藻细胞,将硅藻细胞冷冻干燥 48 h,获得冻干藻粉。冻干藻粉用铝箔包裹,于 -20 ℃ 冰箱中冷冻保存。冻干藻粉需在一个月内进行叶黄素类成分提取及分析。
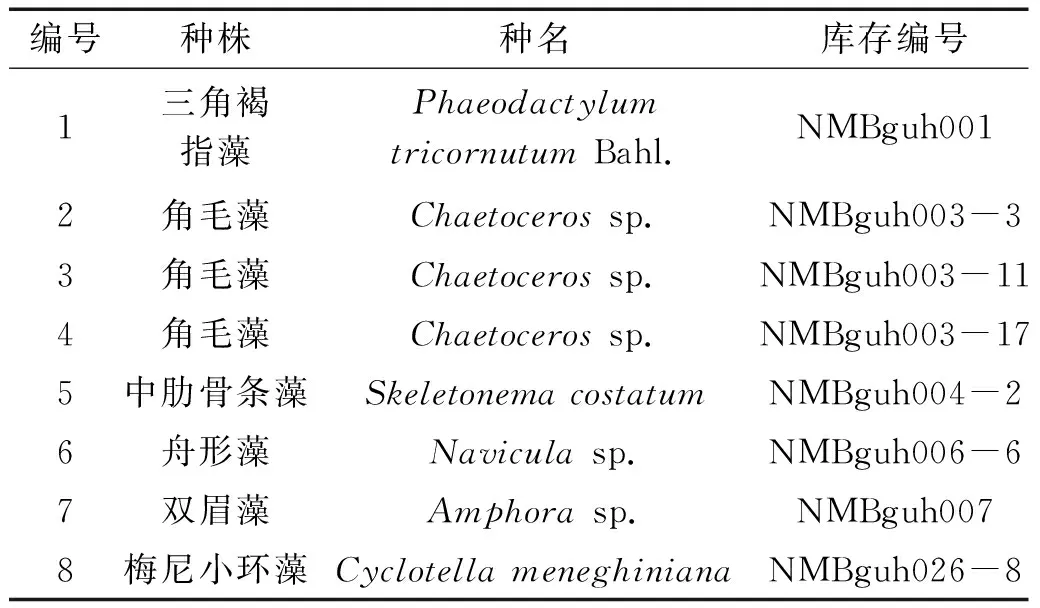
表1 实验用海洋硅藻藻株种名及库存编号
1.4 海洋硅藻中叶黄素类成分的提取
海洋硅藻中叶黄素类成分的提取参照郑立洋等[28]的方法,略加修改。海洋硅藻在指数生长期末尾收获约 3000 mL 藻种培养液,准确称量制备得到的硅藻冻干藻粉的质量,计算每 100 mL 海洋硅藻培养液应制得的冻干藻粉质量并准确称取,放入 5 mL 具塞刻度试管中,加入 2.7 mL 冷丙酮,在冰水中超声 2 min,再加入 0.3 mL 的去离子水,使丙酮最终含量为90%,将具塞刻度试管置于 -20 ℃ 冰箱中静置过夜。海洋硅藻提取液在12000×g离心 10 min,取上清液经 0.22 μm 滤膜针式滤器过滤,取续滤液进行HPLC分析。为了避免提取过程中叶黄素类组分降解,以上实验均在暗室的冰盒中进行,且处理得到的样品应在 48 h 内进行HPLC分析。
1.5 HPLC色谱分析条件
采用高效液相色谱(HPLC)法对海洋硅藻提取物进行分离,用岩藻黄素、硅甲藻黄素、硅藻黄素、玉米黄素、新黄素等5个标准品作为参照物进行指标成分峰的定位。HPLC分析条件如下:使用安捷伦Agilent Eclipse XDB-C18色谱柱(250 mm×4.6 mm,粒径 5 μm),进样量为 10 μL,柱温为 25 ℃;流动相为乙腈(A)和纯水(B),流速为 2.0 mL/min,检测波长为 450 nm。线性梯度洗脱程序见表2。
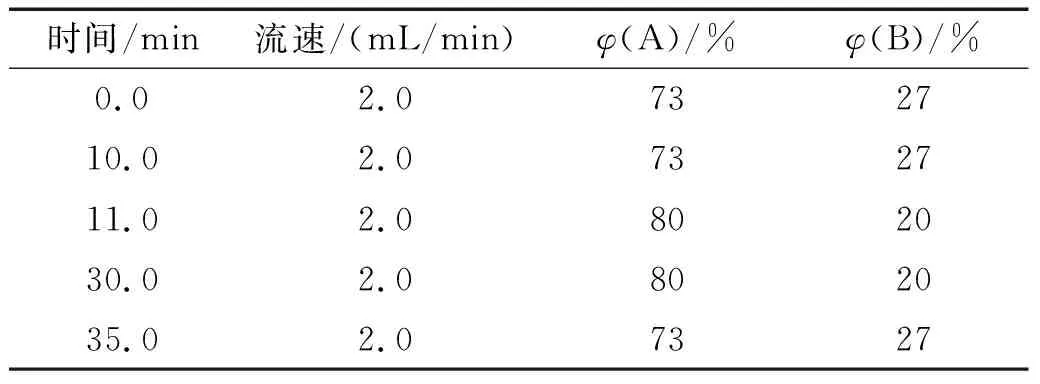
表2 流动相梯度洗脱程序
2 结果与讨论
2.1 方法验证
2.1.1 标准曲线、检出限(LOD)和定量限(LOQ)
取新黄素、岩藻黄素、硅甲藻黄素、硅藻黄素和玉米黄素混合标准系列工作液,按照1.5节的HPLC色谱条件进行分析。由表3可知,新黄素、岩藻黄素和硅甲藻黄素的标准曲线范围为0.2~20 mg/L;硅藻黄素的标准曲线范围为2.0~20 mg/L;玉米黄素的标准曲线范围为5.0~20 mg/L,5种叶黄素类成分在以上质量浓度范围内线性关系良好,相关系数r2均高于0.999。
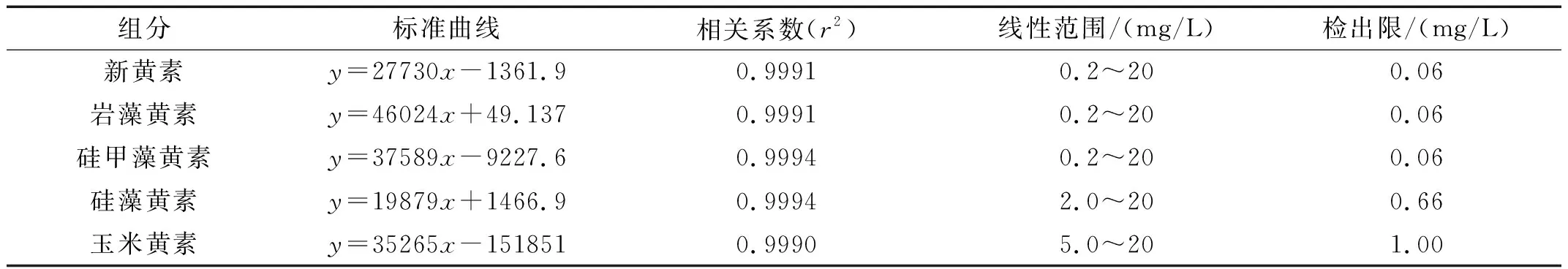
表3 五种叶黄素类成分的标准曲线、线性范围、检出限和定量限
取混合标准溶液适量,采用逐级稀释的方法进行稀释并进行HPLC检测,以信噪比(S/N)≥ 3为检测限(LOD)。由表3可知,新黄素、岩藻黄素和硅甲藻黄素的检测限均为 0.06 mg/L,硅藻黄素的检测限为 0.66 mg/L,玉米黄素的检测限为 1.00 mg/L;以信噪比(S/N)≥ 10为定量限(LOQ),新黄素、岩藻黄素和硅甲藻黄素的定量限均为 0.20 mg/L,硅藻黄素的定量限为 2.00 mg/L,玉米黄素的定量限为 3.00 mg/L。
5个叶黄素类成分混合标准溶液(10 mg/L)的HPLC色谱图见图1。由图1可知,新黄素、岩藻黄素、硅甲藻黄素、硅藻黄素和玉米黄素的保留时间分别为7.2、8.6、14.7、21.7、25.3 min,出峰时间合适,峰形良好,建立的方法对5种叶黄素类成分均具有良好的分离效果,表明该方法专属性良好。
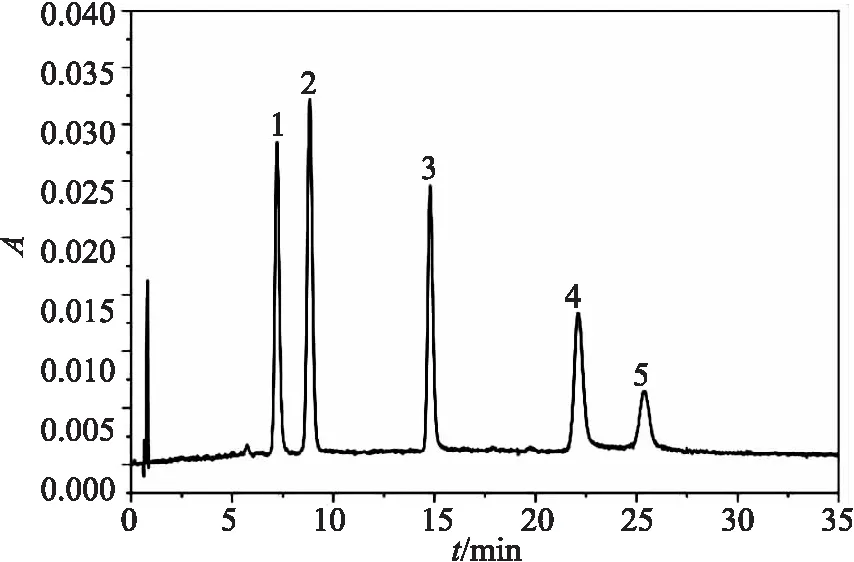
1.新黄素;2.岩藻黄素;3.硅甲藻黄素;4.硅藻黄素;5.玉米黄素。图1 5种叶黄素类成分混合标准溶液(10 mg/L)的HPLC色谱图
2.1.2 方法的精密度和回收率
选取低、中、高3个不同质量浓度的混合标准溶液进行HPLC测定,计算方法的日内精密度。每个样品在一天内连续进样5次,记录5种叶黄素类成分的峰面积及保留时间,分别计算相应的峰面积和保留时间的日内精密度,测定结果见表4。由表4可知,5种叶黄素类成分峰面积的日内RSD为0.33%~3.56%,保留时间的日内RSD为0.13%~0.68%。
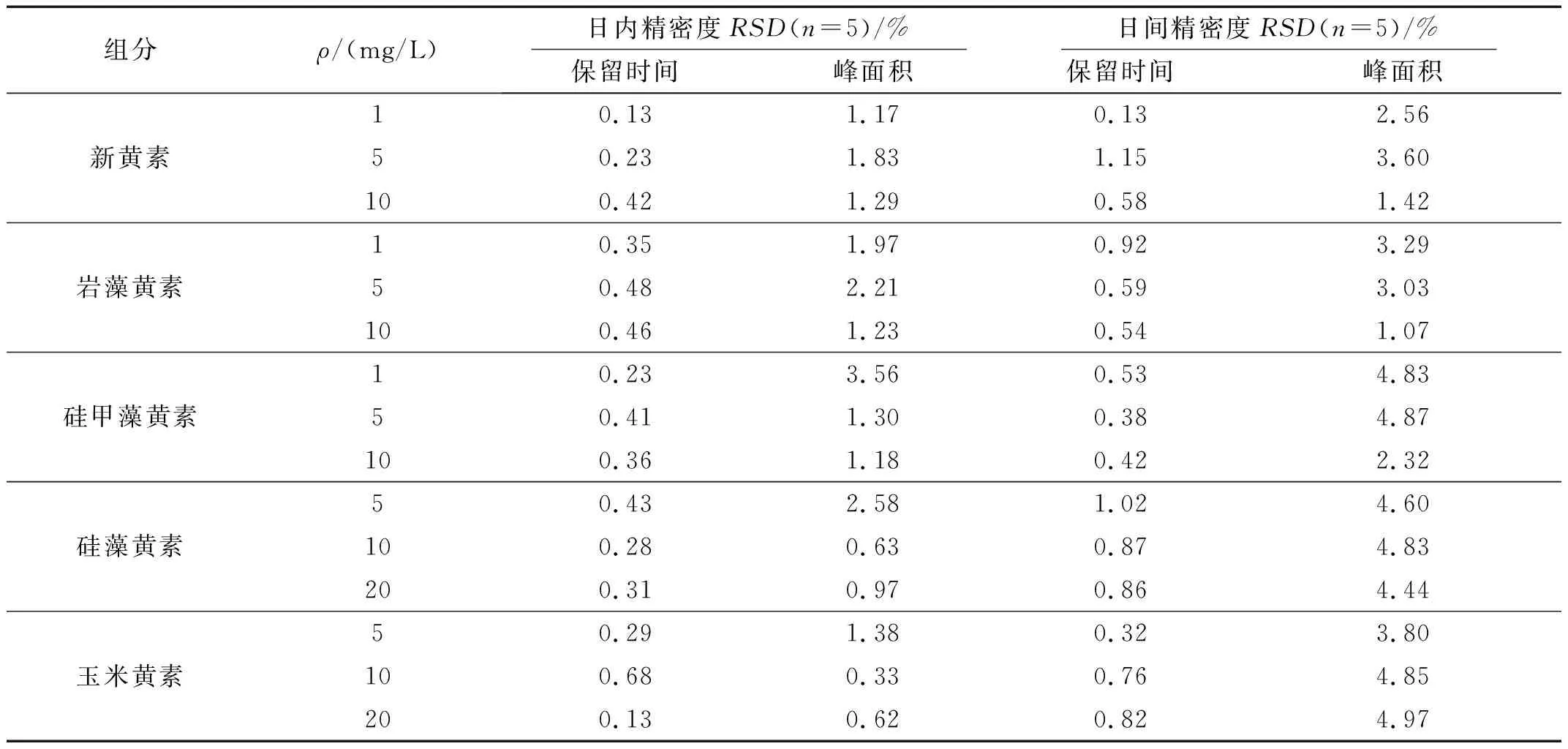
表4 五种叶黄素类成分的峰面积和保留时间的日内、日间测定精密度
选取低、中、高3个不同质量浓度的混合标准溶液进行HPLC测定,每天连续进样测定5次,连续5天,记录5种叶黄素类成分的峰面积及保留时间,分别计算相应的峰面积和保留时间的日间精密度,测定结果见表4。由结果可知,5种叶黄素类成分峰面积的日间RSD为1.07%~4.97%,保留时间的日间RSD为0.13%~1.15%。
经分析可知,新黄素、岩藻黄素、硅甲藻黄素、硅藻黄素和玉米黄素的峰面积和保留时间的日内、日间精密度RSD值均小于5%,说明本方法精密度良好。
准确称取相同质量的梅尼小环藻(NMBguh026-8)样品2份,其中1份加入已知量的含有5种叶黄素类成分的混标,另1份不加,2份样品均采用1.4节所示方法提取样品中叶黄素类化合物。两份样品均按照1.5节的HPLC色谱条件测定5次。根据加标样品测出量减去未加标样品测出量再除以标准加入量计算各组分的回收率,并根据5次平行测定的结果计算相对标准偏差,结果见表5。
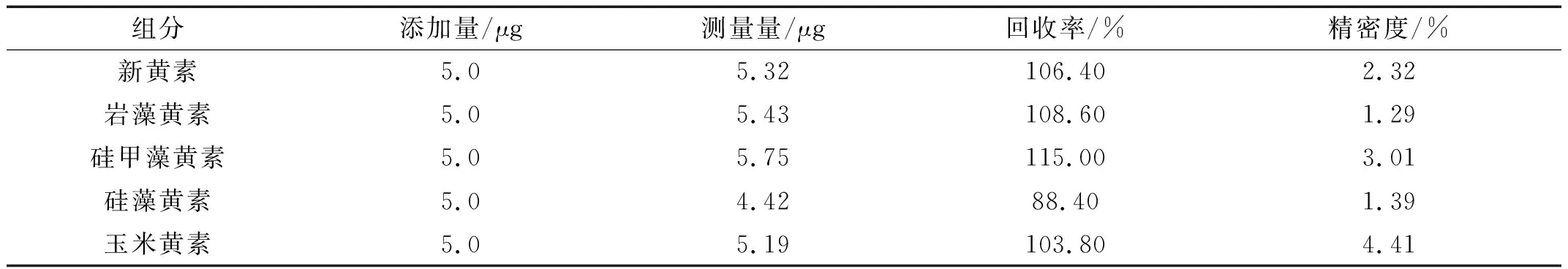
表5 5种叶黄素类化合物的回收率
由表5可知,5种叶黄素类成分的回收率均在88.40%~115.00%,且RSD均低于5.0%。表明该方法能较好地满足硅藻中叶黄素类化合物的分析要求。
2.2 样品测定
海洋硅藻藻株收获时,充分摇匀藻液,分别取1mL藻液,用血球计数板在显微镜下进行藻细胞计数。结果表明,三角褐指藻(NMBguh001)、角毛藻(NMBguh003-3)、角毛藻(NMBguh003-11)、角毛藻(NMBguh003-17)、中肋骨条藻(NMBguh004-2)、舟形藻(NMBguh006-6)、双眉藻(NMBguh007)和梅尼小环藻(NMBguh026-8)的藻密度分别为5.85×105、4.50×105、4.65×105、6.00×105、8.03×105、3.00×105、2.33×105、1.05×105mL-1。按照1.4节建立的方法对每个藻株进行处理,每个样品平行上机检测3次,测定结果如表6所示。
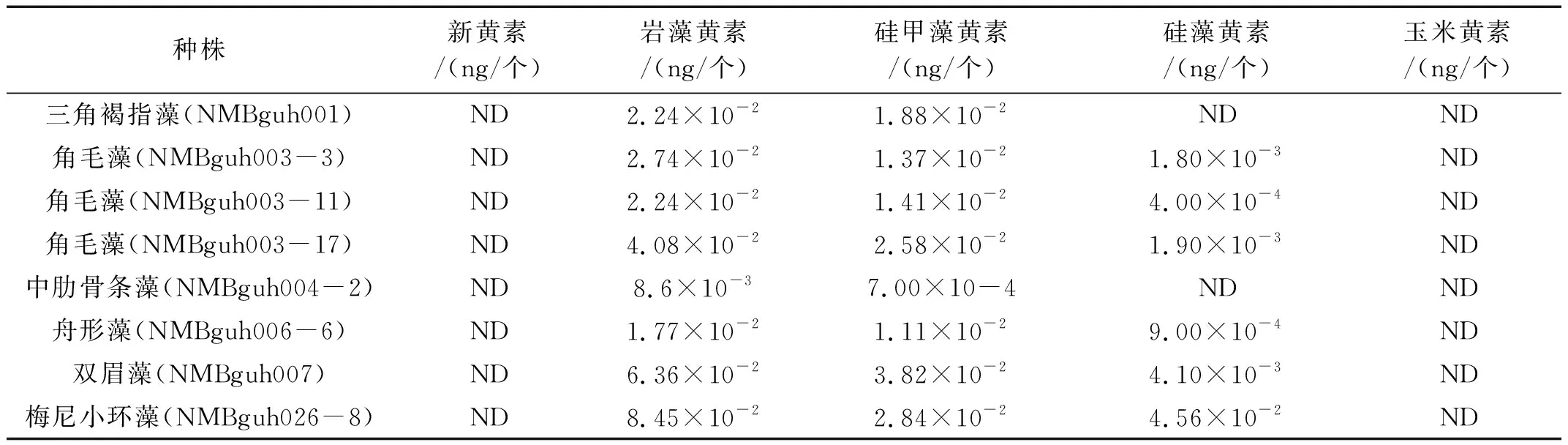
表6 各种硅藻中5种叶黄素类成分含量
由表6可知,岩藻黄素和硅甲藻黄素存在于所有检测的硅藻藻株中。其中,岩藻黄素含量在梅尼小环藻(NMBguh026-8)中最高(8.45×10-2ng/个),在中肋骨条藻(NMBguh004-2)中最低(8.6×10-3ng/个);硅甲藻黄素含量在双眉藻中含量最高(3.82×10-2ng/个),在中肋骨条藻(NMBguh004-2)中最低(7.00×10-4ng/个)。硅藻黄素存在于6种检测的硅藻藻株,包括梅尼小环藻(NMBguh026-8)、角毛藻(NMBguh003-3)、角毛藻(NMBguh003-17)、角毛藻(NMBguh003-11)、舟形藻(NMBguh006-6)和双眉藻(NMBguh007)。其中,硅藻黄素在梅尼小环藻(NMBguh026-8)中含量最高(4.56×10-2ng/个),在角毛藻(NMBguh003-11)中含量最低(4.00×10-4ng/个)。新黄素和玉米黄素在所有检测的硅藻藻株中均未检测出来。
本方法可对海洋硅藻同时测定分析5种叶黄素类化合物,具有灵敏度高,效率高,操作方便的优点,为今后的硅藻中叶黄素类组分的分析提供了简便的测定方法。
3 结论
本文建立了运用高效液相法同时测定海洋硅藻中5种叶黄素类化合物的方法,并进行了方法有效性验证,包括方法的线性关系、相关系数、检测限、定量限、日内精密度、日间精密度和回收率等。采用该方法测定分析了8种海洋硅藻中5种叶黄素类化合物的分布情况,发现岩藻黄素和硅甲藻黄素存在于所有检测的硅藻藻株中,硅藻黄素存在于6种检测的硅藻藻株中,新黄素和玉米黄素在所有检测的硅藻藻株中均未检测出来。该方法具有前处理过程简单、分析灵敏高、重复性好的优点,有效避免了叶黄素类组分在长时间、复杂的前处理及分析检测过程中的损失,提高了叶黄素类组分检测的效率以及准确性。本方法可为硅藻中多种叶黄素类化合物的同时测定提供技术支持,为今后利用叶黄素类组分含量进行藻种优选、培养条件优化、制备技术开发提供了实验分析手段。
