不同湿度下金属Ce的腐蚀行为
2023-10-20李连顺
李连顺
(中核四零四有限公司,甘肃嘉峪关 732850)
金属钚(Pu)化学性质非常活泼,一旦于表面发生氧化腐蚀,化学性质和核反应能力都会受到极大影响。因此Pu的防腐研究对Pu的储存和安全隐患有至关重要的作用。但考虑到Pu放射性等问题,通常用电子结构相似的铈(Ce)来代替进行腐蚀研究。Ce作为一种重要的镧系稀土元素,价电子结构(4f15d16s2)与锕系元素铀(U)(5f36d17s2)和钚(Pu)(5f67s2)的价电子结构相近似。Ce在镧系元素中也是化学性质最活跃、最复杂的金属元素之一,且本身无放射性,因此,可利用Ce来安全模拟锕系元素U,Pu等固化高放射性废物材料的熔炼及腐蚀等行为,为锕系元素U,Pu等放射性和高活泼性金属的物理化学性能研究提供借鉴和参考。
国内外利用Ce模拟Pu,U的相关研究开展已久。邹林秋等[1]利用Ce模拟U研究晶格固化的问题,发现在高温固相反应中掺杂Ce形成晶相有钙钛矿和金红石的陶瓷固化体过程中,Ce核素只进入钙钛矿的晶格中,且与其形成了固溶体。Wang等[2]以Ce模拟Pu研究高放射性废物的固化处理,发现Ce在玻璃化产物中具有2种协同固定机制,一种是Ce进入晶格形成Ce-O-Si键;另一种是存在于玻璃结构间隙中的CeO2晶体。
针对U,Pu的储存和安全隐患等方面的研究,采用Ce模拟U,Pu的环境腐蚀亦有诸多报道。罗丽珠等[3]利用X射线光电子能谱技术(X-ray photoelectron spectroscopy,XPS)研究了Ce氧化后的组分结构变化,发现最先形成Ce2O3,增大充入氧气的量就会进一步生成CeO2。陈丕恒等[4]研究Ce在室温大气环境下的氧化过程,认为Ce的氧化物较复杂,初期氧化物Ce2O3会继续氧化形成Ce7O12,并进一步形成CeO2。吕俊波等[5]采用原位拉曼技术对Ce的氧化还原过程进行了研究,发现在大气环境中,Ce的氧化过程分为3个阶段:首先,各个价态的Ce氧化物层均会迅速增长;其次,最外层的CeO2的形成会停滞,而Ce3+的Ce氧化层会不断增加;最后,在出现OH-时,CeO2再次继续增长。黄昆等[6]在300 ℃的氩气载带的水蒸气中研究了Ce蒸气的氧化行为和机理,发现水分子在表面发生吸附,解离生成了OH-,并与金属Ce反应最终形成氧化物,且在整个表面都形成Ce氧化物之前,这个反应会一直持续。
以上Ce在环境腐蚀方面研究取得了不少进展,但大多在单一氧气、水蒸气、氘气氛等内进行,或将空气整体视为单一组分开展研究。而空气中同时有氧气和水蒸气,且不同环境的空气温度和湿度会有不同,因此腐蚀行为可能更复杂,也更难形成较统一的腐蚀机理。如在潮湿的空气中,室温下的U的腐蚀速率比在干燥空气中的快约100倍,氢和水的加入可能会加速整个腐蚀过程[7]。本文结合X射线衍射仪(X-ray diffraction,XRD)和扫描电子显微镜(scanning electron microscope,SEM)等表征手段对Ce在纯氧及不同湿度的环境中腐蚀实验样品进行分析,并结合相关数值模拟探讨了腐蚀产物的相组成及化学价态转变机制,可为相似金属大气腐蚀机制研究提供参考。
1 实验
1.1 样品的制备
将纯度为99.99%的金属Ce板材分割成尺寸为10 mm×10 mm×1 mm的Ce金属片。平时放置于真空密封贮存,实验前在手操箱中将金属片表面在500#,1 000#,2 000#和3 000#的碳化硅砂纸上进行逐级抛光,然后在无水乙醇中超声清洗10 min,用滤纸擦干后立即封存于手操箱中。
将制备好的样品分别放置在常压(1 atm,1 atm = 1.013×105Pa)常温(25 ℃)下,湿度约为50%和95%的空气及干燥纯氧3组气氛中进行腐蚀。其中,湿度为95%的水气氛环境是在中性盐雾试验机中按标准加入蒸馏水。各组通过控制反应时长(0.5 h~14 d)获得样品,反应后的样品立即塑封存于手操箱中,只在进行各项表征时取出。
1.2 分析测试
采用SEM对不同氧化时间的氧化物表面形貌进行对比分析,采用XRD进行相结构分析,判断不同氧化时间Ce氧化层内所含的氧化物类型和质量分数的变化。对XRD数据均进行平滑及去背景处理。
1.3 理论计算
为更深入理解水蒸气与Ce的反应机理,还采用了基于密度泛函理论(density functional theory,DFT)的第一性原理方法计算了反应物(Ce,H2O)与生成物(CeO2,Ce7O12,Ce2O3)的反应热力学性质。电子与离子之间的相互作用采用PAW形式的赝势,经测试,平面波展开的截断能取为500 eV。计算Ce及其氧化物和气体的相关性质时,电子之间的交换关联能采用局域密度近似。由于f电子的局域性,电子之间的强关联效应不能忽略。引入Hubbard参数U,采用DFT+U的方法加以矫正,计算时U取为5 eV。布里渊区积分策略采用Monkhorst-Pack方案,计算Ce及其3种氧化物时分别取为9×9×9(Ce),13×13×9(Ce2O3,Gamma),7×7×7(Ce7O12),9×9×9(CeO2)。优化时能量收敛标准为每个原子10-5eV,全弛豫时收敛标准为10-3eV·nm-1。
2 结果与讨论
2.1 SEM分析
图1为大气中不同氧化时间Ce表面形貌图。由图1(a)可见,刚打磨不久的样品表面还没有产生明显的变化,能观察到打磨后表面留下的磨抛划痕等缺陷;由图1(b)和图1(c)可见,氧化24~72 h后,样品表面逐渐模糊,局部区域有岛状物形成,且逐渐增多开始相连,接触后随厚度增加,表面形成致密的氧化层;当氧化时间为14 d时,氧化产物增多,氧化膜明显变厚,致密的氧化层发生了开裂,局部区域氧化层剥落,剥落处出现了空洞和疏松结构。由图1可观测到Ce表面氧化层逐渐形成和损坏的过程。

(a) 0.5 h

(b) 24 h

(c) 72 h
2.2 XRD分析
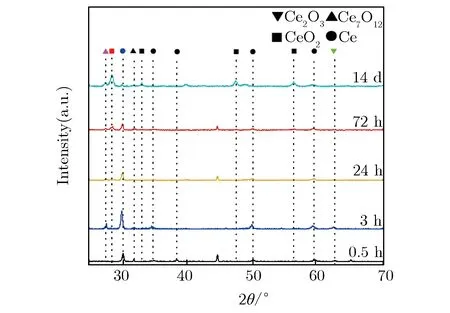
图2为大气环境中Ce表面的XRD分析图,腐蚀产物的衍射角如表1所列。由于XRD测试过程中样品不可避免地会与空气接触,因此将氧化时间约为0.1 h的金属Ce作为标准样品,发现除Ce外,表面基本未观测到其他反应物的衍射峰。
(a) XRD plots of samples with different oxidation times
(b) Trend of the main characteristic peak of each product with time
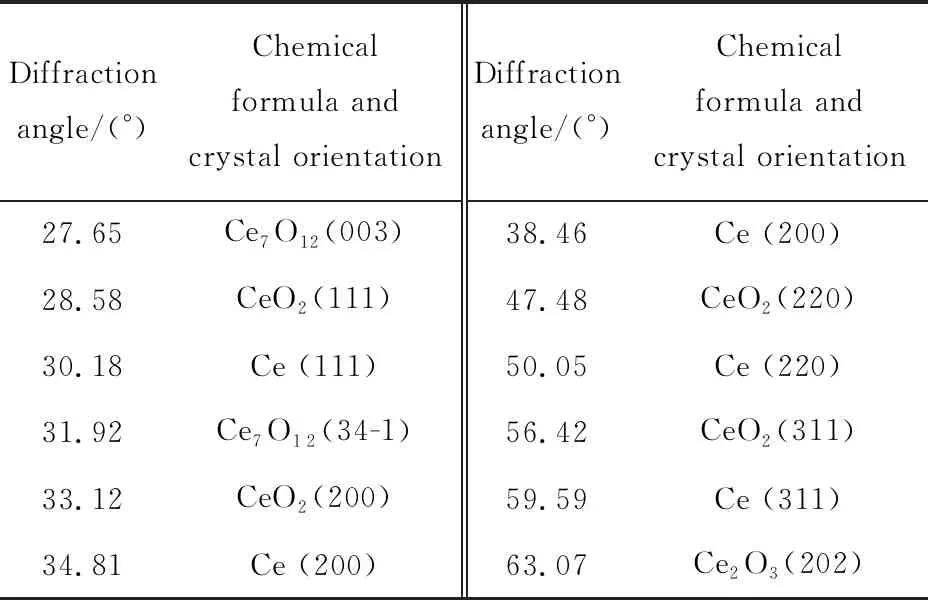
表1 腐蚀产物的衍射角Tab.1 Diffraction angles of corrosion products
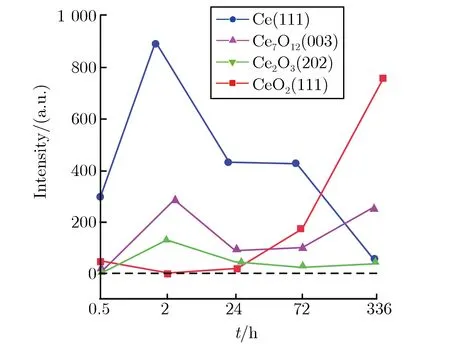
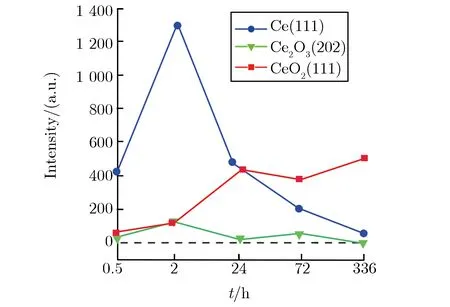
由图2(a)可见,随氧化时间的增加,Ce,Ce2O3,Ce7O12,CeO2相继出现;同时由表1可知,该样品组腐蚀产物的相组成及其变化相对复杂。为便于观察,本文将各类产物的主要特征峰单列出来进行分析,0.5 h~14 d的变化趋势如图2(b)所示,每个产物选取的特征峰强度所对应的5个点在时间轴上从左到右依次为0.5,3,24,72,336 h。由图2(b)可见,Ce(111)峰的峰值随时间的增加逐渐变小,并在336 h时变为一个小峰,说明基片Ce在氧化表层中的质量分数逐渐降低;Ce2O3(202)衍射峰的强度从0.5 h到14 d(336 h)都维持在较低位,在3 h时达到最大,然后逐渐减弱,24 h后维持在低位;Ce7O12(003)峰在3 h时开始出现,强度在较高区域保持波动;CeO2(111)峰的强度在前24 h非常微弱,但72 h时变得很明显,14 d(336 h)时达到最高。根据该组XRD在时间线上的分析表明,Ce在室温、大气环境中的氧化会依次产生Ce2O3,Ce7O12,CeO23种氧化物,且氧化初期首先产生Ce2O3,随后部分Ce2O3被氧化为中间价的Ce7O12,最后被进一步氧化为稳定的CeO2。由于这3种氧化物的密度分别为6.86,6.486,7.215 g·cm-3,Ce2O3与Ce7O12的密度相近,Ce2O3氧化成Ce7O12时膜层仍连续致密,局部Ce7O12继续被氧化为密度较大的CeO2时体积缩小,产生拉应力导致膜层开裂[4]。Ce被氧化过程中生成的不同氧化物膜层主要以分层形式存在,空气通过裂纹与Ce基体反应依次生成上述3种氧化物,不同层的氧化物膜之间产生应力导致膜层剥落[8],这与图1所见的表面形貌所对应。
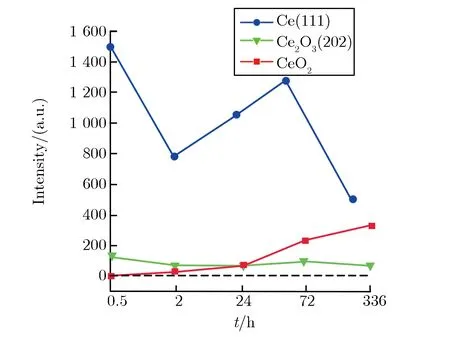
对纯氧环境(25 ℃,相对湿度为0,常压)和水气环境(25 ℃,相对湿度为95%,常压)下腐蚀试样组XRD图谱进行类似图2(b)的处理,且时间轴上点对应的时间也一致,不同环境各产物主特征峰强度随时间变化的关系如图3所示。由图3(a)可见,纯氧环境下,随氧化时间的增加,在样品组中均未发现Ce7O12,表面基本都是Ce,CeO2,Ce2O3的峰;其中,Ce(111)峰的强度随氧化时间的增加而减少,但在14 d(336 h)时仍很明显,说明氧化速度比相对湿度为50%的空气中低;Ce2O3(202)峰的强度始终维持在较低位;CeO2(111)峰的强度随氧化时间的增加而增加,但与大气环境相比,峰值偏低。
(a) Pure oxygen environment
(b) Water vapour environment
分析可知,纯氧环境下,氧分压比空气中高很多,处于金属充足和氧气充足的条件下,有充分的氧维持反应进行,且在金属Ce的氧化过程中,O2向O2/Ce7O12(Ce2O3)界面扩散,并在这一界面处发生物理吸附,物理吸附的分子氧变成吸附的原子氧,进而发生化学吸附变成O2-,并最终以O2-的形式结合到氧化物晶格中去[8]。所以,中间氧化物Ce7O12反应较快,存在的时间很短,因此质量分数很低,在这几个样品中用XRD探测不出来。此外,Ce(111)的持续存在及CeO2(111)峰的强度相对较低说明,纯氧下Ce的腐蚀速度要更低。
由图3(b)可见,高湿度样品组中同样未观察到Ce7O12,其他变化与大气环境趋势较相似;在14 d后,出现了Ce(111)及Ce2O3(202)的峰;24 h后,CeO2(111)峰就一直维持在一个较高值区间。与前两组相比,金属Ce的氧化及CeO2生成速度明显加快,可观测的层厚区间内,Ce2O3全部转换为CeO2。原因可能是样品在水气环境中,湿度较大,氧化速率较快,且Ce2O3直接转变成CeO2,不再形成中间亚稳态相Ce7O12。
由图2(b)及图3各成分衍射峰强度的对比可见,随时间的增加,各成分质量分数表现为Ce逐渐降低,Ce2O3在较低范围内先升高后降低,CeO2逐步升高。对比3组样品峰强度变化表明,空气中水含量的多少对氧化程度有明显影响。
2.3 Ce氧化物的理论计算
本文还采用数值模拟结合实验分析相,对Ce的腐蚀行为进行研究。目前采用基于DFT第一性原理方法对金属Ce腐蚀行为研究已有一些相关报道[9-11]。为验证实验结果,本文对金属Ce与水蒸气(H2O)发生反应的热力学性质开展了第一性原理分析。根据第2.1和2.2节SEM及XRD实验测试结果,假设Ce在水蒸气中发生的反应为

(1)

(2)
Ce在水蒸气中发生反应对应的焓值变化可表示为
ΔH(T)=Δμ0(T)+
T(n1SH2O(T)-n2SH2[T)+ΔSPH(T)]
(3)
其中:H为焓;T为温度;
首先采用共轭梯度算法对研究体系的结构进行优化,得到与实验结果相一致的基态结构,相对偏差约为1%,Ce单质及其氧化物的晶格常数和计算得到的总能(EDFT)、零点能(EZP)及气体分子H2O和H2的键长和键角如表2所列。优化后得到的晶体结构如图4所示,为后面展开相关性质的研究计算打下了基础,后文计算都将采用本部分优化得到的结构参数。
(a) Ce as a single metal
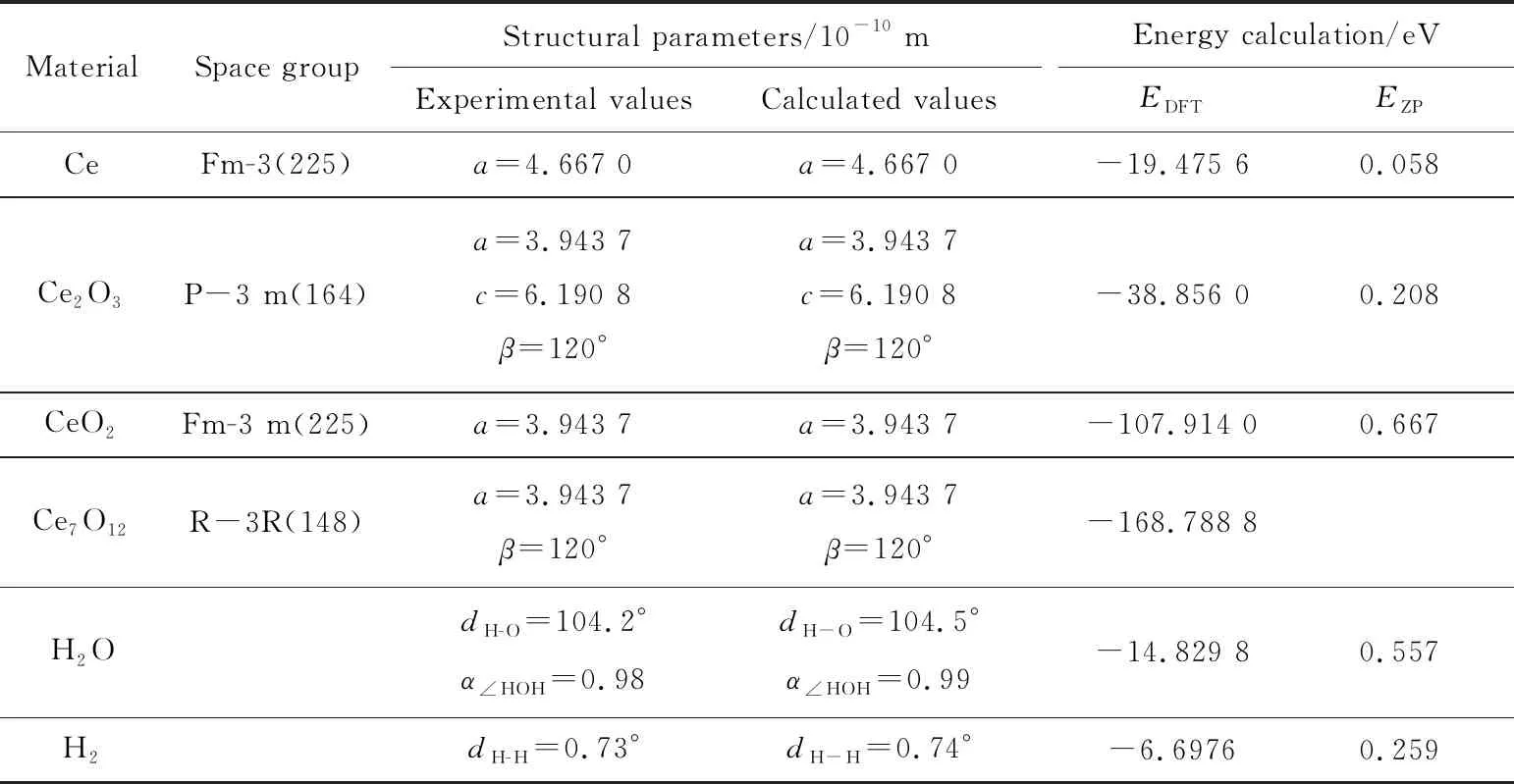
表2 Ce单质及其氧化物的晶格常数和计算得到的总能(EDFT)、零点能(EZP)及气体分子H2O和H2的键长和键角Tab.2 Lattice constants and calculated total (EDFT) and zero-point (EZP) energies for Ce monomers and their oxides, bond lengths and angles for the gas molecules H2O and H2
(b) Ce2O3
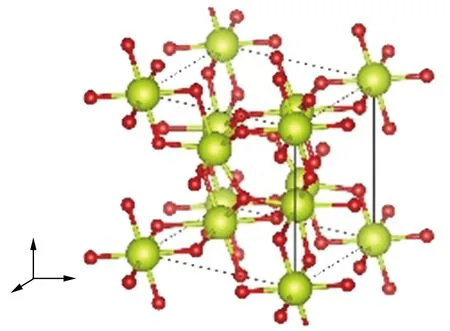
(c) Ce7O12
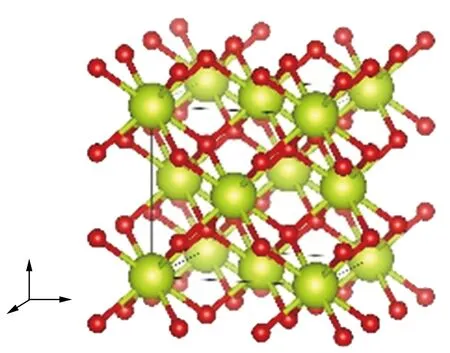
(d) CeO2
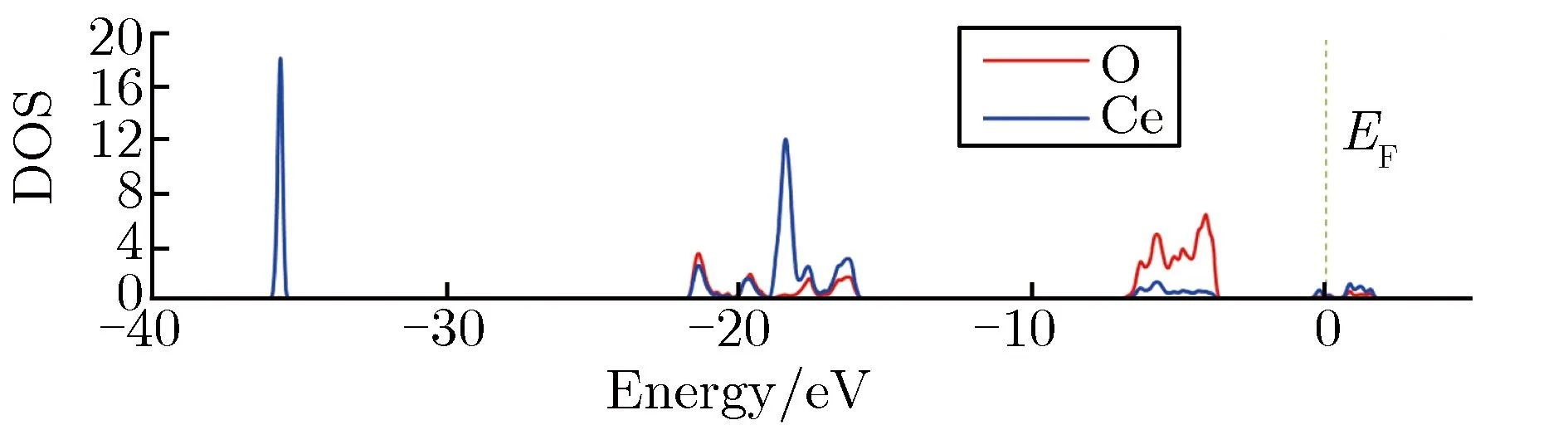
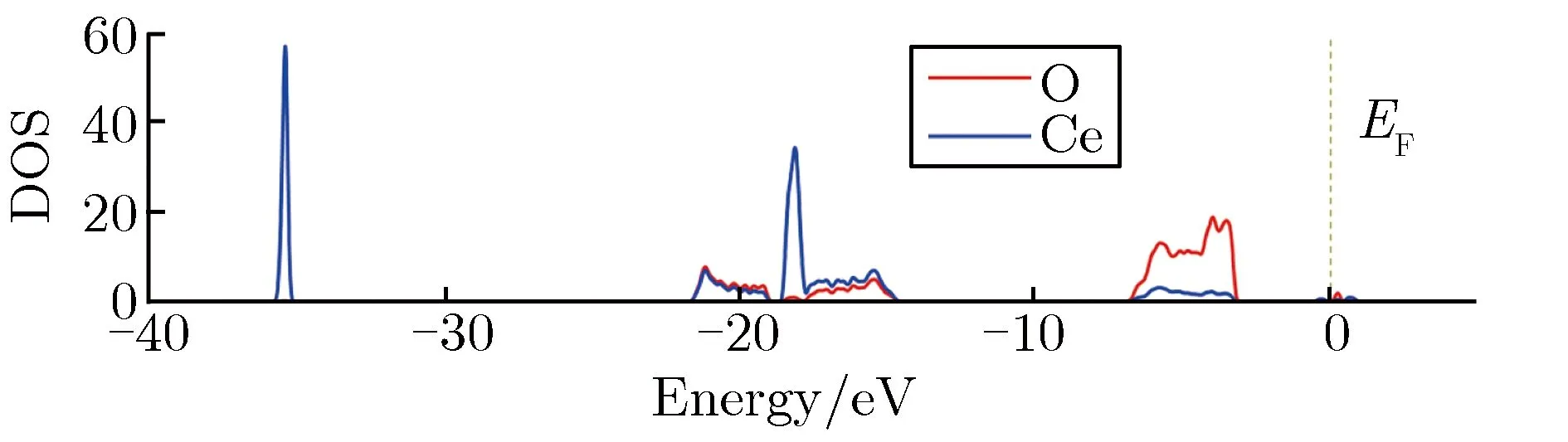
氧化的过程中金属Ce的电荷被O原子夺取,在Ce原子与O原子之间发生电荷转移。本文通过计算Bader电荷研究了3种Ce氧化物中原子的Bader电荷转移,如表3所列。表3中,正值表示得到电荷,负值表示失去电荷。由表3可知,氧化初期生成的Ce2O3的过程中,平均每个Ce原子失去2.017个电荷,随着氧化的进行,失去电荷增多;在生成Ce7O12的过程中,平均每个Ce原子失去2.085个电荷;在生成的稳定氧化物中,Ce原子电荷进一步被O原子夺取,平均每个Ce原子失去2.358个电荷。在生成稳定氧化物的过程中,参与夺取电荷的O原子也进一步增加,每个O原子获得的电荷相对是减少的。至于氧化过程中Ce原子与O原子的电子轨道杂化成键情况可从电子态密度的角度进行研究,3种Ce氧化物的电子态密度(density of states,DOS)随能量的变化关系如图5所示。由图5可见,不稳定的Ce2O3和Ce7O12在费米能级(0)附近出现了带隙能级,而稳定的CeO2则没有出现。此外,与Ce2O3和Ce7O12相比,CeO2中显示出更宽的轨道杂化区域,费米能级附近电子轨道杂化区域达5 eV,而Ce2O3和Ce7O12中杂化区域约为2 eV。说明生成稳定的化合物需有充分的电子轨道杂化。

表3 3种Ce氧化物中原子的Bader电荷转移Tab.3 Bader charge transfer of atoms in three oxides of Ce metal

(a) CeO2
(b) Ce2O3
(c) Ce7O12
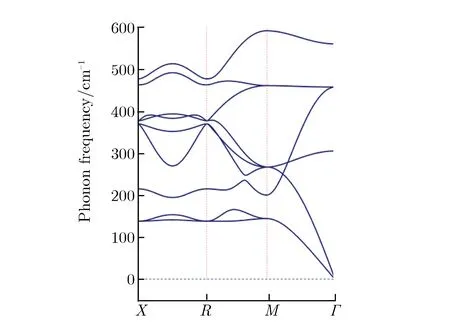
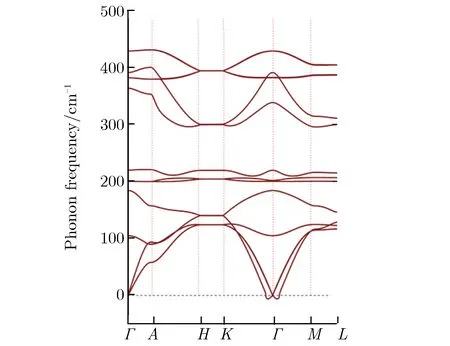
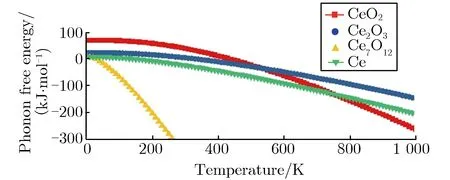
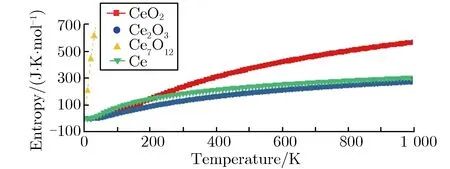
第一性原理主要从晶格动力学和热力学角度研究了金属Ce与气体分子H2O反应的可行性。关于3种Ce氧化物的稳定性,本文从声子谱的角度进行了研究。由于Ce7O12相的声子谱出现了非常明显的虚频现象,证明了其不稳定性,本文没有给出Ce7O12的声子谱。CeO2与Ce2O3的第一布里渊区沿高对称方向的声子谱如图6所示。由图6(a)可见,CeO2声子谱计算结果与李沛娟等[12]的结果较一致,有关Ce2O3的声子谱计算目前尚未见报道。从Γ点附近的声子色散曲线可见,CeO2声子色散曲线完全没有虚频,Ce2O3出现了少量虚频,说明CeO2的稳定性要好于产物Ce2O3。图7为金属Ce和其氧化物的声子自由能及熵值随温度的变化关系。由图7可见Ce7O12随温度的异常变化趋势,说明该结构并不稳定,只是一个亚稳态,其数据与实验结果相符。有关反应焓的计算就不再考虑Ce7O12相,只考虑另外2种氧化物。金属Ce与水蒸气(H2O)生成CeO2与Ce2O3的反应焓随温度的变化关系如图8所示。由图8可见,在全温度范围内,生成Ce2O3的反应焓都低于CeO2的生成焓,可判断在水蒸气中Ce2O3将优先生成,这与实验结果相符,验证了Ce2O3先于CeO2产生的实验性结论。
(a) CeO2
(b) Ce2O3
(a) Phonon free energy vs. temperature
(b) Entropy vs. temperature
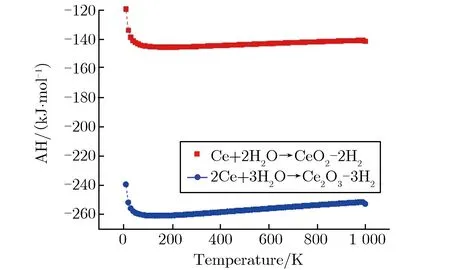
图8 金属Ce与水蒸气H2O生成CeO2与Ce2O3的反应焓随温度的变化关系Fig.8 Reaction enthalpy of CeO2 and Ce2O3 generated from metal Ce and H2O and their temperature variation
3 结论
金属Ce会与空气中的氧气和水蒸气发生较强烈的化学反应。对于不同湿度环境下的样品组,随反应时间增加,金属Ce的氧化速度及氧化产物有所不同,氧化产物较复杂。具体表现为:
(1) 与氧气气氛相比,空气中的水会加快腐蚀,各种环境下金属Ce氧化过程中均会出现Ce2O3和CeO2,但在大气气氛下会有中间产物Ce7O12形成;湿度越大,反应越快。
(2) 通过SEM,XRD分析与数值模拟的结果相结合,发现Ce2O3,Ce7O12将最终向更稳定的CeO2转变,且在相同时间内,湿度越大,转换率越高。空气中水的多少对氧化度有明显影响。
