PET生物降解酶的研究进展
2023-10-20张馨月白晓拴
张馨月,袁 博,白晓拴
(内蒙古师范大学 生命科学与技术学院,内蒙古 呼和浩特 010022)
塑料作为高分子材料之一,得益于有机高分子技术的发展,人们不断开发新的塑料产品、扩大生产规模,据联合国环境规划署(UNEP)的数据显示,2019年全球塑料年产量达到 4.60 亿t,其中我国的塑料产量占比超过 30%,居世界首位[1]。尤其自2020年新型冠状病毒感染暴发以来,口罩等一次性塑料防护用品使用量激增[2],这些人工合成的高分子聚合物在自然环境中无法被快速降解,给土壤等带来严重的污染。人们将直径小于5 mm的塑料颗粒称为微塑料,微塑料通过多种途径进入人体并产生危害:据研究显示微塑料可以通过抑制乙酰胆碱酯酶活性对神经系统产生毒性作用,并且在分子水平上影响细胞功能[3-4]。人体内的微塑料超过一定量将引发炎症,破坏免疫系统。此外,微塑料中的化学物质还会导致糖尿病、癌症等发生[5]。
1 PET概述
聚对苯二甲酸乙二醇酯(PET),由对苯二甲酸(TPA)和乙二醇(EG)脱水缩合而成的热塑性聚酯,其结构式如图1。PET自1929年由杜邦实验室合成以来,由于其优越的物理力学性能及热稳定性成为最常用的合成塑料之一,并广泛应用于饮料包装。据统计,市场中约有 70% 的饮料瓶采用了PET外包装技术[6]。数量庞大的PET制品在废弃后形成了“白色污染”,严重破坏了生态环境的可持续发展。因此,PET塑料垃圾的回收降解引起了世界的广泛关注。

图1 聚对苯二甲酸乙二醇酯分子式Fig.1 Molecular formula of polyethylene terephthalate
目前,针对PET废弃物降解方法主要有3种:物理法、化学法和生物法。物理法即将PET废弃物回收分类后进行粉碎等处理后,进行二次制造或改性造粒生产纤维[7]。该方法的缺点是有害物质残留、PET分子链受到破坏、黏度下降等,影响PET制品的质量。化学法即利用化学方法对PET进行解聚,解聚形成的单体或低聚物可作为原料进行再生产。目前化学法是工业降解PET的主要方法,包括水解法、醇解法和氨解法3种[8]。相较物理法,化学法实现了PET的循环利用,但降解成本高昂、降解过程中使用的化学催化剂会对环境造成二次污染。因此研究人员迫切寻求更为经济环保的PET降解方法。
在1977年,Tokiwa等[9]发现了几种可以水解多种聚酯的酶。随着生物工程技术不断发展,人们将目光转向了生物降解。微生物首先分泌胞外酶,在胞外与大分子聚合物PET结合,将大分子PET转化为水溶性的小分子化合物,并吸收至体内,这些水溶性的小分子在微生物体内进一步分解,最终分解为二氧化碳、水等物质(具体过程见图2[10])。相较于物理法和化学法,生物法具有成本低、反应条件温和、绿色无污染等优点。因此PET的生物降解已经成为热门话题之一,目前已经报道了多种PET降解酶,研究人员对这些降解酶的结构及降解机制进行深度解析,并对其进行多种工程改造,以获得更为高效的降解酶,实现PET废弃物的无污染降解。
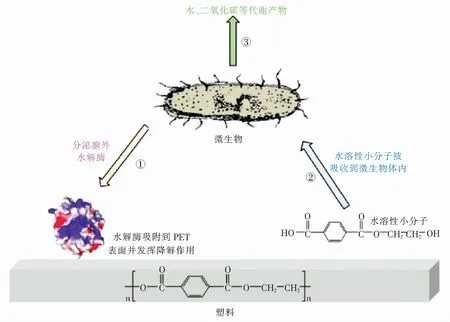
图2 PET塑料的生物降解机理Fig.2 Biodegradation mechanism of PET plastics
2 PET水解酶
PET水解酶,属于α/β水解酶家族的羧酸酯水解酶[11]。目前已知PET水解酶有:酯酶、角质酶、脂肪酶、PETase与MHETase。其中酯酶只能改善PET膜的表面亲水性[12]、脂肪酶因其催化中心结构域所限,对PET的水解活性较低[13]。而角质酶及其同系物具有很强的PET水解能力,能够在高温下降解PET;同时PETase和MHETase可在常温下高效水解PET[14]。因此大多研究集中于采用角质酶与PETase降解PET。
2.1 角质酶
角质酶属于α/β水解酶超家族,最早在植物及昆虫病原真菌中发现。角质酶具备羧酸酯酶和脂肪酶的部分特性,但又与之不同。与脂肪酶相比,角质酶不需要界面活化,其催化丝氨酸可直接暴露于溶剂中,有利于PET的高效水解[15]。此外,角质酶可形成氧阴离子空穴,该空穴位于活性位点,对于稳定底物酯或酰胺羰基氧上的负电荷具有重要意义[16]。如图3[17]所示,角质酶可将PET水解成对苯二甲酸乙二酯(BHET)、单羟乙基对苯二甲酸酯(MHET)、苯二甲酸(TPA)、乙二醇(EG)等亚基。以TfCut2为例,在角质酶的作用下,酯键催化断裂,形成TPA末端链和HE末端链。TPA末端链和HE末端链继续被降解成2-HE(MHET)2、(MHET)2、BHET、MHET、TPA等二聚体和单体,最终降解为MHET、TPA和EG[18]。
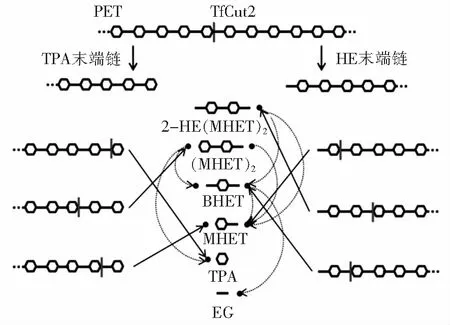
图3 角质酶PET降解机制Fig.3 Mechanism of PET degradation with cutinase
2005年,Silva等[19]发现腐皮镰刀菌角质酶(FsC)能够对PET纤维的表面进行改性,并将PET分解为TPA和EG;且实验结果表明,FsC的最佳反应温度应低于50 ℃,达到60 ℃时失活。Ronkvist等[20]发现在40 ℃的条件下,FsC能够将 7% 低结晶度的PET膜完全分解成TPA和EG单体。同时,在2009年Ronkvist等[20]还发现了一种来源于特异腐质霉(Humicolainsoles)的HiC角质酶能够降解低结晶度的PET;HiC具有良好的热稳定性,可在70 ℃下反应96 h[20]。此外,研究人员还从多种褐色喜热裂孢菌(Thermobifidafusca)菌株中发现了TfH、ThcCut1和ThcCut2等角质酶[15]。TfH可在55 ℃下降解 10% 结晶度的PET膜,三周后PET膜的重量减少了 50%,这是对TfH降解PET的首次报道[21]。Then等[22]通过在TfH中添加大量的Ca2+、Mg2+,使得在65 ℃下PET膜的质量减少 13%,Ca2+、Mg2+的添加将酶的活性提高了 4.5 倍。Acero等[23]发现了两个来自嗜热纤维菌DSM44535的角质酶ThcCut1和ThcCut2,二者紧密相关且均具有水解PET的能力。Kawai等[24]在绿色糖单胞菌AHK190病毒体中获得了Cut190,该酶的活性及热稳定性与之前发现的角质酶相比均有所提高。2012年,Sulaiman等[25]克隆出了堆肥宏基因组的LCC,LCC在pH值为 8.0 的条件下水解PET,显示出12 mg·h-1·mg-1的酶活性[26]。以上提到的角质酶均具有较高的热稳定性,温度范围可达65~75 ℃。而在pH值范围,绝大多数的角质酶适应于中性或碱性pH值环境。例如,真菌角质酶的最佳pH值为 7.5~10.0[24,27]。
2.2 PETase和MHETase
2016年,Yoshida等[28]筛选出了一种新的菌株大阪堺菌(Ideonellasakaiensis) 201 F6,该菌株以PET为唯一碳源。在此之前,人们普遍认为只有脂肪酶、酯酶等能够水解酯键分解PET,数量稀少活性较低[29]。该菌株利用水解酶PETase在30 ℃的反应条件下与 1.9% 的PET膜反应,6周后,低结晶度的PET膜完全分解为小片段——单(2-羟乙基)、MHET。此外,研究人员还发现了一种MHET水解酶(MHETase)。该酶与PETase协同反应,将分解的MHET进一步水解,最终转化为TPA和EG(图4[30])。
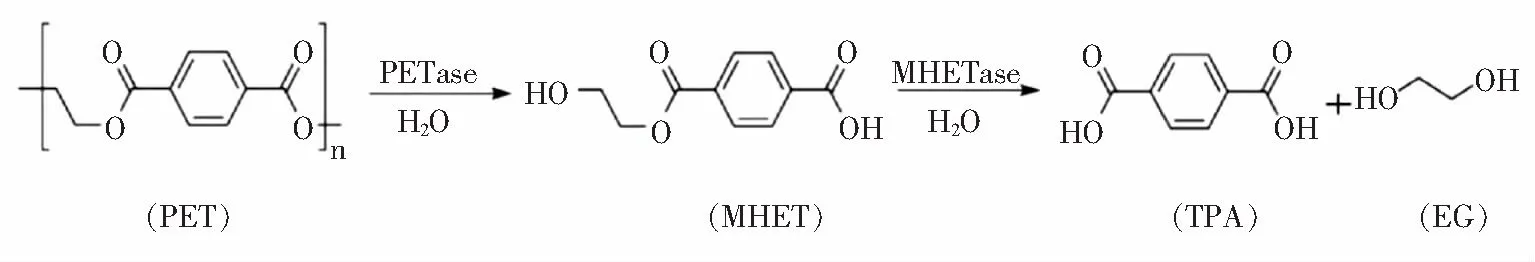
图4 Ideonella sakaiensis 201 F6中关键PET降解酶的反应Fig.4 Reaction of key PET-degrading enzymes in Ideonella sakaiensis 201 F6
IsPETase,一种来自细菌Ideonellasakaiensis的PETase(即一种降解PET的酶,被称作IsPETase),属于α/β水解酶超家族,α/β水解酶根据构成氧阴离子孔的氨基酸,可以分为GX型、GGGX型和Y型,IsPETase等PET降解酶均为GX型[31-32]。经过进一步研究发现,IsPETase由290个氨基酸残基组成,具有典型的α/β水解酶折叠方式[18,33]。该酶具有独特的延长环,以增强酶与PET的结合[18]。Liu等[34]发现IsPETase与角质酶具有 53% 的氨基酸序列相似性,因此他们认为IsPETase是角质酶的同源物。与角质酶相比,IsPETase具有更宽的活性位点,有利于PET大分子进入催化中心。在活性位点处,发现了IsPETase的保守催化三联体Ser160-His237-Asp206,丝氨酸残基位阻较小,能够产生更宽的口袋以供PET底物的结合,而角质酶中则为苯丙氨酸残基,位阻较大[18,33,35]。这些结构均使得IsPETase对PET具有特异性的降解。IsPETase在活性位点具有两个二硫键(角质酶只含有一个二硫键),特殊的二硫键DS1能够连接PETase特有的一段loop区[26,33];特殊的二硫键结构使得PETase适于在中温下水解PET;数据表明,PETase 30 ℃ 下的水解活性较其他水解酶高 5.5~120.0倍[30,36]。相对角质酶等需要在高温下才能水解PET,PETase表现出了更高的优势,并为生物降解PET提供了更多的可能性。
与其他PET水解酶相比,除上述所提到的特异性降解PET外,PETase还表现出了以下特征:(1)水解活性与酶浓度影响呈负相关,酶浓度较高时水解活性反而出现降低现象[15]。(2)降解效率高;PET还能够降解高结晶度PET膜,降解效率是其他PET水解酶的20.0倍[37]。
3 提高PET水解酶效率的方法
生物降解PET法相对其他处理方法表现出了极高的优势以及广阔前景,其污染性低的特点也符合当下人们对绿色环保的追求,这项研究正受到越来越多的关注。然而,PET生物降解技术仍存在许多问题,水解酶由于其热稳定性及水解活性等限制,无法进行大规模的工业化应用,如何有效提高PET水解酶的降解速率成为科学家们思考的问题。
在2020年,发表于《Nature》的一篇文章中提到:来自法国图卢兹南部比利牛斯联合大学的研究团队提出了一种新的可在10 h分解 90% PET的LCC角质酶[38]。该团队在评估验证后选择了ICCG和WCCG两个最佳突变体,在20 h和15 h内分别达到 82% 和 85% 的转化率,进一步借助计算机进行辅助后,可在10 h内达到 90% 的PET分解率。近期,Yuan等[39]利用弹性蛋白样多肽(ELP)标记角质酶,标记后的角质酶相对野生型角质酶活性和热稳定性等均有所提高,有效解决了酶降解PET过程中产物抑制的问题,但产量不足,需要进一步研究。
3.1 酶的定向进化
定向进化是提高酶性能的有效方法之一,高通测量筛选技术可作为定向进化应用的主要手段。PETase可特异性地降解PET,是一种极具潜力的PET水解酶。Shi等[40]基于一种新的高通量荧光筛选技术,获得了高性能突变体DepoPETase,DepoPETase可完全降解 10% 结晶度的PET材料,而对于高结晶度的PET材料,需先对材料进行处理,将结晶度降低至 10% 以下,再进行解聚。
近期,Liu等[41]利用基于双荧光的高通量筛选方法,对IsPETase进行突变体筛选,获得了6个高效IsPETase突变体,其活性提高了 1.3~4.9 倍。该实验的高通量筛选方法经证实具备广泛的PET材料适用性,且方便快捷,在4 d内能够完成2 850个突变体的筛选,因此对PET降解的研究提供了新的数据参考,有助于优化PET塑料的降解方案。
3.2 基于未培养微生物的可培养化提高PET水解酶效率
生物降解法限制之一在于目前能够分泌降解PET酶的微生物数量极低,且酶分泌量不足,因此,需要进一步发掘更多的PET水解酶与微生物,并加大其产量,以扩大PET回收水解的工业化应用。然而,人类对微生物的了解仍是狭隘的,在自然界中有6 000多种的微生物基因组中存在着高达16 170种有关塑料降解的酶基因,其中PET降解酶相关同源基因有8 233种,但目前仅有400余种微生物被鉴定出可降解PET,大部分都来源于未培养微生物[42],这些未培养微生物中可能存在高塑料降解能力的微生物类群。Sulaiman等[43]利用高通测量技术测定了未培养微生物宏基因组,并筛选出能够降解PET的LC-角质酶基因。Gao等[44]将塑料进行长期人工培养,获得了一个具有PET降解能力的微生物菌群。对未培养微生物进行人工培养也是提高PET降解酶产量的有效方法之一[45]。此外,研究人员利用原位培养装置模拟微生物的原生环境,成功培养出数种未培养微生物。Nichols等[46]设计了一种新的原位培养装置,将培养体系与外界环境以半透膜的形式隔离,成功解决了未培养微生物的VBNC状态(活而不可培养态),获得了未培养微生物的纯菌株。原位培养装置还能对微生物的群体感应机制(Quorum Sensing,QS)进行最大程度的模拟,利用微生物的成膜性,极大提高了未培养微生物降解PET的能力[40,47]。综上,未培养微生物的可培养化策略在PET生物降解方面表现出了广阔的前景。
3.3 提高PET水解酶热稳定性与水解活性
由于PET材料自身需要在高温下才能够进行玻璃性转化,因此反应过程中需要水解酶具有较高的热稳定性。研究人员曾在水解酶中添加二价金属离子(Ca2+、Mg2+等)增加稳定性。然而Ca2+在反应过程中可能会和其他物质产生不溶性副产物[48],因此在工业中不能依赖Ca2+进行大规模降解。研究人员在此基础上提出可利用二硫键对Ca2+结合位点进行替代,之前的研究表明,二硫键对于蛋白酶的热稳定性具有重要意义。Then等[49]对TfCut2酶进行改造,引入二硫桥或盐桥,使得TfCut2突变体在 70.0 ℃下有效降解PET薄膜。Son等[50]对TfCut2改造获得了IsPETase S92D/D157H双突变体,在 40.0 ℃下反应72 h,催化活性提高了 6.0 倍。该突变体的Tm(DNA熔解温度)比野生型的提高了 8.0 ℃。Yin等[51]依据静电相互作用提高IsPETase热稳定性,通过实验发现突变体I139R水解活性提高 3.6 倍,并显示出 56.4 ℃的最高Tm值。 Liu等[52]在DuraPETase的基础上添加了一对二硫键,设计出了DuraPETase-4M突变体,增强了DuraPETase的整体刚性,提出增加关键区域的柔性可在一定程度提高PET降解的能力。同时,研究人员还通过蛋白质表面静电荷优化来提高DuraPETase的热稳定性,使得该突变体可降解 93.3% 的无定型PET粉末和69.8%的PET预成膜,速率分别提高了 3.2 倍和 5.4 倍。该实验进一步提高了IsPETase在PET降解方面的潜力与应用。
3.4 基于计算机技术提高PET水解酶活性
除了上述基于酶结构的改造外,计算机技术也被用于PET降解酶的热稳定改造[30]。目前已有多种基于计算的蛋白质工程改造方法。目前开发的混合策略,可显著扩大预测突变体的数量,增加了更多的组合途径。贪婪算法目前在人工智能中的应用愈加广泛,Cui等[53]以该算法为基础,引入了蛋白质工程的贪婪积累策略(GRAPE),该策略可最大化地利用突变集之间的可加性和(或)协同作用来探索上位性效应。研究人员基于蛋白质工程的贪婪积累策略[53]对PETase进行改造,利用融合策略预测了85个有益单点并进行检验,将得到的21个有益单点分为3个Cluster,依据贪婪算法将Cluster进行10轮迭代增加,获得了具有10个氨基酸突变的DuraPETase突变体。该突变体的Tm值较野生型增加31 ℃,对 30% 的高结晶度PET的水解活性提升了 300.0 倍[33,54]。
4 总结与展望
截至目前,已发现的角质酶等水解酶能够有效降解PET,但这些水解酶法同时也存在着许多不足。水解酶PETase对底物具有专一性并且所需反应温度较低,但对降解PET具有较高的潜力,可对该水解酶做进一步的研究。而蛋白质工程可针对酶的基因组进行增强改进,因此可利用蛋白质工程对PETase水解酶进行工程改造,以提高其降解效率。此外,随着高通量技术的发展,该技术可用于对酶进行定向进化以及筛选,目前已经有诸多科学家通过该手段筛选了新的未培养微生物产生的水解酶,并思考这些未培养微生物的可培养化方案。此外研究人员还通过高通量技术获得更为有效的水解酶突变体,提高了水解酶的活性及热稳定性,这可能成为更有效的手段之一。计算机技术的进步可在另一方向上辅助科学家进行探索,研究人员或许应该更多地思考计算机对酶的预测筛选,以期更快地解决PET降解难题。
总之,PET生物降解法将成为PET乃至其他塑料制品降解的最有效手段之一,需要人们进行更多的研究来发掘这些酶的潜能,为塑料污染的彻底降解以及创造绿色的生态未来提供理论基础和研究方案。
