新型可吸收骨蜡的临床前动物实验研究
2023-10-20杨柳张雨吴亚东陈丹丹付海洋
杨柳 张雨 吴亚东 陈丹丹 付海洋
临床常用的传统骨蜡的主要成分为蜂蜡、麻油等,但其生物相容性差,难以被机体降解和吸收,局部残留对骨的愈合造成很大的阻碍,因其止血机理只是物理屏障作用,导致新骨不能正常合成[1]。国内外学者已经从人工合成高分子材料、生物制剂等,进行了骨蜡替代产品的研究工作,如胶原纤维、明胶海绵、氧化纤维素、聚乳酸和多聚糖等[2-6]。动物实验和临床应用表明,这些物质具有可降解性,但在物理性状改变、材料安全性等方面仍存在较多尚未解决的实际问题[7]。本研究中的新型可吸收骨蜡是由脂肪族聚酯和聚乙二醇组成的混合物。聚酯链植入人体后通过酯键的断裂缓慢降解吸收,聚乙二醇可溶解,以原型从肾脏排出体外。可降解骨蜡在临床应用中是通过填塞和覆盖骨创面,机械性控制骨损伤表面的出血,达到辅助止血的目的,同时可在体内自然降解,促进骨质愈合,在临床上适用于控制骨损伤表面出血。本研究通过羊胸骨植入试验、小鼠急性毒性试验和兔刺激试验研究其生物安全性。由于新型可吸收骨蜡性状可揉捏至可塑形状态,还具有可降解的特性,如果其生物安全性也符合要求,其将成为临床理想的骨表面止血材料。
1 材料与方法
1.1 主要材料、试剂与仪器
主要材料:新型可吸收骨蜡(北京颐合恒瑞医疗科技有限公司);ETHⅠCON骨蜡(强生医疗器械有限公司)。主要试剂:盐酸赛拉嗪(吉林省华牧动物保健品有限公司);异氟烷(济南广盛源生物科技有限公司);生理盐水(石家庄四药有限公司);注射用青霉素(华北制药集团动物药业有限责任公司);阿托品(山西省芮城科隆兽药有限公司);无水乙醇、二甲苯、盐酸、氨水(国药集团化学试剂有限公司);玉米油(江西益普生物药业有限公司)。
主要仪器:呼吸麻醉机(VME+MODEL300,美国Midmark公司);电动吸引器(YX9304,上海斯曼峰医疗器械公司),心电监护仪(Vet-12N,山东铭泰医疗器械有限公司);电外科发生器(Mega Power,美国Megadyne公司);恒温箱(DH3600,天津泰斯特仪器有限公司);显微镜(Nikon Ci-S,日本尼康公司);成像系统(DS-FⅠ2,日本尼康公司);摇床(上海智诚分析仪器制造有限公司)。
1.2 实验动物
胸骨植入实验采用12个月的普通级小尾寒羊,18只,雌雄各半,体重为(45±5) kg,由北京迈迪思维生物技术有限公司提供,动物使用许可证号:SYXK(京)2021-0024。实验前将在实验机构内预适应7 d。实验获得北京迈迪思维生物技术有限公司动物伦理委员会审批(批准文号:MDSV-2021-004A)。
急性毒性试验采用昆明小鼠(雄性,体重15 ~ 17 g)20只,每5只小鼠一笼,添加饲料足量,饮水瓶给水;刺激试验动物采用SPF级新西兰大白兔(雄性,体重2.5 ~ 3 kg)6只,单笼喂养,添加饲料足量,饮水瓶给水。小鼠实验动物许可证号为SYXK(京)2017-0013,兔实验动物许可证号为SCXK(京)2019-0017,均由中国食品药品检定研究院提供。
1.3 骨植入实验
实验品:新型可吸收骨蜡,由北京颐合恒瑞医疗科技有限公司生产。
对照品:目前国内已上市的同类产品均为以蜂蜡为主材的非吸收性产品,尚无可吸收性产品上市。因此,选择已上市的非吸收性同类产品,即强生医疗器械有限公司生产的ETHⅠCON骨蜡(BONEWAX,W810,2.5 g,国械注进20163133039)作为对照品,其是目前外科手术中最常用的止血产品之一。
18只小尾寒羊在给药时的体重差异不超过平均体重的10%。小尾寒羊异氟烷麻醉满意后,于胸骨行纵切口,切开皮肤、皮下组织和深筋膜,暴露胸骨断面见活动性出血。胸骨断面的长度为20 cm,深度为胸骨贯穿伤,暴露心脏。纱布初步处理出血后,用预先揉捏至可塑形状态的实验品或对照品进行填塞止血,空白组胸骨切开术后只用纱布处理出血。
将18只小尾寒羊随机分为2、6、12周时间点的实验组、对照组和空白组,每个时间点6只。同一只羊的每节胸骨(共6节)作为1个独立的植入位点,每只实验动物的胸骨上随机选择各2个植入位点分别植入实验品(实验组)和对照品(对照组)[8-9],剩余2个植入位点作为空白(空白组),对术中止血情况进行记录。在术后饲养2、6、12周的时间节点各随机处死6只试验羊(每个时间点每组12节胸骨),并取胸骨做病理检测。
为保证与对照组、空白组进行比较时具有足够的组间差异检出能力,共对18只实验用小尾寒羊进行实验,且每个产品每个时间点分别在6只羊上进行实验。每个时间点各组产品有12个平行样进行相关评价。结合临床实际使用情况,保证每个植入位点的样品使用量不低于160 mg,保持植入的每个样本量基本一致。实验位点使用可吸收骨蜡进行止血,对照位点使用强生骨蜡进行止血,空白位点不使用产品。于术后2、6、12周时,分别将实验用羊处死,并将已实验的胸骨部位组织取出,福尔马林固定以进行病理评价[9-12]。通过组织病理切片分析确认材料的体内降解周期[13-16]。
实验品植入2、6、12周的炎症反应与空白组、对照组有无明显差别。植入后局部组织学评价标准依据GB/T16886.6—2015附录E[17],参见表1和表2。
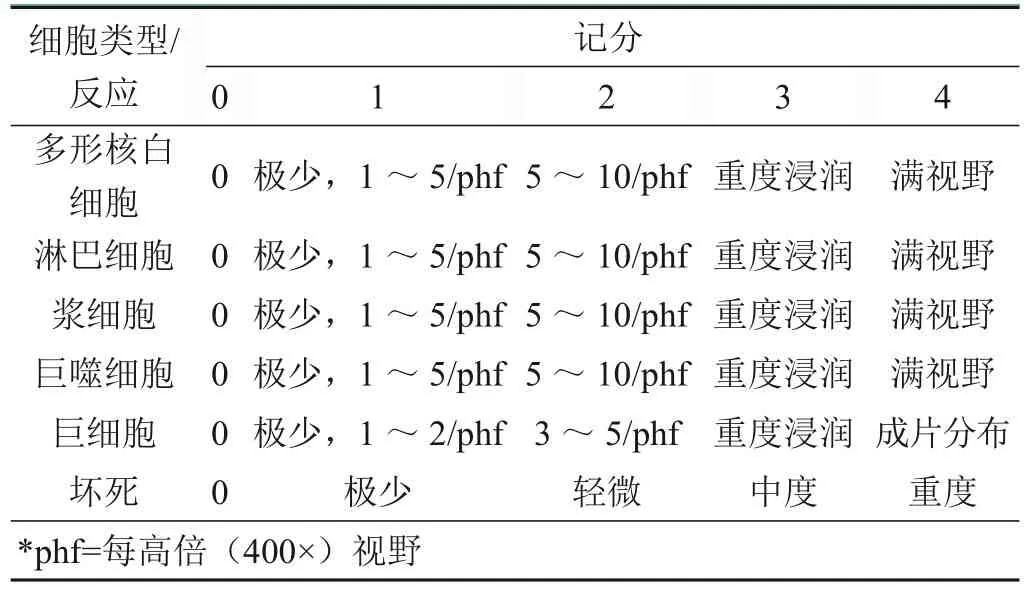
表1 组织学评价系统举例——细胞类型/反应

表2 组织学评价系统举例——反应
按以上的评分标准,各组间比较组织反应,两组之间的评分相减后计算得分,实验样品得分的判定标准为:①无刺激(0.0 ~ 2.9);②轻微刺激(3.0 ~ 8.9);③中度刺激(9.0 ~ 15.0);④重度刺激(>15.0)。
1.4 急性毒性实验
取昆明小鼠20只,随机分为4组,每组5只。其中两组分别尾静脉注射生理盐水对照、可吸收骨蜡的浸提液(50 mL/kg,生理盐水样品组),另外两组分别腹腔注射玉米油(玉米油对照组)、可吸收骨蜡的玉米油浸提液(50 mL/kg,玉米油样品组)。记录注射后第1、2、3 d观察到的小鼠的毒性症状,并记录小鼠的体重变化,若发现死亡动物则需要进行尸检并隔离濒死动物。
1.5 刺激试验
取6只新西兰大白兔,分为4组:生理盐水对照组和生理盐水样品组,玉米油对照组和玉米油样品组。其中3只兔子在脊柱左边选5个点注射生理盐水对照,每点间隔2 cm,在脊柱右边选5个点注射可吸收骨蜡生理盐水浸提液,各点注射量为0.2 mL。另外3只兔子相同操作,左边注射玉米油对照,右边注射可吸收骨蜡玉米油浸提液。在注射的1、2、3 d观察记录各个注射部位的情况,对每个观察期各注射部位的红斑和水肿的组织反应评分,并记录实验结果。
3只兔子记分相加后除以3得出每一试验样品和相应的生理盐水对照和玉米油对照平均积分,试验样品的平均积分减去相应对照的平均记分得到刺激指数。刺激指数小于1为无刺激。
1.6 统计学方法
使用SPSS 26.0软件进行统计学分析。所有统计检验均采用双侧检验,定量指标的描述将计算均值、标准差,分类指标描述各类的例数及百分数。定量资料的组间比较采用One-way ANOVA差异性分析。P<0.05为差异有统计学意义。
2 结果
2.1 骨植入试验结果
2.1.1 术中止血情况
本研究中的实验组和对照组在术中涂抹3 min后均起到显著止血效果:创面出血完全停止,止血效果明显,材料黏附牢固,无脱落。空白组止血效果为无效:创面仍有明显渗血。
2.1.2 术后一般状况
小尾寒羊术后2、6、12周时均无创口感染、出血、血肿或其他任何异常临床症状出现,创口均已愈合。18只羊呼吸、运动、饮食、排便均正常。
2.1.3 组织病理学结果
小尾寒羊于术后2周的胸骨切片HE染色结果如图1所示。术后2周,可见骨组织出现断裂,两侧断离面呈现大量坏死的骨组织和渗出物,可见不同数量的破骨细胞浸润。骨组织断离面端可见有带状的纤维化的肉芽组织出现,其中有炎性细胞浸润,伴有明显的充血、水肿和出血。各张切片中肉芽组织的厚度不一致。各组切片骨折处均存在由骨折时的暴力造成的创伤性坏死骨组织和渗出物,由于大量坏死组织和渗出物的存在而未被清除,虽然可见少量新骨组织的再生,但在各组之间没有明显的差别。
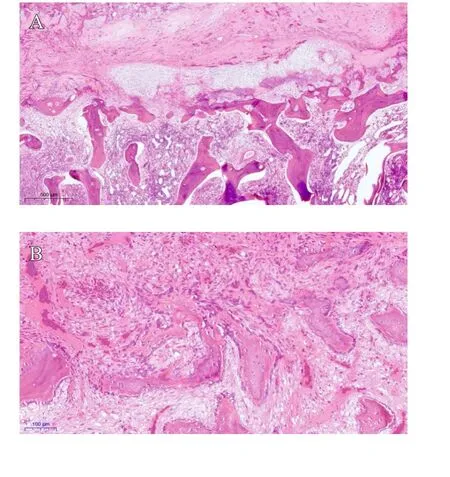
图1 术后2周小尾寒羊胸骨切片HE染色图:A. 空白组(×50);B. 对照组(×200);C. 实验组(×200)
小尾寒羊于术后6周的胸骨切片HE染色结果如图2所示。术后6周,各组切片骨折处都存在由增生的纤维结缔组织和骨小梁构成的骨痂。骨折处残存的未被吸收的坏死组织在对照组中可见最多;空白组次之;而在实验组中最少。骨小梁在实验组中可见最多;空白组次之;而在对照组中较少。
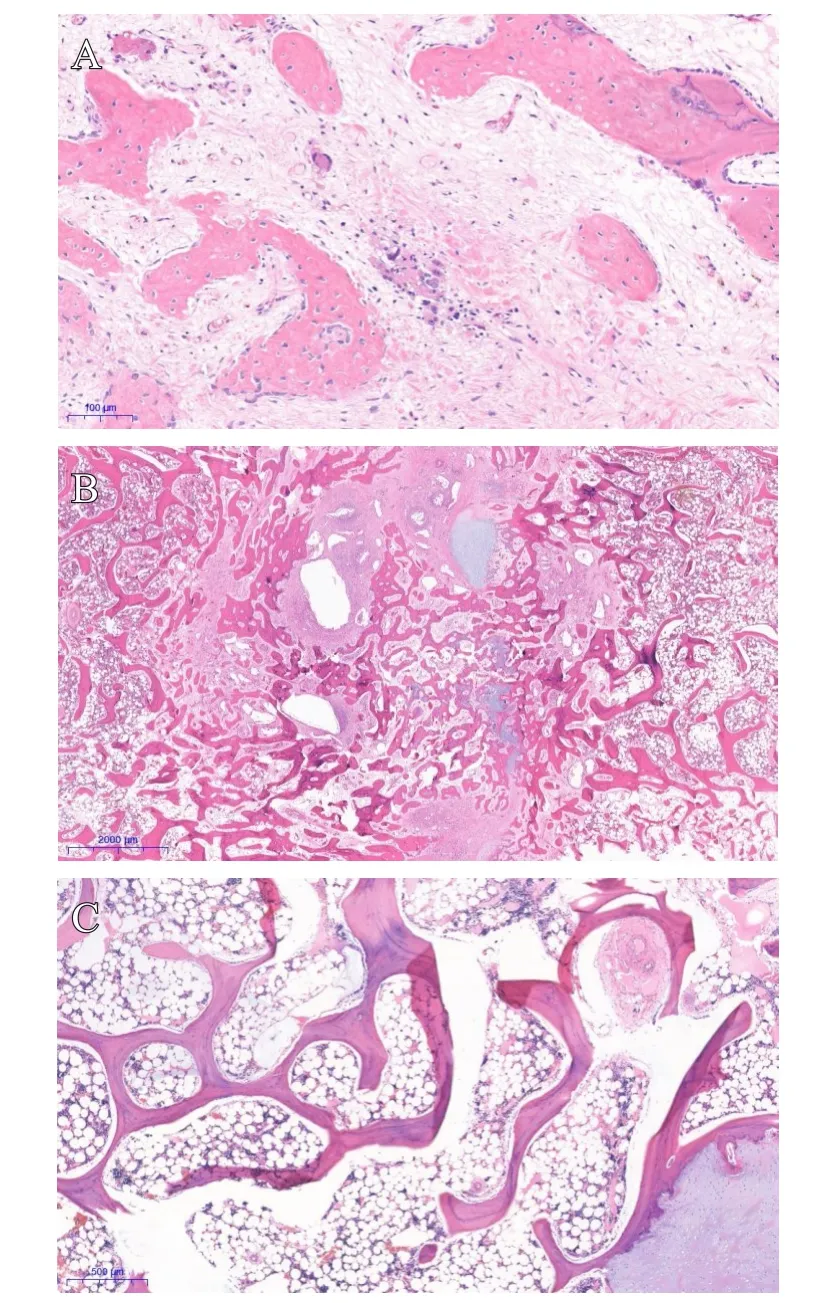
图2 术后6周小尾寒羊胸骨切片HE染色图:A. 空白组(×200);B. 对照组(×10);C. 实验组(×50)
小尾寒羊于术后12周的胸骨切片HE染色结果如图3所示。术后12周,空白组切片骨折处残存病变最少,仅可见骨小梁稍微增多,排列稍微不整,分布不均匀;实验组次之,除骨小梁稍微增多,排列稍微不整,分布不均匀之外,可见少数切片中残存少量坏死组织,并可见残存有软骨;而对照组残存较多,每例都可见残存的坏死组织以及周围的组织反应和炎性细胞浸润,少数切片中可见有残存的软骨。
图3 术后12周小尾寒羊胸骨切片HE染色图:A. 空白组(×20);B. 对照组(×20);C. 实验组(×100)
2.1.4 组织病理学半定量评分结果
组织病理学半定量评分结果如表3所示。

表3 组织病理学半定量评分结果(分)
2周时,实验组和空白组与对照组相比为0,判定为无刺激(0 ~ 2.9)。
6周时,实验组与空白组相比为1,判定为无刺激(0 ~ 2.9);而对照组与实验组相比为9.6,判定为中度刺激(9.0 ~ 15.0)。
12周时,实验组与空白组相比为1.7,判定为无刺激(0 ~ 2.9);而对照组与实验组相比为9,判定为中度刺激(9.0 ~ 15.0)。
2.1.5 体内降解周期
在病理切片图1-3中,实验组缺损处2周时观察到大量样品。6周时样品明显崩解,崩解后的样品最大不超过300 μm,分散在新骨空隙处。降解过程中未见纤维组织包囊,新骨生长明显,至12周时,少数切片偶见样品残余且不超过50 μm,样品已基本降解,新骨连接两断端,骨损伤已得到修复。
对照组于6、12周时在损伤处仍残留较多样品。样品未见明显降解,引起纤维组织增生形成包囊而阻挡新骨形成,至12周时,骨缺损间隙明显。
2.2 急性毒性实验
在急性毒性实验中,小鼠在样品浸提液注射后1、2、3 d的体重变化情况如图4所示。
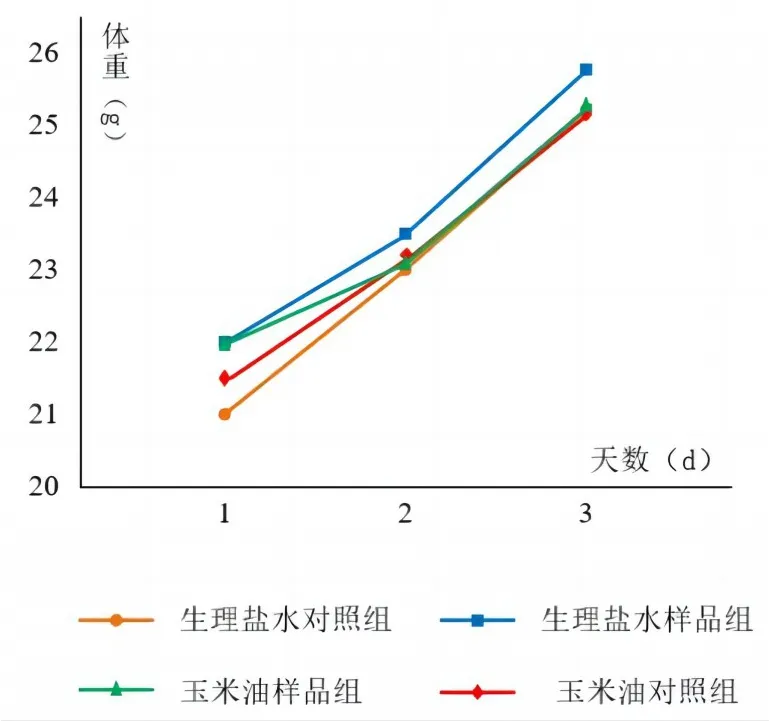
图4 急性毒性试验中小鼠的体重变化
在整个试验过程中,各组小鼠均未出现毒性表现,也未出现死亡的实验个体。玉米油样品组的小鼠和玉米油对照组相比,生理盐水样品组的小鼠和生理盐水对照组相比,小鼠的体重均呈增长的趋势。因此,可以得出可吸收骨蜡不具备急性毒性。
2.3 刺激试验
样品组3只兔子注射后1、2、3 d记分相加后除以3,减去相应对照组的平均积分,得到生理盐水样品组刺激指数为0,不大于1,玉米油样品组刺激指数为0.11,不大于1。
3 讨论
目前,常用的传统骨蜡在骨科手术骨断面止血方面效果显著,简单易用,但其存在的最大问题在于材料的不可吸收性,尽管是常用的骨止血剂,但已有研究表明其会阻碍骨愈合[18],引发慢性炎症反应、增加感染率,这一缺陷限制了骨蜡在骨性融合术后创面止血方面的应用,患者失血量的增加不仅给手术带来极大不便,而且对于其预后也会产生一定的影响[19]。由于骨蜡的不可吸收性,可以使用胶原蛋白和氧化纤维素等经典的可吸收止血剂作为骨蜡的替代产品在骨止血方面加以应用。然而,这类材料因其在骨骼内缺乏黏附性,其储存稳定性、生物相容性等方面也存在问题,这些不足使经典的可吸收止血剂在骨止血方面的应用受到限制[20]。因此,在传统骨蜡的有益特性的基础上,解决其不可吸收性,使其成为在体内可降解的材料可能是临床骨损伤表面出血的好方法。
以往的对骨蜡植入动物后安全性评价试验都是采用小型动物进行试验,选择的动物骨缺损部位也不同,有的研究使用SD大鼠颅骨缺损动物模型[21],有的研究使用家兔股骨缺损模型[8]。本研究使用大型动物小尾寒羊的胸骨损伤动物模型,与小型动物模型相比更接近于临床真实结果。
组织病理学是最常用的观察植入部位生长和炎症情况的方式,通过组织病理学可以直观反映新型可吸收骨蜡植入小尾寒羊后植入部位的新骨生成,组织病理学的半定量评分则能半定量反映植入部位的炎症情况。本研究通过组织病理学发现,实验组骨折修复效果最好,可见大量新生骨小梁,骨缺损处得到一定的修复,可观察到红细胞、脂肪细胞等结构,缺损部位血供正常。未降解的植入样品分散在骨缺损后新骨生长的空隙处,且对局部组织显示无刺激。对组织病理学进行半定量评分:实验组可吸收骨蜡与空白组相比,样品植入胸骨损伤表面2、6、12周,显示为无刺激;对照组不可吸收骨蜡与实验组可吸收骨蜡相比,植入6、12周,显示中度刺激。新型可吸收骨蜡植入后引起的组织学反应与对照相比更加轻微。
植入物的降解速度若与组织生长速度不匹配,则可能会阻碍骨骼愈合速度并影响愈合质量,同时可吸收植入材料滞留体内时间过长,往往会导致慢性炎症的发生,影响骨组织愈合。所以本研究对新型可吸收骨蜡植入小尾寒羊进行了体内降解周期的观察发现体内降解周期为2周时,实验组可吸收骨蜡在骨损伤处有大量实验品残留;6周时实验品实验组可吸收骨蜡明显崩解,崩解后的样品最大不超过300 μm;12周时,实验组可吸收骨蜡已基本降解完全。
新型可吸收骨蜡在小尾寒羊胸骨创面进行止血后,其降解速度与组织生长速度匹配,小尾寒羊胸骨病理结果中可见大量新生骨小梁。可吸收骨蜡在一定时间内可以被机体吸收,并且对于骨折的愈合不会产生不良影响。
在急性毒性试验中,生理盐水样品组和玉米油样品组均未出现呕吐、走路不稳等临床反应,且每组的体重均正常增长,说明了该可吸收骨蜡不具有急性毒性。在刺激试验中,玉米油样品组的新西兰大白兔和玉米油对照组相比,生理盐水样品组的新西兰大白兔和生理盐水对照组相比,未出现泛红、水肿等皮肤刺激症状,说明该可吸收骨蜡不具有刺激毒性。
综上,本研究中的新型可吸收骨蜡是一种安全、无急性毒性、无刺激性、可用于骨创面止血的材料。并且,由于这种新型可吸收骨蜡具有可以在体内逐渐降解的特性,比传统骨蜡更有优势。这种新型可吸收骨蜡不会阻碍新骨组织生成,所以更有利于骨组织修复,在临床上有望替代传统骨蜡,成为理想的骨表面损伤止血材料。
