响应面法优化六妹羊肚菌原生质体的制备条件
2023-10-20李丰硕冀宝营韩冰孙立梅王洪奇柴林山池景良
李丰硕,冀宝营,韩冰,孙立梅,王洪奇,柴林山,池景良
(辽宁省微生物科学研究院,辽宁朝阳 122000)
羊肚菌[Morchella esculenta(L.)Pers]属于真菌界子囊菌门(Ascomycota)盘菌纲(Pezizomycetes)盘菌目(Pezizales)羊肚菌科(Morchellaceae)羊肚菌属(Morchella),是羊肚菌属的模式种[1]。羊肚菌菌丝易老化,可形成“假菌核”以适应不良的环境条件[2]。 其风味独特,子实体富含维生素、蛋白质、类固醇、矿物质、多糖和多核苷酸等物质,是兼备药用价值和经济效益的食用菌[3]。 自2000 年四川省林业科学院首次研发外营养添加技术至2015 年技术逐步成熟,我国羊肚菌产业进入了快速发展时期,最近5 年羊肚菌的人工商业化栽培发展十分迅速,栽培区域从最初的四川、云南等地扩展到辽宁、河北等20 余省(市、自治区)[4-5]。
近年来,借力短视频,“羊肚菌热”在全国兴起,羊肚菌栽培面积连年增加,产业发展势头强劲,但“不确定性”一直是羊肚菌栽培种植过程中的突出问题。 据统计,约70%种植户的盈利能力较差,平均每公顷新鲜羊肚菌产量不足1 500 kg。对于有经验、有可靠种源的农户来说,栽培产量可能会高些,小规模种植时偶尔会超过6 000 kg/hm2,但好收成很难重复实现,不确定性的关键是缺乏可靠的育种技术[6]。 同时,羊肚菌作为子囊菌,与担子菌相比,菌种容易老化和退化,因而保证羊肚菌的菌种质量稳定性和培育高品质的可栽培菌株是其生产成功的关键因素,这就对羊肚菌育种工作提出许多新的要求[7]。 原生质体技术具有试验周期短、易于操作、可进行单核体的快速分离等特点,可以在种内、种间、属间和异种间进行融合操作,不仅在高等植物领域应用广泛,在野生菌种驯化、品种改良与选育等方面也取得长足发展。 原生质体技术的有效应用离不开高效的原生质体分离和再生,因此,优化其制备条件是获得优质原生质体的基础[8]。
原生质体的制备受多种因素的交互影响,如酶解时间、酶解温度、酶质量分数以及稳渗剂种类和浓度等,响应面法可以对多个因素的组合效应进行研究,从而找到最优的试验条件[9]。 孙佳星等[10]利用响应面法对香菇原生质体制备条件进行优化得出,在酶解液浓度1.7%、30.49 ℃条件下酶解3.25 h,原生质体产量为14.02×106CFU/mL;娄海伟等[11]发现在2.06%溶壁酶、26.1 ℃条件下酶解2.57 h,蛹虫草单核芽生孢子原生质体得率可达(9.17±0.29)×106个/mL。 目前还未见到基于响应面法优化羊肚菌原生质体制备条件的相关报道,制备条件间的相互作用效应也不清晰。 因而本研究结合单因素试验结果,应用响应面法进一步对羊肚菌原生质体制备条件进行优化,以期获得高产、优质的原生质体,为后续羊肚菌交配型分析、同核体分离及融合等工作的开展提供优良的试验材料。
1 材料与方法
1.1 试验材料
1.1.1 菌株与试剂 六妹羊肚菌菌株(Morchella sextelataZP-01),由辽宁省微生物科学研究院食用菌栽培研究室分离保存。 溶壁酶(广东省微生物菌种保藏中心)和纤维素酶、蜗牛酶(上海源叶生物科技有限公司),均为生物技术级。 甘露醇、蔗糖等化学制剂为国产分析纯。
1.1.2 主要溶液及培养基 PDA 培养基:去皮马铃薯200 g(煮沸30 min,取汁,下同),葡萄糖20 g,琼脂粉15 g,蒸馏水定容至1 000 mL;PDB 培养基:去皮马铃薯200 g,葡萄糖20 g,蒸馏水定容至1 000 mL;再生培养基:去皮马铃薯200 g,葡萄糖20 g,胰蛋白胨1 g,酵母浸粉1 g,甘露醇109.3 g(0.6 mol/L),琼脂10 g,蒸馏水定容至1 000 mL。 稳渗剂:称取10.93 g 甘露醇、3.51 g NaCl、7.2 g MgSO4、20.54 g 蔗糖分别溶解于100 mL 无菌水中。 以上培养基以及稳渗剂均于1×105Pa 下灭菌20 min。
酶解液:质量分数2%的溶壁酶、蜗牛酶和纤维素酶液,经0.22 μm 无菌滤膜过滤,现配现用。
1.2 试验方法
1.2.1 菌丝体培养 将PDA 培养基上培养的菌丝连带培养基切成2~3 mm 小块,接种5 ~6 块至PDB 培养基,置于20 ℃黑暗条件静置培养1 d,再于20 ℃、150 r/min 下培养3 d,用于羊肚菌原生质体的制备。
1.2.2 原生质体的制备及再生 将PDB 液体培养基中培养的新鲜幼菌丝分别用无菌蒸馏水和0.6 mol/L 甘露醇洗涤3 次,然后用无菌滤纸吸干水分。 称取菌丝200 ~300 mg 置于2 mL 离心管中,加入3 倍体积的酶解液约1.5 mL,振荡混匀,置于恒温金属浴中酶解,每30 min 振荡一次,保证酶解液与菌丝充分接触,得到酶解后的原生质体粗提取液;将粗提液用顶端含1 cm 灭菌脱脂棉柱的注射器过滤纯化,滤液经3 000 r/min 离心5 min,弃上清液,再经稳渗剂洗涤2 次,获得纯化后的原生质体,立即将沉淀重新悬浮于稳渗剂中,400 倍显微镜下用血球计数板计数,即为原生质体产量。
用稳渗剂将原生质体稀释至105个/mL。 吸取100 μL 原生质体悬浮液均匀涂布至装有再生培养基的90 mm 培养皿中,20 ℃黑暗培养,一般3 d 能够看到原生质体再生的菌落。 再生率为再生的原生质体数量占涂布原生质体数量的比值。为排除可能存在菌丝碎片的影响,以PDA 培养基为对照计算原生质体再生率,公式为:原生质体再生率(%)=(再生培养基萌发菌落数-对照PDA培养基萌发菌落数)/涂布原生质体数×100[12-13]。
1.2.3 单因素试验设计 在预试验的基础上,以原生质体产量为评价指标,选取酶解时间(1、2、3、4、5 h)、酶解温度(20、25、30、35、40 ℃)、酶质量分数(1%、2%、3%、4%)、稳渗剂种类(NaCl、MgSO4、甘露醇、蔗糖,均为0.6 mol/L)进行单因素试验,重复3 次。
1.2.4 响应面试验设计 在单因素试验基础上,选取酶解时间(A)、酶质量分数(B)、酶解温度(C)为自变量,原生质体产量(Y)为响应值,根据单因素试验结果确定自变量的变化区间,经Box-Behnken 设计17 次试验。 试验设计因素及水平见表1。

表1 响应面法因素和水平设计
1.3 数据统计与分析
采用Microsoft Office 2021 统计数据,SPSS 26.0 对数据进行相关性及显著性差异分析,Design-Expert 13.0 设计响应面试验方案并对结果进行分析,Origin 2021 制图。
2 结果与分析
2.1 羊肚菌原生质体制备的单因素试验结果
2.1.1 不同酶解时间条件下原生质体产量及再生率 在酶质量分数2%、甘露醇作稳渗剂、酶解温度30 ℃条件下,分别进行1、2、3、4、5 h 酶解试验。 由图1 可知,羊肚菌原生质体产量和再生率先随时间的延长而升高,均在酶解3 h 达到最高值,分别为3.96×105个/mL 和1.2%。 再生率对酶解时间的响应更为迅速,酶解3 h 与4 h 差异显著,原生质体产量差异不显著;超过4 h,产量与再生率均快速降低。 选择2 ~4 h 为酶解时间较为适宜。

图1 不同酶解时间条件下原生质体产量及再生率
2.1.2 不同酶质量分数条件下原生质体产量及再生率 由于羊肚菌菌丝壁不能被完全酶解,前人的相关研究多采用组合酶,故本研究采用以溶壁酶、蜗牛酶、纤维素酶的组合酶系作为水解酶。分别选取质量分数1%、2%、3%、4%的组合酶进行酶解试验,结果如图2 所示。 在酶解温度30 ℃、甘露醇作稳渗剂、酶解时间3 h 的条件下,2%和3%质量分数的组合酶作用下的原生质体产量差异不显著,但再生率在2%时达到最大值;当酶质量分数超过3%时,再生率和原生质体产量显著降低。 选取1%~3%酶质量分数为适宜酶解液浓度。

图2 不同酶质量分数条件下原生质体产量及再生率
2.1.3 不同酶解温度条件下原生质体产量及再生率 如图3 所示,在甘露醇作稳渗剂、2%组合酶液、酶解3 h 条件下,当酶解温度30 ℃时,原生质体产量和再生率均达到最大值,分别为4.67×105个/mL 和1.44%,酶解温度20 ℃与25 ℃再生率差异不显著,30 ℃与35 ℃原生质体产量差异不显著。 40 ℃时由于酶活性的变化,原生质体产量和再生率均显著下降,因此选择适宜酶解温度范围为25~35 ℃。
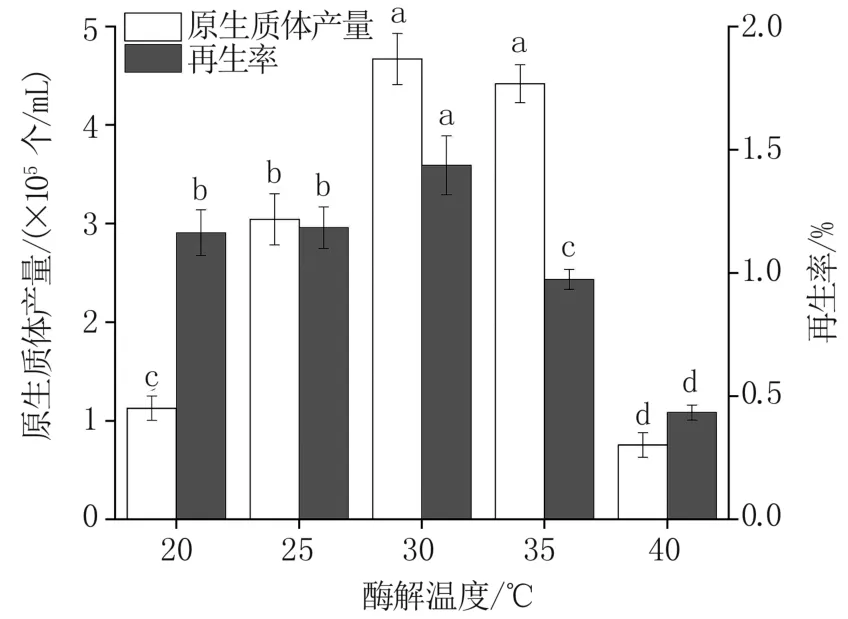
图3 不同酶解温度条件下原生质体产量及再生率
2.1.4 不同稳渗剂条件下原生质体产量及再生率 以30 ℃、2%组合酶液酶解3 h 为基本条件,不同种类稳渗剂中原生质体产量和再生率结果如图4。 用甘露醇作为稳渗剂的原生质体产量最高,蔗糖作为稳渗剂再生率最高,但两者再生率差异不显著。 故选用甘露醇为羊肚菌原生质体制备的稳渗剂。

图4 不同稳渗剂条件下原生质体产量及再生率
2.2 羊肚菌原生质体制备的响应面优化试验结果
2.2.1 响应面优化设计试验结果 在单因素试验基础上,采用Box-Behnken 设计17 组试验,结果如表2。 采用Design-Expert 13.0 软件对试验结果进行分析,如表3 所示。 该模型的F 值为39.11,P<0.0001,失拟项P值为0.685、不显著,故该模型高度显著;决定系数R2=0.9805,校正决定系数Adjusted R2=0.9554,说明拟合度较好,误差小,模型有效可靠,可充分体现自变量与羊肚菌原生质体产量间的相互关系,可做预测应用。 A、B、C、BC、A2、B2、C2均达极显著水平,AC 达显著水平,即酶解时间、酶质量分数、酶解温度及酶质量分数与酶解温度间的交互作用对羊肚菌原生质体的制备有极显著影响,酶解时间与酶解温度的交互作用有显著影响。
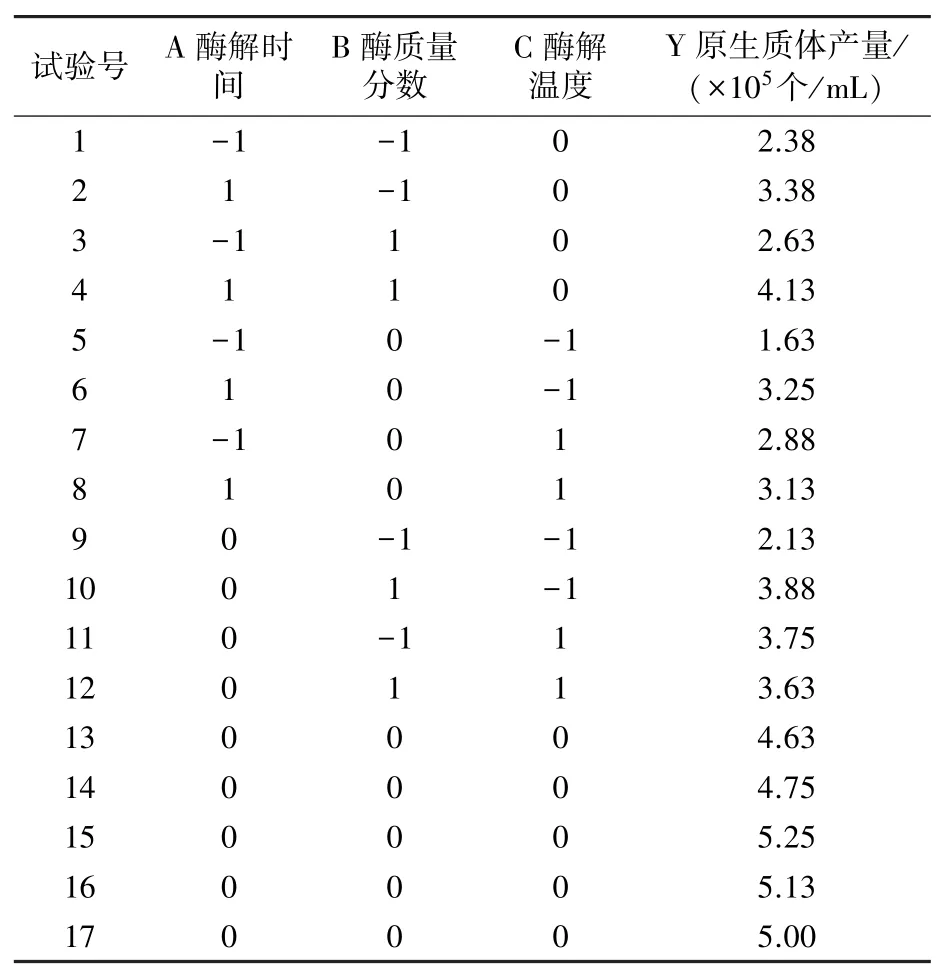
表2 响应面试验设计与结果

表3 回归方程的方差分析
为预测最优点,以酶解时间(A)、酶质量分数(B)、酶解温度(C)为自变量,原生质体产量(Y)为因变量,剔除不显著项,得到最终拟合方程:
Y =-59.86575+9.69225A+5.15275B+2.8694C-0.0685AC-0.0935BC-1.2235A2-0.5985B2-0.04024C2。
对各因子的显著性和F 值分析可知,制备条件对原生质体产量的影响程度:酶解时间>酶质量分数>酶解温度。
2.2.2 响应面交互作用分析 为了更好地评价三因素之间的交互作用效果,建立了三维响应曲面和二维等高线图,如图5 至图7 所示。 图5A、B显示,在固定酶解温度30 ℃条件下,酶解时间从2 h延长至4 h,酶质量分数由1%增加到3%,原生质体产量均呈现先增大后减小的趋势,等高线近似圆形,结合P值为0.3151>0.05,说明两者的交互作用不显著;图6A、B 显示了固定酶质量分数2%条件下,酶解时间从2 h 延长至4 h,酶解温度由25 ℃升至35 ℃,原生质体产量均呈现先增大后减小的趋势,等高线椭圆但接近圆形,结合P值为0.021<0.05,说明两者存在较弱的交互作用;图7A、B 显示,固定酶解时间3 h 条件下,酶质量分数与酶解温度交互作用的曲面最陡,从等高线图可看出,两者交互作用极显著(P<0.01)。 三组交互作用对原生质体产量的影响表现为BC>AC>AB,其中AB 之间的交互作用不显著。

图5 酶解时间与酶质量分数交互作用的响应面图(A)与等高线图(B)

图6 酶解时间与酶解温度的交互作用响应面图(A)与等高线图(B)
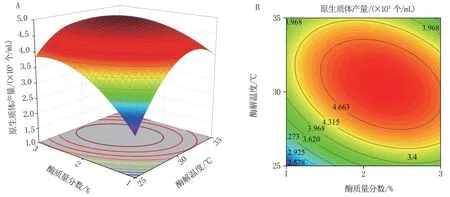
图7 酶质量分数与酶解温度交互作用的响应面图(A)与等高线图(B)
2.2.3 最适条件和回归模型的验证 基于上述回归方程,预测六妹羊肚菌原生质体最适制备条件,如图8 所示,在酶解时间3.23 h、酶质量分数2.28%、酶解温度30.26 ℃条件下,产量可达5.07×105个/mL。 考虑试验的可操作性,验证试验选取条件为酶解时间3.2 h、酶质量分数2.3%、酶解温度30 ℃,稳渗剂选择0.6 mol/L 的甘露醇,重复3次,原生质体产量达到(5.13±0.13)×105个/mL,与预测结果的差异不显著,说明响应面法用于羊肚菌原生质体制备条件优化可行。
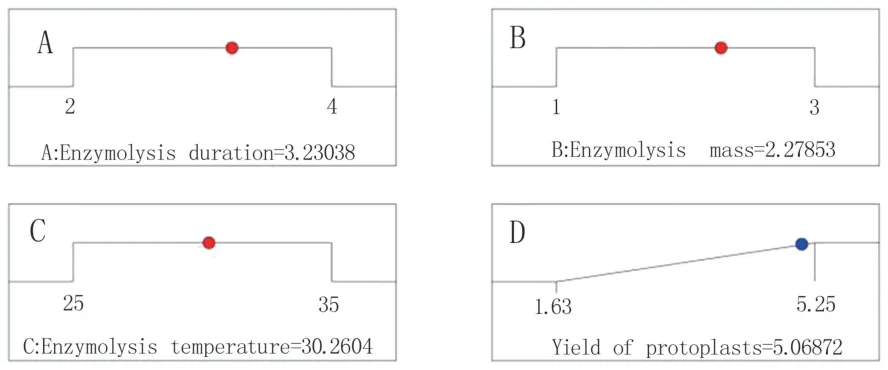
图8 六妹羊肚菌原生质体最适制备条件
2.3 羊肚菌原生质体的显微观察
在上述最优条件下制备羊肚菌原生质体,将纯化后的原生质体稀释至105个/mL,在1 000 倍油镜的明场显微镜下观察,共观察到67 个原生质体,直径大小分布如图9 所示,个体大小以2 ~7 μm 居多;10 μm 以下的原生质体形态如图10,可供后期融合等操作参考。

图9 原生质体直径分布

图10 1 000 倍油镜下原生质体形态
3 讨论
羊肚菌菌丝壁不能被完全酶解,部分细胞壁困住了原生质体,使其难以全部释放出来,本研究也观察到类似现象。 无论是真菌还是高等植物,在进行原生质体分离时,组合酶相比单一酶能更加有效地溶解细胞壁中的纤维素、角质等物质,因而在预试验期间,选用单一溶壁酶、溶壁酶+蜗牛酶、溶壁酶+蜗牛酶+纤维素酶三种形式的酶系进行原生质体制备试验,结果发现溶壁酶+蜗牛酶+纤维素酶的组合酶效果最佳,同时要选用针对食用菌菌丝壁有强破壁效果的溶壁酶,否则效果会大打折扣[14-17]。
本研究综合单因素试验、响应面优化试验,探究各影响因素对六妹羊肚菌原生质体制备的影响,结果表明,酶解时间对羊肚菌原生质体产量影响最大。 这可能与羊肚菌菌丝细胞壁中有大量S-葡聚糖有关,需要更长的酶解时间以破坏菌丝壁,释放原生质体;随着酶质量分数增加,原生质体产量和再生率呈现先增加后降低的趋势,并且在超过3%后急剧下降,这可能是因为细胞膜的完整性和原生质体的生理活性受到酶的影响,浓度过高的酶液对原生质体膜产生了毒性作用[18-20]。 适当的酶解温度同样非常重要,可以提高酶活性,但过高的酶解温度会导致酶失活,本研究也验证了此现象,即在酶解温度40 ℃时原生质体产量下降明显,并且酶解温度与酶质量分数交互作用显著,因此,试验过程要保证酶解温度充分可控,偏差不超过±1 ℃。
由于不同物种的细胞壁组成不同,因此不同物种细胞对渗透压的选择是不同的[21]。 本研究选择0.6 mol/L 甘露醇作为稳渗剂制备原生质体的效果最佳,这与王珂[22]制备羊肚菌原生质体稳渗剂的选择结果相一致;但与陈芳草等[13]以0.3 mol/L KCl 和0.3 mol/L 环己六醇配合使用再生率高的结果不一致。 分析其原因,可能与所用菌株的特性相关,本研究使用的六妹羊肚菌子实体中等至稍大,菌盖呈圆锥形,成熟期菌盖为褐色至黑褐色,子实体长8 ~15 cm,为商品化栽培菌种。本研究原生质体再生率最高的稳渗剂为0.6 mol/L蔗糖溶液,这与崔宗强等[15]的研究结果一致,考虑兼顾原生质体产量,本研究最终选择0.6 mol/L甘露醇为原生质体制备和再生过程中的稳渗剂。但本研究中羊肚菌原生质体产量和再生率均偏低,远低于香菇、蛹虫草、玉木耳等,还需进一步研究探索。
4 结论
本研究经响应面法优化获得羊肚菌原生质体制备的最佳条件:酶解时间3.2 h、酶质量分数2.3%、酶解温度30 ℃、稳渗剂0.6 mol/L 甘露醇,在此条件下原生质体产量可达(5.13±0.13)×105个/mL;酶解条件对原生质体得率的影响程度为:酶解时间>酶质量分数>酶解温度。 本研究结果可为后续羊肚菌原生质体融合、单核自交、杂交等优良菌种的选育提供技术支撑。
