基于牛支原体P48蛋白间接ELISA检测方法的建立
2023-10-19陈志远李树凡迟丽丽于泽海刘健张玫瑜徐守振
陈志远,李树凡,迟丽丽,于泽海,刘健,张玫瑜,徐守振
(青岛农业大学动物医学院,山东 青岛 266109)
牛支原体(Mycoplasmabovis)是柔膜体纲、支原体属中的一员,是引起牛病的一种重要的致病性病原体,在1961年被鉴定为致乳腺炎的病原,1976年被描述为呼吸道疾病的病因并命名为牛支原体[1]。现在证实牛支原体还可以导致牛的关节炎、流产、生殖道炎症等多种疾病[2]。牛群运输、饲养管理、环境变化等都可能引起牛支原体的流行,给养殖业带来巨大危害。近年来随着养牛业的不断发展,养殖规模的不断扩大,牛支原体感染已呈世界性分布,日本、欧洲、美国都暴发过牛支原体肺炎,造成了巨大的经济损失[3-4]。2008年,我国首次出现了支原体引起的牛坏死性肺炎疫情[5]。2010年湖北省从外地引进的肉牛出现了以坏死性肺炎为主要特征的呼吸道传染病并在全省快速传播[6],在中国十多个省份报道了牛支原体肺炎病例,危害十分严重,造成的经济损失巨大[7]。牛支原体引起的疾病严重阻碍了我国养牛业的健康发展。因此,深入对支原体蛋白的研究,建立准确而快速的牛支原体抗体检测方法是十分必要的。
由于支原体缺乏细胞壁,所以支原体细胞膜表面的膜蛋白在侵袭过程中起着非常重要的作用。目前认为,牛支原体主要通过膜蛋白纤毛,促进炎性因子的分泌、激活炎症信号通路等方式干扰宿主细胞膜表面受体的功能,导致宿主细胞膜损伤甚至引起细胞凋亡[8]。P48蛋白广泛存在于支原体表面,影响宿主细胞的黏附作用,与致病机理密切相关。支原体P48蛋白与其他膜蛋白相比,不同菌株间的基因序列同源性极高,具有保守性高的优势[9],可用作牛支原体诊断的靶标抗原,适用于诊断试剂的开发[10]。由于支原体的特殊结构,普通的药物治疗效果不显著且没有成熟的商品化疫苗[11]。病原的分离周期长,营养要求高,需要专业人员和仪器设备,因而无法适应牧场大量牛群筛选工作。ELISA有着高通量、操作简单快捷、灵敏性及特异性好等优点,被广泛应用于牧场检测和筛查牛支原体。目前,用P48全蛋白建立抗体ELISA检测方法未见报道。因此,本研究选取P48全蛋白进行可溶性表达、纯化和Western blot鉴定,建立牛支原体抗体间接ELISA检测方法,对该病的诊断、抗体水平的评估和防控措施的制定都具有重大意义。
1 材料与方法
1.1 样品来源
牛支原体抗体阴、阳性血清,牛巴氏杆菌抗体阳性血清,牛曼氏杆菌抗体阳性血清,牛呼吸道合胞体病毒(BRSV)抗体阳性血清,牛传染性鼻气管炎病毒(IBRV)抗体阳性血清,牛病毒性腹泻病毒(BVDV)抗体阳性血清,牛结核病(MAP)抗体阳性血清均由青岛农业大学兽医微生物学实验室保存,临床血清收集自山东地区规模化奶牛场。
1.2 主要试剂和仪器
重组质粒pCold-P48由实验室前期构建,His蛋白纯化试剂盒购自康为世纪生物科技有限公司;马血清购自Biosharp公司;酪蛋白、牛血清白蛋白(BSA)、兔抗牛HRP标记抗体、TMB单组份显色液购自Solarbio公司;牛支原体ELISA抗体检测试剂盒购于国生生物;蛋白电泳仪、凝胶成像仪购自Bio-Rad公司;超声波细胞粉碎机购自宁波新芝股份生物科技有限公司。
1.3 方法
1.3.1 P48蛋白原核表达及纯化
重组质粒转化BL21(DE3)感受态细胞,培养至菌液OD600为0.5~0.8时,加入IPTG至终浓度为0.5 mmol/L,16 ℃、220 r/min培养12 h,离心收集菌体沉淀,蛋白超声破碎后,分别取上清液和沉淀进行SDS-PAGE,检测蛋白是否可溶性表达。按照蛋白纯化试剂盒说明书进行重组蛋白纯化。
1.3.2 表达产物Western blot鉴定
采用湿转法进行Western blot鉴定,100 V恒压转膜100 min;5% BSA封闭液室温封闭1 h;1∶2 000稀释鼠源抗His标签一抗,4 ℃孵育过夜;1∶2 000稀释兔抗鼠HRP标记抗体,室温孵育1 h;按照碧云天BeyoECL Plus试剂盒说明进行显色。
1.3.3 间接ELISA检测方法建立
对纯化后的P48蛋白,以间接ELISA方法为基础,采用单因素变量的试验方式,分别对影响间接ELISA反应的抗原包被浓度、最佳封闭液、一抗稀释度、二抗稀释度、抗原包被时间、封闭时间、一抗孵育时间、二抗孵育时间、显色时间等因素进行方阵优化,每孔做3次平行重复,并计算变异系数,以评估本方法的重复性。
1.3.4 间接ELISA方法阴阳性临界值确定
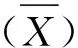
1.3.5 特异性试验
使用优化后的ELISA方法对牛支原体抗体阴、阳性血清,IBRV,BVDV,MAP,BRSV,牛巴氏杆菌,牛曼氏杆菌抗体阳性血清进行同步检测,以评估本ELISA方法的特异性。每孔做3次重复,并计算变异系数。
1.3.6 敏感性试验
将牛支原体抗体阳性血清倍比稀释至1∶160、1∶320、1∶640、1∶1 280、1∶2 560、1∶5 120、1∶10 240,使用优化后的ELISA方法进行检测,以评估本ELISA方法的敏感性。每孔做3次重复,并计算变异系数。
1.3.7 重复性试验
使用不同批次的蛋白包被酶标板,选取4份支原体阴性牛血清和4份牛支原体阳性牛血清进行检测,每个血清做6个重复。使用同一批次的P48蛋白包被,对8份牛血清进行检测,每个血清做6个重复,检测结果分别计算变异系数,判定其重复性。
1.3.8 临床样品检测
应用建立的ELISA方法与商品化牛支原体抗体ELISA检测试剂盒同时检测90份临床牛血清样品,比较检测结果,计算阴阳性符合率。
2 结果与分析
2.1 重组P48蛋白表达及鉴定
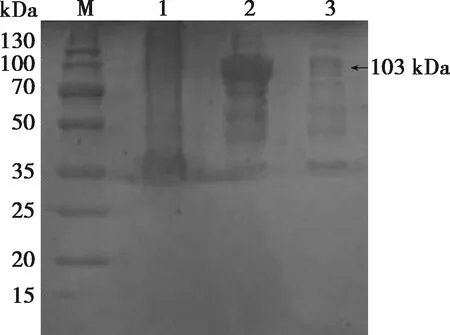
SDS-PAGE结果显示,超声破碎后分离上清液成功表达P48蛋白,大小为103 kDa,与预期大小相符(见图1),纯化后的蛋白与目的蛋白大小一致。Western blot鉴定结果显示,纯化后的重组P48蛋白在103 kDa处出现了特异性条带,目的蛋白大小与预期大小相符,说明表达的蛋白为目的蛋白(见图2)。
M. 蛋白质分子质量标准;1. 诱导后沉淀;2.诱导后上清液;3. 对照菌液。图1 P48蛋白的诱导表达分析
M. 蛋白质分子质量标准;1. 未诱导对照;2. 重组P48蛋白;3. 空载体。图2 重组蛋白的Western blot鉴定
2.2 间接ELISA方阵优化
2.2.1 最佳抗原包被浓度的确定
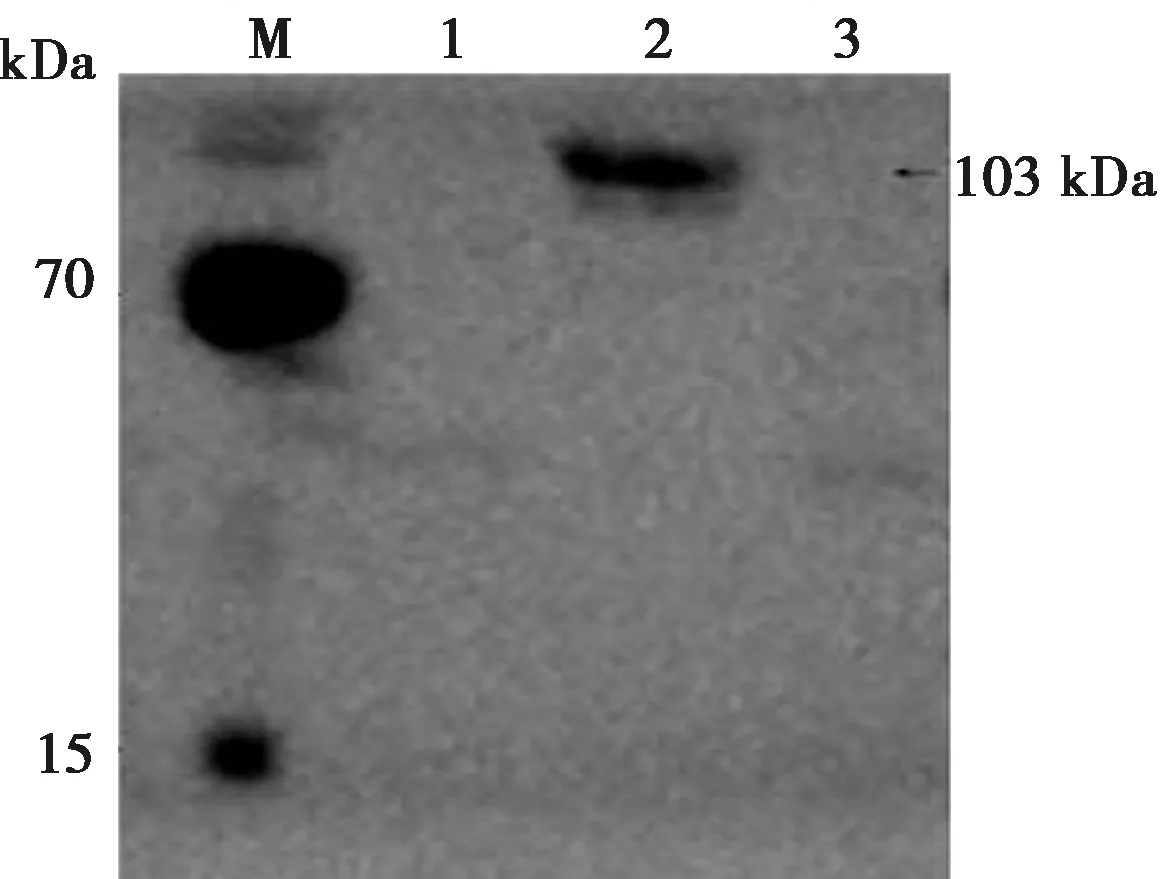
结果显示,抗原包被浓度为5 μg/mL时,P/N比值最高,确定为最佳的抗原包被浓度,各包被浓度OD值见表1。
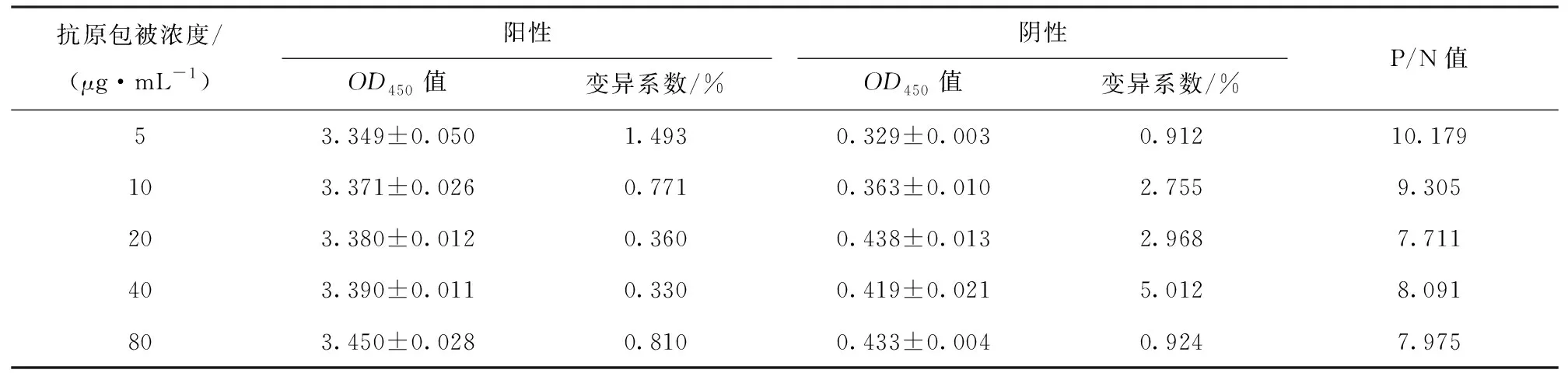
表1 抗原包被浓度优化
2.2.2 最佳封闭液的确定
结果显示,当封闭液为10%马血清时,阴阳性P/N值最高,确定为最佳的封闭液,各封闭液OD值见表2。
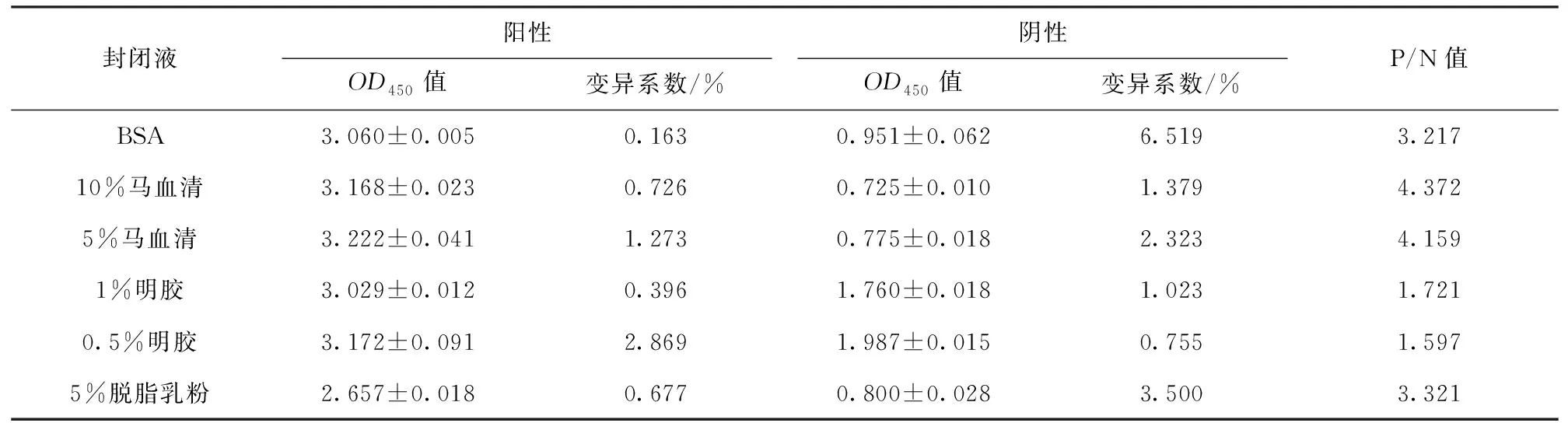
表2 最佳封闭液选择
2.2.3 一抗最佳稀释度的确定
结果显示,当一抗稀释度为1∶160时,P/N值最高,确定为最佳一抗稀释度,各一抗稀释度OD值见表3。
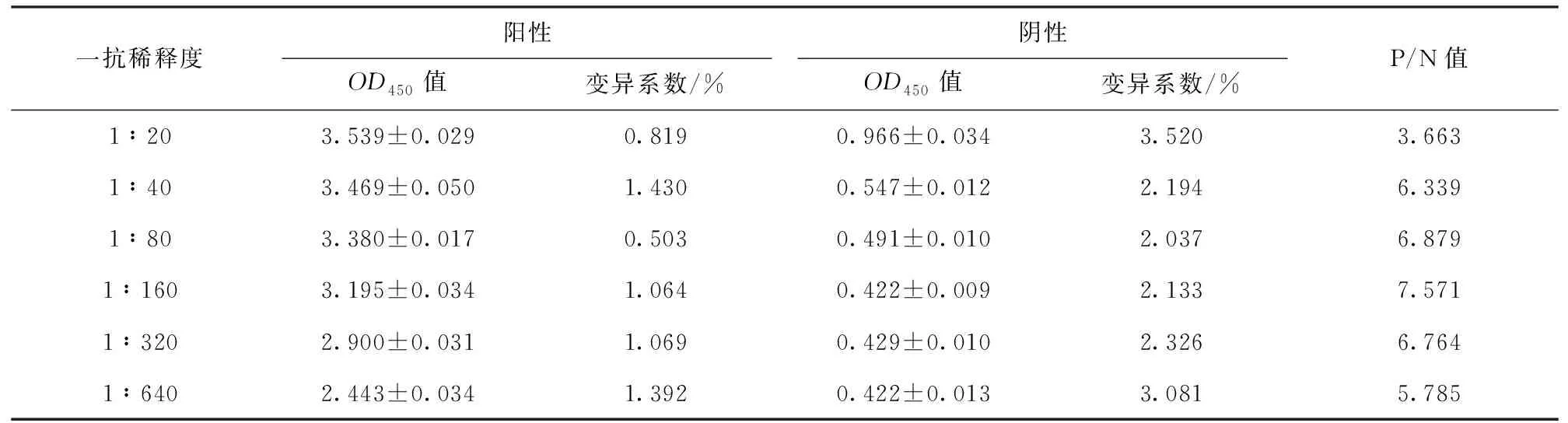
表3 一抗稀释度优化
2.2.4 二抗最佳稀释度的确定
结果显示,当酶标二抗稀释度为1∶12 000时,P/N值最高,确定为最佳二抗稀释度,各二抗稀释度OD值(见表4)。
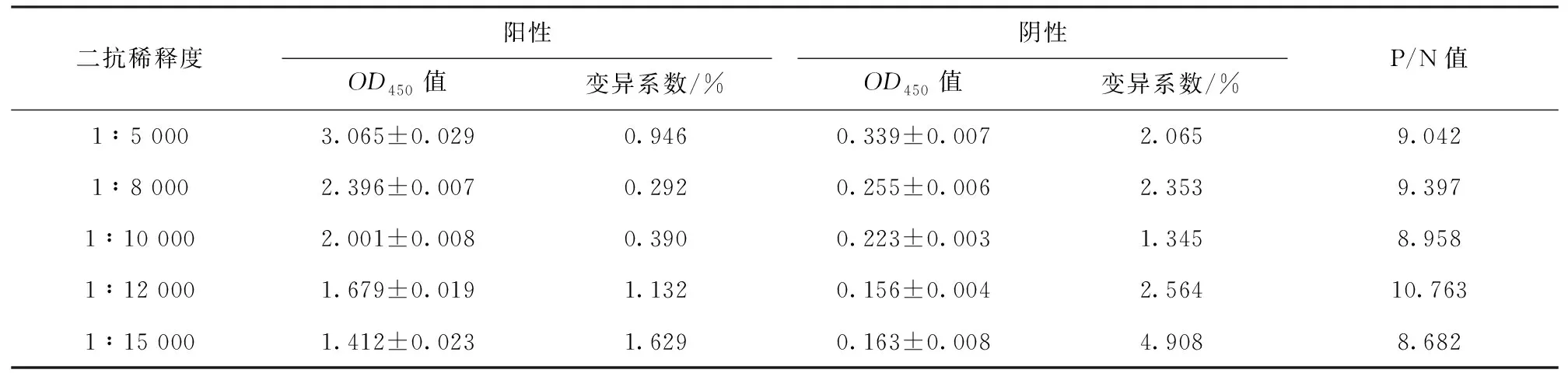
表4 二抗稀释度优化
2.2.5 最佳包被温度、时间、封闭时间的确定
结果显示,当包被温度为4 ℃,包被时间为过夜,封闭时间为2 h时,P/N值最高,确定为最佳包被和封闭条件,各条件的OD值见表5。
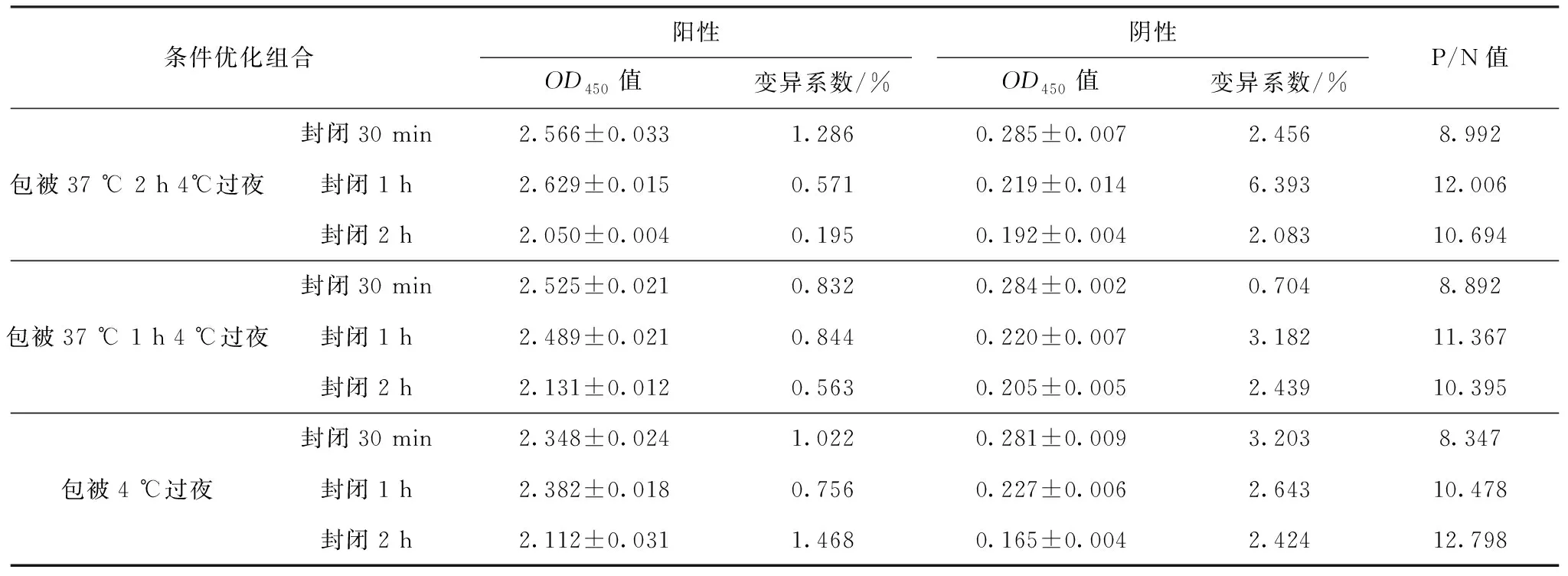
表5 包被温度、时间、封闭时间优化
2.2.6 一抗孵育时间及显色时间
结果显示,当一抗孵育时间为1 h,显色时间为20 min时,P/N值最高,确定为最佳一抗孵育时间和显色时间,各条件的OD值见表6。
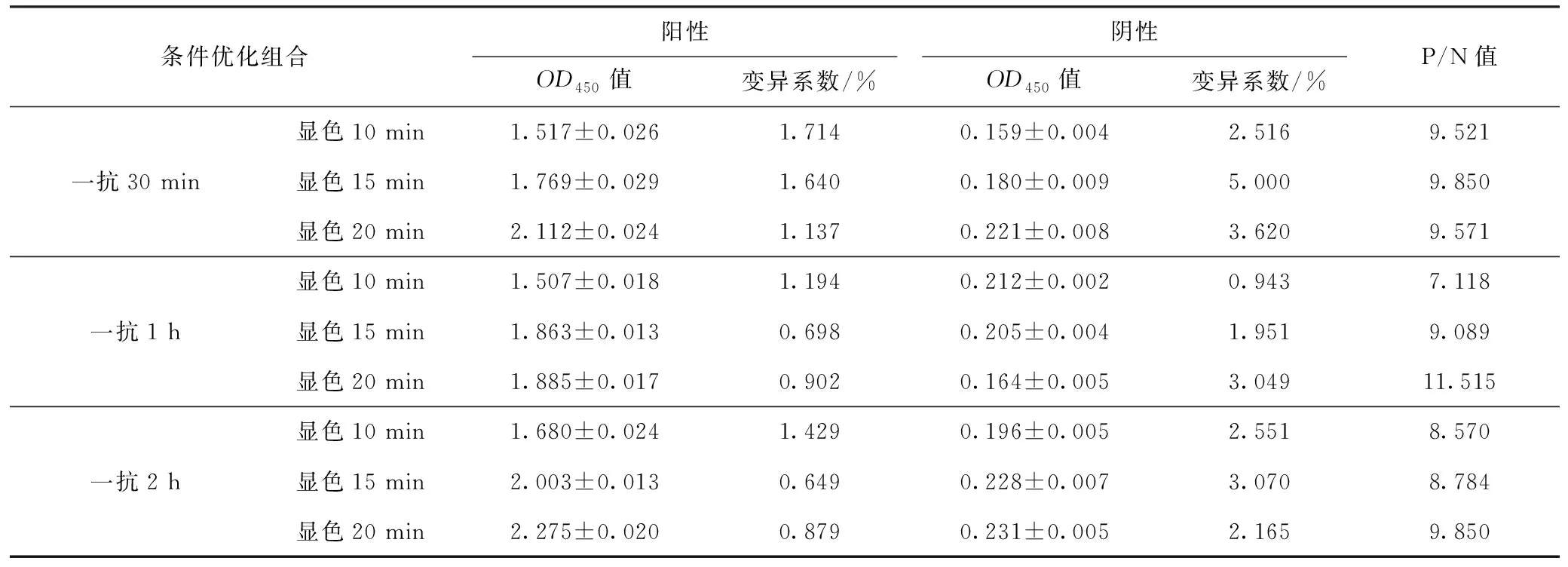
表6 一抗孵育时间及显色时间优化
2.2.7 酶标二抗孵育时间的优化
结果显示,当酶标二抗孵育时间为30 min时,P/N值最高,确定为最佳二抗孵育时间,酶标二抗孵育时间的OD值见表7。
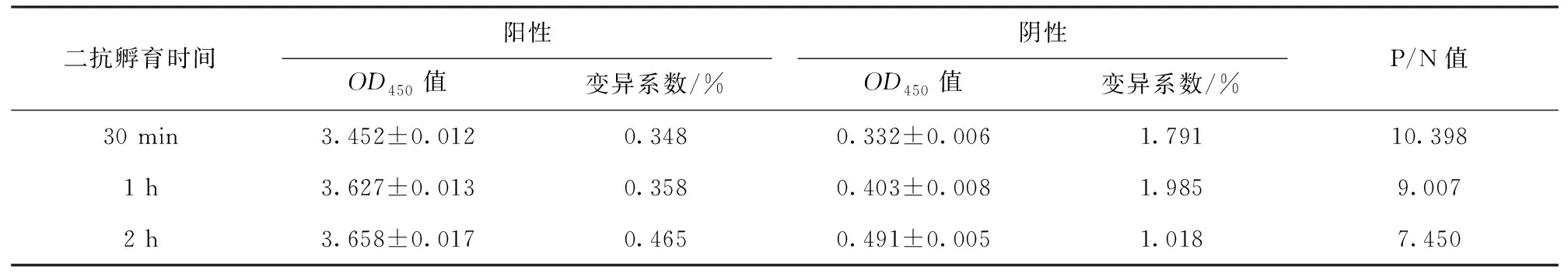
表7 二抗孵育时间优化
经过方阵优化后最佳条件为:5 μg/mL抗原包被后4 ℃过夜,10%马血清封闭时间2 h,1∶160稀释一抗孵育1 h,1∶12 000稀释二抗孵育30 min,显色20 min。
2.3 间接ELISA方法阴阳性临界值确定
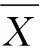
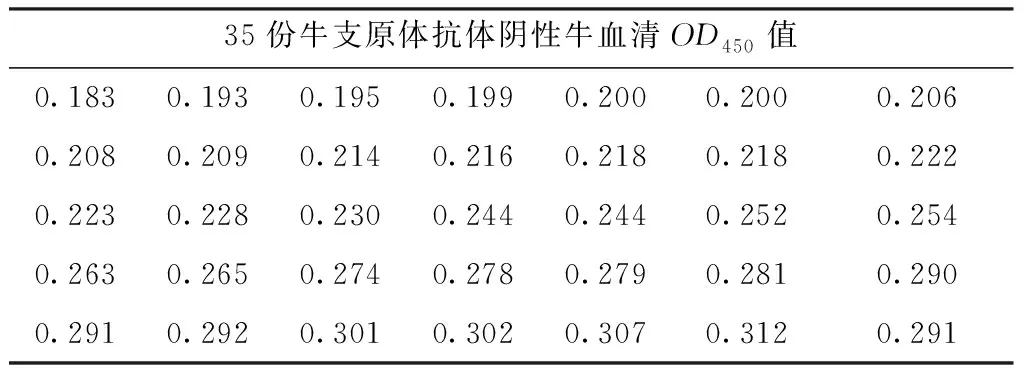
表8 阴阳性临界值的确定
2.4 特异性试验
特异性试验结果显示,仅牛支原体抗体阳性血清检测OD450值大于0.361,其他血清均为阴性(表9),表明该方法具有良好的特异性。
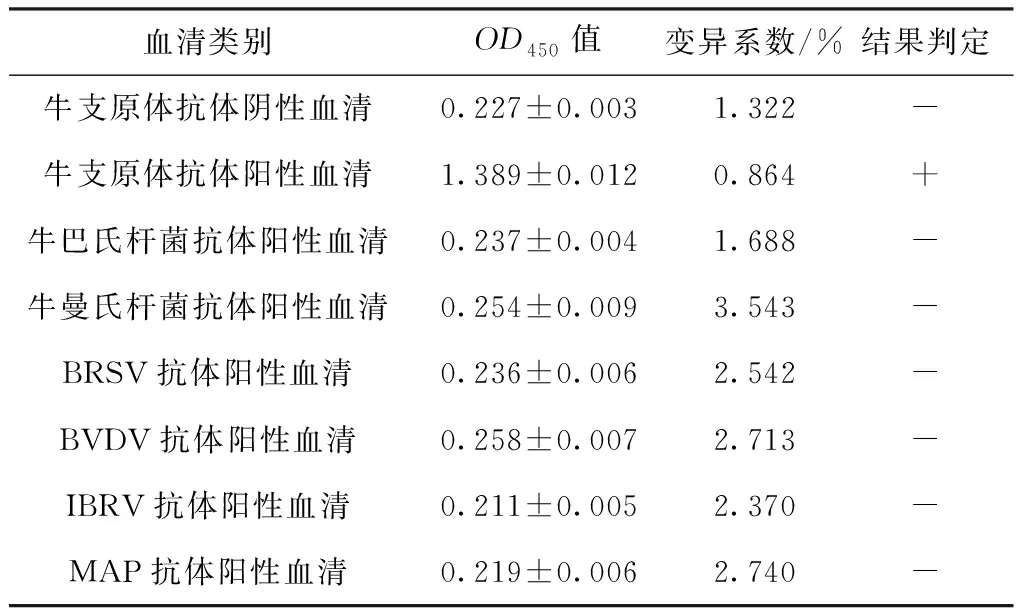
表9 特异性试验结果
2.5 敏感性试验
敏感性试验结果显示,当阳性血清稀释2 560倍时,OD450值仍大于0.361(表10),表明本方法具有良好的敏感性。

表10 敏感性试验结果
2.6 重复性试验
使用优化后的ELISA条件,检测血清样品,检测结果显示,批间重复试验和批内重复性试验的变异系数均小于15%(表11、表12),表明该方法具有良好的重复性。
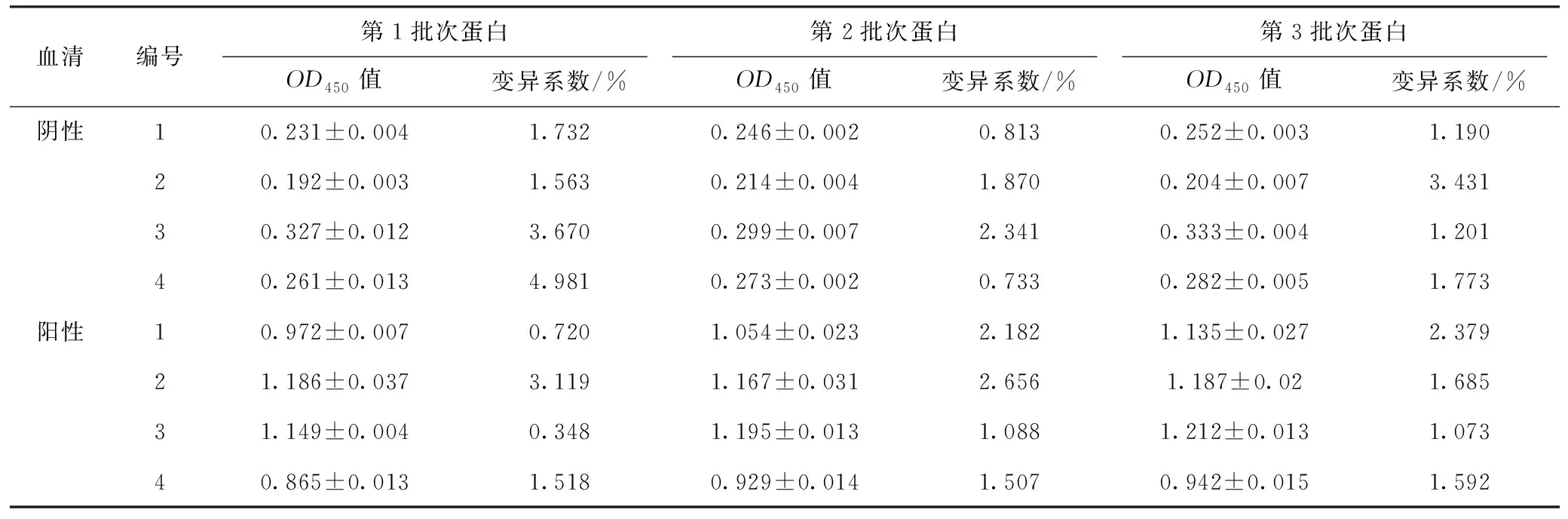
表11 批间重复性试验

表12 批内重复性试验
2.7 临床样品检测
使用建立的间接ELISA方法与商品化牛支原体ELISA抗体检测试剂盒同时检测90份临床牛血清样品,并对检测结果进行统计分析(表13)。牛支原体检测试剂盒检测结果:阳性样品27份,阴性样品63份。建立的间接ELISA检测方法检测27份阳性样品结果为24份阳性,3份阴性;63份阴性样品中,58份阴性5份阳性;两者阳性符合率为88.89%,阴性符合率为92.06%,总体符合率为91.11%。
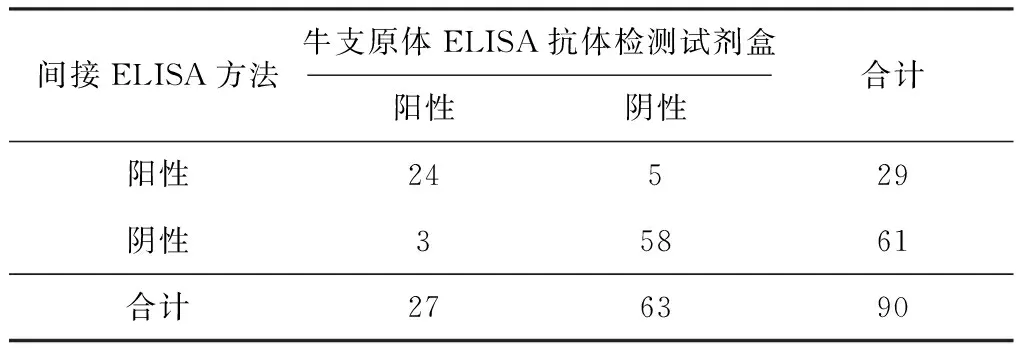
表13 临床样品检测结果
3 讨论
牛支原体相关疾病已成为危害养牛业的重要疾病之一,我国多个地区发生过牛支原体感染,造成了严重的经济损失。目前,牛支原体的诊断包括病原分离鉴定、分子生物学、血清学诊断等[12],牛支原体生长缓慢,诊断周期长,对病料的采集、运输、试验设备要求较高,临床诊断较为困难。对牛群进行支原体抗体筛查可追踪牛群近期感染情况,有利于判定牛群的感染状态。牛支原体抗体检测有多种方法,特异性抗体的血清学检测被认为是筛选牛群的常用方法[13],由于间接ELISA方法对仪器、环境要求不高,敏感性好,成本较低,检测迅速,因此得到了广泛认可,在对临床血清、乳样的大规模抗体检测上具有广阔的前景。目前,已经建立了P28[14]、P81[15]等牛支原体蛋白抗体检测方法,因为各个蛋白的功能不同,因此选择优势蛋白进行表达十分重要[16]。P48蛋白具有良好的抗原性,稳定性高、特异性强,在支原体的生存中占据重要地位[17]。本研究将P48全蛋白进行可溶性表达,建立的间接ELISA方法敏感性高,特异性和重复性好。马海彬等[18]用表达的支原体P48截短片段建立了间接ELISA方法,但未进行敏感性试验。刘洋等[14]用支原体P28蛋白建立的ELISA方法检测16份阳性血清,稀释到1 028倍时出现阴性结果。本试验建立的ELISA与基于P28[14]、P81[15]建立的ELISA相比,包被用抗原蛋白更少,被检血清稀释倍数更高,阳性血清稀释到2 540倍时仍出现阳性结果,敏感性更高。对影响结果的各项因素进行优化,尽量减少试验过程中抗体的交叉反应和非特异吸附[19],节约了试剂,降低了试验成本,使反应达到最佳效果。此外,表达的P48蛋白也可以和牛支原体乳样相结合,可用来检测乳样中牛支原体抗体水平。
综上,本研究建立的ELISA方法能够正确区分牛支原体阴性、阳性血清,未与呼吸道常见细菌、病毒阳性血清发生反应,具有良好的特异性。与商品化牛支原体ELISA抗体检测试剂盒相比,阳性符合率为88.89%,阴性符合率为92.06%,总体符合率为91.11%,说明本研究建立了一种符合率好、敏感性高的牛支原体间接ELISA检测方法。本方法也可用于乳样中牛支原体抗体水平的评估,具有广阔的应用前景,对牛群的全群检疫、抗体水平及支原体感染情况的评估都具有重大意义。
