高低温催青温度敏感期家蚕卵的差异蛋白筛查
2023-10-19冯嘉伟白新宇李庆荣钟仰进杨婉莹
白 旭,冯嘉伟,白新宇,李庆荣,钟仰进,杨婉莹*
(1. 华南农业大学动物科学学院, 广东省农业动物基因组学与分子育种重点实验室, 广州 510642; 2. 广东省农业科学院蚕业与农产品加工研究所, 广州 510610)
滞育(Diapause)是昆虫对外界环境变化做出的对策,在漫长的进化过程中,该机制保护昆虫渡过不利环境并保证了种族繁衍(柴华等,2019;Zhangetal., 2019)。根据昆虫滞育发生阶段的不同,可分为卵滞育、幼虫滞育、蛹滞育以及成虫滞育(徐卫华,2008)。家蚕Bombyxmori是卵滞育昆虫的典型代表,也是最早开展滞育研究的模式昆虫。滞育诱导和滞育解除机理的应用对蚕业生产有非常重要的推动作用。
家蚕滞育由滞育激素(Diapause hormone, DH)调控,DH由咽下神经节(Suboesophageal ganglion, SG)的12个神经细胞合成,再由心侧体至咽侧体释放到血淋巴中(Kunioetal., 1991;Xuetal., 1995;Hayakawaetal., 1998)。DH被卵巢上的滞育激素受体(Diapause hormone receptor, DHR)识别后,作为G蛋白偶联受体的DHR促使卵巢细胞内第二信使鸟苷酸环化酶(cAMP)活性下降(Hommaetal., 2006),导致血液中的海藻糖被分解为葡萄糖。葡萄糖就如卵母细胞中的糖原,最后在滞育卵中被转化为山梨醇和甘油。这些物质帮助蚕卵抵御低温等不良环境(Chino, 1958;Yasuhiroetal., 2000)。
二化性家蚕滞育的发生主要受基因和外界环境的影响。蚕卵在25℃长光照下催青时,其产下的子代卵是滞育卵;当蚕卵在15℃短光照下催青时,产下的子代为非滞育卵,可以正常发育(Noguchietal., 2001)。Sato等(2014)研究发现家蚕瞬时受体电位通道蛋白BmTrpA在高于21℃时被激活表达,继而通过未知的方式激活γ-氨基丁酸(γ-aminobutyric acid, GABA)信号系统和黑化诱导神经肽(corazonin)级联系统,通过调节滞育激素释放诱导子代滞育(Tsuchiyaetal., 2020)。也有研究发现激素控制、生物节律和瞬时电位通道等途径也参与了家蚕滞育调控(Clapham, 2003;Huang, 2004)。说明家蚕滞育发生是一个非常复杂的过程,其具体机制还在不断探索研究中。
随着家蚕全基因组测序的完成和蛋白表达图谱的建立,家蚕组学研究发展迅速。Lanfen等(2018)通过液相色谱-串联质谱(LC-MS/MS)对家蚕产下的滞育卵和非滞育卵进行数据分析,从滞育卵和非滞育卵中鉴定出309个共有蛋白质。陈艳荣(2019)分别对产滞育卵和产非滞育卵的雌蛹进行转录组测序,鉴定出滞育相关基因akr2e-like,将其敲除后,25℃催青的雌蚕产下部分非滞育卵,证明该基因参与滞育调控。为了研究高低温诱导家蚕滞育发生的分子机制,本研究用25℃和15℃分别催青蚕卵,按照Xu等(1995)建立的催青方法,在蚕卵发育到温度敏感期时取样,抽提蚕卵蛋白通过LC-MS/MS技术进行蛋白质测序,筛选出差异表达的蛋白质,并结合数据库对差异蛋白进行功能分类和功能富集,为进一步解析温度诱导家蚕滞育发生的分子机理提供参考依据。
1 材料与方法
1.1 家蚕
供试家蚕二化性品种P50由中国科学院蚕业研究所徐安英研究员提供,幼虫在温度26±2℃,相对湿度60%±5%,12 h日夜交替的环境下用新鲜桑叶饲养。
1.2 试剂
SDS、BSA、Tris、二乙醇胺、尿素等购自广州翔博生物科技有限公司;BCA法蛋白定量试剂盒购自上海碧云天生物技术有限公司。蛋白酶抑制剂、TCA、Triton X-100、TSA、NAM、TEAB、二硫苏糖醇DTT、碘乙酰胺(IAA)购自上海蓝木化工有限公司。RNAex Pro RNA提取试剂、Evo M-MLV反转录试剂盒购自湖南艾科瑞生物工程有限公司。qPCR SYBR Green Master Mix购自上海翌圣生物科技股份有限公司。
1.3 蚕卵催青处理
按照宋宇航等(2022)的方法,将二化性家蚕品种P50的蚕卵放在25℃催青,饲喂1代后产下滞育卵。将产下的滞育卵放置20 h后进行浸酸处理,在比重1.075(115℉)的盐酸溶液中浸泡270 s,随即放在流动的水中浸泡30 min,冲洗干净后放置在25℃晾干。将解除滞育的蚕卵分成两组,1组放置于25℃气候箱中催青(高温滞育诱导组),另一组放置于15℃气候箱中催青(低温非滞育诱导组)。分别在蚕卵发育至反转终了期即23期时取样,将蚕卵在液氮中速冻后放入-80℃冰箱。
1.4 蚕卵蛋白质的抽提
从-80℃取出蚕卵,加液氮充分研磨至粉末。各组样品分别加入粉末4倍体积裂解缓冲液(1% Triton X-100,1%蛋白酶抑制剂,3 μmol/L TSA,50 mmol/L NAM),超声裂解。4℃,12 000 g离心10 min,去除细胞碎片,上清液转移至新的离心管,利用BCA试剂盒进行蛋白浓度测定。
1.5 蛋白质电泳检测
制样:根据蛋白浓度测定结果,每个样品取等量蛋白到离心管中,加入5 μL的4×Loading buffer,再加入2% SDS使总体积为20 μL;上样:依次上样1 μL预染蛋白marker和20 μL蛋白样品;电泳:按照15 mA/gel的电流跑浓缩胶,约15 min后蛋白浓缩为一条线;用35 mA跑分离胶直至电泳到胶底部;染色和脱色:将凝胶取出后于考马斯亮蓝R-250染液中室温染色2 h,然后加入脱色液,脱色至背景无色、条带清晰。
1.6 胰酶酶解
取等量蛋白样品,用裂解液将体积调整浓度体积一致。缓慢加入终浓度20%TCA,涡旋混匀,4℃沉淀2 h。4 500 g离心5 min,弃上清,用预冷的丙酮洗涤沉淀2~3次。晾干沉淀后加入终浓度200 mmol/L TEAB,超声波打散沉淀,以蛋白酶∶蛋白=1∶50的比例(m/m)加入胰蛋白酶,酶解过夜。加入DTT使其终浓度为5 mmol/L,56℃还原30 min,然后加入IAA使其终浓度为11 mmol/L,室温避光孵育15 min。
1.7 液相色谱-质谱联用分析
肽段用液相色谱流动相A相溶解后使用NanoElute超高效液相系统进行分离。流动相A为含0.1%甲酸和2%乙腈的水溶液;流动相B为含0.1%甲酸和100%乙腈溶液。液相梯度设置:0~70 min,6%~24%B;70~84 min,24%~35%B;84~87 min,35%~80%B;87~90 min,80%B,流速维持在450 nL/min。肽段经由超高效液相系统分离后被注入Capillary离子源中进行电离然后进timsTOF Pro质谱进行分析。离子源电压设置为1.65 kV,肽段母离子及其二级碎片都使用高分辨的TOF进行检测和分析。二级质谱扫描范围设置为100~1 700。数据采集模式使用平行累积串行碎裂(PASEF)模式。一张一级质谱采集后进行10次 PASEF模式采集母离子电荷数在0~5范围内的二级谱图,串联质谱扫描的动态排除时间设置为30 s避免母离子的重复扫描。
1.8 差异蛋白转录水平验证
将蚕卵样品置于液氮预冷的研钵中研磨为粉末,使用Trizol沉淀法提取样本RNA,经过去基因组DNA反应和反转录得到cDNA。使用Primer-BLAS网站设计目的基因的qRT-PCR引物(引物序列如表1所示),由生工生物公司合成。荧光定量PCR方法参照试剂SsoFast EvaGreen Supermix(Bio-Rad)操作说明进行。
2 结果与分析
2.1 家蚕胚胎发育进度观察
家蚕的胚胎期被划分为30个发育阶段,Xu等(1995)通过温度交换催青实验发现,在蚕卵胚胎发育的第20~23阶段,即器官形成期的头胸分节期、反转期、反转终了期、毛瘤发生期时对温度诱导最为敏感。只要在蚕卵发育的20~23阶段保持25℃催青,94%的子代卵为滞育卵,第20~25阶段保持25℃催青,则子代97%为滞育卵。说明家蚕胚胎发育的第20~25阶段是感受温度变化诱导子代进入滞育的窗口期,20~23阶段是关键期,因此本实验取23阶段即反转终了期的蚕卵进行蛋白质质谱分析。为确保两组蚕卵样本处在同一发育阶段,通过观察胚胎形态来监控蚕卵的发育进程。图1为15℃催青组和25℃催青组蚕卵胚胎,可以看出取样时两组蚕卵都发育到了第23阶段。
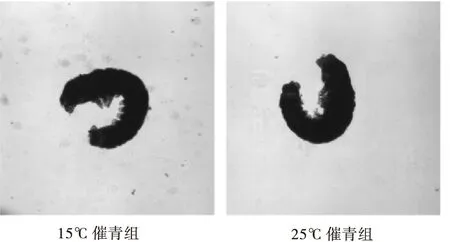
图1 反转期家蚕胚胎Fig.1 Embryo in reversal period of Bombyx mori
2.2 蚕卵蛋白浓度测定及电泳检测
蚕卵蛋白抽提完成后,使用BCA蛋白浓度测定试剂盒测定蛋白浓度,根据标准曲线和使用的样品体积计算出样品的蛋白浓度(表2)。
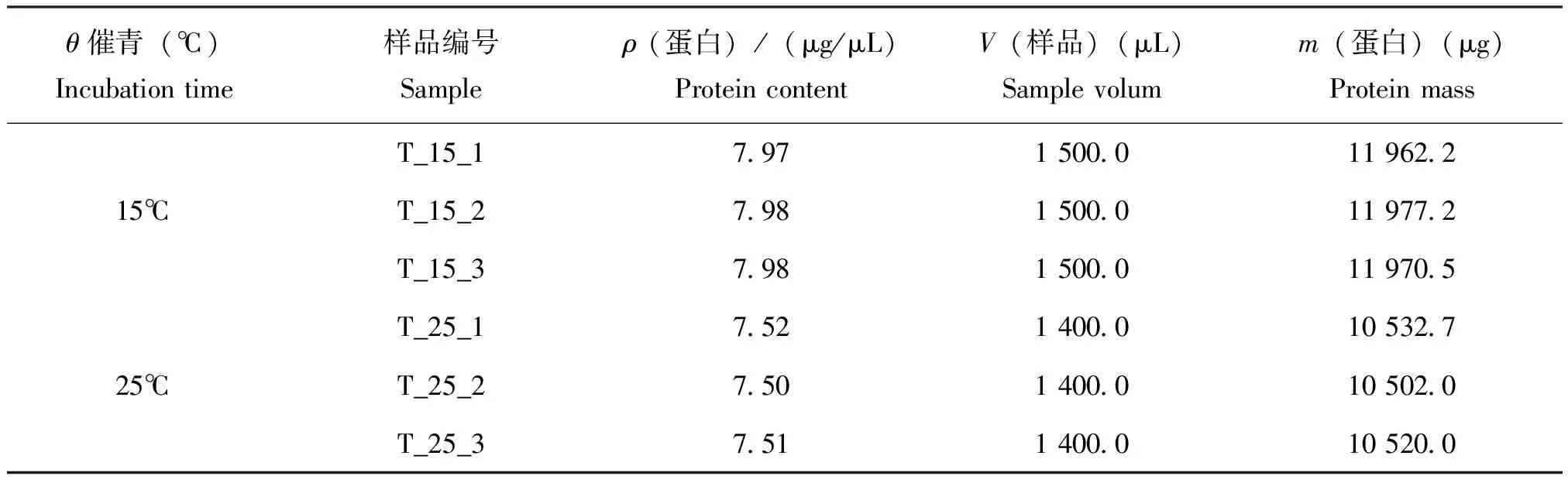
表2 蚕卵蛋白浓度测定结果
通过SDS-PAGE电泳检测抽提蛋白质量,每个样品取15 μg进行电泳。结果如图2所示,25℃和15℃催青组的蚕卵蛋白条带清晰,分布正常均一,蛋白无降解,组内各泳道平行性好,组间电泳行为差异不明显。存在明显的高丰度蛋白,蛋白总量满足接下来的质谱要求。

图2 高低温催青温度敏感期家蚕卵蛋白的SDS-PAGE 电泳检测Fig.2 SDS-PAGE electrophoresis detection of silkworm egg protein in temperature-sensitive period of high and low temperature注:泳道M为蛋白Maker,15-1、15-2、15-3为15℃催青组的三个重复样本,25-1、25-2、25-3为25℃催青组的三个重复样本。Note: Lane M was the protein maker, 15-1, 15-2, and 15-3 were three replicates of the 15℃ group, and 25-1, 25-2, and 25-3 were three replicates of the 25℃ group.
2.3 质谱数据库筛选
质谱测序完成后,为了得到高质量的数据分析结果,首先做数据过滤。将谱图、肽段、蛋白3个层面鉴定的准确性FDR设定为1%;鉴定蛋白至少需要包含一个特异性(Unique)肽段。图3-A是经过数据过滤后鉴定的肽段和蛋白总数。从图中可以看出质谱检测产生的二级谱图数,即总谱图数(Total spectrums)为719 520条,其中有效谱图数(Matched spectrums)为164 030条,鉴定肽段数(Peptides)为28 334条,根据匹配结果解析出的特异性肽段(Unique peptides)有27 570个。这些肽段对应的鉴定蛋白数(Identified proteins)有3 817个,可量化的蛋白(Quantifiable proteins)数有3 076个。图3-B是各组生物重复样本的相对标准差(RSD),RSD值越小,表明重复试验定量的波动程度越小。从图中看出25℃催青蚕卵与15℃催青蚕卵组间的RSD数据均小于0.6,说明样本重复性较好,具有统计学一致性。
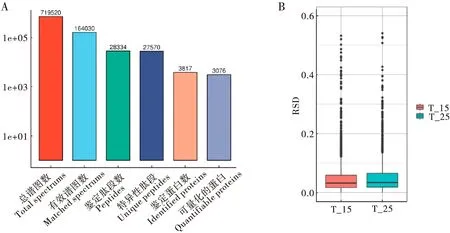
图3 差异蛋白质组学基础数据统计Fig.3 Basic data statistics of differentially expressed proteomics注:A,蛋白质鉴定质谱结果统计图;B,样品重复性的RSD检验。Note: A, Statistical chart of protein identification mass spectrometry results; B, RSD test of sample repeatability.
2.4 差异蛋白质的分析
将15℃催青组与25℃催青组的质谱数据进行分析,首先通过样本定量值的P-value筛选差异表达蛋白,当P-value <0.05时,以差异表达量变化超过1.5作为显著上调的变化阈值,小于1/1.5作为显著下调的变化阈值。比较发现两个处理组中差异表达的蛋白有104个,其中56个蛋白上调,48个蛋白下调(图4)。表3是部分显著差异蛋白。
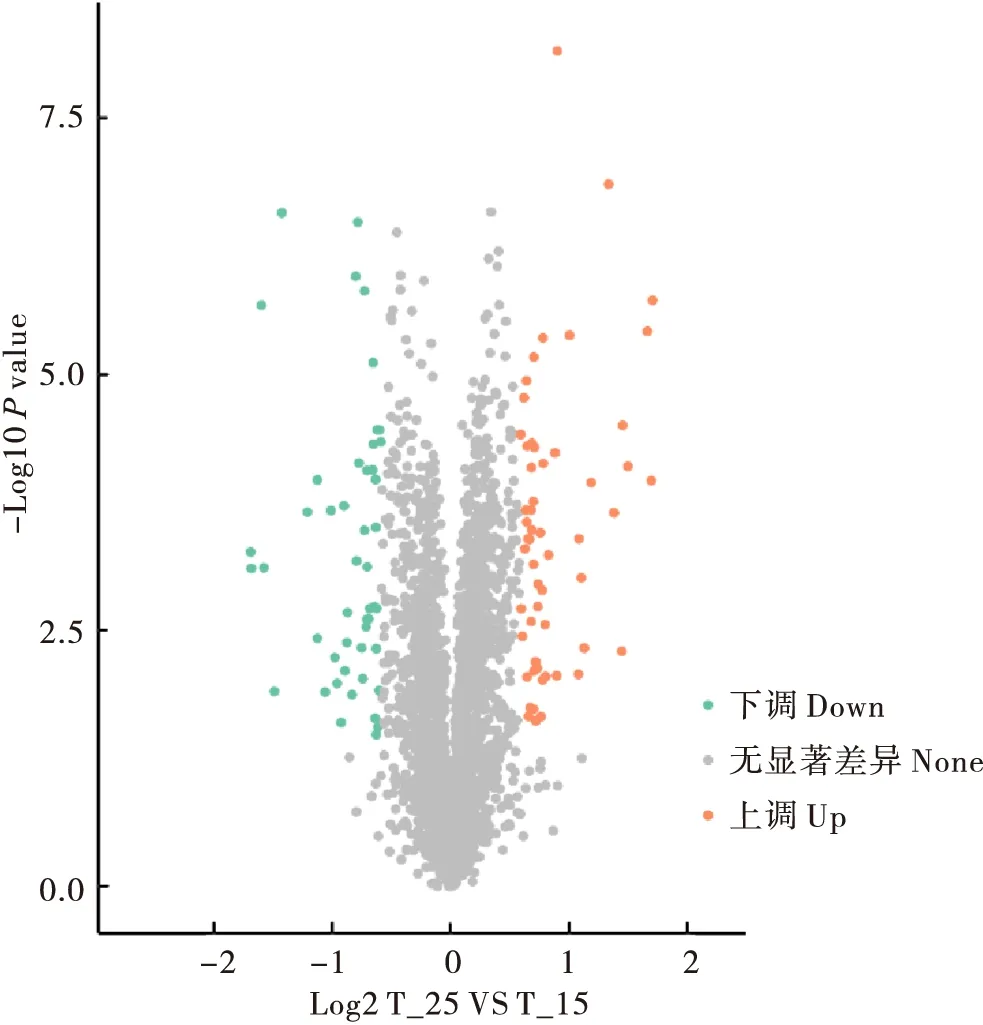
图4 25℃和15℃催青的蚕卵差异蛋白的火山图Fig.4 Volcano plots of differential protein expression in silkworm eggs incubated at 25℃ and 15℃

表3 25℃/15℃下催青家蚕温度敏感期卵的差异表达蛋白
2.5 差异蛋白的聚类分析
对25℃和15℃催青的蚕卵差异蛋白分别进行了GO分类、KEGG通路和蛋白结构域3个层面的富集分析。图5-A是差异蛋白的本体聚类分析(Gene Ontology,GO),从图中可以看出差异蛋白主要参与的生物过程有细胞过程(Cellular process)、代谢过程(Metabolic process)、生物调节(Biological regulation)、生长发育过程(Developmental process)、多细胞生物过程(Multicellular organismal process)和胁迫应答(Response to stimulus)。差异蛋白的分子功能主要为催化活性(Catalytic activity)和结合(Binding)。
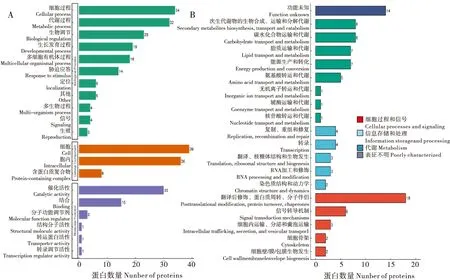
图5 差异蛋白的聚类分析Fig.5 Cluster analysis of differentially expressed proteins注:A,差异蛋白的GO分类;B,差异蛋白的COG分类。Note: A, GO classification of differential protein expression; B, COG classification of differential protein expression .
图5-B是COG功能分类的结果,从图中可以看出差异蛋白的功能主要为翻译后修饰(Posttranslational modification)、蛋白质周转(Protein turnover)、分子伴侣(Chaperones)和物质代谢。对差异蛋白的亚细胞定位显示差异蛋白主要分布于细胞质、细胞质基质和细胞核中。
2.6 差异蛋白的KEGG功能富集分析
接下来对差异蛋白进行KEGG功能富集分析,通过气泡图的方式展现差异表达蛋白显著富集(P-value <0.05)到的功能分类和通路。结果显示(图6),差异蛋白主要参与了乙醛酸和二羧酸代谢途径(Glyoxylate and dicarboxylate metabolism)、丙酮酸代谢途径(Pyruvate metabolism)和半乳糖代谢途径(Galactose metabolism)。其中,差异蛋白在乙醛酸和二羧酸代谢途径富集最为显著,所含5个显著差异蛋白全部上调。此外,在丙酮酸代谢途径中,苹果酸合酶显著上调,而苹果酸酶显著下调。这些差异蛋白的主要分子功能有:铁反应元件结合(Iron-responsive element binding)、催化活性(Catalytic activity)、裂解酶活性(Lyase activity)、乌头酸水合酶活性(Aconitate hydratase activity)、水解酶活性(Hydro-lyase activity)、外肽酶活性(Exopeptidase activity)、葡萄糖醛酸转移酶活性(Glucuronosyltransferase activity)以及碳-碳裂解酶活性(Carbon-carbon lyase activity)。
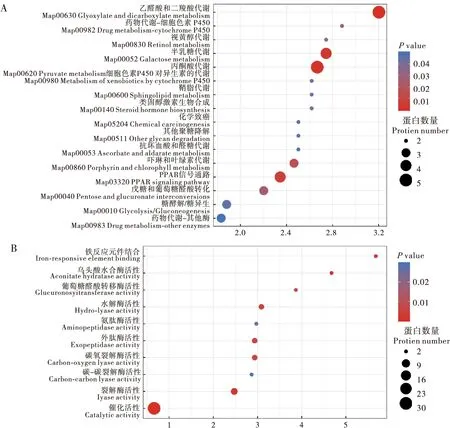
图6 差异蛋白的KEGG分析Fig.6 KEGG analysis of differentially expressed proteins注:A,差异蛋白的KEGG通路分析;B,差异蛋白的KEGG分子功能分析。纵轴为通路或功能分类,横轴为差异表达蛋白在该功能类型中所占比例相比于鉴定蛋白所占比例的变化倍数(Fold enrichment)的Log2转换后的数值。圆圈颜色表示富集显著性P-value,圆圈大小表示功能类或通路中的差异蛋白个数。Note: A, KEGG pathway analysis of differential protein expression; B, KEGG molecular function analysis of differential protein expression. Vertical axis was the pathway or functional classification, and horizontal axis was the Log2-transformed value of the fold enrichment (Fold enrichment) of the proportion of differential protein expression in this functional type compared to the proportion of identified proteins. The color of the circle indicated the significant P-value of enrichment, and the size of the circle indicated the number of differential protein expression in the functional class or pathway.
2.7 差异蛋白转录水平验证
为了验证上述差异蛋白定量结果,选取了参与代谢过程的L-乳酸脱氢酶、地芬甲酸酯合酶、尿酸酶、脱氧海丝氨酸合酶、UDP-葡萄糖4-差向异构体、泛素硫酯酶和氨肽酶;参与胁迫应答的蛋白丝光蛋白、血管紧张素转化酶和触角特异性蛋白;保幼激素信号通路中的保幼激素结合蛋白进行实时荧光定量qRT-PCR验证。图7分别是qRT-PCR检测结果,15℃和25℃催青组中,目的蛋白转录水平的变化趋势与蛋白组学结果一致,说明差异蛋白定量结果准确。

图7 25℃和15℃催青的蚕卵差异蛋白的转录水平定量结果Fig.7 Quantitative results of transcriptional levels of differential protein expression in silkworm eggs treated at 25℃ and 15℃注:qRT-PCR检测差异基因表达情况。用内参基因Eif-4A使基因表达标准化。*表示P<0.05,**表示P<0.01,***表示P<0.001。Note: Differential gene expression was detected by qRT-PCR. Gene expression was normalized with the internal reference gene Eif-4A. * means P<0.05, ** means P<0.01, *** means P<0.001.
3 结论与讨论
家蚕滞育卵胚胎发育被划分为30个阶段,Xu等(1995)以二化性家蚕品种大造为研究材料,对蚕卵进行高低温(25℃/15℃)交替催青,发现在第20~23阶段进行25℃催青对诱导滞育至关重要,22~25期对滞育卵的诱导也很重要,完整经历20~25阶段25℃催青的蚕卵,其子代滞育率升至100%。这说明第20~25阶段是家蚕胚胎感受温度变化诱导子代进入滞育的敏感期。
本研究通过液相色谱-质谱串联技术对高、低温催青下家蚕敏感期卵的差异蛋白进行研究,结果发现,与15℃催青的蚕卵相比,25℃催青的蚕卵在敏感期蛋白表达显著上调的有56个,显著下调的有48个,这些蛋白可能参与了温度诱导家蚕子代滞育发生的调控过程。对差异表达蛋白的GO功能注释显示,差异蛋白主要参与的生物过程有细胞过程、代谢过程、生物调节、生长发育过程、多细胞生物过程和胁迫应答。差异蛋白的分子功能主要为催化活性和结合。KOG功能分类的结果显示,差异蛋白的功能主要为翻译后修饰、蛋白质周转、分子伴侣和物质代谢。KEGG富集结果显示,差异蛋白主要参与了乙醛酸和二羧酸代谢途径、丙酮酸代谢途径和半乳糖代谢途径。
特定昆虫通过调节发育过程中的某一步骤,在特定发育阶段进入滞育(Mikietal., 2020)。如,烟草天蛾Manducasexta蛹期滞育的原因被认为是大脑分泌促前胸腺激素(Prothoracicotropic hormone, PTTH)的释放量减少(Tomiokaetal., 1995);家蚕通过滞育激素诱导胚胎进入滞育(Okitsugu, 1996);黑腹果蝇Drosophilamelanogaster和库蚊Culexpipiens主要通过胰岛素(insulin)信号途径诱导成虫进入滞育(Simetal., 2013)。保幼激素(Juvenile hormone,JH)被认为是调节昆虫变态、繁殖和滞育的重要激素之一(Royetal., 2018)。胰岛素信号通过JH通路诱导滞育发生,用外源性JH可以回补胰岛素受体敲除后引起的滞育改变(Simetal., 2013)。大部分昆虫滞育的诱导和发生往往伴随着体内JH水平的显著降低,但在少数昆虫中,滞育也会随着体内JH增加而发生。短光照可诱导异色瓢虫Harmoniaaxyridis发生滞育,其体内的JH滴度在短光照下饲养比在长光照下饲养更低(Gaoetal., 2022)。Jiang等(2011)的研究也表明,在家蚕中提高保幼激素水平的同时,降低蜕皮激素的水平可诱导滞育卵的产生。在筛选到的差异表达蛋白中发现,保幼激素结合蛋白(Juvenile hormone binding protein, JHBP)在25℃催青蚕卵中的表达比15℃催青蚕卵显著上调。在鳞翅目昆虫中,JH信号主要由血淋巴中的物种特异性JHBP介导(Lietal., 2016)。在与其受体相互作用之前,JH作为与JHBP的复合物被转运至靶组织,在此期间,JHBP是JH信号转运中的第一个关键元件(Krameretal., 1974)。JHBP将JH从血淋巴输送到靶器官的细胞,并保护JH免受非特异性酯酶的降解(Debskietal., 2004)。来自不同物种的JHBP的序列分析表明,JHBP蛋白与两个保守的N末端半胱氨酸残基具有高度相似性,并且可以结合亲脂性小分子如JH的结构域(Kolodziejczyketal., 2008)。保幼激素合成过程中JHBP基因的表达受JH负控制。JHBP在高低温催青卵中的差异表达,也为研究家蚕滞育诱导的机制提供了新的靶标。
温度是影响家蚕卵滞育发生的最主要环境因素(Baleetal., 2010),越来越多的研究表明温度应激反应与滞育之间关系密切。在家蚕的滞育过程中,启动了一套应激反应机制来保证越冬存活,如合成甘油和山梨醇(Han, 1998;Kostaletal., 2000)、热休克蛋白(Hsps)等分子伴侣的合成(Rinehartetal., 2007)。本研究发现的差异表达蛋白,如L-乳酸脱氢酶、磷酸烯醇丙酮酸羧激酶、苹果酸酶和保幼激素结合蛋白等,可能参与到这些物质的代谢和转化。
综上所述,家蚕滞育诱导的分子机制较为复杂,涉及多种信号通路和调控因子,本研究利用蛋白组学技术初步发现多种信号通路和差异蛋白可能在家蚕受环境温度影响下诱导子代滞育的分子机制中起到重要作用,为进一步研究滞育发生的分子机制研究提供候选蛋白。
