基于生理学的药动学/生物药剂学模型在中药药动学研究中的应用进展
2023-10-19田锁燕贾国香胡静雯苏布达杨珅珅李遇伯
田锁燕,贾国香,胡静雯,卢 倩,苏布达,杨珅珅,李遇伯
基于生理学的药动学/生物药剂学模型在中药药动学研究中的应用进展
田锁燕,贾国香,胡静雯,卢 倩,苏布达,杨珅珅*,李遇伯*
天津中医药大学中药学院,天津 300193
中药具有多成分、多靶点、代谢复杂、临床应用广泛的特点。中药药动学(pharmacokinetics,PK)是中药研究中的重大科学问题之一,在阐释中医中药的科学性、推进中药国际化、现代化中具有重要意义。基于生理学的药动学(physiologically based pharmacokinetics,PBPK)模型与基于生理学的生物药剂学(physiologically based biopharmaceutics,PBBM)模型针对中药及其复方,采用“自下而上”的方法预测药物的体外特性与体内血浆或不同组织中药物及其代谢物的药动学过程,为阐明中药药效物质基础、揭示中药有效性与安全性的科学内涵、中药新药研发与剂型改进等方面提供重要的参考信息。介绍PBPK/PBBM模型在中药药动学研究中的优势和应用,以期为中药现代化研究和临床合理用药等方面提供参考。
中药药动学;生理学的药动学;生物药剂学;药物相互作用;风险评估;剂型优化与开发
近些年来,中药在埃博拉病毒、疟疾和新冠肺炎等众多疑难杂症的治疗中发挥了良好的作用,也正是因为中医药悠久的历史,使得中药在世界许多地区被广泛应用于临床治疗和药品保健等领域[1-3]。由于中药的化学成分多样、生物功能复杂、药效物质基础不明确[4],众多研究者开展了广泛而深入的中药药动学研究,为中药中各成分的体内代谢过程研究做出了重要贡献。中药药动学是运用数学函数和定量描述方法,研究中药有效成分及组成,单方或复方在体内吸收、分布、代谢及排泄(absorption,distribution,metabolism,and excretion,ADME)过程及时-效和时-量关系[5]。其研究对阐明中药药效物质基础、中药代谢途径及其代谢产物的化学结构和中药药理作用机制等具有重要意义,为中药质量监测评估、新药开发以及给药途径提供科学参考[6-8]。然而,中药药动学的研究仍然存在许多需要解决的问题:(1)符合中药自身特征的技术方法和评价体系较少;(2)中药复方的药动学研究有待加强,有些中药的药动学研究还停留在动物实验层面,不能直接应用于人体[9],亦或是由于实验数据太少,导致中药在体内的药物代谢参数不准确[10];(3)基于药物代谢酶和转运体的中药体内过程调控机制和中西药相互作用机制有待深入研究;(4)中药PK-PD结合模型研究需要构建新思路和新方法;(5)中药健康风险评估需要重视。
目前,美国食品药品监督管理局(food and drug administration,FDA)和欧洲药品管理局(European medicines agency,EMA)分别颁布了多项关于生理学的药动学(physiologically based pharmacokinetics,PBPK)平台规范及其研究的报告规范的指南,有助于提高PBPK研究质量[11-13]。PBPK模型的建立从临床实验数据出发,通过将药物信息和生理信息结合起来,对药物浓度-时间曲线进行先验模拟。对于中药的开发和研究,PBPK模型可以弥补传统研究方法的不足,在不同年龄阶段外推、种属间外推、体外到体内外推以及基于动物数据预测人体药动学等研究方向中具有独特优势,对创新药物的临床研究,降低研发成本具有重要的意义。
1 PBPK/生理学的生物药剂学(physiologically based biopharmaceutics,PBBM)模型概述及PBPK研究进展
1.1 PBPK模型概述
基于PBPK模型是一种整合了生理、生化和解剖等方面的知识,模拟机体循环系统血液流向,从整体的角度出发将机体各器官/组织相互联结,并遵循质量守衡原理建立的数学建模技术[14-15]。1937年,Theorell首次提出使用多隔室模型模拟药动学的想法,并在模型中纳入生理参数,至此,PBPK模型逐步发展起来[16]。与传统房室模型(表1)不同的是,PBPK模型是将每个相应的组织器官单独作为一个房室看待,房室间借助血液循环连接,将各个房室内药物复杂的ADME过程简单化,求得质量平衡微分方程,将数据导入专业的PBPK软件进行计算并验证,能真实反映出某一组织/器官内药物浓度的经时变化,以此呈现出药物在体内的分布情况[17-18],同时允许估计最大血浆浓度、吸收动力学、分布动力学和药物消除。
1.2 PBBM模型概述
基于PBBM在药品质量监管领域的应用正在不断发展。PBBM和基于生理学的吸收模型(physiologically based absorption modeling,PBAM)原理相同,也称为PBPK吸收模型,涵盖生物药剂学的所有领域,在本文中以PBBM统称。PBBM是在GastroPlus™(Simulations Plus,Inc)中开发的一种有前途的工具,整合了吸收建模、生物预测溶出度测试和PBPK建模,用于预测体内吸收和指导制剂开发[19]。因此,可以使用最小的PBPK或全身PBPK模型,在PBBM中模拟系统药物处置过程,对不同制剂进行全面的生理药动学/药理学研究,量化PK和PD图谱。PBBM模型被用于多个研究领域,包括(1)溶出方法/检测标准;(2)粒径分布设置;(3)IVIVR;(4)风险评估;(5)特殊人群口服吸收;(6)生物药剂学分类系统(biopharmaceutics classification system,BCS)的分类依据;(7)胃pH的影响;(8)生物等效性评价等。FDA相关会议报告决定,一般性PBPK指南适用于PBBM模型[20]。

表1 PBPK模型与传统房室模型的比较
1.3 PBPK模型研究概况
PBPK结合体外至体内外推(In vitro-In vivo extrapolation,IVIVE)技术,预测药物的药动学特征和药物间相互作用(drug-drug interaction,DDI)的程度等[21-22],已变得越来越普遍。众多研究者意识到其为人类发展所带来的无限价值,利用PBPK模型在包括但不限于以下几个方面。
1.3.1 特殊人群安全用药问题 外推得到儿童、妊娠妇女及病理状态下(如肝、肾功能不全)药物在体内的过程和给药方案[23-26],如Guo等[27]开发并验证了成年患者奥马利珠单抗的PBPK模型,外推到儿童患者,成功预测到患有中度至重度过敏性哮喘的2~6岁儿童的临床用药剂量。
1.3.2 药物多成分相互作用研究 通过考察对代谢酶和转运体的竞争性抑制,研究药物-药物相互作用(DDI)[28-30],Lien等[31]建立PBPK模型,研究特格拉赞与CYP3A4抑制剂和诱导剂的DDI。
1.3.3 仿制药和药物新制剂研发 研究者可通过修改不同化合物或制剂的相应参数来获得不同药物制剂体内ADME过程[32-35],研发临床疗效佳、生物利用度高的仿制药和药物新剂型。
1.3.4 环境风险物健康风险评估 已有研究[36-39]成功利用PBPK模型预测到环境中污染物的健康风险值,为人类健康和环境治理提供了参考。上述研究证明PBPK是药物体内过程研究中的一大亮点,同时为新药研发和临床患者合理安全用药研究奠定了基础。
随着计算机行业的快速发展,国内外许多公司开发出不同的机制性吸收软件,包括开放软件(acslX、SAAM II、ADAPT 5和Berkeley Madonna等)和用户界面友好的常用专业软件(GastroPlusTM、Simcyp®- Simulator、PK-Sim®),3个专业软件分别囊括了基础模块、PBPK模块、ACAT、ADAM模块以及儿科模块[40]-[41],为PBPK/PBBM建模和模拟做出了巨大贡献,很大程度上减少了科研成本、动物实验及临床实验受试者人数。
2 PBPK/PBBM模型在中药药动学中的应用
目前,随着中药现代化的不断推进,PBPK模型利用其自身优势克服了传统房室模型的不足,在中药体内ADME与风险评估、中药-药物相互作用、中药在特殊人群的给药方案调整、中药整体CMMBCS分类属性研究等领域发挥了极为重要的作用(图1)。例如,吴桐[42]利用PBPK模型不仅预测到雷公藤甲素(triptolide,TP)存在体内肝毒性风险和药物相互作用反应,同时观测到中度肝损伤患者体内TP血浆暴露量明显升高。
2.1 中药健康风险评估
近些年,随着有关中药不良反应的报道逐渐增多,人们对中药的安全使用意识逐渐提高。但是,由于中药成分复杂多样并且有些毒性成分也能发挥临床治疗效果,因此,我国中药风险效益评估仍在初步研究阶段,尚未形成完整的理论体系[43-44]。根据美国与欧盟颁布的一系列以非动物实验作为评价药物安全性指标的政策[45],得出PBPK模型可以预测中药成分在器官组织中的暴露量,提高中药安全性评价和限量标准的科学性和准确性[46]。药物性肝损伤(drug-inducedliver injury,DILI)是临床实践中观察到的最常见不良反应之一[47],重症DILI表现为急性肝功能衰竭甚至死亡[48]。PBPK模型可以预测肝脏组织浓度,并与体外测定的氧化应激、线粒体损伤、胆汁酸淤积和先天免疫反应的激活等肝损伤机制整合(图2),模拟中药所致肝损伤[49-52]。Li等[53]利用PBPK建模预测口服苦参碱、氧化苦参碱、雷公藤甲素和大黄素4种中药活性成分的最大安全剂量。模拟结果与后续的临床试验结果相近。Liu等[54]采用体外毒性和计算机反向剂量测定的综合方法,研究16种蒽醌及其衍生物的潜在人体肝脏毒性。PBPK模拟证实了患者服用香豆素及其代谢物不足以引起肝毒性的发生[55]。综上,利用PBPK模型进行正向或反向剂量测定有助于人类对中药的风险评估,避免肝毒性等不良事件的发生。
2.2 中药活性成分与药物相互作用研究
中药及其复方制剂具有复杂多样的活性成分,极易影响部分中药或化学药的药动学行为,从而发生相互作用[56]。研究发现,中药复杂成分可以改变体内细胞色素P450酶和转运蛋白的活性[57],间接影响CYP酶和P-gp底物药或抑制剂的代谢和清除[58],从而无法达到临床预期治疗效果甚至引发不良反应。目前,各监管机构对(drug-drug interaction,DDI)体外和临床研究的相关指南不断完善与更新。国家药监局审评中心(center for drug evaluation ,CDE)于2021年发布适用于化学药品、中药、天然药物等最新版《药物相互作用研究技术指导原则》,此方案指导了经真实的临床试验或人体数据验证过的PBPK模型对不同机制引起的药物相互作用进行评价,同时支持剂量选择和外推,将有助于减少药物开发过程中的不确定性,提高研发效率[59]。PBPK模型严谨科学的预测能力为其在中药配伍及中药-药物相互作用的机制和结果研究中发挥了极其重要的作用,通过模拟获得中药对代谢酶和转运体的诱导或抑制作用,定量预测相互作用的程度,将为中药的临床剂量预测和调整以及安全使用拓宽前景。

图1 PBPK建模过程及其在中药PK中的应用
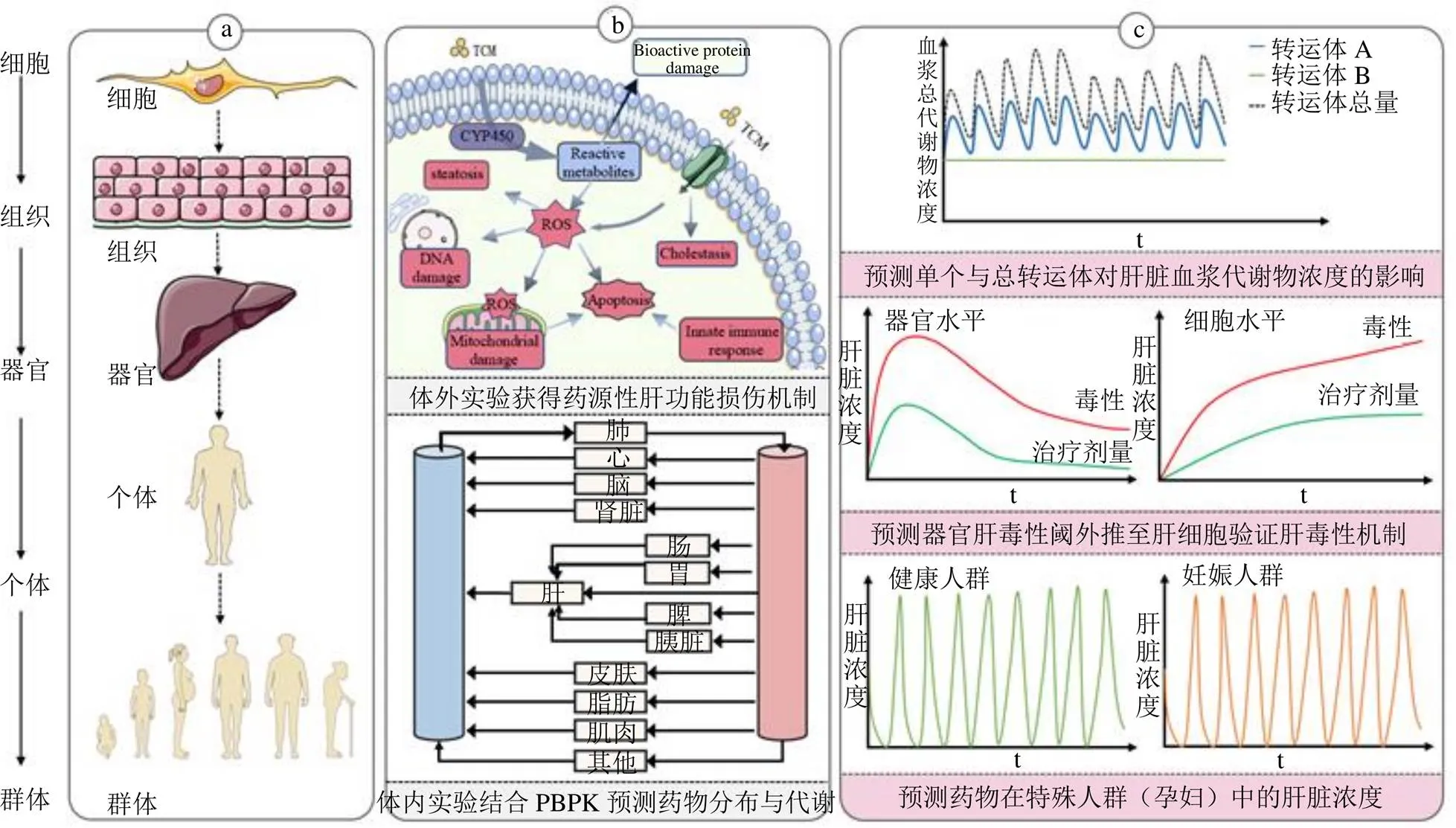
图2 PBPK模型预测中药致肝损伤的机制和程度
2.2.1 预测中药与CYP450酶介导的药物相互作用 中药与药物代谢酶相互作用大多呈现抑制作用,易引起药物不良反应。采用PBPK建模评估方法简化了中草药产品的安全性评估,并最终促进了临床肿瘤药物的安全使用。Jeffry等[60]建立并验证了贯叶金丝桃素的PBPK模型,预测圣约翰草与CYP底物药物相互作用的程度。模拟结果表明,圣约翰草提取物显著降低了经口给药后咪达唑仑的全身暴露量,而对服用伊马替尼患者的全身暴露量未产生影响。之后,他们以相同的思路建立黄连碱和小檗碱的PBPK模型,预测白茅根提取物与伊马替尼和博舒替尼在CYP3A酶存在时相互作用的程度。建议临床上调整博舒替尼的剂量,以保证药物疗效和安全性[61]。Tanveer等[62]使用PBPK模型评估不同CYP2C9基因型中水飞蓟宾A和氯沙坦相互作用的可能性和程度。预测结果可知,在CYP2C9*1/*2基因型个体中,水飞蓟宾与氯沙坦联合给药导致中度药动学相互作用。He等[63]开发并验证了五味子醇A和五味子醇B的PBPK模型,以预测CYP3A5表达者或非表达者中五味子醇A和五味子醇B联合给药后他克莫司暴露量的变化。结果表明,多次口服五味子醇B会导致CYP3A5表达者和非表达者他克莫司的体内暴露分别增加26%和57%,相互作用较强。
2.2.2 预测中药与转运蛋白介导的药物相互作用 中药活性成分会对转运蛋白的功能和表达产生影响,当与化学药物联用或与中药配伍时,有的能增强或降低原有药效,有的能抑制或消除毒副作用,有的则能产生或增强毒副反应[64]。例如,Liu等[65]采用SPIP模型探讨浙贝母和附子的不相容机制。结果显示,浙贝母对P-gp的功能和表达均有抑制作用,而附子中的苯甲酰新乌头原碱是P-gp的底物。紫杉醇是P-gp底物药,也是OATP1B1和OATP1B3的体外底物,而酮康唑与维拉帕米是P-gp抑制剂。Mailys等[66]通过建立紫杉醇静脉给药PBPK模型,预测癌症患者合用紫杉醇与酮康唑或维拉帕米发生HDI的程度以及导致中性粒细胞减少的发生率。预测结果可知,紫杉醇与酮康唑或维拉帕米合并使用的情况下,预计39%和26%的人群将发生重度中性粒细胞减少症,2种抑制剂均可导致紫杉醇的AUC比值增加。如果使用酮康唑或其他强抑制剂,建议在给药紫杉醇后至少12 h给药,以降低毒性风险。
2.3 中药活性成分在特殊人群中的药动学研究
特殊人群的机体功能和其他生理机能会影响药物在体内的过程,代谢酶与转运体的功能和表达与健康成年人存在差异,更容易产生相互作用和肝损伤等不良反应,所以其临床治疗方案的选择需尤为谨慎。CDE于2023年发布了《生理药动学模型在儿科人群药物研发中应用的技术指导原则》,其中明确提到PBPK模型通过对人体PK的预测,可为临床试验设计提供依据,如剂量选择、药物组织分布和儿科剂型开发等[67]。因此,在研究药物在特殊人群体内吸收机制时,PBPK模型提供了一个虚拟的模拟平台,通过纳入与年龄、疾病相关的生理参数,模拟健康人与特殊人群体内药物暴露量,为其剂量药动学预测和精确治疗提供更加严谨的参考信息[68]。Li等[69]通过PK-Sim软件,建立了广金钱草总黄酮的标志性成分夏佛塔苷的人体PBPK模型,考察包括老年人(71~80岁)和慢性肾功能受损患者在内的特殊人群PK特征。预测结果显示,慢性肾脏病患者中夏佛托苷的血浆浓度比健康成年人要高得多,老年人口服TFDS后暴露量差异不大。因此,对于重度肾损害患者,建议减少临床用药剂量。陈琳[70]应用SimCypTM软件构建了欧前胡素、异欧前胡素的大鼠和人体PBPK模型,预测严重吸烟人群血浆药动学和HDI潜能,为服用含有补骨脂素中药的吸烟人群提供安全有效的用药指南。李会娟[71]基于PBPK模型联合PA-1细胞,对补骨脂的胚胎毒性进行定性定量研究。此方法为建立符合中医药特点的中药胚胎毒性筛查体系奠定基础,为妊娠期应用中药的安全性研究搭建良好的平台。
2.4 中药整体CMMBCS分类属性研究
中药活性成分大多为BCS-Ⅲ类或Ⅳ类药物,不能完全被人体吸收入血,导致口服生物利用度低,PBPK模型可以预测出剂量数、吸收数及溶出数等参数[72],进而完善BCS分类属性,揭示中药肠吸收的特征与行为。中药溶解性、渗透性是PBPK建模的核心参数之一,一方面,通过体外实验获得的中药BCS数据,可更进一步校验PBPK建模的默认参数,从而更准确地对中药人体吸收进行预测[73]。另一方面,PBPK模型也可以预测出剂量数、吸收数及溶出数等关键指标参数[74],以进一步完善中药BCS分类。
Liu等[75]以葛根芩连复方中的黄芩素为研究对象,基于大鼠、比格犬和健康人的PBPK模型及CMMBCS理念,研究黄芩素BCS属性分类。结果显示黄芩素为BCS-II类,与体外溶出速率结果一致。通过PBPK模型异速增长方程预测了槲皮素、大豆苷元、芒柄花素等体内有效渗透系数和吸收分数[76]。尹秀文[77]通过GastroPlus软件建立并验证小檗碱大鼠吸收PBPK模型,预测小檗碱在大鼠体内的吸收系数和CMMBCS属性分类。以上案例充分证明PBPK模型结合体内外实验方法是研究中药CMMBCS分类及预测人体吸收的良好工具,为中药成分的体内吸收研究方面提供数据基础及科学理论参考。
2.5 中药剂型优化及开发
美国FDA在药品开发早期就鼓励对PBPK技术的开发,尤其对于溶出是限速步骤的产品[78]。对于成分复杂或者不便于使用常规PK等效方法进行评估的中药制剂,基于生物药剂学的PBPK建模可将药物体内吸收、临床表现、药物关键质量参数和体外评估方法等联系起来[79],进行生物等效性预测(图3),帮助建立体外-体内联系,辅助制剂优化和新剂型开发,制定以患者为中心的临床制剂质量标准。
为了研究中药单体雷公藤红素及其纳米制剂在大鼠体内的药动学行为以及肝毒性,石忠波[80]成功利用雷公藤红素及纳米制剂的大鼠全身PBPK模型,预测血浆及各组织雷公藤红素的C-关系,获取相关药动学参数。发现雷公藤红素在肝脏中分布最多,有蓄积现象。与雷公藤红素比较,其纳米制剂腹腔注射后生物利用度提高、肝毒性降低,其他药动学行为亦有所改善。Wang等[81]用GastroPlus软件建立3种姜黄素口服制剂PBBM模型,评估姜黄素在肠道吸收动力学参数。PBBM模型预测值与大鼠体内药动学实测值基本一致,表明其模拟中药制剂体内吸收结果可靠。此外,Gao等[82]以高疏水性药物穿心莲内酯作为模型药物,用PK-Sim软件分别建立大鼠口服纯穿心莲内酯、穿心莲内酯滴丸和穿心莲内酯环糊精三元复合制剂的PBBM模型,预测3种制剂的PK参数,并通过细胞和动物实验进行验证,辅助临床成功研制出穿心莲内酯环糊精三元复合制剂。

图3 PBPK吸收模型在剂型开发中的应用
综上所述,基于生理学的建模技术已经成为促进中药复方配方设计的有力工具,相比于传统药动学模型,其能够更加准确的预测出不同制剂的体内吸收过程,为中药制剂优化和新剂型开发提供科学指南。
3 结语与展望
近些年来改进的机制性生理模型由于综合了口服药物吸收的多重过程及影响因素,拥有更好的模拟和预测能力,与Caco-2细胞模型及在体肠灌流模型的预测结果具有良好的相关性。PBPK模型在探索中药复方配伍的科学内涵、中药-药物相互作用、体内体外相关性和指导临床合理安全用药等方面具有极大的优势,同时可为药物说明书中特殊人群用法用量的撰写提供依据,加快了中药新药的研发历程。美国FDA等权威监管机构已经意识到PBPK模型的重要性,将其列入了新药注册的审查环节[83-84]。PBBM模型由于近年来在支撑药品质量标准制定领域使用的增加,人们对这一PBPK模型分支的兴趣渐长,在生理相关性溶出方法基础上构建的PBBM模型的模式,不仅可以帮助预测中药的体内吸收情况,还可以为中药复方生物豁免提供依据。相信未来这类技术在中药标准化中的使用会越来越普及和规范化。
在以上应用实例中,中西药相互作用研究占比较大。临床工作中,中西药联用现象也十分普遍,并且取得了突出成绩。然而,PBPK模型预测中西药相互作用仍面临不少挑战,一方面,由于中药成分复杂、种属差异等因素,使得模型预测结果无法得到保证,目前将PBPK建模用于代谢酶和转运体参与的体内HDI研究并不多[85-86];另一方面,中西药相互作用研究缺乏整体的定量评价体系和因果关系,无法从根源解决联合用药带来的安全问题。相信随着科学技术的发展与新的体外和体内数据的出现,PBPK等机制性生理模型在中药–药物相互作用研究中将会得到更多的开发和使用,为临床安全用药提供科学有用的参考指南,为中西药联用的增效减毒研究开启新篇章。此外,以上方法用于中药生物药剂学分类规律的研究对解释低生物利用度、高生物学效应的中药药效物质与作用机制的研究具有指导意义,从而促进中药复方剂型优化和开发。
PBPK模型作为一种机制性模型,其预测结果的准确性依赖于当前科学认知水平和数据的可靠性。目前,对人类PBPK建模的研究尚处于积累阶段,系统参数来源少、参数准确性无法保证、模型验证缺少严谨性和计算复杂等难题,使得其无法在中药研究中被广泛使用。但随着各学科间的相互渗透、相互影响和更多科研工作者不懈的努力,PBPK在中药标准化研究中的应用会越来越广泛和深入。
利益冲突 所有作者均声明不存在利益冲突
[1] Rao T, Tan Z R, Peng J B,. The pharmacogenetics of natural products: A pharmacokinetic and pharma- codynamic perspective [J]., 2019, 146: 104283.
[2] 苏布达, 李晓萌, 刘慧, 等. 生理药动学模型用于中药风险评估的思考及认识 [J]. 中草药, 2022, 53(15): 4593-4603.
[3] 凌利. 旴江医家外感热病临证经验及思想初探 [D]. 南昌: 江西中医药大学, 2022.
[4] Yang Z R, Pan G F, Zhang L Y,. Deviating from clinical practice: Pharmacokinetics of Chinese materia medica faces a substantial challenge [J]., 2020, 127: 110191.
[5] 余健, 辛艳飞, 宣尧仙. 中药药动学研究进展 [J]. 中华中医药学刊, 2014, 32(6): 1337-1340.
[6] Li C, Jia WW, Yang J L,. Multi-compound and drug-combination pharmacokinetic research on Chinese herbal medicines [J]., 2022 ,43(12):3080-3095.
[7] Li C, Cheng C, Jia W W,. Multi-compound pharmacokinetic research on Chinese herbal medicines: identifying the medicines’ potentially therapeutic compounds and characterizing their disposition and pharmacokinetics [J]., 2021, 56(1): 26-46.
[8] Liu J, Li X, Bai H,. Traditional uses, phytochemistry, pharmacology, and pharmacokinetics of the root bark ofxAndrews: A comprehensive review [J]., 2023, 308(2): 116279.
[9] 王林元. 外来中药的发展及在中药学科建设中的地位和作用 [J]. 北京中医药大学学报, 2022, 45(10): 1005-1017.
[10] 蔡其霖, 黎文星, 严真, 等. 基于PBPK模型预测不同晶型利福平的生物等效性 [J]. 中国药科大学学报, 2022, 53(2): 207-214.
[11] European Medicines Agency (EMA). Guideline on the reporting of physiologically based pharmacokinetic (PBPK) modelling and simulation(2018-458101) [EB/OL].[2018-12-13].https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-reporting-physiologically-based-pharmacokinetic-pbpk-modelling-simulation_en.pdf
[12] Food and Drug Administration(FDA). Physiologically based pharmacokinetic analyses-format and content guidance for industry (2018-19065) [EB/OL]. [2018-9-4].https://www.regulations.gov/document/FDA-2016-D-3969-0017
[13] Mitra A, Suarez-Sharp S, Pepin X J H,. Applications of physiologically based biopharmaceutics modeling (PBBM) to support drug product quality: A workshop summary report [J]., 2021, 110(2): 594-609.
[14] 沈淑娇, 樊玉娟, 裘福荣, 等. 生理药动学模型发展现状及其在药物临床研究中的应用 [J]. 中国临床药理学与治疗学, 2020, 25(3): 334-343.
[15] Jia Q L, He Q F, Yao L,. Utilization of physiologically based pharmacokinetic modeling in pharmacokinetic study of natural medicine: An overview [J]., 2022, 27(24): 8670.
[16] 孙琦, 李晓冰, 何晓静, 等. 生理药动学模型的研究与应用进展[J]. 药物流行病学杂志, 2020, 29(4): 280-284.
[17] 姚美村, 姜晓飞, 陆亚松, 等. 生理药动学模型及其在中药研究中的应用 [J]. 世界科学技术—中医药现代化, 2007, 9(3): 55-59.
[18] 董柳含, 许小菊, 王瑾, 等. PBPK模型在抗感染药物研发及临床评价中的应用 [J]. 中国抗生素杂志, 2022, 47(10): 1013-1019.
[19] Om A, Pepin Xavier J H, Vidula K,. The use of physiologically based pharmacokinetic analyses-in biopharmaceutics applications-regulatory and industry perspectives [J]., 2022, 39(8): 1681-1700.
[20] Heimbach T, Suarez-Sharp S, Kakhi M,. Dissolution and translational modeling strategies toward establishing an-link-a workshop summary report [J]., 2019, 21(2): 29.
[21] 沙碧君, 周素凤, 王璐, 等. 药物相互作用临床研究方法及进展 [J]. 中国临床药理学与治疗学, 2019, 24(9): 1037-1045.
[22] 李雪, 王磊, 卜睿臻, 等. 基于模型引导的中药安全用药的研究策略: 中药定量毒理学 [J]. 中草药, 2023, 54(2): 359-366.
[23] Chen J R, You X, Wu W H,. Application of PBPK modeling in predicting maternal and fetal pharmacokinetics of levetiracetam during pregnancy [J]., 2023, 181: 106349.
[24] Shen C Z, Shao W X, Wang W H,. Physiologically based pharmacokinetic modeling of levetiracetam to predict the exposure in hepatic and renal impairment and elderly populations [J]., 2023, 12(7): 1001-1015.
[25] Cui C, Qu Y, Sia JEV,. Assessment of aging-related function variations of P-gp transporter in old-elderly Chinese CHF patients based on modeling and simulation [J].. 2022, 61(12):1789-1800.
[26] Berton M, Bettonte S, Stader F,. Physiologically based pharmacokinetic modelling to identify physiological and drug parameters driving pharmacokinetics in obese individuals [J]., 2023, 62(2): 277-295.
[27] Guo G M, You X A, Wu W H,. Physiologically- based pharmacokinetic modeling of omalizumab to predict the pharmacokinetics and pharmacodynamics in pediatric patients [J]., 2023, 113(3): 724-734.
[28] Li Z R, Shen C H, Li R D,. Individual dose recommendations for drug interaction between tacrolimus and voriconazole in adult liver transplant recipients: A semiphysiologically based population pharmacokinetic modeling approach [J]., 2023, 184: 106405.
[29] Liu H R, Yu Y Q, Liu L,. Application of physiologically-based pharmacokinetic/ pharmacodynamic models to evaluate the interaction between nifedipine and apatinib [J]., 2022, 13: 970539.
[30] Montanha M C, Fabrega F, Howarth A,. Predicting drug-drug interactions between rifampicin and ritonavir-boosted atazanavir using PBPK modelling [J]., 2022, 61(3): 375-386.
[31] Ngo L T, Lee J, Yun H Y,. Development of a physiologically based pharmacokinetic model for tegoprazan: Application for the prediction of drug–drug interactions with CYP3A4 perpetrators [J]., 2023, 15(1): 182.
[32] Zhou K X, Huo M X, Ma W J,. Application of a physiologically based pharmacokinetic model to develop a veterinary amorphous enrofloxacin solid dispersion [J]., 2021, 13(5): 602.
[33] Khan D, Badhan R, Kirby D J,. Virtual clinical trials guided design of an age-appropriate formulation and dosing strategy of nifedipine for paediatric use [J]., 2023, 15(2): 556.
[34] Zhang Z W, Fu S, Wang F R,. A PBPK model of ternary cyclodextrin complex of ST-246 was built to achieve a reasonable IV infusion regimen for the treatment of human severe smallpox [J]., 2022, 13: 836356.
[35] Tang C, Ou-yang C X, Chen W J,. Prediction of pharmacokinetic parameters of inhaled indacaterol formulation in healthy volunteers using physiologically-based pharmacokinetic (PBPK) model [J]., 2022, 168: 106055.
[36] Wiśniowska B, Linke S, Polak S,. Physiologically based modelling of dermal absorption and kinetics of consumer-relevant chemicals: A case study with exposure to bisphenol A from thermal paper [J]., 2023, 459: 116357.
[37] Pech K, Pérez-Herrera N, Vértiz-Hernández Á A,. Health risk assessment in children occupationally and para-occupationally exposed to benzene using a reverse-translation PBPK model [J]., 2023, 20(3): 2275.
[38] Lee S, Kim J H, Moon H B,. Effects of mercury exposure on fetal body burden and its association with infant growth [J]., 2023, 217: 114780.
[39] Li C H, Jiang L D, Zhang D H,. Human health risk assessment of 6: 2 Cl-PFESA through quantitativetoextrapolation by integrating cell-based assays, an epigenetic key event, and physiologically based pharmacokinetic modeling [J]., 2023, 173: 107846.
[40] Soliman M E, Adewumi A T, Akawa O B,. Simulation models for prediction of bioavailability of medicinal drugs—The interface between experiment and computation [J]., 2022, 23(3): 86.
[41] 周旭, 魏园园, 马涛, 等. 儿童生理药动学模型及其建模软件的应用 [J]. 药学学报, 2023, 58(2): 320-329.
[42] 吴桐. 雷公藤甲素体内外代谢处置以及与CYP酶的相互作用研究 [D]. 北京: 军事医学科学院, 2018.
[43] 胡欣燕, 李璐, 郭桂明. 高警示中药品种的安全性分析和归纳 [J]. 中国初级卫生保健, 2021, 35(5): 6-8.
[44] 马双成, 王莹, 魏锋. 中药质量控制未来发展方向的思考 [J]. 中国药学杂志, 2021, 56(16): 1273-1281.
[45] Zhang M, Chen M J, Tong W. Is toxicogenomics a more reliable and sensitive biomarker than conventional indicators from rats to predict drug-induced liver injury in humans? [J].,2012, 25(1): 122-129.
[46] 窦亚洁, 刘慧, 李晓萌, 等. 中药中外源性有害物的残留现状及风险评估的研究进展 [J]. 中草药, 2023, 54(2): 396-407.
[47] 池肇春. 药物性肝损伤研究现状与进展 [J]. 世界华人消化杂志, 2021, 29(16): 915-925.
[48] Miguel A, Azevedo L F, Araújo M,. Frequency of adverse drug reactions in hospitalized patients: A systematic review and meta-analysis [J]., 2012, 21(11): 1139-1154.
[49] 李敏, 李思泽, 姚莉, 等. 数学模型预测药源性肝损伤研究进展 [J]. 中国药理学与毒理学杂志, 2021, 35(5): 382-390.
[50] 李红颖, 杨翠平, 靳洪涛. 常用药物肝损伤发生机制研究进展 [J]. 中国药物警戒, 2019, 16(12): 750-756.
[51] Watkins P B. Improving interpretation of new and old serum biomarkers of drug-induced liver injury through mechanistic modeling [J]., 2018, 7(6): 357-359.
[52] Wang Q M, Peng X Y, Chen Y F,. Piezo1 alleviates acetaminophen-induced acute liver injury by activating Nrf2 and reducing mitochondrial reactive oxygen species [J]., 2023, 652: 88-94.
[53] Li S Z, Yu Y Q, Bian X L,. Prediction of oral hepatotoxic dose of natural products derived from traditional Chinese medicines based on SVM classifier and PBPK modeling [J]., 2021, 95(5): 1683-1701.
[54] Liu Y T, Mapa M S T, Sprando R L. Liver toxicity of anthraquinones: A combinedcytotoxicity andreverse dosimetry evaluation [J]., 2020, 140: 111313.
[55] Miura T, Kamiya Y, Hina S,. Metabolic profiles of coumarin in human plasma extrapolated from a rat data set with a simplified physiologically based pharmacokinetic model [J]., 2020, 45(11): 695-700.
[56] 金杨, 王燕, 何云长. 中药质量控制研究进展 [J]. 广东化工, 2022, 49(21): 119-121.
[57] 郑雁雪, 王圆圆, 王琳, 等. 中药配伍减毒增效的现代研究及思考 [J]. 中草药, 2023, 54(2): 386-395.
[58] Chen L, Ji N, Zhang M,. The influence of Wuzhi capsule on the pharmacokinetics of cyclophosphamide[J].,2022, 17(2): 195-203.
[59] 国家药品监督管理局药品审评中心. 国家药监局药审中心关于发布《药物相互作用研究技术指导原则(试行)》的通告 (2021年第4号) [EB/OL]. [2021-01-26]. https://www.cde.org.cn/zdyz/domesticinfopage?zdyzIdCODE=e0293bfd34a7c44a93382776199101bb.
[60] Jeffry A, Boddy Alan V, McLachlan Andrew J. Physiologically based pharmacokinetic modelling of hyperforin to predict drug interactions with st John’s wort [J]., 2019, 58(7): 911-926.
[61] Adiwidjaja J, Boddy A V, McLachlan A J. Physiologically based pharmacokinetic model predictions of natural product-drug interactions between goldenseal, berberine, imatinib and bosutinib [J]., 2022, 78(4): 597-611.
[62] Tanveer A, Hussain K, Tasneem H,. Prediction of CYP-mediated silybin A-losartan pharmacokinetic interactions using physiological based pharmacokinetic modeling [J]., 2022, 49(3): 311-323.
[63] He Q F, Bu F J, Wang Q Z,. Examination of the impact of CYP3A4/5 on drug–drug interaction between schizandrol A/schizandrol B and tacrolimus (FK-506): A physiologically based pharmacokinetic modeling approach [J]., 2022, 23(9): 4485.
[64] 刘方明, 田利霞. 中医药文化的内涵 [J]. 内蒙古中医药, 2010, 29(21): 128-129.
[65] Liu W J, Wei L, Kanai Y,. Studies on the incompatibility betweenandbased on the P-gp [J]., 2021, 2021: 1-11.
[66] De Sousa Mendes M, Hatley O, Gill K L,. A physiologically based pharmacokinetic-pharmacodynamic modelling approach to predict incidence of neutropenia as a result of drug-drug interactions of paclitaxel in cancer patients [J]., 2020, 150: 105355.
[67] 国家药品监督管理局药品审评中心. 国家药监局药审中心关于发布《生理药动学模型在儿科人群药物研发中应用的技术指导原则》的通告 (2023年第24号) [EB/OL]. [2023-03-28]. https://www.cde. org.cn/zdyz/ domesticinfopage?zdyzIdCODE=05491ca1e5d56557219001c3c08cc0c5.
[68] Li X E, Chen C, Zhang T J,. Comparative pharmacokinetic studies of five C-glycosylflavones in normal and urolithiasis model rats following administration of total flavonoids fromby liquid chromatography-tandem mass spectrometry [J]., 2022, 45(15): 2901-2913.
[69] Li X, Chen C, Ding N,. Physiologically based pharmacokinetic modelling and simulation to predict the plasma concentration profile of schaftoside after oral administration of total flavonoids of[J], 2022, 13(1): 1073535.
[70] 陈琳. 白芷呋喃香豆素的体内外处置以及基于CYP酶的药物相互作用研究 [D]. 北京: 中国人民解放军军事医学科学院, 2017.
[71] 李会娟. 基于p-PBPK模型探讨补骨脂胚胎毒性的示范性研究 [D]. 天津: 天津中医药大学, 2018.
[72] 刘洋, 王子禹, 徐文娟, 等. 中药生物药剂学分类系统的研究和发展思路探讨 [J]. 中国中药杂志, 2019, 44(17): 3637-3644.
[73] 王子禹. 基于抗炎活性的葛根芩连片整体中药生物药剂学分类系统研究 [D]. 北京: 北京中医药大学, 2019.
[74] 吴春暖. 基于生理药动学模型的BCS Ⅱ类药物的体内外相关性及制剂研究 [D]. 沈阳: 沈阳药科大学, 2015.
[75] Liu Y, Sun J, Zhong L Y,. Combination of a biopharmaceutic classification system and physiologically based pharmacokinetic models to predict absorption properties of baicaleinand[J]., 2021, 8(3): 238-247.
[76] 刘洋, 张鑫, 石秀佳, 等. 基于PBPK模型的在体单向肠灌流技术对苷元成分的适用性分析评价 [J]. 中国中药杂志, 2019, 44(17): 3645-3652.
[77] 尹秀文. 小檗碱吸收预测模型建立与中药生物药剂学分类系统属性的研究 [D]. 北京: 北京中医药大学, 2018.
[78] Food and Drug Administration (FDA). The use of physiologically based pharmacokinetic analyses- biopharmaceutics applications for oral drug product development, manufacturing changes, and controls guidance for industry (2020-D-1517)[EB/OL]. [2020-10- 01]. https://www.regulations.gov/document/FDA-2020- D-1517-0002.
[79] 周舟, 刘波. 模型引导的药物研发:发展历程和应用思考 [J]. 中国临床药理学杂志, 2021, 37(6): 772-776.
[80] 石忠波. 雷公藤红素及其纳米制剂HA-CEL-NPs的药动学研究 [D]. 重庆: 重庆医科大学, 2022.
[81] Wang L J, Li W J, Cheng D,. Pharmacokinetics and pharmacodynamics of three oral formulations of curcumin in rats [J]., 2020, 47(2): 131-144.
[82] Gao H S, Su Y, Wang W,. Integrated computer-aided formulation design: A case study of andrographolide /cyclodextrin ternary formulation [J]., 2021, 16(4): 494-507.
[83] Huang S M. PBPK as a tool in regulatory review [J]., 2012, 33(2): 51-52.
[84] Grimstein M, Yang Y, Zhang X Y,. Physiologically based pharmacokinetic modeling in regulatory science: An update from the U.S. food and drug administration’s office of clinical pharmacology [J]., 2019, 108(1): 21-25.
[85] 傅春燕, 刘永辉, 曾立, 等. 中药(复方)药动学研究进展 [J]. 邵阳学院学报: 自然科学版, 2021, 18(5): 101-108.
[86] Witta S, Collins K P, Ramirez D A,. Vinblastine pharmacokinetics in mouse, dog, and human in the context of a physiologically based model incorporating tissue-specific drug binding, transport, and metabolism [J]., 2023, 11(1): e01052.
Utilization of physiologically based pharmacokinetic/biopharmacological modeling in pharmacokinetic study of TCM
TIAN Suo-yan, JIA Guo-xiang, HU Jing-wen, LU Qian, SU Bu-da, YANG Shen-shen, LI Yu-bo
School of Traditional Chinese Medicine, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China
Traditional Chinese medicine (TCM) has been characterized by multi-component, multi-target, complex metabolism and wide clinical applications. Pharmacokinetics (PK) of TCM is one of the major scientific issues in the study of TCM, which plays a pivotal role in explaining the scientific nature of TCM and promoting the internationalization and modernization of TCM. The physiologically based pharmacokinetics (PBPK) and physiologically based biopharmaceutics (PBBM) models were found to not only simulateproperties of TCM, but also predict pharmacokinetic processes of TCM and their metabolites in plasma or different tissueswith a bottom-up approach. Furthermore, they provide important references for elucidating the material basis of the efficacy of TCM, revealing the scientific connotation of efficacy and safety of TCM, as well as improving dosage forms of new TCM. In this review, the advantages and applications of PBPK/PBBM model in pharmacokinetic study of TCM were summarized, with view to providing references for the modernization study and the rational clinical use of TCM.
pharmacokinetics of TCM; physiologically based pharmacokinetics; physiologically based biopharmaceutics; drug interactions; risk assessment; formulation optimization and development
R286
A
0253 - 2670(2023)20 - 6903 - 10
10.7501/j.issn.0253-2670.2023.20.033
2023-03-06
国家自然科学基金资助项目(82141209)
田锁燕(1999—),女,硕士,研究方向为中药学。Tel: 18609557870 E-mail: suoyantian1222@163.com
通信作者:杨珅珅(1984—),女,副教授,研究方向为中药成分的胃肠转运与剂型设计。E-mail: shine2099@163.com
李遇伯(1978—),女,教授,主要研究方向为中药安全性评价。E-mail: yaowufenxi001@sina.com
[责任编辑 时圣明]
