黄芩素调控NLRP3/Caspase-1/GSDMD通路介导的焦亡减轻小鼠急性肺损伤作用
2023-10-19兰悦嘉孟宪丽吴嘉思
兰悦嘉,孟宪丽,吴嘉思
• 药理与临床•
黄芩素调控NLRP3/Caspase-1/GSDMD通路介导的焦亡减轻小鼠急性肺损伤作用
兰悦嘉1,孟宪丽1*,吴嘉思2*
1. 成都中医药大学药学院,四川 成都 611137 2. 成都中医药大学针灸推拿学院,四川 成都 611137
探究黄芩素对急性肺损伤(acute lung injure,ALI)小鼠的治疗作用以及对NOD样受体热蛋白结构域3(NOD-like receptor family pyrin domain containing 3,NLRP3)/半胱氨酸天冬氨酸蛋白酶-1(cystein-asparate protease-1,Caspase-1)/消皮素D(gasdermin D,GSDMD)焦亡通路的调控作用。60只雄性C57BL/6小鼠随机分为对照组、模型组、Caspase-1抑制剂VX-765(30 mg/kg)组和黄芩素低、中、高剂量(10、20、40 mg/kg)组,每组10只。除对照组外,其余各组ip脂多糖(lipopolysaccharide,LPS,15 mg/kg),分别于造模前24 h和造模0.5 h后给予黄芩素或VX-765(30 mg/kg)干预。造模24 h后,检测小鼠肺湿干质量比以评价肺肿胀;苏木素-伊红(HE)染色法检测肺组织病理变化;透射电子显微镜观察肺组织中巨噬细胞损伤情况;ELISA法检测小鼠血清和肺泡灌洗液中白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、IL-18、IL-1α和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平;采用Western blotting检测肺组织NLRP3、凋亡相关的斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)、cleaved Caspase-1、pro Caspase-1、GSDMD-N以及GSDMD蛋白表达。人源单核细胞白血病THP-1细胞加入100 nmol/L佛波酯诱导24 h,贴壁后随机分为对照组、模型组、VX-765(500 nmol/L)组和黄芩素低、中、高剂量(3、10、30 μmol/L)组,除对照组外,采用1 μg/mL LPS联合5 mmol/L三磷酸腺苷(adenosine triphosphate,ATP)刺激THP-1细胞建立细胞炎症模型,给予黄芩素或VX-765干预,采用CCK-8法检测细胞活力;ELISA法检测上清液中IL-1β、IL-18和IL-1α水平;LDH试剂盒检测上清液中乳酸脱氢酶(lactate dehydrogenase,LDH)活力;免疫荧光评估NLRP3炎症小体组装情况;采用膜联蛋白-V-PE(Annexin-V-PE)/7-氨基放线菌素(7-aminoactinomycin,7-AAD)试剂盒评价细胞焦亡情况;Western blotting检测细胞NLRP3/Caspase-1/GSDMD通路相关蛋白表达。在ALI小鼠模型中,与模型组比较,VX-765组和黄芩素组小鼠肺肿胀程度明显减轻(<0.01),肺组织损伤评分显著降低(<0.01),肺组织中巨噬细胞炎性病变得到缓解,血清及肺泡灌洗液中IL-6、IL-1β、TNF-α、IL-18、IL-1α水平明显降低(<0.05、0.01),肺组织NLRP3、ASC、cleaved Caspase-1、pro Caspase-1、GSDMD-N以及GSDMD蛋白表达水平均显著降低(<0.05、0.01)。在细胞炎症模型中,与模型组比较,VX-765组和黄芩素组THP-1细胞IL-1β、IL-18、IL-1α分泌量显著降低(<0.01),NLRP3/Caspase-1/GSDMD通路相关蛋白表达水平明显降低(<0.05、0.01),NLRP3炎症小体组装明显被抑制(<0.05、0.01),LDH释放量及细胞焦亡率显著降低(<0.01)。黄芩素通过抑制NLRP3/Caspase-1/GSDMD通路介导的细胞焦亡,从而改善LPS诱导的小鼠ALI。
黄芩素;急性肺损伤;脂多糖;NLRP3/Caspase-1/GSDMD通路;细胞焦亡
急性肺损伤(acute lung injury,ALI)是脓毒症患者常见的并发症之一,其特征是肺泡上皮细胞和内皮细胞损伤、肺部炎症细胞浸润以及出现充血水肿等,属于临床常见的危重症,其发病急骤、病死率高[1-2]。目前西医治疗以原发病的治疗、呼吸支持为主,总体上缺乏特效的药物及方法,不能达到理想的治疗效果,此外,针对脓毒症临床治疗所使用的抗生素、糖皮质激素,因不良反应大且易引起药物依赖性[3],故不宜长期应用。因此,深入探究ALI发生的作用机制,寻找新型ALI预防及治疗药物的具有意义。
NOD样受体热蛋白结构域3(NOD-like receptor family pyrin domain containing 3,NLRP3)/半胱氨酸天冬氨酸蛋白酶-1(cystein-asparate protease-1,Caspase-1)/消皮素D(gasdermin D,GSDMD)为典型的炎症通路,是ALI的发病核心[4],其诱导的下游肺泡巨噬细胞焦亡是肺损伤和肺肿胀的主要原因之一[5]。据报道,抑制巨噬细胞中NLRP3的激活可减少白细胞介素-1β(interleukin-1β,IL-1β)、IL-18的释放,抑制炎症反应,缓解脓毒症小鼠组织损伤[6]。此外,抑制Caspase-1介导的细胞焦亡能够明显降低机体过度炎症反应,从而改善脓毒症小鼠ALI并抑制脂多糖(lipopolysaccharide,LPS)诱导的肺血管内皮细胞和肺泡巨噬细胞炎症反应[7]。因此,NLRP3/Caspase-1/GSDMD通路可作为治疗脓毒症的重要潜在靶点。
《太平圣惠方》中记载治疗脓毒症药物使用频次位于前5位的是大黄、黄芩、甘草、栀子、麦冬[8]。此外,黄芩作为臣药在黄连解毒汤治疗脓毒血症过程中发挥了清泻上焦心肺之火的效用[9]。成分-效应研究结果显示黄芩素是黄芩中含量最高的黄酮类化合物[10],临床常应用于治疗多种感染性疾病,有较好的解热、抗炎及改善“热、毒、瘀”状态作用。既往研究表明黄芩素针对多种炎症相关疾病具有明显的改善作用,如对酒精诱导的小鼠急性肝损伤具有保护作用[11];通过抑制缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)/血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路抑制类风湿性关节炎大鼠炎症反应及病理性血管生成等[12]。然而,黄芩素能否通过调控NLRP3/ Caspase-1/GSDMD通路改善LPS诱导的炎症反应和ALI尚不可知。因此,本研究主要探究黄芩素对脓毒症小鼠ALI的影响及其作用机制。
1 材料
1.1 动物
SPF级雄性C57BL/6小鼠60只,7~8周龄,体质量(20±5)g,购自北京华阜康生物科技股份有限公司,动物许可证号SCXK(京)2019-0008。动物于12 h昼夜交替环境下适应性喂养1周。动物实验经成都中医药大学动物保护与使用委员会批准(批准号2022-79)。
1.2 细胞系
人源单核细胞白血病THP-1细胞、小鼠单核巨噬RAW264.7细胞购自武汉普诺赛生命科技有限公司,并取第3~10代细胞用于后续实验。
1.3 药品与试剂
黄芩素(质量分数≥98%,批号MUST-21101117)购自成都曼思特生物科技有限公司;LPS(批号L4391-1MG)、二甲基亚砜(dimethyl sulfoxide,DMSO,批号RNBF8134)均购自美国Sigma公司;佛波酯(phorbol ester,PMA,批号514V021)、三磷酸腺苷(adenosine triphosphate,ATP,批号530S021)购自北京索莱宝科技有限公司;PBS(批号GA22090352838)、电镜固定液(批号CR2203215)购自武汉赛维尔生物科技有限公司;THP-1细胞专用RPMI 1640培养基(批号WH1623N271)、RAW264.7细胞专用高糖DMEM培养基(批号WHAA23N141)购自武汉普诺赛生命科技有限公司;NLRP3、Caspase-1、cleaved Caspase-1、GSDMD、HMGB1抗体(批号分别为15101、83383S、67314S、46451S、6893)购自美国CST公司;凋亡相关的斑点样蛋白(apoptosis-associated speck-like protein containing CARD,ASC)抗体(批号sc-365611)购自美国Santa Cruz Biotechnology公司;3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号BB12287199)、山羊抗兔IgG二抗(批号BA12163708)购自北京博奥森生物科技有限公司;Alexa Fluor 488标记的山羊抗兔IgG二抗(批号A0423)、Alexa Fluor 555标记的驴抗小鼠IgG二抗(批号A0460)、乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒(批号C0016)购自上海碧云天生物技术有限公司;Caspase-1抑制剂Belnacasan(VX-765,批号S2228)购自美国Selleck公司;蛋白酶抑制剂PMSF(批号17E10A92)、RIPA裂解液(批号17K17B05)、CCK-8试剂盒(批号17K16B60)购自武汉博士德生物工程有限公司;IL-1β、IL-6、IL-1α、IL-18、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒(批号分别为PA1064X87935、PA08L02H1995、PA02FDR00461、PA09FR8B5902、PA0684VL9962)购自武汉伊莱瑞特生物科技有限公司;膜联蛋白-V-PE(Annexin-V-PE)/7-氨基放线菌素(7-aminoactinomycin,7-AAD)细胞凋亡检测试剂盒(批号C08A090)购自上海爱必信生物科技有限公司。
1.4 仪器
SpectraMaxR iD5型全波长多功能酶标仪(美国美谷分子仪器有限公司);CLM-170B-8-NF型培养箱(新加坡ESCO公司);SP8SR STED型超高分辨激光共聚焦显微镜(德国Leica公司);JEM-1400型FLASH透射电子显微镜(TEM,日本JEOL公司);1384系列生物安全柜(美国Thermo Fisher Scientific公司);AE2000型倒置显微镜(Motic股份有限公司);Mini PROTEAN型蛋白电泳仪、Mini Trans-Blot蛋白转印系统(美国Bio-Rad公司);UVP ChemStudio多功能成像仪(德国Jena公司);Milli-Q Plus超级纯水仪(美国Millipore公司);FACSCanto Ⅱ型流式细胞仪(美国BD公司);SK-O180-S型数显圆周摇床(上海珂淮仪器有限公司)。
2 方法
2.1 体内实验
2.1.1 分组、造模与给药 将60只雄性C57BL/6小鼠适应性喂养1周后,随机分为对照组、模型组、VX-765(30 mg/kg)组和黄芩素低、中、高剂量(10、20、40 mg/kg)组,每组10只。参照文献方法[13]构建ALI小鼠模型,除对照组外,其余各组ip LPS(15 mg/kg),各给药组分别于造模前24 h和造模0.5 h后ip黄芩素或VX-765,造模后24 h收集各组小鼠血液、肺组织及肺泡灌洗液。
2.1.2 肺组织病理学观察 每组取4只小鼠的左肺组织于4%多聚甲醛中固定,脱水、透明、石蜡包埋,制备组织切片,切片厚度3~5 μm,进行苏木素-伊红(HE)染色、封片后,于显微镜下观察肺组织病理学变化,并进行病理分析评分。
2.1.3 肺肿胀度评估 取“2.1.2”项下各组小鼠的右肺,生理盐水清洗后,使用滤纸擦拭干净水分,然后称定质量并标记为湿质量。随后置于65 ℃烘箱内24 h称定质量并标记为干质量,计算肺湿干质量比。
2.1.4 TEM观察肺组织超微结构 取新鲜肺组织,组织体积2 mm×2 mm大小,于电镜固定液内室温固定2 h,再用含1%锇酸的0.1 mol/L磷酸缓冲液(pH 7.4)在室温下固定2 h,0.1 mol/L磷酸缓冲液(pH 7.4)漂洗3次,每次15 min,然后以梯度丙酮进行脱水,Epon812渗透包埋,采用超薄切片机制备60~90 nm超薄切片,以铀铅双染色法染色,最后置于TEM下观察,采集图像并分析。
2.1.5 ELISA法检测血清、肺泡灌洗液中IL-1β、IL-6、IL-18、IL-1α和TNF-α水平 小鼠血液样本常温静置2 h后,4 ℃、4000 r/min离心10 min,吸取上层血清。按照文献方法[14]收集小鼠肺泡灌洗液,离心后吸取上清。按照试剂盒说明书测定血清、肺泡灌洗液中IL-1β、IL-6、IL-18、IL-1α和TNF-α水平。
2.1.6 Western blotting法检测肺组织相关蛋白表达 将剩余各组的肺组织于匀浆机中匀浆,取匀浆液100 mg与1 mL RIPA裂解液混合,再加10 μL PMSF混匀搅碎,离心取上清液,采用BCA法测定蛋白浓度,调整蛋白浓度并加入上样缓冲液,加热使蛋白变性。样品经十二烷基硫酸钠-聚丙烯胺凝胶电泳、转膜、封闭、TBST洗膜后,分别加入NLRP3、pro Caspase-1、cleaved Caspase-1、ASC、GSDMD抗体,4 ℃孵育过夜,TBST洗涤3次,每次10 min。加入二抗,室温下摇床孵育2 h,TBST洗涤3次,每次10 min。ECL显色后曝光,采用Image J 1.8.0软件分析。以GAPDH为内参,计算目的蛋白相对表达量。
2.2 体外实验
2.2.1 细胞培养与处理 THP-1细胞用RPMI 1640培养基,于37 ℃、5% CO2培养箱中培养,取对数生长期细胞进行实验。THP-1细胞接种于96孔板或6孔板中,加入100 nmol/L PMA诱导24 h,贴壁后随机分为对照组、模型组、VX-765(500 nmol/L)组和黄芩素低、中、高剂量(3、10、30 μmol/L)组。除对照组外,其余各组加入LPS(1 μg/mL)预处理3 h;各给药组分别加入相应药物孵育3 h后,除对照组外各组另加入5 mmol/L ATP继续刺激45 min。
2.2.2 CCK-8法测定细胞活力 THP-1细胞接种于96孔板中,加入100 nmol/L PMA诱导24 h,贴壁后分别加入0、1、10、30、50、100、200 μmol/L的黄芩素处理24 h,另设置不接种细胞不含药物的空白孔。各孔更换为新鲜培养液,加入10 µL CCK-8溶液继续培养1.5 h,采用酶标仪测定各孔在450 nm处的吸光度()值,计算细胞存活率。
细胞存活率=(实验-空白)/(对照-空白)
2.2.3 ELISA法检测上清液中IL-1β、IL-18和IL-1α水平 按“2.2.1”项下方法进行分组及处理,收集各组细胞上清液,按照试剂盒说明书测定IL-1β、IL-18和IL-1α水平。
2.2.4 Western blotting法检测THP-1细胞相关蛋白表达 按“2.2.1”项下方法进行分组及处理,收集细胞,加入RIPA裂解液提取蛋白,采用BCA蛋白定量试剂盒测定蛋白浓度,蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,于5%牛血清白蛋白中封闭,分别加入NLRP3、pro Caspase-1、cleaved Caspase-1、ASC、GSDMD、HMGB-1抗体,4 ℃孵育过夜;加入二抗,室温孵育2 h,加入超敏ECL化学发光试剂,于凝胶成像仪中曝光显影。
2.2.5 免疫荧光法观察NLRP3炎症小体组装情况 THP-1细胞以4×105/mL接种于玻底小皿中,加入100 nmol/L PMA诱导24 h,贴壁后随机分为对照组、模型组、VX-765(500 nmol/L)组和黄芩素高剂量(30 μmol/L)组。按“2.2.1”项下方法处理,用PBS清洗3次,用2.5%戊二醛固定细胞,分别加入含NLRP3兔抗、ASC鼠抗、pro Caspase-1兔抗、ASC鼠抗的5%牛血清白蛋白,4 ℃孵育过夜;加入Alexa Fluor 488标记的山羊抗兔IgG二抗或Alexa Fluor 555标记的驴抗小鼠IgG二抗,室温孵育2 h,再进行DAPI染色,最后在激光共聚焦显微镜下观察并拍照。
2.2.6 Annexin-V/7-AAD检测细胞焦亡 RAW264.7细胞以8×105/mL接种于6孔板中,贴壁12 h后随机分为对照组、模型组、VX-765(500 nmol/L)和黄芩素低、中、高剂量(3、10、30 μmol/L)组。各给药组分别加入相应药物预处理1 h后,除对照组外,其余各组加入LPS(500 ng/mL)处理12 h,再另加入5 mmol/L ATP继续刺激45 min。最后使用Annexin-V/7-AAD试剂盒染色,并采用流式细胞仪上机检测。
2.2.7 LDH释放量检测 THP-1细胞接种于96孔板中,加入100 nmol/L PMA诱导24 h,贴壁后按“2.2.1”项下方法进行分组及处理,收集细胞培养液,400×离心5 min,取上清液,根据LDH检测试剂盒说明书测定LDH释放量。
2.3 统计学分析
3 结果
3.1 黄芩素对ALI小鼠肺组织损伤的影响
如图1-A所示,与对照组比较,模型组小鼠肺组织肺湿干质量比显著升高(<0.01);与模型组比较,VX-765组和黄芩素中、高剂量组肺湿干质量比显著降低(<0.01)。如图1-B所示,对照组小鼠肺组织各级支气管结构无明显异常,肺泡壁结构清晰,未见明显的炎性改变;模型组小鼠肺组织肺泡壁增厚,肺泡腔狭窄或消失,伴少量炎性细胞及淋巴细胞浸润,偶见血管周围水肿及少量出血;与模型组比较,VX-765组和黄芩素高剂量组肺组织结构损伤减轻,包括肺水肿、肺泡壁增厚减轻,炎性细胞浸润减少。此外,与对照组比较,模型组肺组织损伤评分显著升高(<0.01,图1-C);与模型组比较,各给药组肺组织损伤评分均显著降低(<0.01)。采用TEM观察各组小鼠肺组织超微结构,如图1-D所示,与对照组比较,模型组肺组织的巨噬细胞中线粒体明显肿胀,粗面内质网扩张呈囊状,细胞膜出现破裂;与模型组比较,VX-765组和黄芩素高剂量组线粒体轻度肿胀,粗面内质网扩张程度降低,其中黄芩素高剂量组发生自噬现象。以上结果表明黄芩素能明显缓解LPS诱导的小鼠肺损伤,包括减轻肺水肿、减少炎性细胞浸润以及阻止肺组织中巨噬细胞发生炎性病变等。
3.2 黄芩素对ALI小鼠血清和灌洗液中炎症因子水平的影响
如图2所示,与对照组比较,模型组小鼠血清和肺泡灌洗液中IL-6、IL-1β、TNF-α、IL-18、IL-1α水平均显著升高(<0.01);与模型组比较,VX-765组及黄芩素低、中、高剂量组小鼠血清IL-1β、TNF-α、IL-18和肺泡灌洗液TNF-α、IL-18、IL-1α水平均显著降低(<0.01),VX-765组及黄芩素中、高剂量组小鼠血清IL-6、IL-1α和肺泡灌洗液IL-6、IL-1β水平均显著降低(<0.01),且黄芩素作用呈剂量相关性。
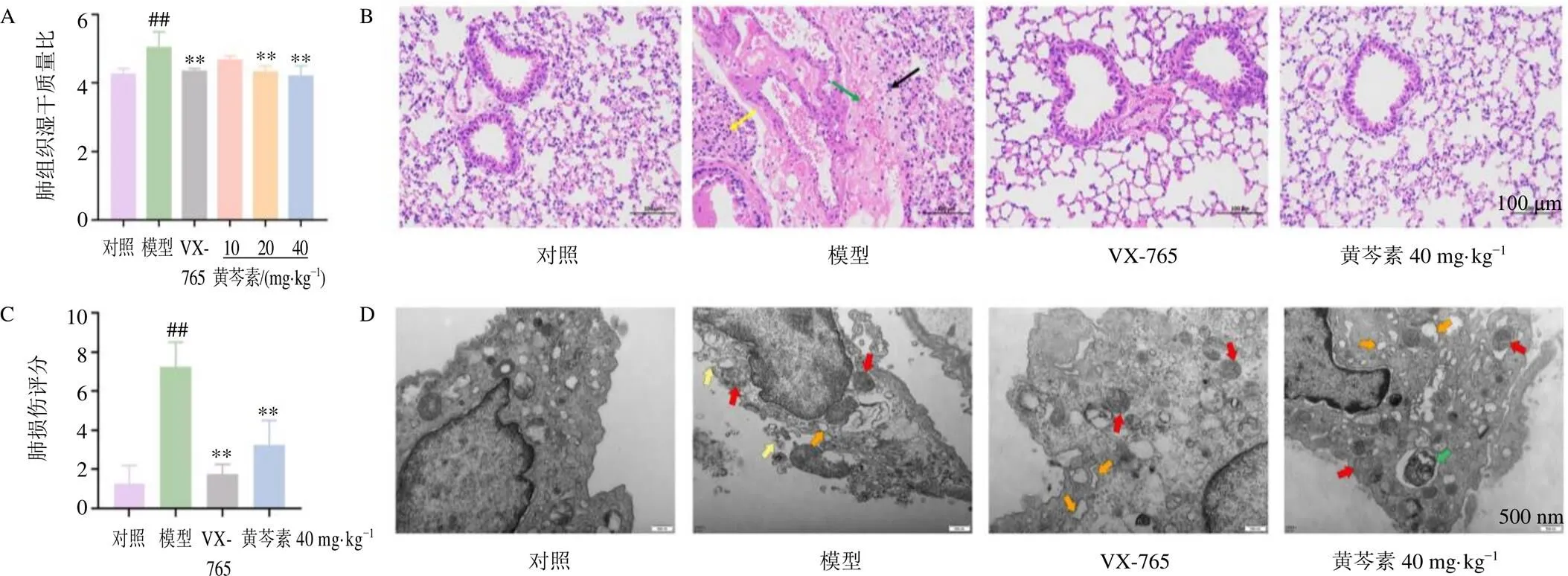
A-肺组织湿干质量比 B-肺组织病理变化(×200,黄箭头表示炎性细胞浸润聚集,绿箭头表示出血,黑箭头表示淋巴细胞浸润) C-肺损伤评分 D-肺组织超微结构(×25 000,黄箭头表示细胞膜破裂,红箭头表示线粒体肿胀,橙箭头表示粗面内质网扩张,绿箭头表示自噬) 与对照组比较:##P<0.01;与模型组比较:*P<0.05 **P<0.01,下图同
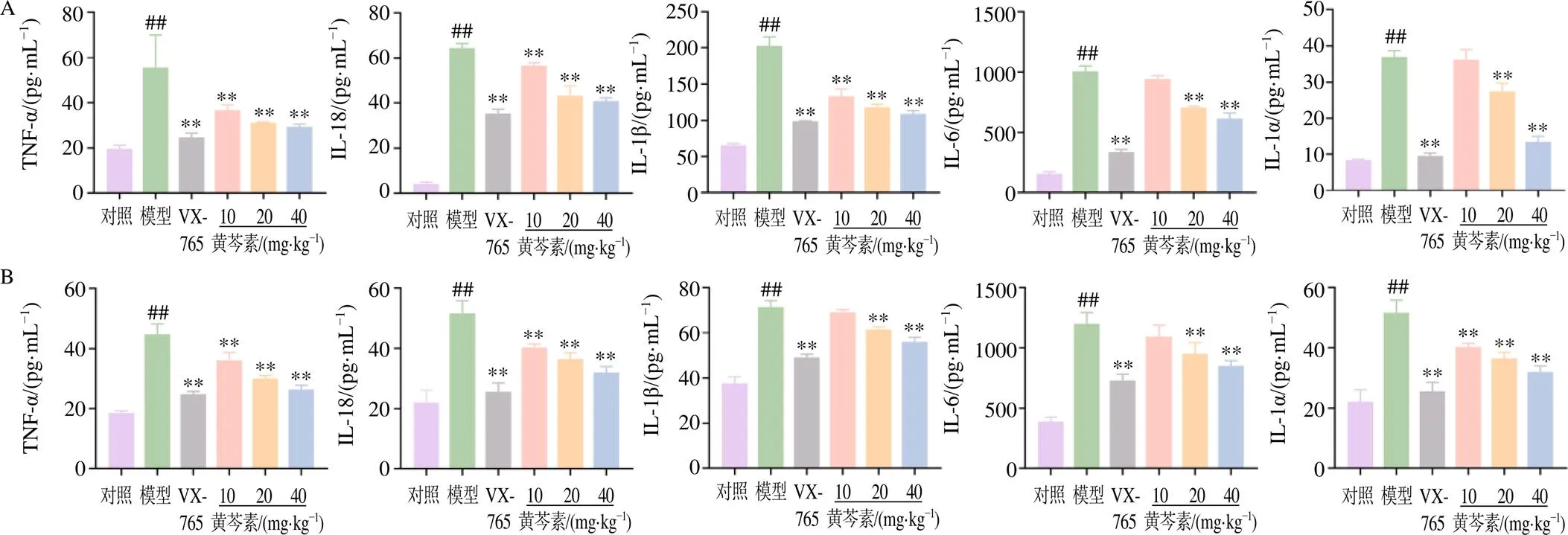
图2 黄芩素对ALI小鼠血清(A) 和肺泡灌洗液(B) 中IL-6、IL-1β、TNF-α、IL-18、IL-1α水平的影响(, n = 4)
3.3 黄芩素对ALI小鼠肺组织NLRP3通路相关蛋白表达的影响
如图3所示,与对照组比较,模型组小鼠肺组织NLRP3、ASC、cleaved Caspase-1、pro Caspase-1、GSDMD-N和GSDMD蛋白表达水平均显著升高(<0.01);与模型组比较,VX-765组及黄芩素中、高剂量组pro Caspase-1和GSDMD蛋白表达水平明显降低(<0.05、0.01),且呈剂量相关性;VX-765组及黄芩素高剂量组NLRP3、ASC、cleaved Caspase-1和GSDMD-N蛋白表达水平均显著降低(<0.05、0.01)。
3.4 黄芩素对LPS联合ATP诱导THP-1细胞NLRP3通路相关蛋白表达及炎症因子水平的影响
如图4-A所示,1、10 μmol/L的黄芩素促进细胞增殖,30、50、100、200 μmol/L的黄芩素抑制细胞活力,且呈剂量相关性。如图4-B、C所示,与对照组比较,LPS联合ATP刺激后THP-1细胞IL-18和IL-1β分泌量显著升高(<0.01);与模型组比较,VX-765组及黄芩素低、中、高剂量组IL-1β分泌量显著降低(<0.01),VX-765组及黄芩素中、高剂量组IL-18分泌量显著降低(<0.01)。如图4-D所示,与对照组比较,模型组NLRP3和cleaved Caspase-1蛋白表达水平显著升高(<0.01);与模型组比较,VX-765组及黄芩素中、高剂量组NLRP3蛋白表达水平显著降低(<0.05、0.01),VX-765组及黄芩素低、中、高剂量组cleaved Caspase-1蛋白表达水平显著降低(<0.05、0.01),各组间ASC蛋白表达水平无明显差异。

图3 黄芩素对ALI小鼠肺组织NLRP3/Caspase-1/GSDMD通路相关蛋白表达的影响(, n = 3)

图4 黄芩素对THP-1细胞存活率(A)、LPS联合ATP刺激后THP-1细胞中IL-18、IL-1β水平(B、C) 及NLRP3/Caspase-1/ GSDMD通路相关蛋白表达(D) 的影响(, n = 3)
3.5 黄芩素对LPS联合ATP诱导THP-1细胞NLRP3炎症小体组装的影响
如图5所示,与对照组比较,LPS联合ATP诱导的THP-1细胞中pro Caspase-1与ASC间、ASC与NLRP3间蛋白-蛋白相互绑定作用增强,且共定位系数差异具有统计学意义(<0.01);与模型组比较,VX-765组及黄芩素高剂量组显著减弱以上蛋白间相互作用(<0.05、0.01),表明黄芩素抑制了LPS联合ATP刺激后THP-1细胞中NLRP3炎症小体的组装。
3.6 黄芩素对LPS联合ATP诱导THP-1细胞焦亡的影响
如图6-A所示,与对照组比较,LPS联合ATP刺激的THP-1细胞中LDH释放量显著升高(<0.01);与模型组比较,VX-765组及黄芩素中、高剂量组LDH释放量显著降低(<0.01)。如图6-B所示,对照组细胞状态优良,极少量出现凋亡、坏死情况;而模型组在LPS联合ATP刺激下出现明显的焦亡现象(<0.01);与模型组比较,VX-765组及黄芩素低、中、高剂量组均不同程度地抑制了细胞焦亡(<0.01),且黄芩素的作用呈剂量相关性。如图6-C所示,LPS联合ATP刺激介导焦亡标志性蛋白GSDMD-N蛋白及下游炎症因子HMGB-1的过表达(<0.01);而VX-765组及黄芩素中、高剂量组明显降低GSDMD-N蛋白表达水平(<0.05、0.01),VX-765组及黄芩素高剂量组明显降低HMGB-1蛋白表达水平(<0.05、0.01)。如图6-D所示,模型组IL-1α分泌量显著升高(<0.01),而VX-765组及黄芩素中、高剂量组IL-1α分泌量明显降低(<0.01)。以上结果提示黄芩素逆转LPS联合ATP诱导的细胞焦亡。

图5 黄芩素对LPS联合ATP刺激后THP-1细胞NLRP3炎症小体组装的影响(, n = 3)

图6 黄芩素对LPS联合ATP刺激后THP-1细胞中LDH释放量(A)、RAW264.7细胞焦亡(B)、NLRP3/Caspase-1/GSDMD通路相关蛋白表达(C)及IL-1α水平(D)的影响(, n = 3)
4 讨论
ALI是临床上常见的危重症之一,主要发病机制为严重感染、创伤后的肺部或全身不可控的炎症,其发生率和病死率均较高[15]。研究表明,内毒素是导致ALI的重要因素,其主要成分LPS是建立ALI动物模型常用的诱导剂[16-17]。LPS可以激活肺组织中性粒细胞,诱导机体大量炎症因子生成,使炎症系统激活,触发ALI的发生发展[18]。针对ALI目前临床上主要有控制感染、机械通气、抗生素等几种治疗方法,但以上方法均存在疗效不确切和不良反应大等问题[19],因此开发具有治疗潜力的药物对于治疗ALI具有重大意义。
黄芩是唇形科植物黄芩Georgi的干燥根,性寒味苦,具有清热燥湿、泻火解毒等功效,尤其擅长清上焦心肺热。黄芩素是黄芩的主要活性成分之一,具有抗炎、抗氧化、抗肿瘤、抗凋亡[20]等药理作用。研究发现,黄芩素能改善脓毒症大鼠肺水肿与肺部炎性病变,具有潜在的ALI治疗价值[21]。但是目前有关黄芩素对ALI的作用机制尚不完全清楚。为此本研究首先采用LPS建立小鼠ALI模型,观察黄芩素对其作用。结果显示,模型组小鼠肺组织湿干质量比增加,肺组织染色后中性粒细胞大量聚集,肺泡坍塌变形,肺组织中巨噬细胞坏死,细胞膜破裂,细胞器肿胀,血清及灌洗液中细胞因子TNF-α、IL-6等水平升高,提示ALI小鼠模型构建成功。而黄芩素干预后,肺组织湿干质量比明显降低,肺组织结构趋于完整,炎性细胞和淋巴细胞浸润减少,进一步检测发现血清及灌洗液中炎症因子含量显著降低,表明黄芩素能够有效缓解肺肿胀,明显改善肺部炎性损伤,并抑制ALI小鼠体内大量促炎细胞因子的释放,进而发挥治疗ALI的作用。
细胞焦亡是一种同时具有坏死和凋亡表型特征,并介于二者之间的炎症性、可逆的调节性死亡[22],焦亡细胞表现为Annexin-V和7-AAD染色呈双阳性[23],因此通过流式细胞术准确快速地检测造模以及给药前后RAW264.7细胞焦亡的发生率。此外研究证实,NLRP3炎性小体是细胞焦亡启动的关键环节[24]。焦亡是一种由外源刺激信号活化胞内的炎症信号通路,并伴随着先天免疫受体蛋白NLRP3、适配蛋白ASC和炎性蛋白酶Caspase-1组装的炎症小体形成,同时激活Caspase-1,从而诱导的GSDMD依赖性的细胞程序性死亡。期间IL-1β、IL-18、IL-1α及HMGB-1等炎症介质相继释放,并最终参与炎症反应。近年来大量研究表明直接或间接抑制NLRP3/ Caspase-1/ASC炎症小体介导的巨噬细胞焦亡能显著改善ALI的肺部损伤[25]。本研究发现ALI小鼠肺组织NLRP3/Caspase-1/GSDMD通路蛋白表达以及血清和灌洗液中炎症因子IL-1β、IL-18、IL-1α释放均明显升高,而经黄芩素干预后能够明显逆转以上情况。为进一步明确黄芩素是否通过调控NLRP3/ Caspase-1/GSDMD细胞焦亡通路来改善LPS诱导的ALI,通过体外培养THP-1细胞,考察黄芩素对LPS联合ATP诱导THP-1细胞焦亡的影响及机制。结果显示,黄芩素能够抑制细胞焦亡,显著降低NLRP3/Caspase-1/GSDMD信号通路蛋白表达以及LDH、IL-1β、IL-18、IL-1α的释放,与动物实验结果一致。ALI小鼠肺组织中ASC蛋白表达水平增加,给药后表达水平出现不同程度的降低,而在THP-1细胞中刺激前后各组ASC蛋白均稳定表达,且并未受到黄芩素和VX-765干预的影响,这可能与LPS刺激后不影响ASC的转录和翻译,但改变ASC斑点数量有关[26]。此外,黄芩素还能干预NLRP3炎症小体的组装,并抑制下游细胞焦亡。以上结果提示黄芩素可以通过抑制NLRP3/Caspase-1/ GSDMD介导细胞焦亡发挥ALI肺组织损伤的保护作用(图7)。
中医学认为ALI属于“外感热病”,符合“温热病”的范畴[27],而黄芩具有泻实火、除湿热的功效,临床广泛用于治疗各种感染和炎症性疾病。本研究明确了黄芩中重要黄酮类化合物黄芩素通过抑制NLRP3/Caspase-1/GSDMD通路,降低ALI细胞焦亡,改善肺损伤。基于黄连-黄芩联合应用发挥抗炎作用的文献支撑,本课题组前期还研究了黄连中表小檗碱对ALI小鼠的作用及机制[28],证明了表小檗碱对LPS介导的ALI也具有明显的改善作用,与调控CD39-P2X7嘌呤能通路与下游NLRP3炎症小体有关。这为黄连-黄芩联合应用作为临床治疗脓毒症药物提供理论基础,为临床抗脓毒症新药的选择提供更多可能性。

图7 黄芩素通过调控NLRP3/Caspase-1/GSDMD通路介导的细胞焦亡减轻LPS诱导的ALI
以上研究结果为黄芩素治疗ALI提供了潜在研究机制,但仅对其中的NLRP3炎症小体信号通路进行了初步研究,对于其他炎性小体如NLRP1、白介素-1β转换酶激活因子(interleukin-1β-converting enzyme protease-activating factor,IPAF)、黑素瘤缺乏因子2(human absent in melanoma 2,AIM2)的相关性研究不足,对NLRP3炎症小体通路上游以及更深的影响机制尚未完全阐明,因此仍需更多进一步的实验研究来丰富和发展ALI的相关理论基础,以期最终改善疾病的预后。
利益冲突 所有作者均声明不存在利益冲突
[1] Xu H B, Qi Q, Yan X X. Myricetin ameliorates sepsis-associated acute lung injury in a murine sepsis model [J]., 2021, 394(1): 165-175.
[2] Jin C, Chen J, Gu J,. Gut-lymph-lung pathway mediates sepsis-induced acute lung injury [J]., 2020, 133(18): 2212-2218.
[3] Wang R H, Xie Y X, Qiu J W,. The effects of dexmedetomidine in a rat model of sepsis-induced lung injury are mediated through the adenosine monophosphate-activated protein kinase (AMPK)/silent information regulator 1 (SIRT1) pathway [J]., 2020, 26: e919213.
[4] 罗亚岚, 许才明, 李兆霞, 等. NLRP3炎性小体: 急性肺损伤的发病核心 [J]. 中国急救医学, 2019, 39(3): 285-289.
[5] Jing W D, Pilato J L, Kay C,.α-toxin activates the NLRP3 inflammasome by engaging GPI-anchored proteins [J]., 2022, 7(71): eabm1803.
[6] Kim M J, Bae S H, Ryu J C,. SESN2/sestrin2 suppresses sepsis by inducing mitophagy and inhibiting NLRP3 activation in macrophages [J]., 2016, 12(8): 1272-1291.
[7] Li Z Y, Jia Y F, Feng Y,. Methane alleviates sepsis-induced injury by inhibiting pyroptosis and apoptosis:andexperiments [J]., 2019, 11(4): 1226-1239.
[8] 陈子秋, 庞博. 《太平圣惠方》治疗脓毒症用药规律分析 [J]. 河南中医, 2021, 41(4): 542-547.
[9] 李翀, 翁书和, 梁莉萍, 等. 黄连解毒汤对脓毒症模型小鼠肺损伤的保护作用及其机制研究 [J]. 江苏中医药, 2018, 50(3): 79-82.
[10] 周胜男, 邓瑞雪, 赵爽, 等. HPLC法测定黄芩中8个黄酮类成分的含量 [J]. 化学研究与应用, 2022, 34(8): 1920-1926.
[11] 李金玲. 黄芩素对酒精诱导的小鼠急性肝损伤的保护作用 [D]. 长春: 吉林农业大学, 2022.
[12] 杜红丽, 张晨宇, 赵清. 黄芩素通过调节HIF-1α/VEGF信号通路抑制类风湿关节炎大鼠的炎症反应和病理性血管生成 [J]. 中国病理生理杂志, 2022, 38(12): 2213-2219.
[13] Xiong S Q, Hong Z G, Huang L S,. IL-1β suppression of VE-cadherin transcription underlies sepsis-induced inflammatory lung injury [J]., 2020, 130(7): 3684-3698.
[14] Englert J A, Bobba C, Baron R M. Integrating molecular pathogenesis and clinical translation in sepsis-induced acute respiratory distress syndrome [J]., 2019, 4(2): e124061.
[15] 马晓春, 王辰, 方强, 等. 急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南 (2006) [J]. 中国危重病急救医学, 2006(12): 706-710.
[16] Bayston K F, Cohen J. Bacterial endotoxin and current concepts in the diagnosis and treatment of endotoxaemia [J]., 1990, 31(2): 73-83.
[17] Menden H, Welak S, Cossette S,. Lipopolysaccharide (LPS)-mediated angiopoietin-2-dependent autocrine angiogenesis is regulated by NADPH oxidase 2 (Nox2) in human pulmonary microvascular endothelial cells [J]., 2015, 290(9): 5449-5461.
[18] Nova Z, Skovierova H, Calkovska A. Alveolar-capillary membrane-related pulmonary cells as a target in endotoxin-induced acute lung injury [J]., 2019, 20(4): 831.
[19] Bao H, Gao F Y, Xie G G,. Angiotensin-converting enzyme 2 inhibits apoptosis of pulmonary endothelial cells during acute lung injury through suppressing miR-4262 [J]., 2015, 37(2): 759-767.
[20] Gupta S, Buttar H S, Kaur G,. Baicalein: Promising therapeutic applications with special reference to published patents [J]., 2022, 11(1): 23-32.
[21] 杨丽, 陈卫, 华丽, 等. 黄芩素对脓毒症大鼠的治疗作用及机制 [J]. 广州中医药大学学报, 2022, 39(7): 1637-1643.
[22] Chen X, He W T, Hu L C,. Pyroptosis is driven by non-selective gasdermin-D pore and its morphology is different from MLKL channel-mediated necroptosis [J]., 2016, 26(9): 1007-1020.
[23] Teng J F, Mei Q B, Zhou X G,. Polyphyllin VI induces caspase-1-mediated pyroptosis via the induction of ROS/ NF-κB/NLRP3/GSDMD signal axis in non-small cell lung cancer [J]., 2020, 12(1): 193.
[24] Zeng Y J, Qin Q W, Li K Y,. PKR suppress NLRP3-pyroptosis pathway in lipopolysaccharide-induced acute lung injury model of mice [J]., 2019, 519(1): 8-14.
[25] Li J H, Ma J M, Li M Y,. GYY4137 alleviates sepsis-induced acute lung injury in mice by inhibiting the PDGFRβ/Akt/NF-κB/NLRP3 pathway [J]., 2021, 271: 119192.
[26] Zhao W M, Ma L, Cai C,. Caffeine inhibits NLRP3 inflammasome activation by suppressing MAPK/NF-κB and A2aR signaling in LPS-induced THP-1 macrophages [J]., 2019, 15(8): 1571-1581.
[27] 汪海慧, 熊旭东, 沈晓红. 脓毒症急性肺损伤的中医药治疗进展 [J]. 世界中西医结合杂志, 2016, 11(7): 1024-1027.
[28] 吴嘉思, 兰悦嘉, 王俊, 等. 表小檗碱调控CD39-NLRP3-GSDMD焦亡路径改善脓毒症肺损伤的机制研究 [J]. 中草药, 2023, 54(1): 112-121.
Baicalein alleviates acute lung injury in mice by regulating NLRP3/Caspase-1/ GSDMD pathway mediated pyroptosis
LAN Yue-jia1, MENG Xian-li1, WU Jia-si2
1. School of Pharmacy, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China 2. School of Acupuncture and Tuina, Chengdu University of Traditional Chinese Medicine, Chengdu 611137, China
To investigate the therapeutic effect of baicalein on acute lung injure (ALI) mice and its regulatory effect on NOD-like receptor family pyrin domain containing 3 (NLRP3)/cysteine-aspartate protease-1 (Caspase-1)/gasdermin D (GSDMD) pyroptosis pathway.A total of 60 male C57BL/6 mice were randomly divided into control group, model group, Caspase-1 inhibitor (VX-765, 30 mg/kg), baicalein low-, medium- and high-dose (10, 20, 40 mg/kg) groups, with 10 mice in each group. Except for the control group, mice in the other groups were ip lipopolysaccharide (LPS, 15 mg/kg) to establish a mouse model of ALI, baicalein or VX-765 was given 24 h before and 0.5 h after modeling. The lung wet/dry weight ratio of mice was measured 24 h after LPS administration to evaluate lung swelling; The hematoxylin-eosin (HE) staining was used to detect lung tissue pathological changes; The injury of macrophages in lung tissue was observed by transmission electron microscopy (TEM); ELISA method was applied to detect interleukin-1β (IL-1β), IL-6, IL-18, IL-1α and tumor necrosis factor-α (TNF-α) levels in alveolar lavage fluid and serum of mice; Protein expressions of NLRP3, apoptosis-associated speck-like protein containing CARD (ASC), cleaved Caspase-1, pro Caspase-1, GSDMD-N, and GSDMD in lung tissue were determined by Western blotting. THP-1 cells were induced with 100 nmol/L phorbol ester for 24 h. After adherence, cells were randomly divided into control group, model group, VX-765 (500 nmol/L) group and baicalein low-, medium- and high-dose (3, 10, 30 μmol/L) groups. Except for the control group, THP-1 cells were stimulated with 1 μg/mL LPS combined with 5 mmol/L adenosine triphosphate (ATP) to replicate inflammatory model, baicalein or VX-765 was given for intervention, CCK-8 method was applied to determine the cell ability; IL-1β, IL-18, and IL-1α levels in supernatant were detected by ELISA; The lactate dehydrogenase (LDH) kit was used to measure LDH activity; The assembly of NLRP3 inflammasome was evaluated by immunofluorescence; Annexin V-PE/7-aminoactinomycin (7-AAD) kit was used to evaluate the cell pyroptosis; The expressions of NLRP3/Caspase-1/GSDMD pathway protein were detected by Western blotting.In ALI mice model, compared with model group, lung swelling of mice in VX-765 group and baicalein group weas significantly attenuated (< 0.01), lung injure score was decreased (< 0.01), inflammatory changes of macrophages in lung tissue were alleviated, levels of IL-6, IL-1β, TNF-α, IL-18 and IL-1α in serum and bronchoalveolar lavage fluid were significantly decreased (< 0.05, 0.01), NLRP3, ASC, cleaved Caspase-1, pro Caspase-1, GSDMD-N, and GSDMD protein expressions in lung tissues were decreased (< 0.05, 0.01). In cell inflammatory model,compared with model group, IL-1β, IL-18 and IL-1α secretions of THP-1 cells in VX-765 group and baicalein group were significantly decreased (< 0.01), the expressions of NLRP3/Caspase-1/GSDMD pathway related proteins were obviously decreased (< 0.05, 0.01), NLRP3 inflammasome assembly was inhibited (< 0.05, 0.01), LDH release and pyroptosis rate were significantly decreased (< 0.01).Baicalein can improve LPS-induced ALI in mice by inhibiting NLRP3/Caspase-1/GSDMD pathway-mediated pyroptosis.
baicalein; acute lung injury; lipopolysaccharide; NLRP3/Caspase-1/GSDMD pathway; pyroptosis
R285.5
A
0253 - 2670(2023)20 - 6694 - 10
10.7501/j.issn.0253-2670.2023.20.013
2023-05-31
国家自然科学基金青年基金项目(82104491);四川省自然科学基金面上项目(2023NSFSC0674);中国博士后科学基金面上资助地区专项支持计划项目(2021M693789);成都中医药大学“杏林学者”学科人才科研提升计划项目(XKTD2022013)
兰悦嘉,硕士研究生,从事中药药理与毒理研究。E-mail: lanyuejia@stu.cdutcm.edu.cn
通信作者:孟宪丽,教授,博士生导师,从事中药及民族药药理与毒理研究。E-mail: xlm999@cdutcm.edu.cn
吴嘉思,讲师,博士后,硕士研究生导师,从事中药药理与毒理研究。E-mail: wujiasi@cdutcm.edu.cn
[责任编辑 李亚楠]
