产琥珀酸放线杆菌利用甘薯粉产丁二酸发酵条件优化
2023-10-19李时勇韦秋丽覃琼慧李枢妍陈福慧宋超东张红岩姜明国申乃坤
李时勇,韦秋丽,覃琼慧,李枢妍,陈福慧,宋超东,张红岩,秦 艳,梁 戈,姜明国,申乃坤,
(1.广西民族大学海洋与生物技术学院,广西多糖材料与改性重点实验室,广西南宁 530008;2.广西科学院,广西南宁 530007)
作为大宗商品化合物,丁二酸被广泛应用于医药、食品和纺织等领域[1-2]。在食品行业中,丁二酸可作为风味增强剂、强化剂和乳化剂等[3]。同时,丁二酸还是丁内酯、己二酸和生物可降解的聚丁烯丁二酸(Polymers butylene succinate,PBS)等重要化学品的合成前体。预计到2025 年,全球丁二酸市场可达18 亿美元,年复合增长率为27.4%[4]。目前,丁二酸主要以石油类产品为原料化学合成法生产,生产过程中需要高温、高压反应环境,且排出大量废液、废气。但随着石化资源的短缺,全球环境污染的加剧和人们关于绿色环保、可持续发展意识的增强,化学合成法生产受到限制。而微生物发酵法,具有利用廉价碳源和绿色环保等优点,成为近些年的研究热点[5]。
丁二酸的生产菌株主要有产琥珀酸放线杆菌(Actinobacillus succinogenes),产琥珀酸厌氧螺菌(Anaerobiospirillum succiniciproducens),大肠杆菌(Escherichia coli)和酿酒酵母(Saccharomyces cerevisiae)等[6-7]。其中,产琥珀酸放线杆菌(A.succinogenes)因其具有高产丁二酸,固定温室气体(CO2)和利用多种碳源等能力,成为最有前景的产丁二酸的菌株之一[8]。先前的研究中,常以葡萄糖为碳源利用A.succinogenes发酵生产丁二酸,这极大地增加了生产成本,不利于工业化的大规模生产[9-10]。为降低成本,研究人员探究了以廉价可再生资源(玉米秸秆、甘蔗渣等)替代葡萄糖为碳源来生产丁二酸的方法。Jiang 等[11]以甘蔗渣纤维素水解物为底物,利用A.succinogenesNJ113 发酵产丁二酸,丁二酸浓度可达20.0 g/L。在厌氧分批发酵中,棉花秸秆水解液被用于生产丁二酸,最终丁二酸产量为15.8 g/L,产率为1.23 g/g 葡萄糖[12]。在以玉米纤维为原料的研究中,考察了玉米纤维水解条件对总糖得率的影响,并利用CaCO3中和结合活性炭吸附的方法去除水解液中的糠醛,最终丁二酸产量可达35.4 g/L,丁二酸产率可达72.5%[13]。以上结果可知,纤维素原料虽然可以作为碳源生产丁二酸,但其存在预处理成本高,且丁二酸产量低的缺点,而利用玉米、小麦等粮食原料生产丁二酸会存在“与人争粮”问题,影响粮食安全。因此,亟需寻找一种含淀粉质的“非主粮”类进行丁二酸生产。
甘薯(又叫红薯,地瓜等)具有易种植,产量大,淀粉含量高(占鲜重15%-30%),价格低等优点,是一种理想的微生物发酵原料[14]。目前,已有许多以甘薯为底物进行生物发酵的报道,利用甘薯粉和甘薯渣来生产生物能源和有机酸等高附加值产品。Cheng 等[15]对乳酸乳球菌同步糖化发酵甘薯淀粉产乳酸和乳酸链球菌肽进行研究,对淀粉浓度、糖化酶用量等进行了优化,最终乳酸和乳酸链球菌肽产量分别可达37.06 g/L 和2516.41 IU/mL。在甘薯生产生物乙醇的研究中,酿酒酵母LPB1-93 发酵100 g 甘薯获得的乙醇含量可达25.74 g/L[16]。甘薯饮料残渣和花生壳可以作为底物,利用米曲霉和枯草芽孢杆菌发酵生产动物蛋白饲料,经优化最终蛋白质含量最高可达15.58%[17]。然而,目前关于A.succinogenes利用甘薯粉发酵产丁二酸的报道相对较少。本试验通过单因素实验和正交试验优化A.succinogenes发酵甘薯粉产丁二酸的最佳工艺参数,同时在2 L 的发酵罐中进行放大实验,以期为之后的大规模工业化生产奠定基础。
1 材料与方法
1.1 材料与仪器
产琥珀酸放线杆菌(A.succinogenes)GXAS137(CCTCCM 2011399)本实验室前期筛选获得[18];甘薯干粉(淀粉含量可达73%以上[19])市购;耐高温淀粉酶Liquozyme SC(标准酶活力为120 KNUS/g)、糖化酶Suhong GAⅡ(标准酶活为500 AGU/g)
诺维信(中国)有限公司;丁二酸标准品 分析纯,上海阿拉丁生化科技股份有限公司;乙酸标准品 分析纯,重庆川东化工(集团)有限公司;甲醇 色谱纯,美国TEDIA 公司;其他试剂均为分析纯或生化试剂;营养琼脂培养基(g/L):葡萄糖30,酵母粉10,玉米浆5,NaHCO32,NaCl 2,NaH2PO48.5,K2HPO415.5,琼脂15,pH 自然,121 ℃灭菌20 min。种子培养基(g/L):葡萄糖30,酵母粉10,玉米浆5,NaHCO32,NaCl 2,NaH2PO48.5,K2HPO415.5,pH 自然,121 ℃灭菌20 min。初始甘薯粉发酵培养基(g/L):甘薯粉80,酵母粉 5,玉米浆 10,NaHCO32,MgCl2·6H2O 1,CaCl20.3,MnCl20.06,ZnSO40.06,碱式MgCO370,pH 自然,121 ℃灭菌20 min。
LC100 高效液相色谱仪 上海伍丰科学仪器有限公司;Epoch 酶标仪 美国Bio Tek 公司;BSP-150 生化培养箱 上海博迅医疗生物仪器股份有限公司;DG250 小型厌氧工作站 英国Don Whitley Scientific 公司;BLBIO-XABC-D 2 L 发酵罐 上海百伦生物科技有限公司;AG25 2.5L 厌氧罐 英国OXOID 公司。
1.2 实验方法
1.2.1A.succinogenesGXAS137 种子液的制备 菌株的活化:将甘油保藏管中A.succinogenesGXAS137划线接种到营养琼脂培养基,平板放置于厌氧罐中,37 ℃静置培养2 d。
种子液的制备:将活化后的单菌落接种到种子培养基中,37 ℃静置培养16 h。
1.2.2 甘薯粉的糖化 甘薯粉先糖化后发酵(Separate hydrolysis and fermentation,SHF)[20]:将甘薯粉与蒸馏水混合,用1 mol/L HCl 调节pH 至5.5,添加高温淀粉酶,85~90 ℃水浴液化30 min;迅速冷却,将pH 调为4.2~4.5,再加入糖化酶,在60 ℃水浴锅中糖化2 h,最后添加其他营养成分及碳酸镁,其含量与初始甘薯粉发酵培养基一致,121 ℃高压灭菌20 min,接种发酵。
1.2.3 单因素实验
1.2.3.1 甘薯粉浓度的选择 固定接种量为5%(v/v),MgCO3添加量为70 g/L,液化酶用量为0.376 KNUS/g 底物,糖化酶用量为5.07 AGU/g 底物,混合氮源(酵母粉:玉米浆=1:2)为15 g/L,初始甘薯粉浓度为80、90、100、110 和120 g/L,在37 ℃培养48 h,收集1 mL 发酵液,以12000 r/min 离心10 min 取上清液,用于有机酸含量的测定。每组设置三个平行。
1.2.3.2 MgCO3添加量的选择 固定接种量为5%(v/v),底物浓度为100 g/L,液化酶用量为0.376 KNUS/g 底物,糖化酶用量为5.07 AGU/g 底物,混合氮源(酵母粉:玉米浆=1:2)为15 g/L,初始MgCO3添加量为30、40、50、60、70 和80 g/L,在37 ℃培养48 h,收集1 mL 发酵液,以12000 r/min 离心10 min 取上清液,用于有机酸含量的测定。每组设置三个平行。
1.2.3.3 液化酶用量的选择 固定接种量为5%(v/v),底物浓度为100 g/L,MgCO3添加量为60 g/L,糖化酶用量为5.07 AGU/g 底物,混合氮源(酵母粉:玉米浆=1:2)为15 g/L,初始液化酶用量为0.008、0.037、0.188、0.376 和0.564 KNU-S/g 底物,在37 ℃培养48 h,收集1 mL 发酵液,以12000 r/min 离心10 min取上清液,用于有机酸含量的测定。每组设置三个平行。
1.2.3.4 糖化酶用量的选择 固定接种量为5%(v/v),底物浓度为100 g/L,MgCO3添加量为60 g/L,液化酶用量为0.037 KNU-S/g 底物,混合氮源(酵母粉:玉米浆=1:2)为15 g/L,初始糖化酶用量为0、1.69、3.38、5.07 和6.75 AGU/g 底物,在37 ℃培养48 h,收集1 mL 发酵液,以12000 r/min 离心10 min 取上清液,用于有机酸含量的测定。每组设置三个平行。
1.2.3.5 氮源种类及浓度的选择 固定接种量为5%(v/v),底物浓度为100 g/L,MgCO3添加量为60 g/L,液化酶用量为0.037 KNU-S/g 底物,糖化酶用量为1.69 AGU/g 底物,设定总氮含量为1.4 g/L,分别选取混合氮源(酵母粉:玉米浆=1:2,15 g/L)、混合氮源(酵母粉:玉米浆=1:3,15.72 g/L)、酵母粉(10.92 g/L)、玉米浆(18.45 g/L)、牛肉膏(10.42 g/L)、蛋白胨(10.75 g/L)、尿素(2.92 g/L)作为氮源,并设置对照组(不添加任何氮源),在37 ℃培养48 h,收集1 mL发酵液,以12000 r/min 离心10 min 取上清液,用于有机酸含量的测定。每组设置三个平行。在最佳氮源的基础上,其他条件不变,以3、9、15、21、27 和33 g/L 的浓度进行优化,选出最适氮源浓度。
1.2.3.6 发酵时间的选择 固定接种量为5%(v/v),底物浓度为100 g/L,MgCO3添加量为60 g/L,液化酶用量为0.037 KNU-S/g 底物,糖化酶用量为1.69 AGU/g 底物,混合氮源(酵母粉:玉米浆=1:2)为27 g/L,发酵时间为36、48、60、72 和84 h,在37 ℃环境下进行培养。收集发酵液离心取上清液,测定有机酸含量。每组设置三个平行。
1.2.4 正交试验 在单因素实验的基础上,对丁二酸发酵有较大影响的5 个因素:甘薯粉(A)、混合氮源(酵母粉:玉米浆=1:2)(B)、液化酶(C)、糖化酶(D)和MgCO3(E)进行优化,选用L16(45)正交设计表进行试验。正交试验因素及水平见表1。

表1 正交试验因子与水平Table 1 Orthogonal test factors and levels
1.2.5 2 L 发酵罐放大试验 在2 L 发酵罐中进行厌氧发酵,装液量为1.5 L,所用培养基成分与正交试验优化后的培养基一致。发酵温度设为37 ℃,接种量为5%(v/v),搅拌转速150 r/min,以0.2 L/min 的通气量通入100% CO2,发酵72 h,并对样品进行测定。
1.2.6 分析测定方法
1.2.6.1 样品处理 取1 mL 发酵液12000 r/min 离心10 min,取上清,再使用0.22 μm 孔径无菌滤膜过滤。
1.2.6.2 有机酸测定 使用高效液相色谱法[21](High Performance Liquid Chromatography,HPLC)检测发酵液中有机酸含量(丁二酸、乙酸)。其中,乙酸是A.succinogenes丁二酸发酵时产生的主要副产物,对其含量的检测有利于了解该菌株利用甘薯粉水解液生产丁二酸的效率。色谱条件为:色谱柱(Ultimate®LP-C18 4.6×250 mm),流动相0.05 mol/L Na2HPO4·12H2O,等度洗脱,pH1.8(使用磷酸调pH),柱温22 ℃,进样量20 μL,流速1.0 mL/min,紫外检测波长210 nm。
1.2.6.3 还原糖含量测定 使用3,5-二硝基水杨酸法[22](3,5-Dinitrosalicylic acid,DNS)测定还原糖含量。
1.2.6.4 丁二酸产率的计算 根据公式(1)计算丁二酸产率,计算公式如下:
式中:C—最终的丁二酸浓度,g/L;C1—经甘薯粉糖化后产生的初始糖浓度,g/L。
1.2.6.5 丁二酸生产强度的计算 根据公式(2)计算丁二酸生产强度,计算公式如下:
式中:C—最终的丁二酸浓度,g/L;t—发酵过程的总时间,h。
1.2.6.6 糖利用率的计算 根据公式(3)计算糖利用率,计算公式如下:
式中:C1—经甘薯粉糖化后产生的初始糖浓度,g/L;C2—发酵后的剩余的糖浓度,g/L。
1.3 数据处理
本研究使用Microsoft 2021 Excel 进行数据整理,用IBM SPSS statistics 21.0 对试验数据进行方差分析和显著性分析,用GraphPad Prism 8 进行图形的绘制,每个实验均设三次平行。
2 结果与分析
2.1 丁二酸和乙酸的标准曲线
分别将不同浓度的丁二酸和乙酸标准品溶液进样,通过HPLC 进行分析。以浓度为横坐标,峰面积为纵坐标绘制标准曲线,结果如表2 所示。

表2 丁二酸、乙酸的线性范围、标准曲线及决定系数Table 2 Linear range,standard curve and determination coefficient of succinic acid and acetic acid
2.2 甘薯粉浓度对发酵产丁二酸的影响
甘薯粉作为唯一碳源,为菌体的生长和代谢过程提供重要的能量和物质。如图1 所示,随着甘薯粉浓度的增加,丁二酸产量呈先增后降的趋势,而副产物乙酸产量也呈增长趋势。当甘薯粉的浓度为100 g/L 时,丁二酸产量最高为42.46 g/L,乙酸产量为11.39 g/L,此时丁二酸/乙酸比值最大为3.73,而对应糖浓度为62.91 g/L。当甘薯粉浓度过低(低于100 g/L),随着甘薯粉浓度的增加,丁二酸和乙酸产量呈上升趋势;当甘薯粉浓度过高(超过100 g/L),随甘薯粉浓度的增加,丁二酸产量呈下降趋势,而乙酸产量也稍有降低。这可能是当甘薯粉浓度过高时,在酶水解作用下产生的糖增加,从而使发酵液中的渗透压和粘度升高,导致菌体细胞失水和萎缩,从而抑制了菌体生长并降低丁二酸的产量[23]。李亿等[24]研究也表明,当糖浓度超过60 g/L 后会对菌株生长和丁二酸形成产生抑制作用。因此,甘薯粉丁二酸发酵的适宜浓度为100 g/L。
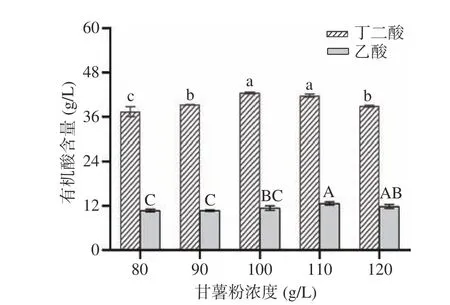
图1 甘薯粉浓度对丁二酸发酵的影响Fig.1 Effect of sweet potato powder concentration on succinic acid fermentation
2.3 MgCO3 添加量对甘薯粉发酵产丁二酸的影响
MgCO3既可以作为pH 中和剂,中和发酵过程中产生的有机酸,使得发酵液的pH 维持在接近7.0 的范围内,同时在与弱酸(丁二酸、乙酸等)反应过程中,产生的CO2可以作为丁二酸合成的底物[25]。产琥珀酸放线杆菌作为嗜CO2的兼性厌氧菌,在厌氧状态下(100%,CO2)有利于丁二酸的生成[26]。此前,Zou 等[27]探究了以MgCO3作为CO2供体对A.succinogenes产丁二酸的影响,结果表明添加过量MgCO3可以替代气体CO2作为发酵所需的唯一CO2供体,为发酵液提供充足的溶解性的CO2,用于丁二酸的合成。由图2 可知,丁二酸的产量随MgCO3添加量的增加呈先增加而后基本保持不变的趋势,而乙酸产量随MgCO3添加量的增加呈增长趋势。当MgCO3添加量由30 g/L 增加到60 g/L 时,丁二酸的产量由26.51 g/L 增加到43.57 g/L,丁二酸的产量增加了64.35%,而乙酸产量从10.17 g/L 增加到11.65 g/L。而当MgCO3添加量由60 g/L 增加到80 g/L 时,丁二酸浓度并没有显著增加(P>0.05),而乙酸产量依旧在增加,这可能是当MgCO3添加量超过60 g/L 后,发酵液中的溶解性CO2浓度达到饱和,即使再增加MgCO3的含量也不会显著提高丁二酸的产量[27]。因此,MgCO3的适宜添加量为60 g/L。

图2 MgCO3 添加量对丁二酸发酵的影响Fig.2 Effect of MgCO3 addition on succinic acid fermentation
2.4 液化酶对甘薯粉发酵产丁二酸的影响
淀粉质原料糖化过程中,需要添加适量的液化酶和糖化酶进行双酶水解。液化酶可以切割淀粉分子间的α-1,4-糖苷键,在液化酶的作用下大分子的淀粉物质被降解为小分子的α-糊精和糖类,同时降低溶液粘度[28]。从图3 可以看出,当液化酶添加量低于0.037 KNU-S/g 底物时,丁二酸和乙酸的产量随着液化酶量的增加而增加,而当液化酶添加量高于0.037 KNU-S/g 底物时,丁二酸和乙酸浓度随液化酶量的增加而降低并趋于不变。这是因为当液化酶添加量过低时,甘薯淀粉酶解不充分,水解液粘度高,不利于后续的糖化过程,导致丁二酸含量偏低。而当液化酶添加量过高时,过量的液化酶在水解淀粉的过程中,会产生超短链分子糖(如麦芽三糖,极限糊精等),这类糖与糖化酶结合困难,因而无法被糖化酶进一步水解为被菌株利用的葡萄糖,从而影响最终的丁二酸产量[29]。因此,液化酶的适宜用量为0.037 KNU-S/g底物。

图3 液化酶添加量对丁二酸发酵的影响Fig.3 Effect of liquefaction enzyme dose on succinic acid fermentation
2.5 糖化酶对甘薯粉发酵产丁二酸的影响
糖化是淀粉水解产生葡萄糖的主要步骤,在糖化酶的作用下将糊精等类低聚寡糖水解为葡萄糖,用于后续发酵产丁二酸的过程[30]。如图4 所示,当糖化酶量低于1.69 AGU/g 底物时,丁二酸和乙酸浓度随糖化酶添加量的增加而增加,而当糖化酶量高于1.69 AGU/g 底物时,丁二酸的产量没有显著性差异(P>0.05),而乙酸产量呈先降低后趋于不变的趋势。这说明当糖化酶量过低(低于1.69 AGU/g 底物)时,醪液糖化程度过低,产生的糖不足以供应菌体的生产及代谢,因此随着糖化酶用量的增加,丁二酸的产量也随之增大。而当糖化酶过多时(高于1.69 AGU/g 底物)时,醪液中的低聚糖被充分降解,因而添加更多的糖化酶只会增加发酵的成本,而不会使丁二酸的产量有显著增加[31]。因此,糖化酶的适宜用量为1.69 AGU/g底物。
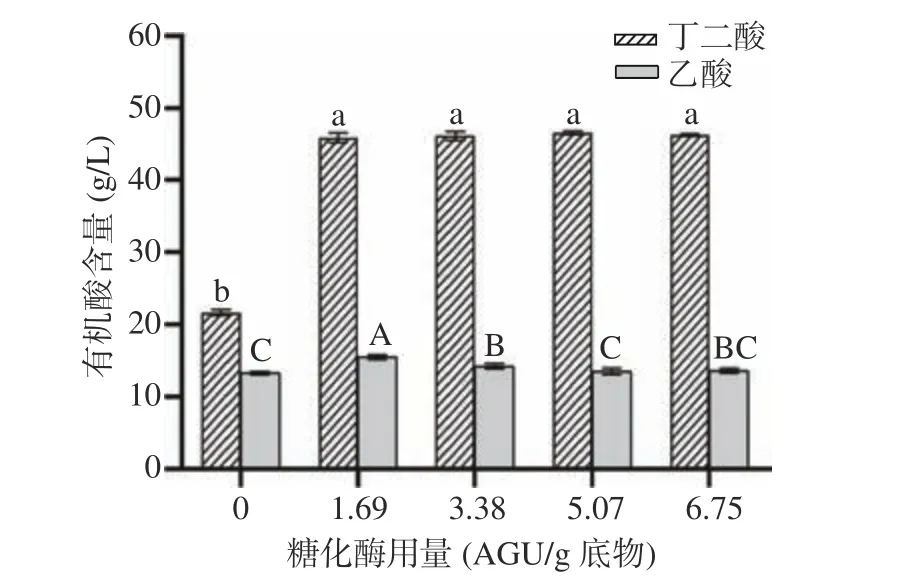
图4 糖化酶添加量对丁二酸发酵的影响Fig.4 Effect of saccharifying enzyme concentration dose on succinic acid fermentation
2.6 氮源对甘薯粉发酵产丁二酸的影响
氮源物质不仅为微生物提供氮元素,用于合成细胞中必需的含氮物质,如蛋白质、核酸等,同时还可为微生物补充生产所需的氨基酸、生物素和烟酸等生长因子[32]。先前的研究表明丁二酸发酵的最佳氮源是酵母粉,但其价格昂贵,不利于丁二酸的工业化大规模生产,因而寻找可替代酵母粉的廉价氮源是非常必要的。如图5 所示,混合氮源(酵母粉:玉米浆=1:2)丁二酸产量为45.81 g/L,且乙酸产量为14.28 g/L,与酵母粉相比(丁二酸为47.16 g/L,乙酸为16.47 g/L),丁二酸和乙酸产量没有显著性差异(P>0.05),混合氮源(酵母粉:玉米浆=1:3)的丁二酸产量为41.85 g/L,而单以玉米浆作为氮源时,丁二酸产量仅为27.95 g/L。以尿素为氮源时,丁二酸产量仅有6.81 g/L,略高于对照组(6.54 g/L)。由此可知,虽然玉米浆无法完全替代酵母粉作为氮源,但使用玉米浆与酵母粉作为混合氮源也可以极大的节约生产成本。在先前的文献中,Xi 等[33]探究了以玉米浆为氮源取代酵母粉进行发酵,在含有血红素的情况下,A.succinogenesNJ113利用 50 g/L 的葡萄糖进行发酵,最终丁二酸产量可达37.9 g/L,与酵母粉相比,丁二酸产量十分接近。因此,适宜的氮源为混合氮源(酵母粉:玉米浆=1:2)。
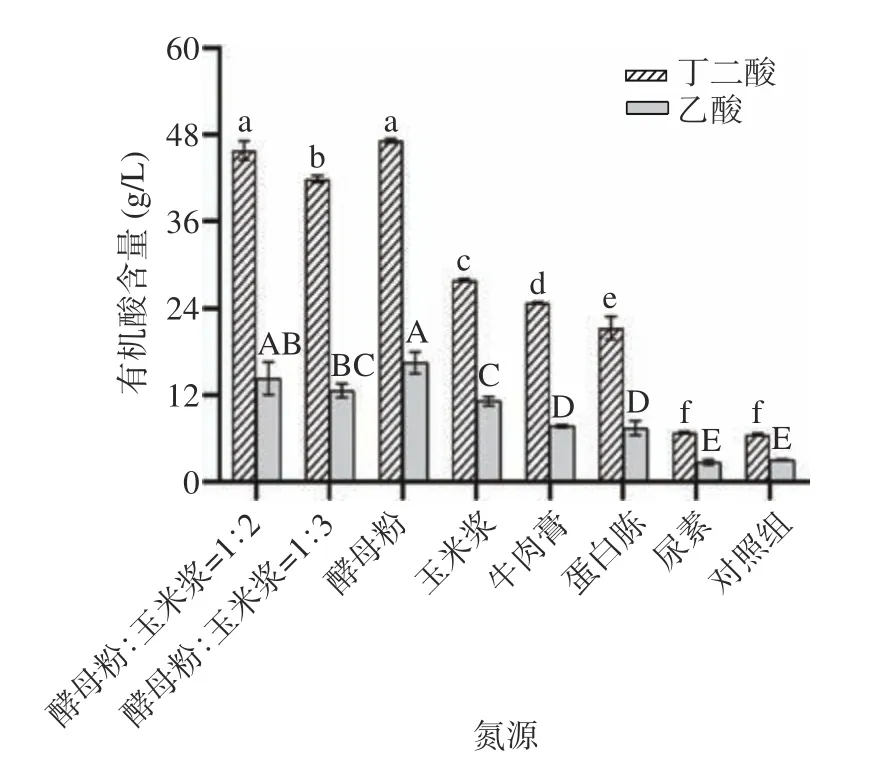
图5 不同氮源对丁二酸发酵的影响Fig.5 Effects of different nitrogen sources on succinic acid fermentation
在此基础上,考察不同质量浓度(3、9、15、21、27、33 g/L)的混合氮源(酵母粉:玉米浆=1:2)对产丁二酸的影响。由图6 可知,随着氮源浓度的增加,丁二酸产量呈先增加而后保持不变的趋势,而副产物乙酸含量呈增加趋势。当氮源浓度低于27 g/L 时,丁二酸和乙酸产量随氮源浓度的增加而增加,而当氮源浓度高于27 g/L 时,乙酸浓度依然随氮源浓度的增加而增加,但丁二酸产量没有显著性差异(P>0.05)。因此,100 g/L 甘薯粉经双酶解后产生的糖(82.14 g/L),至少需要添加27 g/L 的混合氮源(酵母粉:玉米浆=1:2)才能被完全利用,此时丁二酸浓度可达54.85 g/L。所以,混合氮源(酵母粉:玉米浆=1:2)的适宜添加量为27 g/L。
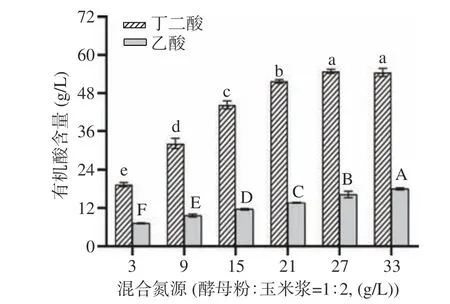
图6 氮源浓度对丁二酸发酵的影响Fig.6 Effect of nitrogen source concentration on succinic acid fermentation
2.7 发酵时间对甘薯粉发酵产丁二酸的影响
发酵时间对于丁二酸和乙酸的产量有显著(P<0.05)影响,发酵时间过短(36 h),则菌体对底物代谢不充分,所得目的产物(丁二酸)浓度偏低(45.39 g/L),但发酵时间过长(高于72 h),既增加生产成本,又降低生产效率。如图7 所示,当发酵时间低于72 h 时,丁二酸、乙酸含量和糖利用率随发酵时间的增加而增加,当发酵72 h 后,丁二酸和乙酸浓度分别为60.74 和19.08 g/L,丁二酸产率为73.23%,糖利用率可达92.82%(糖浓度为82.94 g/L),即使再增加发酵时间,丁二酸产量和糖利用率基本保持不变(P>0.05)。这可能是由于发酵72 h 后,培养基中的糖基本被消耗完。因此,适宜的发酵时间为72 h。

图7 发酵时间对丁二酸发酵的影响Fig.7 Effect of fermentation time on succinic acid fermentation
2.8 正交试验结果
在单因素实验结果的基础上设计L16(45)正交试验,选取对丁二酸发酵有较大影响的5 个因素:甘薯粉(A)、混合氮源(酵母粉:玉米浆=1:2)(B)、液化酶(C)、糖化酶(D)和MgCO3(E)进行优化,设计了16 组实验,每组设三个平行重复。正交试验结果见表3,方差分析结果见表4。
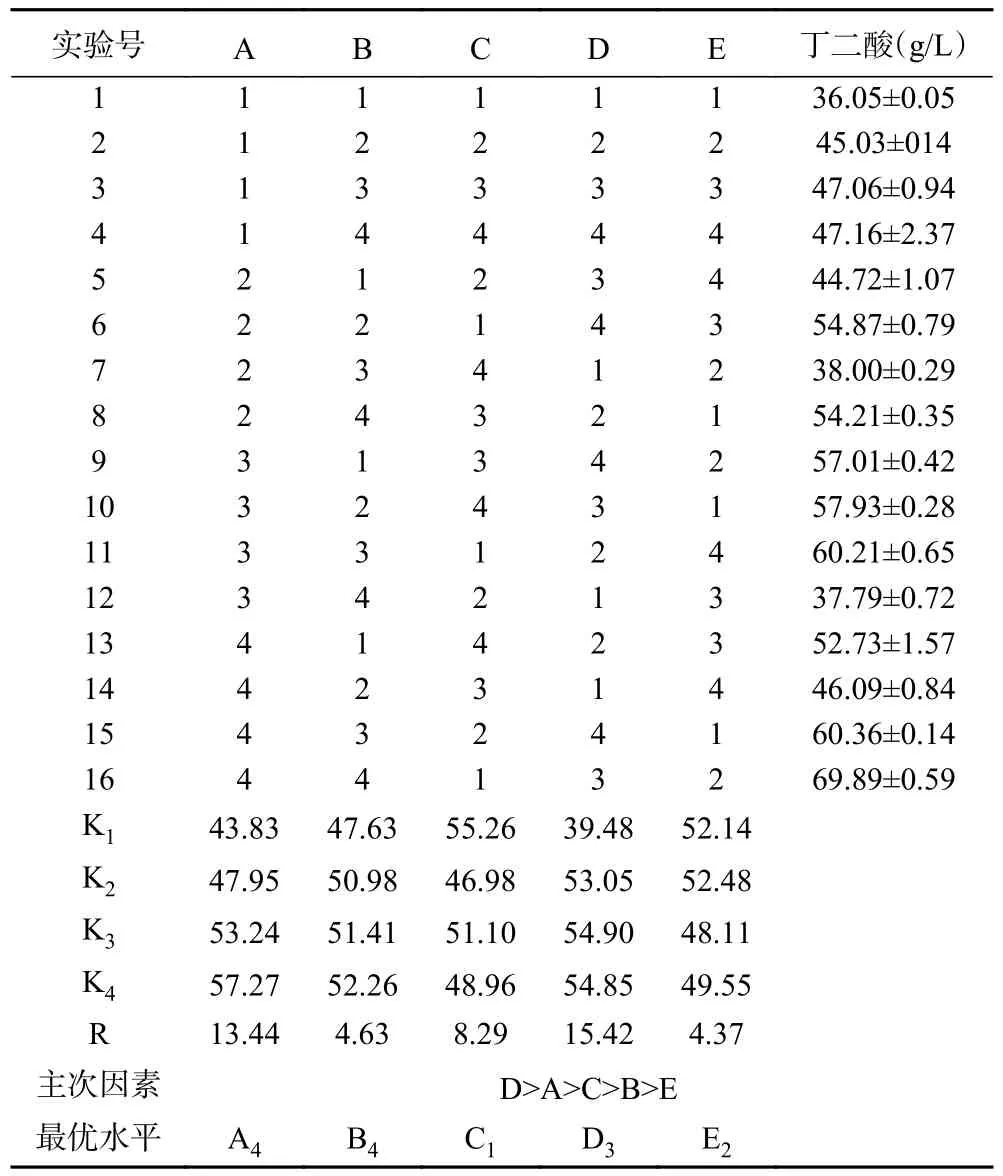
表3 L16(45)正交试验结果Table 3 Orthogonal experimental results of L16(45)

表4 A.succinogenes 菌株正交实验方差分析Table 4 Orthogonal experimental analysis of variance of A.succinogenes strain
极差分析与方差分析表明,A、B、C、D、E 五个因素都达到极显著水平,各因素主次顺序为D>A>C>B>E,即糖化酶添加量>甘薯粉浓度>液化酶添加量>混合氮源(酵母粉:玉米浆=1:2)浓度>碳酸镁添加量。根据表2 可知,最佳发酵条件为A4B4C1D3E2,即甘薯粉浓度为115 g/L,混合氮源(酵母粉:玉米浆=1:2)浓度为33 g/L,液化酶添加量为0.008 KUN-S/g底物,糖化酶添加量为3.09 AGU/g 底物,碳酸镁添加量为60 g/L。此组合在正交表中,且丁二酸含量最高为69.89 g/L,生产强度为0.97 g/(L·h),经优化后与初始条件相比(42.46 g/L),丁二酸浓度提高了64.6%。进一步对最优组合进行了揺瓶发酵验证实验,丁二酸产量达70.24±0.31 g/L,与正交表中结果无显著差异,优化结果可信。在先前报道的利用A.succinogenes发酵不同廉价碳源(角豆树豆荚、大型海藻和甘蔗糖蜜)产丁二酸的研究中,丁二酸浓度和生产强度的范围分别为18.97~55.2 g/L 和0.70~3.9 g/(L·h)[34-36]。与之相比,利用红薯粉为碳源发酵有较高的丁二酸产量。所以,甘薯粉可作为A.succinogenes的一种淀粉质的“非主粮”类发酵底物,具有良好的发展前景。
2.9 2 L 发酵罐放大试验
为更好地探究甘薯粉深层发酵的规律,在2 L 发酵罐中进行放大试验。由图8 可知,随着糖的不断消耗,丁二酸及副产物乙酸浓度在不断增加。当发酵时间超过64 h 后,丁二酸及乙酸含量基本保持不变,此时葡萄糖基本耗尽。丁二酸的浓度最高可达71.42 g/L,乙酸浓度为18.74 g/L,丁二酸产率可达79.87 %,生产强度0.99 g/(L·h)。相较于在厌氧瓶中培养结果,丁二酸的浓度和生产强度都有所提高,这可能是由于发酵过程中连续泵入的CO2直接渗透到细胞膜,并与磷酸烯醇式丙酮酸进行羧基化反应生成草酰乙酸,随后草酰乙酸通过还原性三羧酸循环转化为丁二酸[37]。同时,发酵罐的搅拌和混合能力促进了菌体对营养物质的吸收和代谢,从而提高丁二酸的产量。这为后续的中试试验及大规模工业化发酵提供了一定的数据支持。

图8 甘薯粉发酵产丁二酸2 L 发酵罐放大实验过程曲线Fig.8 Experimental process curve of 2 L fermenter for succinic acid production by fermentation of sweet potato powder
3 结论
本研究以甘薯粉为底物,对A.succinogenesGXAS 137 发酵产丁二酸的培养基进行了优化。在单因素实验的基础上,进行正交试验优化,获得最佳培养参数分别为:甘薯粉115 g/L,混合氮源(酵母粉:玉米浆=1:2)33 g/L,液化酶0.008 KUN-S/g 底物,糖化酶3.09 AGU/g 底物,碳酸镁60 g/L。在最优条件下,厌氧瓶中丁二酸浓度可达69.89 g/L,与初始条件相比(42.46 g/L),丁二酸浓度提高了64.6%。之后,在2 L 发酵罐中进行放大试验,丁二酸产量最终为71.42 g/L,丁二酸产率可达79.87 %,生产强度0.99 g/(L·h)。以甘薯粉作为底物,具有原料成本低、易获取、丁二酸产量高等优点;此外,混合氮源(酵母粉:玉米浆=1:2)的使用也可以大大的减少生产成本。
我国作为甘薯种植大国,至2014 年以后,每年甘薯产量维持在7000 万吨以上[38]。其中,甘薯消费结构主要在饲料、鲜食和加工方面,而工业应用不多,尤其是用于丁二酸的发酵生产。本研究证明甘薯粉可作为A.succinogenes发酵的优良底物,用于丁二酸的生产,具有工业生产的前景。但是,后续的发酵罐放大培养及中试实验都未进行,相关培养条件及参数还需进一步的研究。
