菲律宾蛤仔牛磺酸转运体蛋白基因鉴定、表达及低盐胁迫响应
2023-10-19张志超霍忠明聂鸿涛闫喜武丁鉴锋
张志超, 王 珺, 霍忠明, 聂鸿涛, 闫喜武, 丁鉴锋
(1.大连海洋大学水产与生命学院,辽宁大连 116023; 2.辽宁省贝类良种繁育工程技术研究中心,辽宁大连 116023)
牛磺酸别称2-氨基乙烷磺酸盐,是一种广泛分布在人类和动物体内的小分子含硫氨基酸,在哺乳动物的神经发育、生殖系统发育、糖类代谢、脂类代谢和免疫和调节内环境稳定等过程中发挥着重要作用[1]。牛磺酸也是贝类主要的游离氨基酸之一,在抗逆、生长、发育和免疫等过程发挥重要的作用。贝类,尤其是在潮间带和滩涂环境中生存的贝类,由于潮汐、降雨和河流汇集等因素,会导致其环境盐发生剧烈的变化,在应对盐度变化的过程中,细胞内高浓度的牛磺酸发挥重要作用[2-4]。在高盐度环境中,细胞外牛磺酸转运至细胞内[5-6];而在低渗环境下,牛磺酸则会扩散至细胞外,以维持细胞内外渗透压平衡[7]。此外,研究发现,贻贝(Mytilusgalloprovincialis)鳃组织的表面积和牛磺酸含量呈显著负相关[8]。对不同生长速度的贻贝稚贝的研究表明,生长速度快的稚贝具有更大的鳃表面积而使其具有更高的滤食效率[9]。Babarro等对相同养殖条件下珍珠贝(Pinctadafucata)的转录组分析发现,不同规格的珍珠贝牛磺酸合成限速酶半胱亚磺酸脱羧酶的表达量存在显著差异[10]。因此,贝类体内的牛磺酸可通过影响其摄食能力而对其生长过程产生影响。此外,动物体内的牛磺酸可通过其渗透压调节、抗氧化和类胰岛素样作用及促细胞增殖效应等途径促进体外培养胚胎的发育[11-13]。在贝类的发育过程中,牛磺酸也同样具有重要作用,红鲍(Haliotisrufescens)需要通过其卵细胞中的牛磺酸,维持其胚胎到幼虫发育到变态前体内恒定的牛磺酸含量,保证胚胎的正常发育,长牡蛎(Crassostreagigas)在浮游幼虫期体内牛磺酸含量迅速升高,能够使其适应环境渗透压的剧烈变化[14]。此外,在贻贝(Mytilusedulis)血淋巴中的牛磺酸可作为冷冻保护剂在低温环境中保持血淋巴正常的生理功能[15]。因此,对贝类牛磺酸代谢过程地深入了解将有助于阐明贝类生长、发育和抗逆的机制。牛磺酸转运体是分布在细胞膜上的一种转运蛋白,在牛磺酸代谢过程中发挥关键作用[5,16]。
菲律宾蛤仔是我国重要的经济养殖贝类,其主要广泛分布于潮间带,环境变化剧烈,极易受高温、低盐和病原微生物等影响,从而导致生长变缓、免疫力降低等问题,严重时暴发大规模死亡,造成巨大经济损失。牛磺酸对贝类的生长、发育和抗逆过程,均具有重要的功能[14,16]。目前,关于贝类牛磺酸代谢关键基因牛磺酸转运体的研究相对较少,仅在牡蛎和贻贝等几个物种中进行[17-19],而在菲律宾蛤仔中鲜见报道。本研究对菲律宾蛤仔RpTauT基因进行全基因组鉴定,对其保守基序、保守结构域、系统发育关系进行分析,并对RpTauT基因的组织表达及3种壳色蛤仔低盐胁迫过程中RpTauT基因的表达特征进行分析,旨在阐明蛤仔RpTauT基因在抗逆过程中的作用,并初步探明其在不同壳色蛤仔抗逆性差异形成中的作用。
1 材料与方法
1.1 试验材料
试验在大连海洋大学辽宁省贝类良种繁育工程技术研究中心实验室进行,2021年4月,选取壳长为(3.0±0.5) cm,外壳完整且活力较强的蛤仔个体共300枚,在50 L水体的平底塑料槽中暂养1周后进行试验,试验水温为(18.0±0.5) ℃,盐度为30。每天换水1次,早晚各投喂螺旋藻粉1次。
1.2 菲律宾蛤仔RpTauT基因鉴定、基因结构及进化分析
蛤仔RpTauT基因鉴定主要基于菲律宾蛤仔基因组数据(NCBI项目登录号为PRJNA479743)[20]。将基因组注释结果中与目的基因高度匹配的序列通过NCBI网站的在线保守区分析工具CDD(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)、序列比对工具BlastX等在线工具结合预测候选序列的保守结构域进行确认。推测蛋白的氨基酸比对使用 BioEdit 7.09软件的 Clustal W程序,使用Expasy的ProtScale工具(https://web.expasy.org/protscale/)预测氨基酸序列的疏水性,使用在线软件TMHMM(https://services.healthtech.dtu.dk/service.php?TMHMM-2.0)进行蛋白跨膜区域预测,使用MEME Suite在线工具预测蛋白保守基序(motif)(https://meme-suite.org/meme/tools/meme),motif数目参数设置为 10,长度设置为21~50 aa,使用Tbtools软件进行保守结构域和motifs的可视化[21]。进化分析使用Maga 6.0软件,基于邻接法构建系统进化树,使用iTOL(https://itol.embl.de/)在线工具进行进化树美化。
1.5 菲律宾蛤仔RpTauT基因组织表达分析
取3种壳色菲律宾蛤仔各2枚,冰盘上解剖,提取足、外套膜、鳃、水管、内脏团、性腺和唇瓣组织,液氮速冻后于-80 ℃冰箱保存,用于组织表达分析。
1.6 菲律宾蛤仔RpTauT基因低盐胁迫表达分析
选3种壳色蛤仔橙蛤、白蛤、斑马蛤各60枚,每组30枚,设2个平行。试验对照组盐度为30‰,低盐处理组盐度14‰,在低盐胁迫处理的0、8、16、24、48、72、96 h,每处理随机选4个个体,取其水管组织,液氮速冻后于-80 ℃保存,用于基因表达分析。
1.7 RNA提取和反转录
总RNA提取采用天根生化科技(北京)有限公司的试剂盒,使用1.5%琼脂糖电泳检测RNA完整性,采用核酸分析仪(Thermo Nanodrop 2000C)检测D260 nm/D280 nm值。使用宝生物工程(大连)有限公司反转录试剂盒进行反转录。
1.8 荧光定量PCR(RT-qPCR)检测
基因表达量检测采用RT-qPCR法,以菲律宾蛤仔Tublin基因作为内参基因,对蛤仔RpTauT基因表达量进行分析。引物设计采用Primer Primer 5.0软件,使用引物见表1。基因相对表达量计算采用2-ΔΔCT法[22]。

表1 荧光定量引物
1.9 数据处理

2 结果与分析
2.1 菲律宾蛤仔RpTauT基因结构及进化分析
将推测的蛤仔RpTauT蛋白的氨基酸序列与牡蛎Crassostreagigas(NP_001292278.1)、贻贝Mytilusgalloprovincialis(BAD91313.1)、蛤蜊Phreagenaokutanii(BBK07881.1)和虾夷扇贝Mizuhopectenyessoensis(XP_021352796.1)的序列Motifs和保守区进行比对分析,Motif分析结果见图1。由图1可知,共鉴定出10个保守Motif。除蛤仔RpTauT5、RpTauT6和虾夷扇贝的TauT外,均含有10个保守的motif,其中,蛤仔RpTauT5和虾夷扇贝的TauT蛋白缺失motif 4,RpTauT6缺失mitif 2、motif 4、motif 5、motif7和motif10。保守区结构域分析表明,蛤仔RpTauT1、RpTauT2、 RpTauT3和RpTauT4与牡蛎、贻贝和蛤蜊的TauT蛋白具有溶质载体-6(SLC6)家族的保守结构域,而RpTauT5和RpTauT6与虾夷扇贝的TauT蛋白具有溶质载体-5-6(SLC5-6)家族的保守结构域,均为Na依赖转运体蛋白[23]。
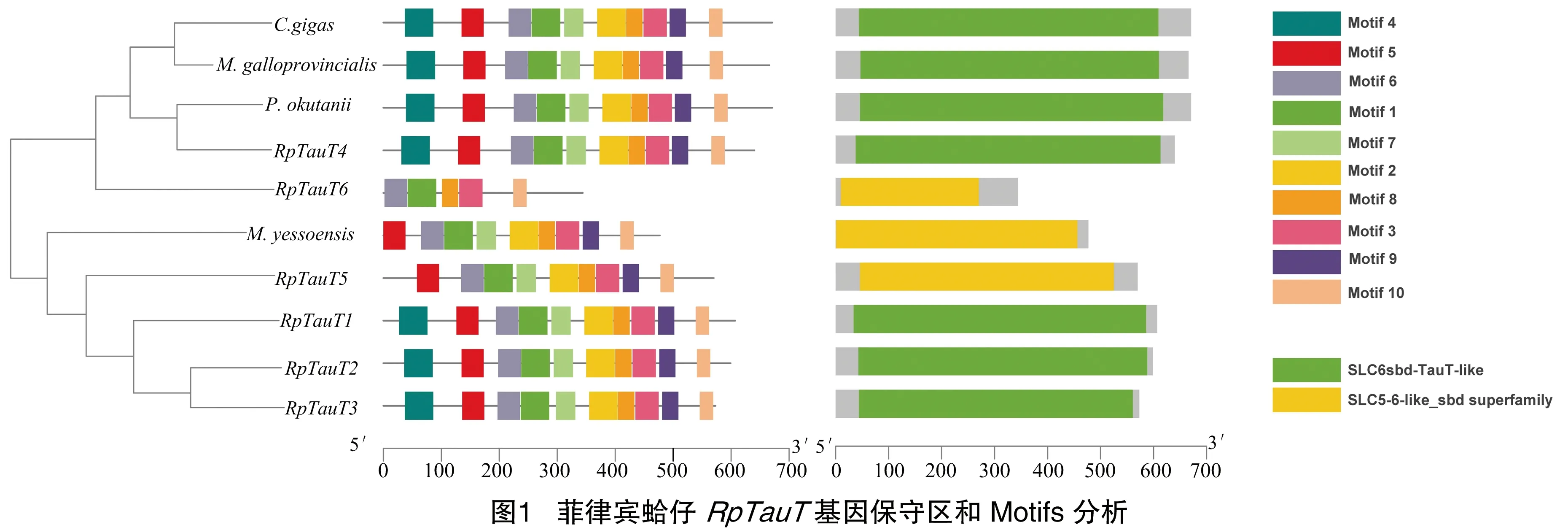
氨基酸比对结果见图2。由图2可知,蛤仔推测的RpTauT蛋白均具有典型的溶质载体蛋白6(SLC6)超家族的疏水结构域,由12个跨膜片段构成,Na+结合位点也高度保守。此外,用以形成二硫键稳定SLC6家族转运体蛋白胞外环的半胱氨酸残基在蛤仔RpTauT1、RpTauT2、RpTauT3和RpTauT4中也高度保守。

2.2 菲律宾蛤仔RpTauT基因系统进化分析
使用包括人类在内的脊椎动物和贝类等无脊椎动物共34个物种的55条TauT基因序列与菲律宾蛤仔RpTauT基因构建系统进化树,由图3可知,脊椎动物的TauT聚为一支,蛤仔的RpTauT与双壳贝类的遗传距离较近,其中,RpTauT1、RpTauT2、RpTauT3和RpTauT5与虾夷扇贝的TauT聚为一支,RpTauT4与蛤蜊聚为一支,RpTauT6与蚌蛎(Mercenariamercenaria)的TauT聚为一支。
2.3 菲律宾蛤仔RpTauT基因的组织表达分析
由图4可知,组织表达分析中,蛤仔RpTauT基因在检测的组织中均有表达。RpTauT1在各组织中的表达量依次为外套膜>足、水管>性腺、唇瓣>鳃、消化腺,其中,在外套膜组织中表达量最高(P<0.05),在鳃和消化腺中表达量最低(P<0.05);RpTauT2在各组织中的表达量依次为水管>鳃、消化腺>足、外套膜>性腺、唇瓣,表达量最高在水管组织(P<0.05),性腺和唇瓣组织表达量最低(P<0.05);RpTauT3在各组织中的表达量依次为外套膜>水管、足>性腺、唇瓣>鳃、消化腺,其中,在外套膜组织中表达量最高(P<0.05),在鳃和消化腺中表达量最低(P<0.05);RpTauT4在各组织中的表达量依次为外套膜>水管>足>性腺>唇瓣>鳃、消化腺,其中,在外套膜组织中表达量最高(P<0.05),在鳃和消化腺中表达量最低(P<0.05);RpTauT5在各组织中的表达量依次为外套膜、水管>足>性腺、唇瓣>鳃、消化腺,其中,在外套膜和水管组织中表达量最高(P<0.05),在鳃和消化腺中表达量最低(P<0.05);RpTauT6在各组织中的表达量依次为水管>性腺、消化腺、足、鳃>外套膜、唇瓣,其中,在水管组织中表达量最高(P<0.05),在外套膜和唇瓣中表达量最低(P<0.05)。
2.4 3种壳色菲律宾低盐胁迫后牛磺酸含量变化
低盐胁迫后蛤仔体内牛磺酸含量变化情况见图5。由图5可知,橙蛤24 h牛磺酸含量显著升高(P<0.05),48 h含量较0 h略有升高,但不显著(P>0.05);斑马蛤牛磺酸含量也表现为先升高后降低的过程;而白蛤牛磺酸含量表现为逐渐升高的过程。

2.5 3种壳色菲律宾蛤仔RpTauT基因在低盐胁迫下的表达
低盐胁迫条件下,由图6可知,3种壳色蛤仔的RpTauT基因表达量均表现出一个升高而后恢复继而再升高的过程。其中,橙蛤、白蛤、斑马蛤RpTauT1基因分别在24、72、16 h时达最高值(P<0.05),且在8、16、48、96 h,斑马蛤RpTauT1基因表达量显著高于其他2种壳色(P<0.05);橙蛤RpTauT2基因表达最高值出现在48 h(P<0.05),白蛤在8、24、 72 hRpTauT2表达量均达最高值(P<0.05),斑马蛤在16 h达最高值(P<0.05),在0、8、24、72、96 h白蛤RpTauT2基因表达量显著高于其他2个壳色(P<0.05),而在16、48 h,斑马蛤RpTauT2基因表达量显著高于其他2个壳色(P<0.05);橙蛤、白蛤、斑马蛤RpTauT3基因最高表达量分别在24、72、16 h(P<0.05),在8、72、96 h,白蛤RpTauT3基因表达量显著高于其他2个壳色(P<0.05);橙蛤、斑马蛤RpTauT4基因分别在24、16 h时达最高值(P<0.05),白蛤RpTauT4基因在24、72 h达最高值(P<0.05),斑马蛤RpTauT4基因在16 h达最高值, 并显著高于其他2种壳色(P<0.05),而橙蛤RpTauT4基因在24 h表达量显著高于其他2种壳色(P<0.05);橙蛤、白蛤、斑马蛤RpTauT5基因表达量分别在24、72、16 h达最高值(P<0.05),白蛤RpTauT5基因在8、72、96 h表达量显著高于其他2种壳色(P<0.05),斑马蛤RpTauT5基因表达量在16 h显著高于其他2种壳色(P<0.05);橙蛤、白蛤、斑马蛤RpTauT6基因表达量分别在 24、24、16 h达最高值(P<0.05),白蛤RpTauT6基因表达量在8、24、72 h显著高于其他2种壳色(P<0.05),斑马蛤RpTauT6基因表达量在16、48、96 h均显著高于其他两种壳色(P<0.05)。

3 讨论
3.1 蛤仔RpTauT基因结构特征和进化分析
牛磺酸(2-氨基乙磺酸)是哺乳动物体内主要的游离β-氨基酸之一,具有广泛的生理功能,包括渗透调节、抗氧化、神经细胞发育和维持细胞膜稳定性等[24-25]。牛磺酸的许多细胞保护特性基于其在细胞内的含量,而细胞内的牛磺酸主要来源于胞内合成或者胞外转运,合成主要由牛磺酸生物合成酶半胱氨酸双加氧酶和半胱氨酸亚砜脱羧酶完成,而转运过程主要由牛磺酸转运体来完成[26]。牛磺酸转运体是分布在细胞膜上的一类通道蛋白,通常有12个疏水性跨膜结构域,N-和C-端位于胞内侧,转运过程需要Na+和Cl-结合至其胞外环状结构启动,是一种钠离子依赖性蛋白[5]。本研究通过全基因组分析在蛤仔基因组中鉴定出6个RpTauT基因,通过对贻贝、太平洋牡蛎、蛤蜊等物种TauT的结构域、保守基序及氨基酸结构等比较发现,蛤仔RpTauT与不同物种尤其是双壳贝类中的TauT蛋白具有类似的高度保守结构域,因而推测RpTauT与其他双壳贝类同源基因具有相似的功能,进化分析也证实蛤仔的RpTauT与双壳贝类具有更近的遗传距离。
3.2 菲律宾蛤仔RpTauT基因的组织表达
研究发现,太平洋牡蛎的TauT在鳃、性腺、血淋巴中表达量较高,而在外套膜、肝胰腺和消化道中表达量较低[18]。Hosoi等采用免疫组化方法在紫贻贝的鳃、外套膜和闭壳肌中均检测出TauT蛋白[16]。在文蛤(M.lusoria)的鳃、外套膜、肌肉、心脏、胃和肠道组织中均检测到TauT基因表达,其在鳃和外套膜中的表达水平高于其他组织[27]。本研究中,蛤仔的RpTauT基因主要在外套膜和水管组织具有高表达,这2个组织是蛤仔与外界环境的主要接触界面,其渗透压波动较大,表明蛤仔RpTauT基因在渗透压调节过程中发挥重要功能,该结果与在牡蛎和文蛤中的研究结果一致。但在鳃组织中,仅RpTauT2和RpTauT6表现出较高的表达量,可能与蛤仔不同RpTauT基因的组织表达特异性有关。研究认为贝类的生殖细胞内含有大量的牛磺酸用于配子在进入海水过程中渗透压的调节[18],在哺乳动物生殖组织内的大量牛磺酸具有多种生理作用[28-29]。在本研究中,蛤仔性腺组织中RpTauT表达量并未达到很高水平,可能与研究未在蛤仔繁殖期进行有关。
3.3 3种壳色蛤仔低盐胁迫后牛磺酸含量比较
牛磺酸是双壳贝类应对盐度变化过程维持细胞内渗透压稳定的最重要的游离氨基酸之一[30]。研究表明,蚶蜊(Glycymerisglycymeris)、贻贝肌肉组织中的牛磺酸含量在适应低盐度环境后会降低[31]。将文蛤转移至稀释1倍的海水中,其鳃组织中的牛磺酸含量在转移3 h显著增加,其外套膜中的牛磺酸含量在24 h后才显著增加[19]。但将文蛤转移至盐度为10的海水中1个月后,其鳃组织中牛磺酸含量显著增加,而外套膜中的牛磺酸含量未发生显著变化[27]。Hosoi等发现,从海水转移至50%稀释海水后8 h时,太平洋牡蛎外套膜中的牛磺酸含量显著降低[32]。在本研究中,检测蛤仔软体部的牛磺酸总含量除在橙蛤 24 h 显著升高外,其余时间点3种壳色蛤仔软体部牛磺酸含量在胁迫过程中均未发生显著变化,表明在应对盐度胁迫过程中,牛磺酸的变化主要发生在组织细胞内外,而对个体牛磺酸含量影响相对较小。
3.4 菲律宾蛤仔RpTauT低盐胁迫表达
牛磺酸转运体蛋白通过对细胞内外牛磺酸的重新分配来协助贝类应对环境渗透压的变化[33]。在低盐胁迫过程中,双壳贝类的牛磺酸成分会流失到细胞外液中[30]。紫贻贝的免疫组化结果显示,其外套膜中TauT低渗胁迫24 h后表达上调[34]。将贻贝转移至低盐环境24、48 h后,其鳃组织中的TAUT mRNA表达量也表现出一定增加[17]。Hosoi等研究发现,低盐胁迫48 h的紫贻贝和低盐胁迫 24 h 的牡蛎的外套膜组织中TauT表达量显著增加[16,18]。Silva等将贻贝离体鳃组织急性暴露于60%人工海水中,虽然牛磺酸吸收的抑制作用>85%,但牛磺酸的表观积累仅减少了约10%[35]。Wright等观察到暴露于外部环境的紫贻贝和加州贻贝鳃组织中的TAUT 活性增加有助于恢复从鳃表面流失的牛磺酸[36]。因此,低盐度环境中,双壳贝类中的外套膜中TAUT诱导表达可能是由于渗透压下降导致组织中牛磺酸含量减少的结果。在本研究中,蛤仔在低盐胁迫过程中水管中的 TAUT mRNA表达也显著上调,可能是由于水管组织中的牛磺酸在低盐环境中大量流失诱导的补偿机制。但牡蛎在低盐环境中处理7 d,其鳃组织中的牛磺酸含量和TauT的表达量均显著降低[37]。TauT在不同物种中对低盐胁迫的不同反应可能是物种差异及处理过程的不同所致。此外,研究发现牛磺酸具有抗氧化活性,能够通过减少电子传输链产生的超氧化物及提高抗氧化酶的活性等途径发挥其抗氧化功能[38]。贝类在应对盐度突变的初期,通常采用关闭贝壳与低盐环境隔离的方式进行应对,结果会导致其短期内摄取氧气含量不足,低氧可导致体内电子的蓄积,为活性氧的形成提供便利,结果导致体内产生较高水平的活性氧[39]。相关研究已初步证实这一过程,在盐度由19.6‰降低至8.8‰时,毛蚶血淋巴细胞中活性氧的含量增加了3.5倍[40];低盐胁迫也能够导致鲍鱼活性氧产量增加[41-42];低氧胁迫后菲律宾蛤仔体内抗氧化酶基因表现出先升高而后恢复的过程,表明蛤仔在低氧胁迫条件下能够导致体内活性氧的增加[43]。因此,本研究中蛤仔RpTauT在低盐胁迫后短时间内表现出升高过程可能是由于缺氧导致的活性氧数量增加而大量消耗的牛磺酸所产生的补偿效应。牛磺酸含量也是影响牛磺酸转运体蛋白表达量的重要原因之一,当牛磺酸含量降低时可通过提高转运体蛋白的表达来增加细胞对牛磺酸的转运能力进行补偿,反之当牛磺酸浓度升高时可抑制转运体蛋白的表达[44]。将文蛤从盐度20‰的海水转移至盐度为10‰的低盐海水中,在本研究的低盐胁迫过程中,3种壳色蛤仔牛磺酸含量的变化是导致蛤仔RpTauT表达量变化的原因之一。前期研究发现,不同壳色菲律宾蛤仔在低盐胁迫条件下表现出不同的抗逆性[45-46],而3种壳色蛤仔RpTauT基因表达量变化在低盐胁迫过程中表现出的差异性可能是不同壳色菲律宾蛤仔抗逆性差异的原因之一。
4 结论
(1)鉴定出6条菲律宾蛤仔RpTauT基因,推测其蛋白具有保守的12个跨膜结构域和钠离子结合位点,进化分析表明蛤仔RpTauT与其他双壳贝类的遗传距离较近。(2)组织表达分析表明,蛤仔的RpTauT基因主要在外套膜和水管这2个与外界环境之间有较大接触界面,且渗透压波动较大的组织中高表达。(3)低盐胁迫条件下,蛤仔水管组织中的RpTauT表现出升高过程,原因可能主要是对低盐胁迫导致的水管组织细胞内牛磺酸的流失和抗氧化过程中消耗牛磺酸的一种补偿机制。
