晚期非小细胞肺癌患者淋巴细胞亚群及细胞因子与免疫治疗疗效的关系探讨
2023-10-19刘俊,王旭,吕坤
刘 俊,王 旭,吕 坤
(1.深圳市沃英达生命科学有限公司,广东 深圳 511816 ;2.深圳博兴生物科技有限公司,广东 深圳 511816;3.深圳市龙岗中心医院心胸外科,广东 深圳 511816)
肺癌是指肺部腺体、支气管黏膜上发生的恶性肿瘤。在所有恶性肿瘤中,肺癌的发病率高居首位,其中又以非小细胞肺癌(Non-small cell lung cancer,NSCLC)为主,占比高达80%[1]。早期NSCLC 患者多无明显症状,晚期NSCLC 患者可表现为胸痛、喘鸣、咳嗽、咯血等。临床针对NSCLC 常采用手术治疗、放化疗等。近年来随着医学的不断发展进步,免疫疗法在恶性肿瘤治疗中的应用越来越广泛,给晚期NSCLC 患者带来了更多的希望[2]。在实际治疗中,明确晚期NSCLC 的疗效预测标志物与免疫治疗疗效之间的关系十分重要,有利于优化免疫治疗方案,提升疗效。在免疫微环境中,细胞因子与淋巴细胞亚群属于重要成员。为了明确NSCLC 患者淋巴细胞亚群及细胞因子与免疫治疗疗效的关系,本研究特选取90例接受免疫治疗的晚期NSCLC 患者,采取分组对照的形式进行研究,现将研究方法及结果报道如下。
1 资料与方法
1.1 基线资料
研究开始于2021 年1 月,于2022 年12 月结束,研究对象为这一期间我院收治的90 例接受免疫治疗的晚期NSCLC 患者。纳入标准:(1)经病理检查确诊为NSCLC[3];(2)预计生存期超过3 个月;(3)肿瘤TNM 分期为Ⅳ期;(4)有可测量的病灶;(5)完成4 个周期以上的免疫治疗;(6)病历资料较为齐全;(7)对本次研究的各项基本内容知情,且签字同意参与。排除标准:(1)有免疫治疗禁忌证者;(2)近期有免疫增强类药物或抑制类药物使用史者;(3)合并其他恶性肿瘤者;(4)免疫缺陷严重者;(5)合并严重自身免疫性疾病者;(6)合并严重血液疾病者。每次完成2 个周期的治疗后,采用增强CT 检查患者的胸部、颈部、全腹部及盆腔[4],并采用MRI 检查其头颅,评估治疗效果,分为完全缓解、部分缓解、病情稳定、疾病进展,按照疗效进行组别,无效组为疾病进展者,共20 例,控制组为完全缓解者、部分缓解者及病情稳定者,共70 例。无效组:男性13 例,女性7 例;年龄在42 ~75 岁之间,平均年龄为(60.27±10.37)岁;其中14 例有吸烟史,6 例无吸烟史;病理类型:15 例为腺癌,5 例为鳞状细胞癌(鳞癌);免疫治疗:6 例为一线治疗,14 例为非一线治疗;联合化疗:19例联合化疗,1 例未联合化疗。控制组:男性60 例,女性10 例;年龄在43 ~77 岁之间,平均年龄为(60.48±10.29)岁;其中45 例有吸烟史,25 例无吸烟史;病理类型:48 例为腺癌,22 例为鳞癌;免疫治疗:43 例为一线治疗,27 例为非一线治疗;联合化疗:69 例联合化疗,1 例未联合化疗。两组基线资料相比,差异无统计学意义(P>0.05),可比性良好。本次研究向伦理委员会报备相关资料,并经过审核与批准。
1.2 方法
1.2.1 治疗方法 所有患者均接受免疫治疗,选用卡瑞利珠单抗(生产厂家:苏州盛迪亚生物医药有限公司;批准文号:国药准字S20190027;规格:200 mg 注射剂)、信迪利单抗﹝生产厂家:信达生物制药(苏州)有限公司;批准文号:国药准字S20180016;规格:10 mL:100 mg 注射剂﹞、帕博利珠单抗﹝生产厂家:爱尔兰MSD Ireland (Carlow);批准文号:进口药品注册证号S20180019;规格:4 mL:100 mg 注射剂﹞作为免疫治疗药物。将200 mg 卡瑞利珠单抗与100 mL浓度为0.9% 的氯化钠注射液混匀,每21 d 静脉注射1 次;将200 mg 信迪利单抗与100 mL 浓度为0.9%的氯化钠注射液混匀,每21 d 静脉注射1 次;将2 mg/kg帕博利珠单抗与100 mL 浓度为0.9% 的氯化钠注射液
混匀,每21 d 静脉注射1 次。持续用药至患者无法耐受或疾病进展。
1.2.2 检测方法 检测所有患者的细胞因子水平与淋巴细胞亚群水平,检测时间为每个治疗周期开始前的1 ~2 d 与完成1 个周期治疗后的20 d,细胞因子包含白细胞介素-2(IL-2)、白细胞介素-4(IL-4)、白细胞介素-6(IL-6)[5];淋巴细胞亚群包括CD19+B细胞、CD3+T 细胞、CD3+CD4+T 细胞、CD3+CD8+T 细胞、CD3-CD16+/56+细胞、CD4+/CD8+T 细胞、淋巴细胞计数、总T 淋巴细胞计数、CD4+T 细胞计数、CD8+T 细胞计数、B 淋巴细胞计数、自然杀伤细胞(NK)计数[6]。检测方法为流式细胞术,采用安捷伦生物杭州有限公司生产的安捷伦试剂盒检测细胞因子水平,采用艾森生物有限公司提供的流式细胞技术配件检测淋巴细胞亚群水平。
1.3 观察指标
对比两组治疗前后的淋巴细胞亚群水平、细胞因子水平及与免疫治疗疗效(NSCLC 进展)的相关性。
1.4 统计学方法
统计学软件为SPSS 22.0,计数资料以% 表示,用χ² 检验。对计量资料进行正态性检验,符合正态分布者以±s表示,用t检验;非正态分布者以中位数(四分位数间距)表示,用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 对比两组治疗前后的淋巴细胞亚群水平
控制组治疗前的B 淋巴细胞计数高于无效组(P<0.05),两组治疗前的其他淋巴细胞亚群水平无明显差异(P>0.05)。控制组治疗前后的B 淋巴细胞计数、CD19+B 细胞水平、CD3+T 细胞水平比较,差异有统计学意义(P<0.05);控制组治疗前后的其他淋巴细胞亚群水平无明显差异(P>0.05)。无效组治疗前后的淋巴细胞亚群水平无明显差异(P>0.05)。控制组治疗后的CD3+CD4+T 细胞水平、总T 淋巴细胞计数、CD4+T 细胞计数、淋巴细胞计数均高于无效组,差异有统计学意义(P<0.05)。详见表1。
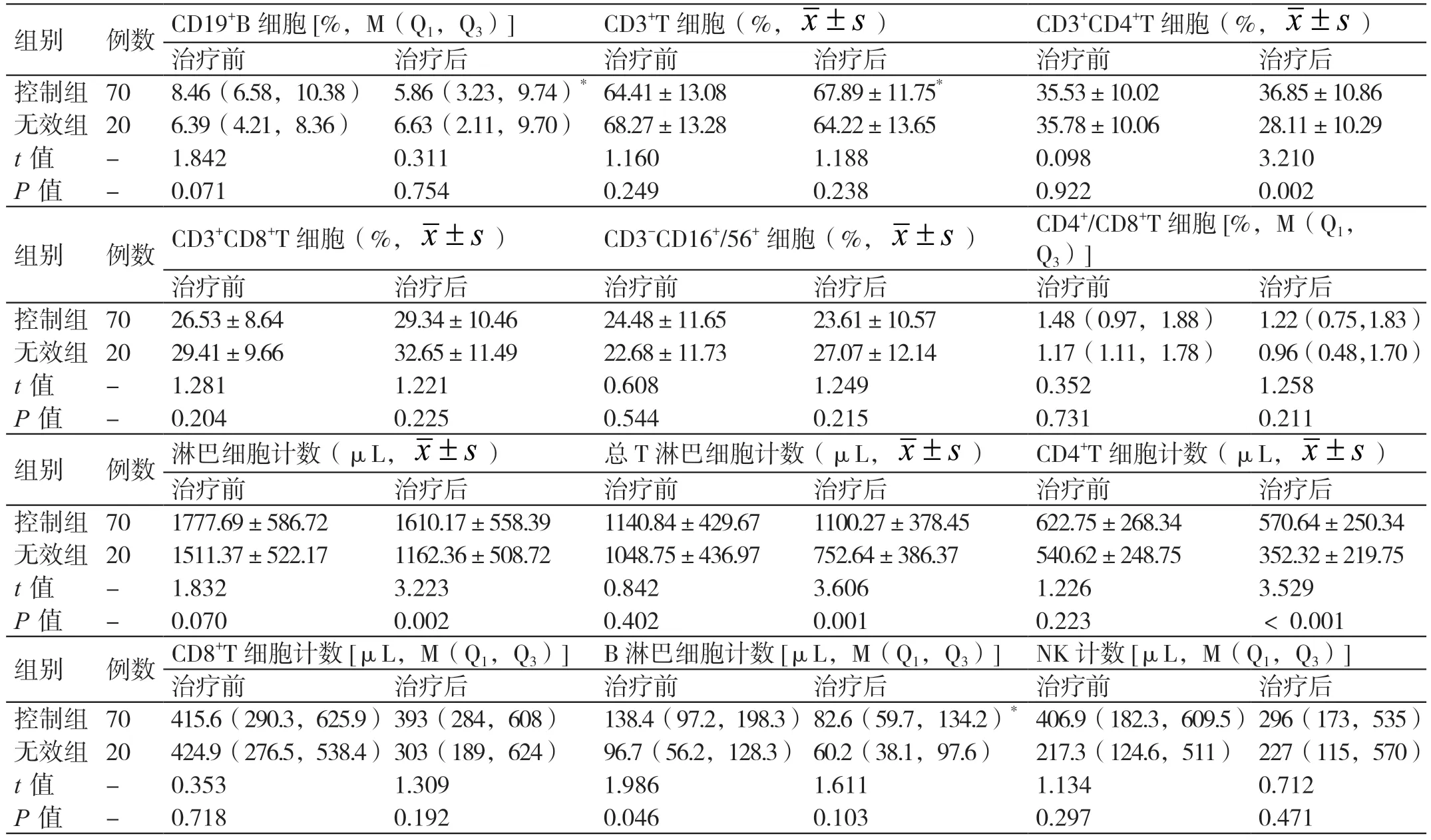
表1 对比两组治疗前后的淋巴细胞亚群水平
2.2 淋巴细胞亚群、细胞因子与免疫治疗疗效(NSCLC 进展)的相关性
IL-4、IL-6 与NSCLC 进 展 呈 正 相 关 性(P<0.05),CD3+CD4+T 细胞水平、淋巴细胞计数、总T 淋巴细胞计数、CD4+T 细胞计数与NSCLC 进展呈负相关性(P<0.05)。详见表2。
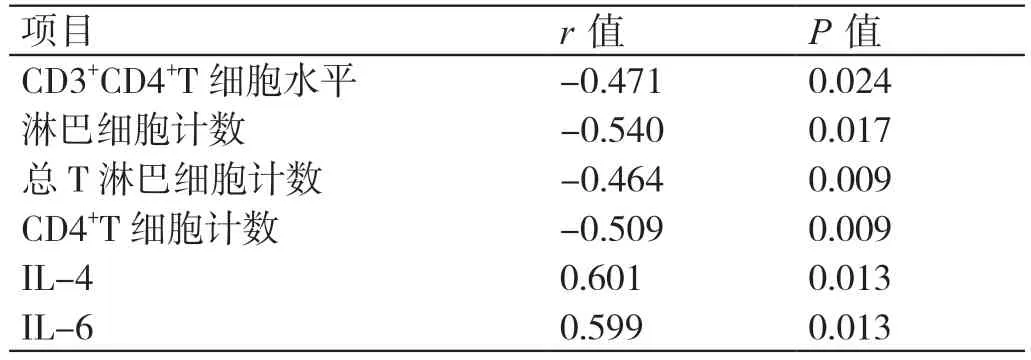
表2 淋巴细胞亚群、细胞因子与免疫治疗疗效(NSCLC进展)的相关性
3 讨论
免疫疗法也被称为肿瘤的“绿色疗法”,可动员免疫系统攻击肿瘤细胞。免疫检查点抑制剂可有效消除或减轻免疫系统的抑制,促使免疫细胞识别、杀伤肿瘤细胞,以发挥治疗肿瘤的作用[7]。近年来随着免疫疗法的不断发展,其在恶性肿瘤的治疗中越发受到重视,程序性细胞死亡蛋白-1(PD-1)及其配体(PD-L1)抑制剂已经获得批准上市,使NSCLC的治疗方法获得了新的突破,免疫微环境也逐渐成为肿瘤治疗的研究热点。在NSCLC 的治疗中发挥免疫作用的免疫细胞主要有CD4+T 细胞、CD8+T 细胞、CD19+B 细胞等。从本次研究结果可以看出,经免疫治疗,在免疫T 细胞增长方面,控制组优于无效组,这可能与免疫治疗后免疫微环境有一定的关系[8-9]。CD4+T 细胞受细胞因子与抗原的影响不断分化成Th1亚型与Th2 亚型,Th1 亚型会释放IL-2、TNF-α、IFN-γ 等细胞因子,提升巨噬细胞、NK、细胞毒性T 细胞的杀伤肿瘤效应,加速肿瘤细胞的凋亡;Th2亚型会释放IL-4、IL-6、IL-10 等细胞因子,其作用与Th1 正相反。在抑制肿瘤免疫监视与促进肿瘤细胞转移的过程中,细胞因子发挥了重要作用[10]。本研究结果显示,相较于治疗前,控制组治疗后的CD19+B细胞水平降低、CD3+T 细胞水平升高(P<0.05),无效组治疗前后的淋巴细胞亚群水平无明显差异(P>0.05);控制组治疗后的CD3+CD4+T 细胞水平、总T 淋巴细胞计数、CD4+T 细胞计数、淋巴细胞计数均高于无效组(P<0.05)。提示T 细胞能正向调节免疫系统,激活免疫细胞,提升抗肿瘤作用。本研究中,IL-4、IL-6 的表达水平与肿瘤进展呈正相关,这多与其对肿瘤的负调控有关。IL-4、IL-6 的表达水平越低,则患者能够获得越长的无进展生存时间,两者之间的负相关性是免疫治疗疗效的印证。
综上所述,淋巴细胞亚群及细胞因子的表达水平与NSCLC 患者免疫治疗的疗效之间存在密切的联系,二者可作为临床预测NSCLC 患者免疫治疗疗效的重要指标,值得推广应用。
