轻腌大黄鱼加工过程中的品质变化
2023-10-18张曦鹏黄海潮郭全友宋晓燕杨柳郑尧杨絮
张曦鹏,黄海潮,郭全友*,宋晓燕,杨柳,郑尧,杨絮
1(上海理工大学 健康科学与工程学院,上海,200093)2(中国水产科学研究院 东海水产研究所,上海,200090)
大黄鱼(Larimichthyscrocea)俗称黄花鱼,体色金黄、金鳞朱唇、肉质鲜美,素有“国鱼”之美誉,为我国最大规模的海水养殖鱼类和八大优势出口养殖水产品之一[1]。2020年我国养殖大黄鱼产量达25.4万t,同比2019年上涨12.64%[2]。当前,大黄鱼以冻品销售为主,冻品通过抑制微生物生长繁殖和酶促反应使其货架期延长、销售范围增大,但冻结和冻藏过程中伴随着的冰晶生长和蛋白变性会使其质构、持水性、色泽等食用品质发生劣变[3]。因而,盐制、冷冻调理和发酵成为目前大黄鱼加工制品的主要形式,根据SC/T 3216—2016 《盐制大黄鱼》标准中盐制品分为盐渍大黄鱼、半干大黄鱼和干大黄鱼三类产品。其中,轻腌大黄鱼属于半干大黄鱼,具有低盐(≤6%)和水分适中(40%~60%)等特点,色泽更柔和、风味俱佳,符合人们对低盐和方便即食的消费需求。
原料、腌制和干燥是轻腌大黄鱼加工过程中3个关键控制点,对确保产品品质、抑制腐败菌生长尤为重要。大黄鱼在养殖、捕捞过程中,黏附多种腐败菌,如肠杆菌和产H2S细菌(H2S-producing bacteria,HSPB),在运输贮藏期间参与鱼体的腐败变质进程[4];腌制过程中,食盐渗入鱼体内,食品中一部分水析出,水分活度(water activity,Aw)降低,抑制腐败菌的生长繁殖,保持产品鲜度和改善产品弹性等质构特性[5];轻腌大黄鱼腌制后需干燥处理,冷风干燥可降低鱼肉水分活度,使腐败菌增殖受到抑制,可有效防止鱼肉腐败变质[6],且脱去部分水后,利于保持鱼体和组织状态的完好。感官、理化和微生物指标是评价轻腌大黄鱼品质的重要手段,其中微生物群落组成和数量与产品品质密切相关。何木等[7]研究了低盐盐渍大黄鱼在5、15、25 ℃下贮藏的感官、挥发性盐基氮(total volatile base nitrogen,TVB-N)、硫代巴比妥酸及菌落总数(total colony count,TVC),并对其贮藏期间菌落进行计数,探究低盐腌渍大黄鱼的鲜度变化与其腐败细菌的关系。目前,针对大黄鱼的养殖、低温贮藏及腐败菌种类等研究较多,而对轻腌大黄鱼加工中腌制、干燥等关键控制点品质特性和微生物变化的报道较少。因此,探究不同加工条件(盐质量浓度、水分含量)对轻腌大黄鱼品质特性的影响,探究加工过程中菌落数量的变化规律具有重要意义。
本文以轻腌大黄鱼为研究对象,探究不同盐质量浓度(0、6、15 g/L)和水分含量(40%、60%)对其感官、质构、pH、Aw、TVB-N含量、水分分布和微生物数量的影响,为提高轻腌大黄鱼产品和改良加工方式提供实践和理论依据。
1 材料与方法
1.1 材料与试剂
冰鲜大黄鱼购自上海市杨浦区东方国际水产市场,规格为0.3~0.5 kg/尾;食盐,上海市杨浦区大润发流通事业股份有限公司。
AgNO3标准滴定溶液(0.1 mol/L)、铬酸钾、NaCl、高氯酸、硼酸、酚酞、甲基蓝、亚甲基红,国药集团化学试剂有限公司;平板计数琼脂培养基、铁琼脂培养基,青岛海博生物技术有限公司。
1.2 仪器与设备
ZM-100全自动不锈钢反压高温蒸煮锅,广州标记包装设备有限公司;HE53/02水分测定仪,梅特勒-托利仪器(上海)有限公司;LabMaster 水分活度仪,大昌华嘉商业(中国)有限公司;KDN-103F自动定氮仪,上海纤检仪器有限公司;TMS-Pro质构仪,美国Food Technology Corporation;Phs-3CpH测定仪,仪电科学仪器股份有限公司;PQ001-20-25V 核磁共振食品分析仪,苏州纽迈分析仪器股份有限公司;PMB35水分含量测定仪,英国爱得姆衡器公司;SW-CJ-1FB超净台,上海博迅实业有限公司医疗设备厂;MIR-153高精密度低温培养箱,上海一恒科学仪器有限公司。
1.3 样品处理
冰鲜大黄鱼流水解冻后去除鱼鳞和内脏,用清水冲洗干净后,沿背脊将整条鱼剖开,沥水后修整并称重。
1.4 实验方法
1.4.1 实验方案设计
通过前期工厂及商超调研,模拟轻腌大黄鱼加工过程,实验流程分为原料、腌制和干燥3个阶段。具体实验流程如图1所示,冰鲜鱼流水解冻后(A)作为加工过程的起始点。腌制组YI、Y2在A组基础上分别置于盐质量浓度为6、15 g/L盐水中腌制,不加盐为腌制环节中空白对照(C)。腌制完成后将C、Y1和Y2组,每组干燥为40%和60% 2种水分含量。

图1 实验设计流程Fig.1 Schematic representation of the experimental design

图2 轻腌大黄鱼不同加工阶段温度-时间履历Fig.2 Temperature and time history of lightly salted large yellow croaker in different processing stages
1.4.2 感官评价
参考SC/T 3216—2016《盐制大黄鱼》感官评价标准,由10位经过培训的感官评定人员组成评定小组,对大黄鱼的色泽、形态、外观、风味和杂质5个方面进行打分,评价采取5分制,1分为最高分,5分为感官拒绝点。

表1 感官评价标准Table 1 Sensory evaluation criteria
1.4.3 pH值
pH值测定方法参考郭全友等[8],并适当修改,称取(5.00±0.02) g鱼肉,每组样品3个平行,加入45 mL蒸馏水,均匀静置30 min后过滤取滤液,用pH计进行测定。
1.4.4 离心损失率
将样品切块(1 cm×1 cm×0.5 cm),每组样品3个平行,称重后于离心管中,在离心管底部放入吸水纸,以8 000 r/min离心20 min,称取离心后样品的质量。通过公式(1)计算离心损失率。

(1)
式中:m0,离心前样品质量;m1,离心后样品质量。
1.4.5 水分含量
取背肌鱼肉去皮,搅碎均匀后取(1.00±0.05) g均匀涂抹于托盘中,扣紧仪器盖,在(105±0.1) ℃下测定,当读数稳定时从显示屏上直接读出样品的水分含量,每组样品平行测定3次。
1.4.6Aw
取背肌鱼肉去皮,搅碎后平铺于样品盒内,以完全覆盖盒底为标准,将样品盒盖打开口放入水分活度仪中,在(25±0.1) ℃下测定,当读数稳定时从显示屏上直接读出样品的Aw,每组样品平行测定3次。
1.4.7 质构
取背肌鱼块(2 cm×2 cm×1 cm)去皮,每组样品3个平行,拭干后采用全质构面剖析法(TPA模式)进行测试,采用P/5探头,测试速度50 mm/min,形变量50%,回程距离30 mm。
1.4.8 水分分布
参考LIANG等[9]稍作修改,将鱼肉样品切成(2 cm×2 cm×1 cm)大小,每组样品3个平行置于核磁试管中,32 ℃水浴至恒温后置于核磁共振分析仪中,在GPMG序列下分析横向弛豫时间,EC=6 000、NS=4、SW=250 kHz,使用核磁共振分析测量软件及CPMG序列采集样品信号, 采用SIRT 1000000进行反演。
1.4.9 TVB-N含量
参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》中的半微量凯式定氮法测定。
1.4.10 菌落计数
在无菌环境下,取10 g剪碎的肉样,置于90 mL无菌生理盐水的锥形瓶中,振摇30 min,按照一定的梯度稀释,选择2~3个合适梯度,分别取100 μL涂布于平板计数琼脂培养基和铁琼脂培养基上,置于28 ℃恒温培养箱中培养(48±1) h后进行菌落计数。
1.5 数据分析
采用SPSS 25软件进行数据处理及显著性分析(P<0.05),测定结果均以“平均值±标准偏差”来表示,并用OriginPro 2022软件制图。
2 结果与分析
2.1 轻腌大黄鱼加工中温度-时间履历
采用红外测温仪对原料、前处理、加工过程中各阶段鱼体温度进行测定,鱼体全程时间-温度履历见图1。为降低品质劣变及微生物污染在-18 ℃条件下贮藏,冰封包装1 h运达实验室;冰鲜鱼经室温流水解冻后三去,并迅速用清水冲洗干净,期间鱼体温度上升至(11.9±0.3) ℃;分别置于质量浓度为0、6、15 g/L(C、Y1、Y2)的盐水中浸渍,料液比1∶3(g∶g),在(4.0±0.1) ℃条件下腌制12 h;冷风干燥的温度为(22.1±0.2) ℃,Y1分别干燥34、15 h,得到最终产品的水分含量分别为40%和60%(Y1G1、Y1G2),而Y2干燥至水分含量至40%和60%(Y2G1、Y2G2)需13 h和32 h,对照组(C1G1、C1G2)干燥至相应水分含量分别耗时40和19 h。整个过程中的低温条件延缓了细菌的生长与增殖,且酶活性相对较弱,利于保证产品在流通和贮藏中的安全和品质[10]。轻腌大黄鱼产品实施危害分析与关键点控制(hazard analysis and critical control point,HACCP)体系管理,原料接收、三去、清洗腌制和干燥等加工过程均是关键控制点,在进行此类产品生产和研发时,必须严格遵守卫生标准操作规范,并对生产过程中关键环节及时采取纠偏措施,切实保证产品的质量。
2.2 感官评价
感官评价可以在一定程度上较为直观地反应产品品质优劣,可作为轻腌大黄鱼在加工过程中品质变化的首要依据[11]。由表2可知,A组鱼体光泽和颜色较佳,鱼肉组织形态和弹性都呈现较好的状态,蒸煮后鱼腥味较重,不为大多数人所接受;腌制结束后对照组C由于长时间水中浸泡,鱼肉暗淡无光泽,肉质松散,浸泡液底部有较多碎肉沉淀,且鱼腥味较重;Y1组感官评价略优于Y2组,Y1组的鱼肉有光泽,鱼香味较浓郁,弹性和肌肉的组织形态也相对较好;干燥过后由于鱼肉水分含量相对降低,腹部两侧肌肉色泽略显暗淡,但Y1G2组感官评分明显优于其他组,蒸煮后咸香味较浓郁,整体外形完整饱满,肌肉组织紧密,呈现良好的弹性。综合考虑外观、质构等品质特征,选择盐质量浓度为6 g/L进行腌制,干燥至水分含量为60%的产品较为理想。

表2 轻腌大黄鱼不同加工阶段感官评价Table 2 Sensory evaluation of lightly salted large yellow croaker in different processing stages
2.3 持水力、水分分布和质构特征
持水能力被认为与蛋白质性质和组织微观结构密切相关,尤其是肌纤维的膨胀[12],图3-a所示,腌制阶段对照组C离心损失率最高,当盐水质量浓度增加至15 g/L离心损失率显著降低至(14.43±0.51)%(P<0.05),表明随着盐质量浓度的增加,大黄鱼肌肉持水力逐渐增加。因为食盐水会导致蛋白与水的结合能力增强,且NaCl是一种亲水性离子物质,可使肌肉中结合水增多,同时不断促进盐溶性蛋白的溶出,从而导致持水力增加[13]。冷风干燥后40%水分含量的鱼肉离心损失率显著降低(P<0.05),因为在较低水分含量情况下部分不易流动水转换成结合水,自由水含量降低,从而肌肉中的水不易损失,导致其持水力增强。

a-离心损失率;b-水分分布变化
图3-b是低场核磁共振测定T2横向弛豫时间图谱,弛豫时间的变化表征不同盐分和水分条件下水分的迁移情况,而峰面积代表着不同状态水的含量。共产生了3个峰,分别对应3种水分相态,即结合水T21(0.01~10 ms)、不易流动水T22(10~100 ms)和自由水T23(>100 ms)。图3-b可知,不加盐腌制,肌肉组织中不易流动水含量最高,盐质量浓度增加至15 g/L时,不易流动水含量下降。结合峰总面积及相应组分所占总水的百分比(表3),与对照组C相比,随着盐水质量分数的增加,S总总体下降,同时,自由水S23比例呈减小趋势,而结合水S21比例增加,表明腌制处理使得自由水转化为不易流动水。比较峰面积可知,干燥后峰总面积、不易流动水峰面积均有不同程度的下降,说明不易流动水在干燥过程中不断迁移为自由水被脱去。随着干燥时间延长,水分含量为40%时,T22峰呈现左移趋势,表征T22弛豫时间逐渐缩短,这与干燥处理使得肌肉中水分含量减少、逐渐失去弹性、出现皱缩等现象一致。

表3 总水分面积及相应组分所占总水分的百分比Table 3 The total moisture area and the percentage of the corresponding components in the total moisture
质构参数是用来衡量鱼肉品质的重要指标之一,肌纤维越粗、结构越紧致则所需的咀嚼力越大,而弹性和硬度则受肌肉的持水性、微观结构的破环程度影响较大[14]。表4显示在不同腌制和干燥条件下质构(弹性、硬度、咀嚼性)变化,冰鲜大黄鱼肉质紧实,呈现较好质构特性,腌制后对照组C组质构特性均显著低于实验组,Y1组硬度、弹性和咀嚼性显著高于Y2组,腌制过程中高质量浓度盐水(15 g/L)对鱼肉质构的变化具有较大影响,可能是由于在腌制时,水分不断从鱼肉中渗出,导致其失去原有的组织状态,造成硬度、弹性等质构参数下降[15]。胡晓飞等[16]研究食盐浓度对大菱鲆食用品质的影响,发现高盐导致肌肉质构特性下降,和本实验结果一致。在干燥过程中,鱼肉质构特性与水分、蛋白质及肌肉组织状态等因素有关[17]。从大黄鱼的硬度、弹性等质构参数的差异性结果分析来看,Y1G2组的硬度显著低于其他组(P<0.05),弹性为(0.94±0.01) mm,达到最高。这是因为Y1G2干燥时间较短,水分流失少,肌肉纤维结构完整,口感鲜嫩多汁,具有良好的质构特性。因此,适宜质量浓度的盐水(6 g/L)腌制后经冷风干燥水分含量控制为60%,鱼肉硬度和咀嚼性呈现较好的适口性,同时能保持良好的弹性。

表4 轻腌大黄鱼不同加工阶段鱼肉质构变化Table 4 Texture changes of lightly salted large yellow croaker at different processing stages
2.4 pH、Aw和TVB-N变化
图4-a显示,整个加工过程中pH变化,总体呈现下降趋势,冰鲜鱼pH为6.99,Y1、Y2组pH显著降低为6.52、6.44(P<0.05),因为鱼类死亡后首次呈僵直状态,肌肉中的糖原因无氧分解产生乳酸,导致pH下降。C组pH显著高于实验组,这可能是因为腌制液浓度抑制微生物生长,鱼肉中蛋白质在微生物作用下被分解产生胺类等碱性物质含量较少,从而对照组pH值较高。由图4-b可知,Y1和Y2的水分活度分别为0.963和0.942,鱼肉水分活度随着盐含量的增加而下降,且盐质量浓度越高,水分活度下降效果越显著,这是因为鱼肉内外渗透压差很大,必须通过失水来达到内外渗透压的平衡;而腌制液的浓度越高,其渗透压越大,导致水分活度进一步降低[18]。图4-c显示,腌制过程中Y1和Y2组的TVB-N值分别为9.65 mg/100 g和8.71 mg/100 g, 一方面是因为盐质量浓度的增加会导致使蛋白质分解的酶的活性降低;另一方面较低pH和水分活度导致部分腐败菌的生长繁殖受到抑制甚至死亡,从而减少氨以及胺类等碱性含氮代谢物质的积累[19]。
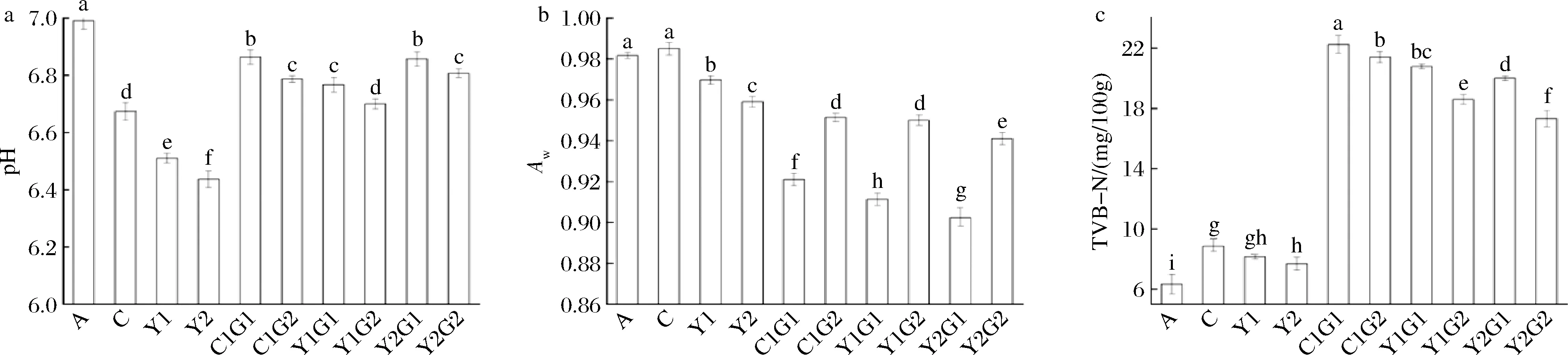
a-pH;b-Aw;c-TVB-N
在冷风干燥过程中,蛋白质在内源酶或微生物的作用下生成含氮的碱性物质,相比于腌制环节pH有所上升[20],并且随着干燥时间的延长,水分含量为40%组pH较高,这是因为伴随着长时间干燥,降解的碱性物质不断积累导致。干燥后实验组4组产品水分活度均小于0.950,其中Y1G1组与Y2G1组水分活度小于0.910,显著低于Y1G2和Y2G2(P<0.05),Y2G1组由于水分活度较低,不利于微生物生长繁殖,从而保持良好的新鲜度。相对于腌制环节,干燥后鱼肉TVB-N含量较腌制环节有较大幅度上升,可能是腌制期间大黄鱼环境温度(4 ℃)较低,导致蛋白质降解生成的碱性物质较少,腐败过程比较缓慢,冷风干燥后,微生物进一步增殖,新鲜度发生变化,导致TVB-N含量上升。Y1G1组TVB-N含量显著高于Y1G2,这可能是由于在长时间的干燥过程中,蛋白质分解后产生二甲胺、三甲胺等胺类物质积存,导致TVB-N含量升高,Y2G1与Y2G2也呈现相似的变化规律。
2.5 菌落计数
新鲜渔获物中的细菌组成多样,包含渔获物生长环境中的细菌和鱼体自带的细菌[21],大多数腐败菌在水分活度低、盐浓度高的环境中生长发育受到一定的抑制。产HSPB是海水鱼类最重要的腐败菌之一,主要包括希瓦氏菌属、沙雷氏菌属、气单胞菌属等,具有较强的蛋白质水解活性,并产生三甲胺和H2S[22]。轻腌大黄鱼在不同加工阶段和条件下,TVC和HSPB测定结果见图5,与冰鲜鱼中的TVC[(5.07±0.01) lg CFU/g]和HSPB[(3.19±0.04) lg CFU/g]相比,清洗腌制后TVC和HSPB均显著降低(P<0.05);其中Y2组TVC和HSPB分别降到(3.49±0.04)和(2.31±0.05) lg CFU/g。说明腌制在一定程度上能够抑制微生物的生长,并且盐质量浓度越高,对细菌的抑制作用越强,因为腌制改变了渗透压造成低耐盐性的细菌死亡,当盐水浓度较低时,未能造成细菌脱水死亡,该条件下大部分细菌仍能维持正常生长繁殖。干燥到低水分含量需要更长时间,鱼体暴露在空气中,更多的微生物黏附在鱼体表面,较腌制后微生物数量在一定范围内增长。其中对对照组C1G1干燥时间最长,TVC和HSPB分别到达(4.84±0.03) lg CFU/g和(3.57±0.11) lg CFU/g,Y2G1和Y2G2组由于高盐含量抑制部分微生物生长繁殖,TVC和HSPB有所降低,其中Y2G2菌落总数仅为(3.88±0.04) lg CFU/g。表明腌制和干燥在一定范围内能够延长轻腌大黄鱼产品货架期,抑制其腐败变质。

图5 轻腌大黄鱼不同加工阶段TVC和HSPB变化Fig.5 Changes of TVC and HSPB at different processing stages of lightly salted large yellow croaker注:大写字母不同表示不同组间TVC变化差异显著(P<0.05),小写字母不同表示不同组间HSPB变化差异显著。
3 结论
腌制和干燥对鱼肉品质的影响均较显著,6 g/L盐水腌制的大黄鱼,其肌肉的水分活度、持水力和pH变化较小,腌制后鱼肉的弹性增加,微生物数量降低,TVB-N≤13 mg/100 g,为一级品。说明低盐腌制对大黄鱼品质破坏程度较小,口感佳。干燥完成后,水分含量为60%的轻腌大黄鱼由于水分含量较高,水分活度、pH和持水力仍保持在良好的范围内;由于干燥时间较长,鱼肉暴露在空气中,导致微生物数量上升,TVB-N含量增加,但仍在可接受范围之内,并且鱼肉的口感呈现最佳状态,弹性和硬度与冰鲜鱼最为接近。综上,轻腌大黄鱼腌制时选择质量浓度为6 g/L的食盐水,干燥后的水分含量为60%的产品最为适宜,能较好地保持产品的品质、质构特性和口感。该研究为轻腌大黄鱼鱼肉品质的控制提供技术依据。
