基于PERK-eIF2α通路探讨苁蓉舒痉颗粒对帕金森病模型大鼠黑质纹状体内质网应激的调节作用
2023-10-18陈乃洁袁明洲林如辉李茜羽陈诗雅
陈乃洁,林 瑶,许 茜,袁明洲,林如辉,李茜羽,陈诗雅,蔡 晶*
(1.福建中医药大学中西医结合学院,福建 福州 350122;2.福建中医药大学科技创新与转化中心,福建 福州 350122;3.福建中医药大学附属第三人民医院,福建 福州 350108)
帕金森病(Parkinson's disease,PD)为全球第二大神经退行性疾病,随着我国人口老龄化的加剧,发病率逐年上升,预计2030 年中国PD 患者将增至494 万,占全球PD 患者的一半[1]。PD 运动症状表现为运动迟缓、静止性震颤、肌强直等,非运动症状包括嗅觉减退、认知功能障碍、睡眠障碍等,给社会带来极大的疾病负担,目前的药物治疗以改善症状为主,随着病程进展,药效下降和并发症等问题往往随之出现[2-3]。因此,探索中药治疗PD 的疗效及机制,可为PD 的治疗提供新的思路。
PD 主要病理特点为黑质神经细胞的丢失及α-突触核蛋白(α-synuclein,α-syn)积聚所致路易小体的形成,具体发病机制可能与内质网应激(endoplasmic reticulum stress,ERS)蛋白激酶样内质网激酶(protein kinase-like ER kinase,PERK)-真核翻译起始因子2α(eukaryotic translation initiation factor 2 alpha,eIF2α)通路有关[4]。补肾益髓活血复方苁蓉舒痉颗粒源于地黄饮子,为课题组基于临床实践并经过药物筛选、动物实验等验证的经验方,可有效降低黑质α-syn 水平,抑制黑质神经细胞的凋亡,改善PD 大鼠模型的行为学异常[5],但其疗效机制是否与PERK-eIF2α 通路相关,尚不明确。本研究拟观察苁蓉舒痉颗粒对PD 模型大鼠黑质纹状体PERK-eIF2α 通路的动态影响,以探索苁蓉舒痉颗粒治疗PD 的作用机制。
1 实验材料
1.1 实验动物 SPF 级成年健康雄性SD 大鼠100只,体质量180~220 g,购自杭州医学院,实验动物生产许可证号:SCXK(浙)2019-0002,饲养于福建中医药大学动物实验中心SPF 级动物实验室,许可证:SYXK(闽)2019-0007,温度20~22 ℃,相对湿度60%~65%,光照/黑暗周期为12 h,饮水摄食自由。本实验经福建中医药大学动物伦理中心审核通过(2019039)。
1.2 实验药物 取鱼藤酮粉末150 mg 加入葵花油100 mL 中,制备浓度为1.5 mg/mL 的鱼藤酮葵花油乳液。苁蓉舒痉颗粒由肉苁蓉6 g,制黄精12 g,丹参15 g,赤芍12 g,牡丹皮10 g 组成,购自福建中医药大学附属第三人民医院。取20 g 苁蓉舒痉颗粒加入100 mL 蒸馏水配制浓度为200 mg/mL 的苁蓉舒痉颗粒药液。以上药物制备后均置于4 ℃低温避光保存。
1.3 实验试剂 鱼藤酮、葵花油均购自美国Sigma公司(批号:R8875、S5007);20%乌拉坦(国药集团化学试剂有限公司,批号:30191228);PERK 抗体、p-eIF2α 抗体均购自武汉赛维尔生物科技有限公司(批号:GB13449、GB13572);p-PERK 抗体、eIF2α抗体均购自美国Immunoway 公司(批号:YP1055、YT1507);电镜固定液(武汉谷歌生物科技有限公司,批号:G1102)。
1.4 实验仪器 透射电镜(日本Hitachi 公司);Eclipse Ci-L 正置白光拍照显微镜(日本Nikon 公司);石蜡包埋机(武汉俊杰电子有限公司);石蜡切片机(上海徕卡仪器有限公司);Image-Pro Plus 6.0分析系统(美国Media Cybemetics 公司);酶标仪(美国Molecular Devices 公司);全自动数码凝胶图像分析系统(上海天能科技有限公司);串联质谱仪(美国Thermo Fisher Scientific 公司)。
2 实验方法
2.1 分组与干预 将100 只SPF 级成年健康雄性SD 大鼠根据SPSS 24.0 软件随机分为正常组33 只和造模组67 只,造模组大鼠按1 mL/(kg·d)予颈背部皮下注射鱼藤酮葵花油乳液建立PD 模型,每日1 次,连续注射2 周,隔周休息1 d[6]。造模结束后,参照陈忻等[7]制定的行为学评分标准进行评定,评分2~8 分者为造模成功。将造模成功的大鼠随机分为模型组34 只和治疗组33 只。参照《医学实验动物学》[8]中的人与动物用药量换算公式,按人的临床常用剂量的6.3 倍换算,治疗组予苁蓉舒痉颗粒药液6.8 mL/(kg·d)灌胃,正常组和模型组予以等体积生理盐水灌胃,每日1 次,连续14 d。
2.2 平行反应监测(PRM)检测大鼠黑质纹状体eIF2α 特异性肽段变化趋势 3 组分别于灌胃第1、3、5、7、9、11、13、14 天各取3 只大鼠腹腔注射20%乌拉坦(0.5 mL/100 g)麻醉,快速断头取脑,冰上分离黑质纹状体,置-80 ℃冰箱保存待用。从样品中提取蛋白,用BCA 法测定蛋白质浓度,采用SDSPAGE 电泳分析评价样品质量是否符合后续实验要求,对质量达标的蛋白样品进行还原烷基化处理。每个样品取等量蛋白进行胰蛋白酶酶解纯化,分别上机进行液相串联质谱PRM 检测,采用该物种Uniprot 蛋白数据库作为背景库,筛选特异性肽段,采用Skyline 对PRM 原始数据进行定量分析。
2.3 透射电镜观察大鼠黑质神经细胞超微结构 灌胃14 d 后3 组各取3 只大鼠腹腔注射20%乌拉坦(0.5 mL/100 g)麻醉,快速断头取脑。在冰浴中切取黑质,用含2.5%戊二醛的电镜固定液快速固定过夜,并于4 ℃下用1%锇酸固定2 h,梯度乙醇脱水,包埋,切成60 nm 超薄切片,用醋酸铀-柠檬酸铅染色,置于透射电镜下观察大鼠中脑黑质神经细胞超微结构的变化并摄影记录。
2.4 免疫组化检测大鼠黑质PERK、p-PERK、eIF2α、p-eIF2α 的表达 灌胃14 d 后3 组各取3 只大鼠,0.5 mL/100 g 腹腔注射20%乌拉坦麻醉,打开胸腔,向左心室灌注生理盐水(4 ℃)冲洗血液至肝脏变白,待右心房流出的液体变清亮时,灌注4%多聚甲醛溶液,灌注完成后仔细分离取脑组织。常规固定、脱水、透明、浸蜡、包埋处理,将石蜡包埋好的各组大鼠组织连续冠状切片,切片厚度5 μm,载玻片附贴组织切片,置于4 ℃冰箱保存备用。石蜡切片常规脱蜡复水,枸橼酸盐修复完成后,经通透、封闭,加入PERK(1∶100)、p-PERK(1∶200)、eIF2α(1∶200)、p-eIF2α(1∶500)一抗孵育,后经辣根过氧化酶标记二抗染色、DAB 显色试剂盒显色、苏木素复染、PBS 返蓝、梯度酒精脱水及中性树胶封片等步骤,于Eclipse Ci-L 拍照显微镜下选取黑质区域采集图像,使用Image-Pro Plus 6.0 分析软件,以棕色颗粒染色为阳性表达,分别测量每张切片中3 个视野阳性表达细胞的累积光密度值(A值)以及对应的组织像素面积(Area),并计算平均光密度值。
2.5 统计学方法 采用SPSS 24.0 软件进行数据分析。计量资料符合正态分布以(±s)表示,组内不同时间点比较采用重复测量方差分析;多组间比较采用单因素方差分析,两两比较方差齐时采用LSD-t法,方差不齐时采用Game's-Howell 法。P<0.05 为差异有统计学意义。
3 结 果
3.1 3 组大鼠黑质纹状体不同时间点eIF2α 特异性肽段变化趋势 与正常组比较,模型组在灌胃第1~7 天总体趋势较低,但差异无统计学意义(P均>0.05),第13、14 天均明显增高(P均<0.05);与模型组比较,治疗组在灌胃第5 天明显增高(P<0.01),第13、14 天时均明显减低(P均<0.05)。见表1。
表1 3 组大鼠黑质纹状体不同时间点eIF2α 特异性肽段定量比较(±s) ×106
注:与正常组比较,1) P<0.05;与模型组比较,2) P<0.01,3) P<0.05。
第14天6.14±0.35 6.98±0.361)6.22±0.313)组别正常组模型组治疗组n3 3 3第1天6.37±0.47 5.98±0.50 6.43±0.49第3天6.19±0.44 6.10±0.46 6.54±0.37第5天6.24±0.45 5.56±0.32 6.90±0.382)第7天6.32±0.37 5.95±0.42 6.65±0.38第9天6.34±0.36 6.48±0.30 6.10±0.42第11天6.30±0.45 6.87±0.33 6.17±0.46第13天6.21±0.49 7.09±0.351)6.28±0.373)
3.2 3 组大鼠黑质神经细胞超微结构观察 透射电镜显示,正常组大鼠黑质神经细胞形态正常,胞质内可见形态正常的内质网,隐约可见核糖体附着;模型组大鼠黑质神经细胞肿胀,内质网明显扩张、断裂,呈小空泡样改变;治疗组大鼠黑质神经细胞肿胀减轻,内质网扩张等形态异常有所改善。见图1。
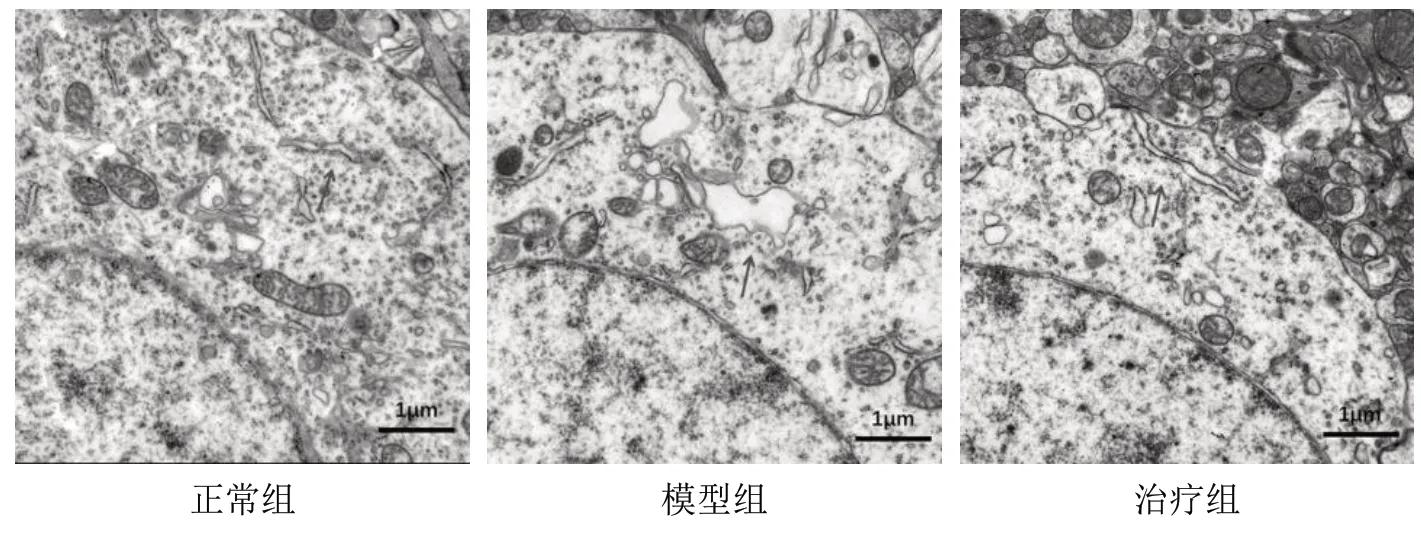
图1 3 组大鼠黑质神经细胞透射电镜图(×2 000)
3.3 3 组大鼠黑质PERK、p-PERK、eIF2α、p-eIF2α表达比较 免疫组化显示目标蛋白染色呈棕色,定位于胞浆中。与正常组比较,模型组PERK、p-PERK、eIF2α、p-eIF2α 的平均光密度值明显增高(P<0.05,P<0.01);与模型组比较,治疗组PERK、p-PERK、eIF2α、p-eIF2α 的平均光密度值明显降低(P<0.05,P<0.01)。见图2、表2。

图2 3 组黑质PERK、p-PERK、eIF2α、p-eIF2α 免疫组化图(×400)
表2 3 组大鼠黑质PERK、p-PERK、eIF2α、p-eIF2α 平均光密度值比较(±s) ×10-3

表2 3 组大鼠黑质PERK、p-PERK、eIF2α、p-eIF2α 平均光密度值比较(±s) ×10-3
注:与正常组比较,1) P<0.01,2) P<0.05;与模型组比较,3) P<0.05,4) P<0.01。
p-eIF2α 0.07±0.05 0.28±0.112)0.10±0.053)组别正常组模型组治疗组n3 3 3 PERK 7.24±2.32 13.89±1.591)9.45±1.023)p-PERK 4.26±1.60 13.05±2.341)4.16±2.034)eIF2α 16.76±1.83 24.00±2.142)16.92±3.653)
4 讨 论
PD 属于中医学“颤证”范畴,其病位在脑,着于筋脉,病机属本虚标实,肾虚为本,血瘀为标。肾精亏虚,精气不能上承,以致瘀血内生,脑窍、筋脉失养,从而出现运动迟缓、震颤不能自止等临床表现。因此,治法需以“补肾益髓活血”为主[9-10]。苁蓉舒痉方以肉苁蓉为君药,补肾壮阳,填精补髓;以制黄精为臣药,健脾益肾,补气养阴;以丹参、赤芍、牡丹皮为佐药,清热凉血,活血祛瘀。诸药合用,标本同治,使肾虚得补,瘀血得化,则脑髓得充,筋脉得养,震颤得除[11-12]。
ERS 是真核细胞的一种自我防御机制。在缺氧、毒物等刺激或疾病状态下,内质网功能障碍,大量未折叠或错误折叠的蛋白质堆积于内质网,可引发未折叠蛋白反应(UPR)以提高细胞的适应性,使内质网重新达到稳态,但持续而过度的ERS 则可诱发细胞凋亡、自噬[13-14]。研究发现,A53T 突变α-syn过表达的PC12 细胞可呈现时间依赖性的ERS 活化,并由于持续过强的ERS 诱发ERS 依赖的细胞程序性死亡;但在必须启动细胞凋亡之前,ERS 未折叠蛋白反应是抑制细胞损伤的最终保护途径[15]。PERK-eIF2α 通路为UPR 信号通路之一,ERS 状态下,PERK 被激活发生磷酸化反应,p-PERK 使其下游eIF2α 活化并磷酸化,根据PERK-eIF2α 通路激活的动态变化,可兼具促适应或促凋亡的作用[16]。PD 患者死后活检显示,黑质多巴胺能神经元p-PERK 和p-eIF2α 的表达显著增加[17];在1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)或6-羟基多巴胺(6-OHDA)诱导的PD 鼠类模型及各类PD 相关转基因动物模型中,均可检测到PERK-eIF2α 通路相关蛋白的活化[18-20],提示PERK-eIF2α 通路激活在PD 发病机制中的促凋亡作用。但亦有研究发现,敲除了PERK 的神经元更易受6-OHDA 的损伤;peIF2α 水平增高可延缓表达家族性PD 相关突变体A53T 人α-syn 的转基因小鼠模型的发病,并减轻α-syn 的聚集,提示PERK-eIF2α 通路的适度激活可促神经元适应,对多巴胺能神经元可能具有一定的保护作用[21-22]。
本研究通过PRM 蛋白相对定量分析检测eIF2α的特异性肽段的动态表达,从大致的变化趋势中可见,在灌胃前7 d 模型组黑质纹状体eIF2α 总体趋势较低,第13、14 天时明显增高,且灌胃14 d 后通过透射电镜观察发现模型组大鼠黑质神经细胞内质网形态紊乱,PERK-eIF2α通路蛋白表达增高。提示在PD 造模下,随着鱼藤酮毒性的累积,内质网应激PERK-eIF2α 通路活性缓慢升高,后持续维持于较高水平,而持续过强的内质网应激则可导致相关细胞凋亡。与模型组比较,经苁蓉舒痉颗粒干预后,eIF2α 于干预第5 天明显提高,第13、14 天时明显减少,且透射电镜显示干预14 d 后治疗组大鼠黑质神经细胞内质网形态明显改善,免疫组化显示治疗组PERK-eIF2α 通路蛋白表达明显降低。提示苁蓉舒痉颗粒在治疗早期可短暂提高内质网应激PERK-eIF2α 通路活性,从而增强内质网蛋白折叠能力及内质网相关蛋白降解,提高细胞适应性,促进细胞存活,减轻造模药物的毒副作用;治疗中后期,药物作用导致内质网应激PERK-eIF2α 通路活性降低,避免持续过强的内质网应激引起的负面作用,以恢复内质网稳态,从而起到动态的神经保护作用。
综上所述,苁蓉舒痉颗粒可调节内质网应激PERK-eIF2α 通路,从而恢复内质网稳态,起到神经保护的作用。后续研究拟进一步增加样本量,选取更多时间节点检测分析,完善治疗期间和后续疗效评估,继续深入探究苁蓉舒痉颗粒的疗效及机制。
