KDM5C通过Hippo-YAP1通路调控人宫颈癌发生的初步机制
2023-10-18刘绪张欣冉李堂华周威梁荷淼高文珍张娟苗林陈晓华
刘绪,张欣冉,李堂华,周威,梁荷淼,高文珍,张娟,苗林,陈晓华,*
1中部战区总医院检验科,湖北 武汉 430070;2湖北民族大学医学部基础医学院,湖北 恩施 445000;3中部战区总医院生殖医学科,湖北 武汉 430070;4南方医科大学第一临床医学院,广东 广州 510280
宫颈癌是妇科第4 大癌症。2020 年全球癌症统计报告显示,宫颈癌导致的死亡人数占女性癌症死亡的8%[1]。超过95%的宫颈癌与人乳头瘤病毒(HPV)持续感染有关,以HPV16、HPV18 型的致病性最强,其中HPV16 型感染占50%以上[2]。高危HPV的致癌机制主要是其编码的两个蛋白E6和E7在宫颈癌的发生发展中发挥关键作用(与宿主细胞中其他癌蛋白协调作用,多途径、多通路促进细胞表皮间质转化进程,影响原癌基因和抑癌基因表达),最终导致癌症的发生[3-4]。由于病毒致癌蛋白E6 是HPV16致癌的主要因子,因此HPV16 E6一直是宫颈癌发病机制研究的重点。Hippo-YAP1 信号通路是一条参与细胞增殖与凋亡、侵袭与迁移、组织修复再生与上皮-间充质转化的重要通路[5],该通路主要由类Ste20 激酶1/2(MST1/2)和大肿瘤抑制因子1/2(LATS1/2)、Yes 相关蛋白(YAP)和(或)其同系物TAZ蛋白构成[6],当该通路被激活后,MST1/2被磷酸化并进一步激活LATS1/2,从而磷酸化YAP1并抑制其活性。Hippo-YAP1 信号通路的失活或异常与多发肿瘤的发生发展密切相关[7]。Hippo-YAP1 信号通路的主要效应分子YAP1 可与HPV16 E6 相互作用,促进宫颈癌的发生发展[5],但其具体分子机制尚不完全清楚。本课题组前期研究发现,HPV16 E6蛋白与组蛋白H3 第四位赖氨酸(H3K4)位点的组蛋白去甲基化酶5C(KDM5C)存在蛋白相互作用。KDM5C 在HPV16感染细胞中的表达广泛下调,HPV16 E6通过降解KDM5C 而激活原癌基因(如EGFR和c-MET等)的超级增强子,最终导致肿瘤的发生[8]。本研究在此基础上,从基因组和转录组学层面深入分析KDM5C 通过Hippo-YAP1 通路调控人宫颈癌发生的分子机制,揭示KDM5C 改变YAP1基因启动子的组蛋白甲基化修饰水平,进而影响宫颈癌细胞增殖和迁移的过程,旨在为高危HPV 阳性宫颈癌的诊断、预后评估及治疗提供新线索。
1 材料与方法
1.1 主要试剂及仪器 胎牛血清、RPMI 1640、Opti-MEM、青(链)霉素溶液均购自美国Gibco 公司,LipopfectmineTM3000转染试剂、三色预染蛋白Marker购自美国Thermo Fisher 公司,RNA 提取试剂盒购自美国Omega 公司,YAP1 多克隆抗体、YAP1 磷酸化(ser127) 单克隆抗体、 KDM5C 单克隆抗体、H3K4me1多克隆抗体和H3K4me3多克隆抗体购自美国Abcam 公司,Protein A/G 磁珠购自美国MCE 公司;SYBR GREEN PCR Mix、反转录试剂盒、羊抗兔IgG 二抗、β-actin 多克隆抗体、IgG 多克隆抗体购自武汉爱博泰克生物科技有限公司,PBS、嘌呤霉素和CCK-8 检测试剂盒购自上海碧云天生物技术有限公司。PCR 引物和siRNA 均由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 细胞来源及细胞培养 宫颈癌细胞CaSki(含HPV16 E6)购自美国典型培养物保藏中心(American Tissue Culture Collection,ATCC),Phage组(过表达对照组)、Phage-KDM5C 组(过表达KDM5C 组)、KOVector 组(敲除对照组)和KO-KDM5C 组(敲除KDM5C 组)稳转细胞系由本实验室前期构建并筛选鉴定[8]。CaSki 细胞使用RPMI 1640 培养基培养,细胞培养条件均为:培养基加入10%胎牛血清和1%青霉素/链霉素溶液,稳转细胞系在此基础上添加2 μg/ml 的嘌呤霉素。将细胞置于37 ℃、5% CO2培养箱中培养,待细胞密度达80%~90%时进行传代,最后收取细胞备用。
1.2.2 转录组测序(RNA-Seq)和差异基因表达分析收集Phage组及Phage-KDM5C组细胞各1×107个,PBS洗2 次,分别加入1 ml Trizol 裂解液室温裂解5 min,放入1.5 ml 无RNA 酶离心管中并做好标记,置于干冰中保存。RNA 提取及转录组测序、分析由北京诺禾致源科技股份有限公司完成。差异表达分析使用Cuffdiff 软件,从统计学意义的角度上考虑,对mRNA类型转录本进行差异分析,以log2Fold Change:log2(Sample 1/Sample 2)≥1.3 且P<0.05 为标准进一步筛选差异表达基因(differentially expressed genes,DEGs)。差异表达转录本以火山图表示。此外对不同实验条件下的差异转录本的定量值(FPKM)表达水平,以log10(FPKM+1)值行层次聚类(hierarchical clustering)分析,红色代表高表达基因,蓝色代表低表达基因。
1.2.3 Gene Ontology(简称GO)富集分析 筛选与KDM5C 相关的基因,研究该类基因在GO中的分布状况,并通过实验阐明其在基因功能上的体现。GO富集分析方法参考GO seq[9],并将GO分析结果通过富集柱状图展示。
1.2.4 KEGG 富集分析 Kyoto Encyclopedia of Genes and Genomes (KEGG)是有关通路的主要公共数据库[10]。本项目使用KOBAS(2.0)进行通路富集分析[11],将错误发现率(FDR)≤0.05 的通路定义为在差异表达基因中显著富集的通路,结果以KEGG 富集散点图和KEGG富集通路图展示。
1.2.5 蛋白互作网络分析 应用经典的STRING 蛋白质互作数据库(http://string-db.org/),将表达差异变化显著的前40位基因输入网站进行蛋白互作分析并关联构建网络。
1.2.6 细胞瞬时转染 细胞转染步骤参照转染试剂LipopfectmineTM3000 的使用说明书进行。简要步骤如下:当铺板细胞生长密度达到50%~60%时,使用Opti-MEM将siRNA/质粒分别稀释至说明书推荐浓度后与转染试剂轻柔混匀,室温静置15 min 后将混合物均匀添加到无血清培养基的细胞中继续培养,6~8 h 后更换为RPMI 1640 完全培养基培养。转染后24~48 h 收集细胞进行后续实验。细胞转染采用的siRNA 序列如下:KDM5C-siRNA1,GCCAACCUUGU GCAGUGUATT;KDM5C-siRNA2,GCCAGUGUAUC AAGUGCAATT;KDM5C-siRNA3,GUGGACAACUU CAGGUUUATT。siRNA-NC 由公司在合成siRNA 时配套赠送。将细胞分为NC-siRNA组(siRNA敲低对照组),KDM5C-siRNA1/2/3 组(KDM5C基因特异siRNA1/2/3敲低组)。
1.2.7 实时荧光定量PCR检测基因表达变化 siRNA转染野生型CaSki细胞24 h后收取细胞用于分析转染效果和下游调控基因,细胞RNA的提取步骤严格按照试剂盒说明书进行;提取的总RNA 经浓度测定后,取4 μg总RNA用反转录试剂盒进行反转录得到cDNA,并使用SYBR 染料法试剂盒进行实时荧光定量PCR 检测KDM5C基因的敲降效果,检测YAP1 和EGFR等基因的表达变化情况。反转录实时荧光定量PCR(RT-qPCR)实验以GAPDH基因作为内参基因,染色质免疫共沉淀实时荧光定量PCR(ChIP-qPCR)实验以对照基因组DNA(input)为参照,并使用IgG 作为阴性对照。qPCR扩增得到循环阈值(Ct值)并采用2-ΔΔCt法计算基因相对表达水平。实验使用的qPCR引物见表1。qPCR 反应体系包括PCR Mix 10 μl、模板cDNA 3 μl、上下游引物各0.5 μl、ddH2O 6.0 μl。qPCR扩增条件为:95 ℃预变性30 s;95 ℃ 15 s、60 ℃60 s(收集荧光),40个循环。熔解曲线程序为:95 ℃30 s,55 ℃ 15 s,95 ℃ 15 s,每0.3 ℃采集一次荧光。

表1 RT-qPCR和ChIP-qPCR采用的引物序列Tab.1 The specific primers designed for RT-qPCR and ChIP-qPCR
1.2.8 Western blotting 检测KDM5C 调控蛋白的表达水平 按照1.2.6的方法分别对野生型CaSki细胞瞬时转染phage 和phage-KDM5C 质粒,同时对野生型CaSki 细胞瞬时转染NC-siRNA、KDM5C-siRNA1/2/3 48 h,然后使用0.25%胰酶消化并收集细胞,采用RIPA 裂解细胞并通过BCA 法测定蛋白浓度,选取40 μg 总蛋白样品沸水变性10 min。配制10% SDSPAGE 凝胶,电泳完成后将凝胶转移至PVDF 膜上,并用一抗封闭液室温封闭2 h,根据目标条带位置将PVDF膜裁剪后加入目标抗体(稀释比例均为1∶2000),4 ℃孵育过夜,洗膜3次,加入辣根过氧化物酶标记的山羊抗兔/鼠IgG(稀释比例为1∶4000),室温孵育2 h,TBST 洗涤后加入ECL 化学发光剂,在暗室中用X线胶片曝光,常规显影、定影,扫描照片。
1.2.9 ChIP-Seq 和ChIP 分析KDM5C 调控的基因中组蛋白甲基化的差异 ChIP实验步骤参考文献[12],采用H3K4me1和H3K4me3多克隆抗体按照实验步骤进行,使用IgG 做为抗体阴性对照,ChIP 免疫共沉淀的DNA 分别用于ChIP-Seq 和ChIP-qPCR 实验,其中ChIP-Seq测序和分析由诺禾致源公司完成,ChIPqPCR步骤参考1.2.7进行。
1.2.10 细胞增殖和迁移实验 细胞增殖实验采用CCK-8 法。96 孔板中分别接种Phage 组、Phage-KDM5C 组、KO-Vector 组及KO-KDM5C 组细胞,待生长密度达50%以上后使用CCK-8 试剂盒分别在0、12、24、36、48、72 h 于450 nm 波长处检测吸光度(OD)值,每组设6 个复孔,实验重复3 次。细胞迁移分析采用细胞划痕实验。6孔板中分别接种Phage、Phage-KDM5C、KO-Vector及KO-KDM5C组细胞,待生长密度达90%以上后使用200 μl 吸头进行细胞划痕,PBS 清洗后,各组细胞加入无血清培养基,置于37 ℃、5% CO2细胞培养箱中培养,分别于0、12、24、36 h在相差显微镜下拍照,观察KDM5C蛋白表达差异对细胞迁移的影响,使用ImageJ 软件测量划痕间距值。划痕间距相对比值(%)=(不同时间节点划痕间距值/0 h原始划痕间距值)×100%。实验重复3次。
1.2.11 蛋白的肿瘤表达差异分析和预后分析 使用GEPIA 网站 (http://gepia.cancer-pku.cn/detail.php)进行蛋白的肿瘤表达差异分析和预后分析,肿瘤类别选择宫颈癌(cervical and endocervical cancers,CESC),肿瘤和对应正常组织数据来源于癌症基因组图谱(The Cancer Genome Atlas,TCGA)。
1.3 统计学处理 采用SPSS 22.0 软件进行统计分析,GraphPad Prism 7.0 软件制图。数据均为计量资料,以±s 表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 RNA-Seq 数据产出情况汇总和mRNA 差异表达分析 RNA-Seq 数据的整体产出情况表明,无论是KDM5C 蛋白过表达组(phage-KDM5C)还是对照组(phage)样本过滤后的读取值(reads)占比均>96%,错误率非常低(0.01%),所有样品Q20值均>97.5%,Q30值均接近94%,送测样品测序生成的数据整体质量较好,符合转录组分析的相关要求,后续的生物信息分析均基于过滤后读数(Clean reads)的数据。通过分析得到过表达KDM5C 蛋白后差异显著的mRNA。差异表达的mRNA火山图如图1A所示,与对照载体比较,过表达KDM5C导致691个mRNA 的表达明显改变,其中356 个mRNA 表达显著上调,335 个mRNA 表达显著下调;差异表达转录本聚类分析如图1B 所示;与Hippo-YAP1 通路相关的差异表达mRNA如表2所示。

图1 差异mRNA表达组学分析Fig.1 Transcriptomics analysis of differential mRNA expression
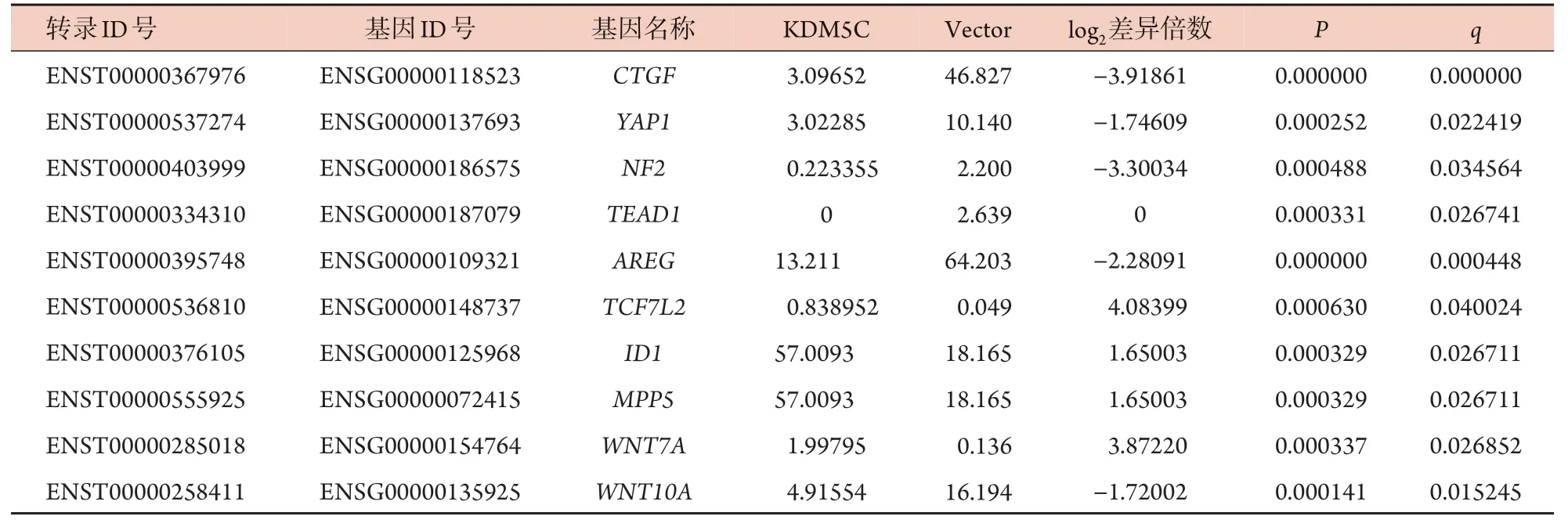
表2 Hippo-YAP1通路差异表达mRNA示例Tab.2 Examples of differentially expressed mRNAs in Hippo-YAP1 pathway
2.2 基因GO富集分析 GO富集分析结果显示,在生物学过程中,KDM5C蛋白的功能主要与各种生物体发育(如组织、系统、皮肤等)相关。在生物过程中,KDM5C 蛋白与单器官进程(single-organism process)相关性最高;在细胞组分层面,胞内(cytoplasm)、细胞器(organelle)和胞质部分(intracellular)的mRNA对KDM5C蛋白表达差异影响最为明显;在分子功能层面,KDM5C 功能与结合(binding)和蛋白结合(protein binding)密切相关(图2)。

图2 差异mRNA GO富集分析Fig.2 Differential mRNA GO enrichment analysis
2.3 KEGG 富集分析 KEGG 富集分析显示,KDM5C 蛋白功能与细胞黏附(cell adhesion)、甾类激素生物合成(steroid hormone biosynthesis)、沙门菌感染(salmonella infection)、凋亡(apoptosis)、FoxO 信号通路(FoxO signaling pathway)和Hippo-YAP1信号通路(Hippo-YAP1 signaling pathway)等相关(图3A)。Hippo-YAP1 信号通路及其相关蛋白的表达差异见图3B。
2.4 蛋白互作网络分析 应用STRING 蛋白质互作数据库各输入20 个表达明显上调或下调的mRNA,蛋白互作网络分析结果如图4 所示。尽管现有数据并未直接表明KDM5C 蛋白与YAP1 蛋白存在互作关系,但YAP1、EGFR 蛋白均可与NF2 因子结合,进而间接与KDM5C蛋白相互作用。
2.5 KDM5C蛋白对YAP1基因和蛋白表达的影响KDM5C蛋白过表达细胞系的RNA-Seq转录分布差异显示,高表达的KDM5C 蛋白可在转录水平降低YAP1基因的表达(图5A)。RT-qPCR 和Western blotting 结果显示,降低KDM5C 蛋白的表达可明显增强YAP1基因和蛋白的表达(P<0.05)(图5B、C),该趋势与已经被证实的EGFR基因一致[8],后者同样可被si-KDM5C诱导表达上调。此外,KDM5C基因敲低后也会导致YAP1蛋白的磷酸化增强(图5C)。

图5 KDM5C在转录和翻译水平对YAP1表达的影响Fig.5 KDM5C affects YAP1 expression at transcription and translation levels
2.6 KDM5C 蛋白对YAP1基因转录的影响 ChIPseq 分析显示,过表达KDM5C 蛋白可明显降低H3K4me3在YAP1基因转录起始区间的富集水平,而H3K4me1 则相反(图6A);ChIP-qPCR 也进一步证实了KDM5C 蛋白过表达可使H3K4me1 对YAP1和EGFR基因启动子的富集增强,而H3K4me3 对YAP1和EGFR基因启动子的富集作用则减弱(图6B、C,P<0.05)。
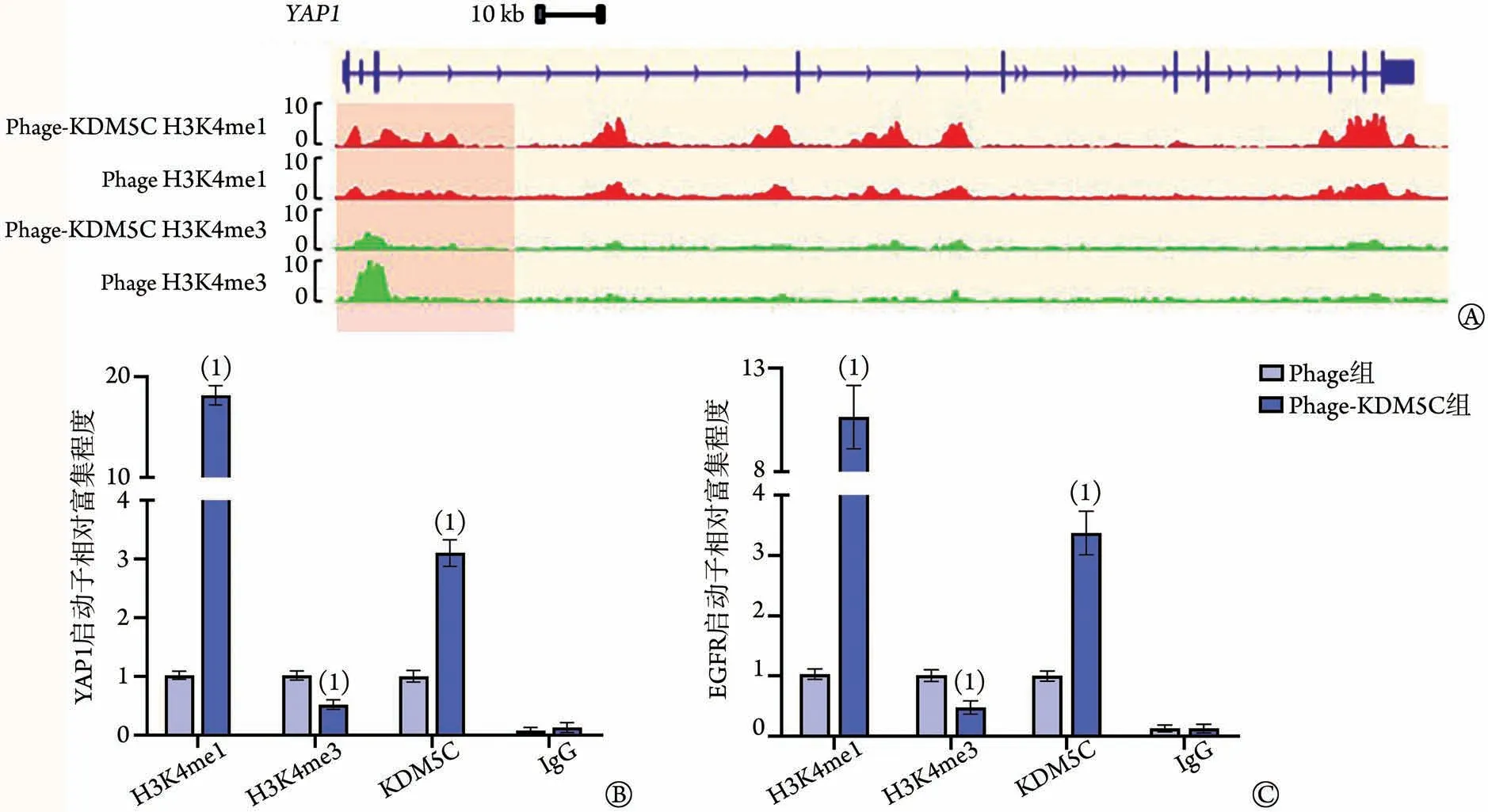
图6 KDM5C对YAP1基因启动子区间组蛋白甲基化修饰的影响Fig.6 KDM5C affects histone methylation modification in YAP1 gene promoter region
2.7 KDM5C蛋白对CaSki细胞迁移和增殖的影响细胞划痕实验结果显示,KO-KDM5C 组细胞的迁移速度明显高于KO-Vector 组和phage-KDM5C 组(图7A、B)。CCK-8 法检测结果显示,从36 h 开始,KO-KDM5C 组细胞的增殖活性明显高于phage-KDM5C组和KO-Vector组(P<0.05,图7C)。
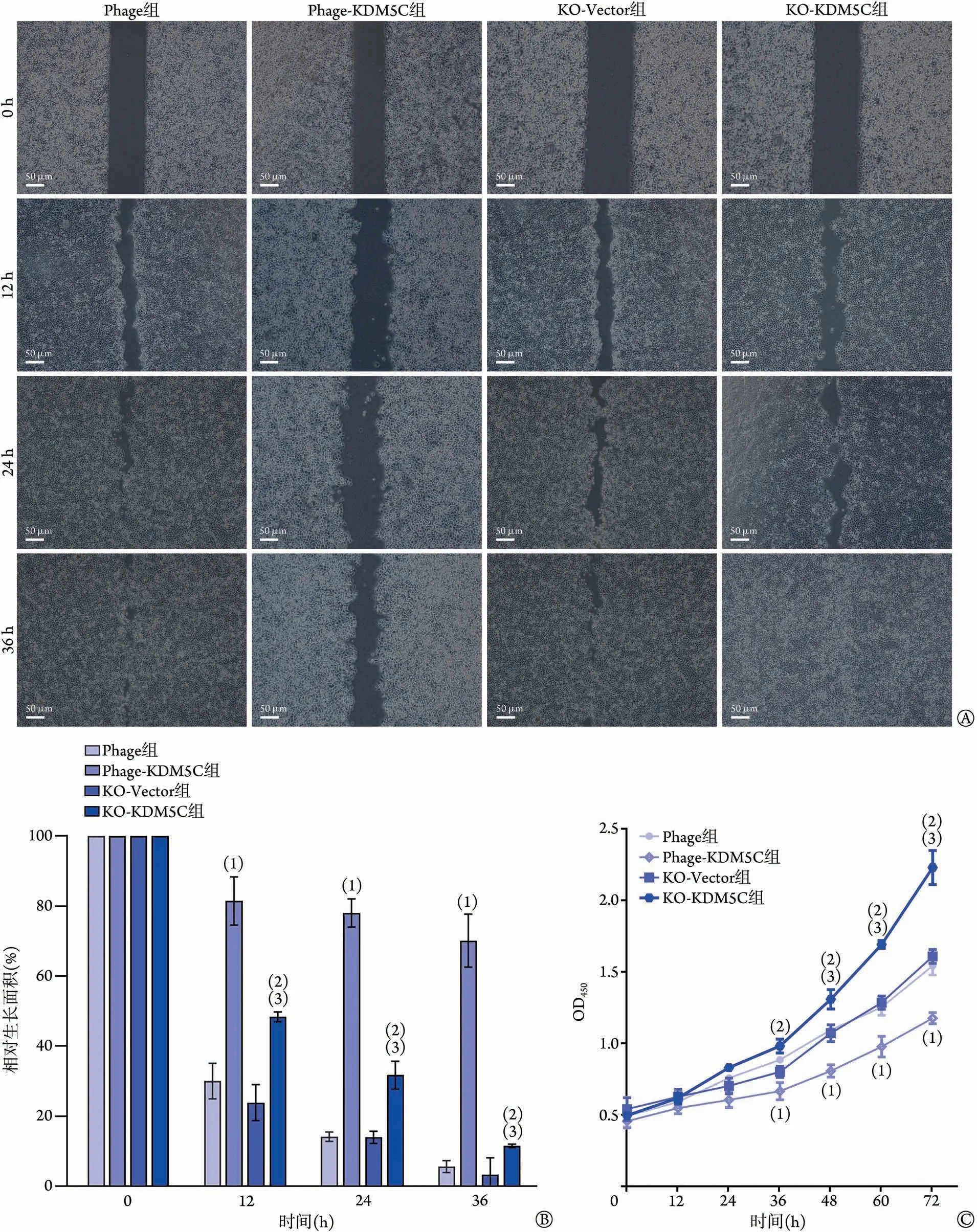
图7 KDM5C蛋白对CaSki细胞迁移和增殖的影响Fig.7 Effect of KDM5C protein to migration and proliferation of CaSki cells
2.8KDM5C、YAP1基因在肿瘤组织中的差异表达分析 对TCGA 数据库的数据进行分析显示,宫颈癌组织中YAP1基因的表达水平明显低于正常组织(P<0.05),但KDM5C基因的表达水平差异无统计学意义(图8A)。生存分析显示,KDM5C基因在前150个月对宫颈癌患者生存期的影响不明显,而在YAP1高表达时宫颈癌患者前100 个月的生存率有所降低(图8B)。

图8 KDM5C和YAP1基因在宫颈癌中表达和生存分析Fig.8 Expression and survival analysis of KDM5C and YAP1 genes in CESC
3 讨 论
宫颈癌是常见的妇科肿瘤,HPV16/18型高危病毒持续感染是其最主要的致病因素,此外,部分肺癌、口腔癌和肠癌等组织中也检测到HPV的致病因子存在,全世界约有4.8%的癌症与HPV相关。本课题组前期研究发现,高危型人乳头瘤病毒HPV16 E6通过降解KDM5C 激活原癌基因的超级增强子表达,进而促进宫颈癌的发生发展;同时还利用CaSki细胞的ChIP-Seq 和增强子RNA(eRNA) 分析描述了KDM5C 对超级增强子上H3K4me3/H3K4me1 的动态调控及HPV16 E6 与KDM5C 的相互作用[8]。本研究在此基础上,选择HPV16感染的宫颈癌细胞系CaSki进行KDM5C蛋白表达差异的蛋白质组学研究,以深入挖掘KDM5C蛋白在宫颈癌致瘤中的作用机制。
KDM5C 蛋白也被称为JARID1C 或SMCX,其基因位于人X 染色体上,编码一个含1560 个氨基酸残基的蛋白,其中Jmj N域是该蛋白行使去甲基化功能最重要的结构域。KDM5C 可特异性清除组蛋白第4位赖氨酸残基(H3K4)的第2位和第3位甲基[13-14],在转录调控中起核心作用。KDM5C在人类的大脑和骨骼肌组织中呈高表达,可参与细胞的多种生命活动,包括细胞的增殖、分化、迁移、侵袭和凋亡,与神经系统疾病和肿瘤(如肾癌、肝癌、乳腺癌和结肠癌等)的发生发展密切相关[15-18],其参与宫颈癌进程的分子机制正在深入研究中。本研究通过构建CaSki过表达KDM5C基因的稳转细胞系,进行了转录组学和染色质免疫共沉淀测序分析。在转录组学测序中,受KDM5C蛋白表达调控的基因总数为737个,其中mRNA 691 个,其他类型RNA 46 个,这些差异表达基因在染色体上基本呈均匀分布,未表现出明显的染色体分布差异。对691 个差异表达的mRNA 进行GO 富集分析发现,KDM5C 蛋白功能主要集中在生物体的组织、系统、皮肤和器官等发育上,与各种蛋白结合及结合调控相关。进一步行KEGG 分析发现,KDM5C 主要参与了包括细胞黏附、阿米巴感染、凋亡、FoxO信号通路和Hippo-YAP1信号通路等相关过程的调控,其中与黏着斑的相关性最强,而与肿瘤相关的调控主要集中在FoxO和Hippo-YAP1信号通路上。FoxO转录因子属于叉头蛋白家族,FoxO蛋白作为转录调节器发挥作用,并激活下游基因的转录,参与多种生物过程,包括细胞代谢、器官发育、应激反应和凋亡等[19]。Hippo-YAP1 信号通路激活导致MST1/2磷酸化并激活LATS1/2,后者迅速磷酸化YAP1 蛋白第127 位的丝氨酸残基,进而使其定位于细胞质并发挥生物学功能[20];而非磷酸化的YAP1则转位至细胞核,并与其他蛋白共同发挥转录共激活作用[21],从而促进细胞增殖并抑制细胞凋亡[22-23]。因此,YAP1通常也被视为原癌基因[24]。鉴于Hippo-YAP1 信号通路在肿瘤中的重要作用,本研究主要关注KDM5C 通过Hippo-YAP1 信号通路调控人宫颈癌发生的作用及其机制。
蛋白互作分析是研究蛋白功能的重要手段,STRING 网站显示与KDM5C 互作的蛋白并不多见,现有的研究数据并不能直接证实KDM5C 与YAP1 直接相关,其原因可能与目前关于KDM5C蛋白的研究偏少有关,但本研究蛋白互作分析显示,KDM5C与YAP1 可同时结合神经纤维瘤病蛋白 2(neurofibromatosis type 2,NF2)。本课题组前期研究发现,受KDM5C 蛋白调控的表皮生长因子受体(EGFR)同样可结合NF2蛋白,后者作为肿瘤抑制因子,其本身也属于Hippo-YAP1 通路的一员[25],同样可参与黏着斑的调节过程[26]。最新研究发现,Hippo-YAP1通路的蛋白受黏着斑分子的调控,YAP1蛋白也控制着整合素和黏着斑对接蛋白编码基因的活性,因此,调节YAP1基因的转录活性可改变细胞力学、作用力发展和黏附强度,并决定细胞的形状、迁移和分化[27]。以上结果进一步提示KDM5C 与YAP1 蛋白及Hippo-YAP1 通路相关。此外,本研究KDM5C 蛋白过表达的转录组测序表明,YAP1基因外显子区间的表达相较于对照组明显下调。为了进一步证实该结论,本研究额外设计了3 条针对KDM5C基因的特异siRNA 来降低其表达水平,RTqPCR和Western blotting 检测结果显示,降低KDM5C基因的表达可上调YAP1基因和蛋白的表达。YAP1蛋白在体内通常有磷酸化和非磷酸化两种形式,敲低KDM5C基因可同时上调磷酸化和非磷酸化YAP1蛋白的表达。但本研究发现,外源性过表达的KDM5C 蛋白并不能降低YAP1 蛋白的磷酸化水平,具体原因可能与细胞瞬时转染导致的细胞刺激相关,有待于进一步研究来阐明。
组蛋白的表观遗传学修饰是调控基因转录的重要方式,过表达KDM5C 蛋白可通过降低H3K4me3水平而抑制特定基因的转录。本研究采用的染色质免疫共沉淀测序结果表明,KDM5C 蛋白可影响H3K4me1 和H3K4me3 在YAP1基因启动子的结合水平,进一步采用的染色质免疫共沉淀qPCR也证实了该结论,提示KDM5C 蛋白对YAP1的作用主要是通过动态调控该基因启动子的组蛋白甲基化水平,进而影响YAP1基因的转录和翻译。因此,KDM5C 蛋白表达下调会导致YAP1 蛋白入核,入核的YAP1 蛋白可调控一系列肿瘤相关因子表达上调,进而促进肿瘤细胞的增殖和迁移。HPV16 感染后,宫颈细胞的KDM5C 蛋白表达下调[8],进而促进YAP1、EGFR和c-MET等原癌基因的表达上调,最终导致宫颈癌的发生发展。以上结论在癌症基因组图谱数据库中也得到了证实。然而,尽管KDM5C基因表达水平在宫颈癌组织中有下降趋势,但并无统计学意义,可能与宫颈癌中包括了HPV 感染和非感染类型,而KDM5C蛋白在HPV16感染阳性的宫颈癌中表达下调更为明显有关[8]。宫颈癌组织中YAP1基因的表达水平较正常宫颈组织明显降低,提示YAP1基因的调控机制不仅仅是通过KDM5C蛋白影响其启动子甲基化状态这一种途径。尽管如此,KDM5C 和YAP1 蛋白对宫颈癌患者生存期的影响并不是十分明显,提示了肿瘤发生发展的复杂性。
综上所述,本研究基于转录组学和染色质免疫共沉淀等分析方法证实,KDM5C蛋白可通过动态改变YAP1基因启动子的组蛋白甲基化修饰,在转录和蛋白水平影响YAP1 的表达;YAP1 蛋白的表达变化导致Hippo-YAP1 信号通路改变,进而影响宫颈癌的发生发展。本研究不仅为高危HPV阳性宫颈癌的诊断、预后评估和治疗提供了新的线索,而且为研究基因环境互作如何影响宿主细胞功能而导致肿瘤发生提供了新思路。但本研究也存在不足之处:对YAP1蛋白的研究仅基于细胞层面,缺乏在宫颈癌实体瘤和动物模型中的实验验证;过表达KDM5C蛋白并不能降低YAP1蛋白的磷酸化水平,具体原因尚待深入分析;尽管YAP1 是Hippo-YAP1 信号通路的核心蛋白,但该通路其他辅助蛋白尚待进一步研究。此外,本研究发现,KDM5C 与黏着斑的相关性最高,在介导细胞的黏着连接中具有重要的调节作用,后期将深入开展其机制研究。
