热打击单核细胞来源外泌体中miR-155 对肝细胞炎症的影响及其机制
2023-10-18张明李悦杨经文施学智肖吉彪童华生
张明,李悦,杨经文,施学智,肖吉彪,童华生*
1广州医科大学附属第六医院/清远市人民医院重症医学科一区,广东 清远 511500;2解放军南部战区总医院重症医学科/全军热区损伤与组织修复重点实验室,广东 广州 510010
随着全球气候变暖,重症中暑的发病率、致残率及病死率在全世界范围内居高不下[1]。中暑诱发的肝功能障碍是其最严重的并发症,目前尚无有效的干预措施。目前中暑导致肝损伤的机制尚不明确,主流观点认为,重症中暑的本质是热刺激引发的、能导致患者器官功能障碍的炎症损伤性疾病[2]。
中暑炎症反应传导至肝脏并致病的具体机制仍然是中暑相关研究的技术难题[3]。作为炎性介质的重要来源,单核巨噬细胞可在免疫相关疾病中发挥促炎作用,它们分泌的外泌体是一种胞外囊泡,其内含物主要包括蛋白、微RNA(microRNA,miRNA)等,能够在细胞与组织之间传导生物学信号而介导炎症反应[4]。本课题组前期研究发现,外泌体可能在中暑后炎症传导过程中导致肝脏细胞发生损伤[5],且外泌体内包含的miRNA 也能够参与肝细胞炎症反应[6],
提示源自单核细胞的外泌体及其内含miRNA 可能参与了包括肝脏损伤在内的中暑炎症损伤过程。乌司他丁作为一种临床常用的抑制炎症反应的药物,可控制重症中暑后的炎症反应,联合其他治疗方式还能降低多器官衰竭及死亡的发生率[7-8],但其具体的作用机制仍未明确。本研究旨在探讨热打击后单核细胞来源外泌体内miRNA 的变化及其对肝细胞的作用,以及乌司他丁作为干预药物对肝细胞炎症损伤的影响。
1 材料与方法
1.1 主要试剂及材料 THP-1、HepG2 细胞系购自中国科学院典型培养物保藏委员会细胞库。ExoQuick外泌体提取试剂盒购自美国SBI公司;谷丙转氨酶(ALT)检测试剂盒购自中国南京建成工程研究所,乳酸脱氢酶(LDH)、细胞计数CCK-8 试剂盒及荧光素酶检测试剂盒购自中国上海碧云天生物技术公司。RNA 提取试剂盒、反转录试剂盒、实时荧光定量聚合酶链反应(RT-qPCR)试剂盒购自日本TaKaRa 公司。细胞因子信号传导抑制分子1(SCOS1)、核因子κB(NF-κB)、β-肌动蛋白(β-actin)抗体购自美国Abcam 公司。转染试剂Lipofectamine 3000 购自美国Invitrogen 公司。miR-155 模拟物、抑制剂、siRNA、阴性对照均购自中国吉玛基因公司。乌司他丁购自广东天普生化医药股份有限公司。
1.2 单核细胞热打击方案 将处于指数生长期的THP-1细胞培养在37 ℃、含5% CO2及10%去外泌体血清的培养基中,分为对照组、热打击组、乌司他丁组。热打击开始后,对照组细胞持续培养于37 ℃环境,热打击组及乌司他丁组在43 ℃敷箱中打击1 h,再转移至37 ℃环境复温9 h。乌司他丁组在热打击前,添加乌司他丁(5000 U/ml)至细胞上清中,余操作同热打击组。
1.3 外泌体刺激受体肝细胞 收集各组单核细胞上清,采用ExoQuick 外泌体提取试剂盒在同样条件下提取外泌体,操作过程严格按照说明书进行。在体外培养的肝细胞系HepG2上清中,分别加入对照组、热打击组及乌司他丁组单核细胞来源的外泌体样本10 μg,作用24 h。
1.4 RT-qPCR法检测外泌体及肝细胞内相关miRNA及mRNA 的表达 采用RT-qPCR 试剂盒提取THP-1及HepG2细胞总RNA,采用外泌体RNA提取试剂盒提取各组外泌体的全部RNA,使用加尾法反转录试剂盒完成miRNA 反转录,再进行qPCR 反应,引物序列见表1,以U6及GAPDH基因作为内参照,计算外泌体及肝细胞内相关miRNA 及mRNA 的相对表达量,结果用2-ΔΔCt法进行相对定量分析。

表1 基因引物序列Tab.1 The primer sequences in the study
1.5 肝细胞上清ALT、LDH水平及肝细胞存活率检测 采用比色法检测肝细胞上清ALT、LDH 水平;采用CCK-8法检测肝细胞存活率。
1.6 数据库预测miR-155 靶基因 使用TargetScan、PicTar 及miRWalk 数据库检索miR-155 的潜在靶基因并取交集。
1.7 双荧光素酶报告基因检测miR-155 靶基因 采用荧光素酶报告基因检测系统构建插入野生型SOCS1 3'-UTR 序列的pGL3 质粒,转染pGL3-luc-SOCS1 质粒到293T 细胞并接种于96 孔板。24 h 后,按照试剂盒操作流程,加入miR-155模拟物及其阴性对照各5 pmol,检测荧光素酶活性。
1.8 Western blotting检测SCOS1、NF-κB及β-actin蛋白表达 收集经外泌体刺激的各组肝细胞并提取总蛋白,采用BCA法测定蛋白浓度后,常规行SDS-PAGE凝胶电泳及PVDF 膜转印,检测SCOS1、p-NF-κB及β-actin蛋白表达水平。
1.9 肝细胞炎性因子TNF-α 及IL-6 mRNA 表达检测设立对照组、miRNA-155 抑制剂组、siSCOS1 组以及miRNA-155 抑制剂+siSCOS1 组,采用Lipofectamine 3000转染试剂,按试剂盒说明书方法分别将miRNA-155抑制剂、siSCOS1以及miRNA-155抑制剂+siSCOS1转染入HepG2 肝细胞;将miR-155 模拟物和miRNA对照转染到43 ℃热打击1 h 的HepG2 肝细胞。采用RT-qPCR检测TNF-α及IL-6 mRNA表达,方法同1.4。
1.10 统计学处理 采用SPSS 20.0 软件进行统计分析。计量资料先经Kolmogorov-Smirnov检验是否符合正态分布,正态分布的变量以x±s表示,两组间比较采用独立样本t检验,多组间比较采用方差分析,组间进一步两两比较采用Bonferroni 方法。P<0.05 为差异有统计学意义。
2 结 果
2.1 热打击单核细胞来源外泌体对肝细胞的影响与对照组相比,热打击组肝细胞上清中ALT、LDH水平升高(P<0.01),肝细胞存活率降低(P<0.05),肝细胞内TNF-α及IL-6mRNA 水平升高(P<0.01);而与热打击组比较,乌司他丁组ALT、LDH 水平降低(P<0.01),肝细胞存活率升高(P<0.05),TNF-α及IL-6mRNA水平降低(P<0.01,图1)。
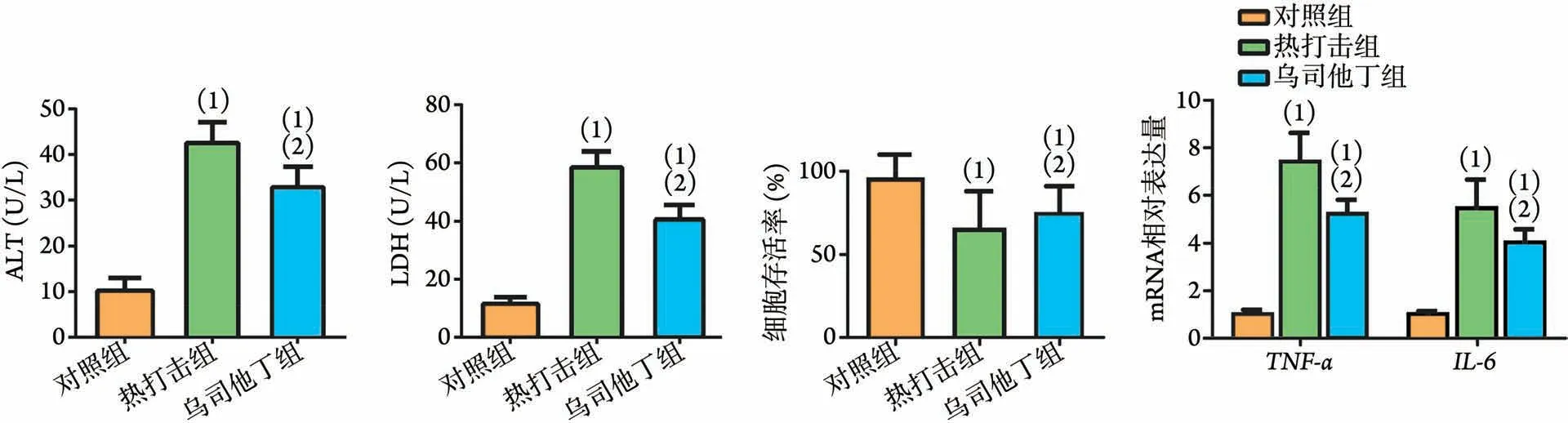
图1 热打击单核细胞来源外泌体对肝细胞的影响Fig.1 The effect of the exosomes derived from monocytes on liver cells
2.2 热打击单核细胞来源外泌体miR-155含量变化与对照组相比,热打击组单核细胞及其来源外泌体中miR-155 水平均明显增高(P<0.01);乌司他丁组单核细胞及其来源外泌体中miR-155水平与热打击组比较则明显降低,差异有统计学意义(P<0.01,图2)。

图2 单核细胞及其来源外泌体内miR-155水平Fig.2 The expression of miR-155 in the monocytes and the exosome derived from monocytes
2.3 miR-155的潜在作用靶点分析及验证 数据库检索发现,SOCS1是miR-155的潜在靶点(图3A)。双重荧光素酶报告基因检测结果显示,采用miR-155模拟物干预后,荧光素酶活性明显下降(P<0.01,图3B)。Western blotting结果显示,与对照组相比,热打击组肝细胞内SOCS1 蛋白表达水平下降,p-NF-κB 蛋白表达水平增高(P<0.05),而乌司他丁组SOCS1 蛋白表达水平高于热打击组,p-NF-κB蛋白表达量低于热打击组(P<0.05,图3C)。

图3 miR-155通过靶向SOCS1调控肝脏炎症反应Fig.3 miR-155 regulates the inflammatory damage of liver cells in a SOCS1-dependent manner
RT-PCR 结果显示,与对照组比较,miRNA-155抑制剂组肝细胞内TNF-α与IL-6mRNA 表达水平下降,siSOCS1组上升,miRNA-155抑制剂+siSCOS1组下降,差异有统计学意义(P<0.05,图3D)。
2.4 热打击单核细胞通过外泌体传递miR-155 对肝细胞的影响 转染miR-155抑制剂的单核细胞在热打击后释放的外泌体,能使其孵育的肝细胞TNF-α和IL-6mRNA 表达下降(P<0.05);孵育来自热打击组单核细胞外泌体的肝细胞,转染miR-155抑制剂能使其TNF-α和IL-6mRNA 表达下降(P<0.05)。相反地,转染miR-155模拟物到经热刺激的肝细胞后,肝细胞内TNF-α和IL-6mRNA表达均增加,差异有统计学意义(P<0.01)(图4)。

图4 热打击单核细胞通过内含miR-155影响肝细胞炎症反应Fig.4 The monocytes stimulated by heat stress affect hepatocyte inflammation by exosome containing miR-155
3 讨 论
单核细胞具有启动并级联放大炎症反应的作用,是机体免疫防御系统的重要组成部分。然而,在病理状态下,单核细胞介导的炎症反应也参与了介导组织脏器的损害[9-10]。在中暑这种同样属于炎症反应损伤靶器官的疾病中,目前也有单核细胞被激活的证据[11]。另外,作为一种胞外囊泡,外泌体携带的内含物介导了细胞间的信号传递,影响了免疫细胞和脏器实质细胞之间的功能互作[4]。本研究团队曾发现,外泌体内含物改变促进了中暑疾病炎症反应的进程[12]。值得注意的是,单核细胞活化后释放外泌体调控下级炎症反应的现象也很普遍,并被认为是疾病潜在治疗靶点之一[13]。但是在中暑研究领域,单核细胞外泌体的功能仍未被重视。为了观察单核细胞外泌体在热打击过程中的作用,本研究首先观察了这些外泌体对实质细胞——肝细胞的影响,发现热打击后单核细胞存在炎症相关基因表达的变化,并伴随着其来源外泌体内含调控基因的变化,进而影响了孵育的肝细胞,使其在存活率、炎症损伤方面发生改变。提示受到热刺激的单核细胞可能通过外泌体激活附近实质细胞的炎症反应。
为了初步了解单核细胞外泌体改变肝细胞的原因,本研究首先尝试观察了外泌体miRNA 的表达变化。miRNA 是一类非编码单链小RNA,主要通过抑制靶基因的表达来发挥调控作用。研究发现,包括单核细胞在内的免疫细胞能通过介导miRNA 表达,参与至少60种疾病的致病过程,同时,外泌体能够携带、传递miRNA 到达靶细胞,具有稳定、高效等特点[14]。miR-155是一种被广泛研究的miRNA,可通过NF-κB 通路快速形成正反馈调节环路,活化炎症通路[15]。有研究表明,免疫细胞来源的miR-155会在炎症激活后,随着释放的微囊泡扩散,进而调控靶细胞微环境及炎症状态[16]。相似的,本研究也发现,热刺激后的单核细胞miR-155明显上调,并通过外囊泡传递增加靶细胞内miR-155水平,伴随了下游肝细胞炎症损伤。使用miR-155抑制剂等药物能缓解这一过程,与前人的研究结论类似。当然,外泌体内含物的改变是复杂多变的,本研究和很多类似研究都不能完全排除外泌体内其他miRNA 或成分对靶细胞的影响,这也是本研究的不足。
SOCS1 是细胞因子信号转导抑制因子(SOCS)蛋白家族成员,其典型特征是可变长度的N 端区域,一个中心SH2 结构域及一个C 端保守的SOCS 框[17]。大量研究证实,SOCS1 是细胞内抑制炎症发展的关键成分之一,除了直接与Jak 的结合、抑制JAK/STAT 通路以外,还能结合下游NF-κB 的p65 亚基、抑制TLR 信号通路,发挥炎症抑制作用[18-19]。不仅如此,早有学者通过生物信息学方法分析、实验验证,证实了SOCS1 与miR-155 的靶向关系:miR-155作为转录后调节因子,能促进靶基因SOCS1 mRNA降解,进而促进炎症反应[20]。基于这些研究成果,本研究通过数据库检索、双荧光素酶、Western blotting 等,再次验证了miR-155 和SOCS1 的靶向关系,即验证了miR-155 与SOCS1 基因的结合位点,以及随着肝细胞内miR-155的变化,SOCS1呈下调趋势等。另外,SOCS1 通路下游的NF-κB 是很多炎症相关基因的转录激活因子,本研究也发现,随着SOCS1 的下调,NF-κB 表达明显增加,这可能是炎症基因活化的机制。由此综合分析,热打击的单核细胞可能通过外泌体传递miR-155,介导靶细胞SOCS1转录调控进而发挥促炎作用。
乌司他丁作为一种尿胰蛋白酶抑制剂,是临床上可获得的非特异性的抗炎药物,能改善包括脓毒症在内的炎症性疾病患者的预后,且仍有进一步拓宽临床适应证的价值和趋势[21-22]。现今,炎症调控治疗在类似脓毒症的中暑疾病里,也受到持续关注[7-8]。鉴于在活体内使用特异性抗炎药物的方案仍处于理论研究阶段,非特异性的抗炎药物乌司他丁在中暑治疗中的临床价值亟待更深入的探索。为了初步在体外证实乌司他丁干预免疫细胞对炎症反应的潜在影响,本研究使用乌司他丁作为干预单核细胞的治疗药物,结果显示,乌司他丁能缓解单核细胞表达和释放炎症性miR-155。这种外泌体在作用于实质细胞后,无论是在炎性因子的表达,还是炎症通路的蛋白方面,都表现出炎症缓解的表型。当然,本研究未对乌司他丁调控miRNA 的具体机制进行分析,借鉴前人的研究结论推测,这种效果可能是通过抑制生成miR-155的转录因子实现的[15,23]。
综上所述,热打击能刺激单核细胞促进肝细胞炎症性损伤,这可能是通过释放外泌体miR-155靶向肝细胞内SOCS1 实现的。使用乌司他丁可能抑制热打击单核细胞释放外泌体miR-155,从而发挥潜在抑炎作用。
