Sdf1-Cxcr4信号在斑马鱼后侧线系统发育中的作用❋
2023-10-18周董华王承昊范纯新
周董华 , 王承昊, 范纯新❋❋
(1. 上海海洋大学 国家海洋生物科学国际联合研究中心, 上海 201306; 2.上海海洋大学 水产种质资源发掘与利用教育部重点实验室, 上海 201306)
侧线系统为鱼类和两栖类所特有,由广泛分布于体表的感觉器官神经丘构成。侧线系统对于鱼类水下生活极为重要,参与鱼类的避敌、捕食、群游和洄游等行为[1]。成鱼侧线感受器的分布模式具有显著的多样性,为鱼类适应不同的水流环境提供结构基础[2-4]。但是,目前对于鱼类侧线系统分布模式形成的机制知之甚少。
斑马鱼(Daniorerio)作为模式生物,在其后侧线系统发育研究中取得了许多进展,对于理解鱼类侧线发育调控机制和模式形成起到重要作用。斑马鱼后侧线系统源自于耳后的后侧线基板(Posterior lateral line placode)。受精后约20 h时,在侧线基板上特化形成初级后侧线原基(Prim-Ⅰ),并延水平肌隔向尾部迁移,于受精后约40 h抵达尾部。原基在迁移路径上留下少量细胞形成神经丘前体(Proto-neuromast),进一步分化为神经丘,排布形成体侧中线。在初级原基迁移过程中(受精后约36 h),后侧线基板又形成次级原基,包括Prim-Ⅱ和Prim-D。Prim-Ⅱ沿水平肌隔迁移,Prim-D向背侧迁移形成背线。从约受精后3周开始,位于体侧中线和背线上的神经丘开始向腹侧迁移,同时在原有神经丘间形成新的间生神经丘(Intercalary neuromast),在仔稚鱼转换期产生躯干上的4条线。在发育至受精后2个月左右,躯干上的部分神经丘开始向周围迁移出部分细胞,由这些细胞增殖分化形成一些附属神经丘,因其排列致密成串,称为针脚神经丘(Stitches neuromast)[5]。综上,斑马鱼的后侧线系统发育存在多个细胞迁移过程。
Sdf1-Cxcr4信号在胚胎发育、免疫细胞动员和癌细胞转移等多种细胞迁移过程中发挥重要作用。Sdf1又称为Cxcl12,为趋化因子,其受体包括两类G蛋白偶联受体:Cxcr4和Cxcr7。当Cxcr4结合Sdf1时,通过G蛋白激活胞内多种信号通路引起迁移、增殖和炎症相关基因的表达[6-7],当Cxcr7结合Sdf1时,不会激活典型的趋化反应,Cxcr7和Sdf1同时内化,抑制Sdf1-Cxcr4信号[8]。David等[9]和Valentin[10]发现初级侧线原基的迁移受到Sdf1-Cxcr4信号的调控。
PLLs发育的第一步是Prim-Ⅰ沿着水平肌间隔迁移,该过程由Sdf1/Cxcr4信号的梯度浓度驱动[11]。Sdf1同Cxcr7的亲和力几乎是同Cxcr4的10倍[12]。Cxcr7可以降低Sdf1的胞外浓度,使Sdf1浓度保持在最佳水平,从而形成细胞迁移所需的趋化因子梯度[13]。斑马鱼的sdf1a在水平肌间隔的尾部表达,cxcr4b表达在迁移侧线原基的引导区,cxcr7b表达于迁移侧线原基的尾随区。但是,斑马鱼后侧线发育过程中其他的细胞迁移事件是否也受Sdf1-Cxcr4调控尚不清楚。有研究表明,过表达cxcr7b可以沉默斑马鱼后侧线Prim-Ⅰ中后部的sdf1a信号活性,而敲除或敲降sdf1a或cxcr4b会抑制侧线Prim-Ⅰ的迁移[14]。本研究中,通过构建热激启动子控制的过表达cxcr7b转基因斑马鱼发现,在不同时间点过表达cxcr7b抑制了Sdf1-Cxcr4信号,检测出过表达cxcr7b对Prim-Ⅰ和Prim-Ⅱ迁移、神经丘腹侧迁移、间生神经丘形成和针脚神经丘形成的影响,为理解鱼类侧线系统发育调控机制奠定基础。
1 材料与方法
1.1 材料
实验用鱼为AB品系野生型斑马鱼和ET(gata2:EGFP)189b(简称ET189b) 斑马鱼[15]养殖于上海海洋大学海洋生物系统和神经科学研究所。鱼房环境温度为26~28 ℃,光周期明∶暗=14 h∶10 h。按照成鱼雌、雄比例1∶1进行交配产卵,获得的胚胎用蓝水(0.3 g/L红海盐和1 mg/L亚甲基蓝)培养于28.5 ℃培养箱中。所有鱼类的实验均符合上海海洋大学动物伦理委员会的规定。质粒pTol2-hsp70l-Tnfrsfa-P2A-mCherry为实验室前期构建,含Tol2转座酶的质粒pCS2-TPase来自美国国立卫生研究院(NIH) Shawn Burgess实验室。引物由安升达公司合成。
1.2 整体胚胎原位杂交
整体原位杂交实验参考文献[16]中的流程。野生型斑马鱼受精后32 h胚胎和受精后72 h仔鱼经 4% 多聚甲醛(PFA) 于4 ℃过夜进行固定,第二天使用甲醇梯度脱水后保存于-20 ℃。保存过的样品首先经过含吐温20的磷酸缓冲液(PBST) 梯度复水,其次用 10%过氧化氢溶液脱色至胚胎黑色素消失,然后用不含反义探针的杂交液于70 ℃孵育样品4 h,后加入含反义探针的杂交液于70 ℃孵育过夜。样品依次经过漂洗、封闭、抗体孵育和漂洗等步骤,最后用NBT/BCIP stock solution (Roche)在室温下显色。显色完成后,使用4% PFA 终止显色反应,再用PBST 多次漂洗后置于 100%甘油中避光保存,最后用光学显微镜(Nikon)观察并拍照。
1.3 质粒pTol2-hsp70l:cxcr7b-P2A-mCherry的构建
以受精后4 d 的野生型斑马鱼cDNA为模板,用引物Cxcr7b-ORF-F和Cxcr7b-ORF-R (见表1)扩增得到cxcr7b的开放阅读框作为插入片段;以质粒pTol2-hsp70l-Tnfrsfa-P2A-mCherry为模板,用引物Cxcr7b-VEC-F和Cxcr7b-VEC-R (见表1)扩增得到载体骨架,并使插入片段和载体骨架两末端具有一致的同源序列。根据ClonExpress ⅡOne Step Cloning Kit (Vazyme)说明书中的方法进行同源重组连接,将目的片段定向克隆至载体的同源位点,将新重组质粒转化E.coliDH5α感受态细胞(Vazyme),然后提取质粒,送上海生工测序得到重组质粒pTol2-hsp70l:cxcr7b-P2A-mCherry(见图1)。
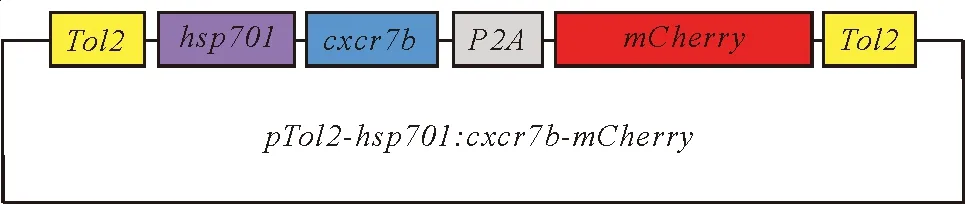
图1 质粒图谱

表1 基因引物信息
1.4 Tol2转座酶mRNA的体外转录
用限制性内切酶XbaⅠ(Thermo Fisher Scientific) 酶切质粒pCS2-TPase。以线性化的pCS2-TPase质粒DNA作为模板,采用SP6 mMessage mMachine kit (Ambion)试剂盒进行体外转录合成Tol2 转座酶mRNA。转录出的Tol2 转座酶mRNA由Quick-RNA MicroPrep Kit (ZYMO RESEARCH)纯化回收。
1.5 建立Tg(hsp70l:cxcr7b-P2A-mCherry)转基因鱼
显微注射前一天晚上将AB斑马鱼按照雌、雄比例1∶1放入孵化盒中,用隔板将雌雄分开。第二天早晨抽去隔板,斑马鱼产卵后收集鱼卵,用于显微注射。配制质粒pTol2-hsp70l:cxcr7b-P2A-mCherry和 Tol2转座酶mRNA混合液(使每1 μL混合液里含有25 ng质粒和50 ng Tol2转座酶 mRNA)。将混合液注射至1-细胞期胚胎的胞质,注射剂量为1.4 nL/枚。将经过注射的F0胚胎养至性成熟,并与AB进行杂交。选择其后代胚胎热激后具有红色荧光的F0作为建立者(Founder),并将带有红色荧光的胚胎养至性成熟,以作为Tg(hsp70l:cxcr7b-P2A-mCherry)稳定遗传的转基因个体。
1.6 热激过表达cxcr7b
将cxcr7b和ET189b转基因斑马鱼进行交配,获得的胚胎培养在蓝水中。在受精后18 h筛选具有绿色荧光的胚胎,并将这些胚胎分为5组,每组约50颗受精卵,然后按照表2中的时段进行热激(每间隔12 h,39 ℃热激1 h,然后转至28.5 ℃培养)。完成热激后,在相应的时间点在荧光倒置显微镜 (Zeiss, Axio Observer)的GFP通道下,对后侧线原基所处体节的位置、神经丘数量和神经丘距离水平肌节的距离进行拍照和测量。同时,在DsRed通道下根据红色荧光确定每条鱼是否带有cxcr7b转基因,带有红色荧光的作为实验组,而不带红色荧光的作为对照组。

表2 实验设计
1.7 数据统计分析
每个实验的实验组和对照组样本量都大于10。使用蔡司公司的ZEN软件分别对迁移距离和神经丘数量进行测量和计数,将所得的数据输入至Graphpad prism 7软件,以对每个实验的实验组和对照组数据使用t-检验来分析数据间差异性,其中p<0.05(用*表示)和p<0.000 1(用****表示)分别表示差异显著和差异极显著。显示迁移距离的柱状图也是由Graphpad prism 7 软件生成的。
2 结果
2.1 cxcr4b和sdf1a分别表达于迁移中的后侧线原基和水平肌间隔
受精后32 h是斑马鱼后侧线Prim-Ⅰ和PrimⅡ的迁移时间,受精后72 h是斑马鱼后侧线Prim-D的迁移时间。本研究利用整体原位杂交技术,检测了cxcr4b和sdf1a在受精后32 h胚胎和在受精后72 h仔鱼中的表达定位。结果显示:在受精后32 h,cxcr4b在整个Prim-Ⅰ中高表达,且在Prim-Ⅰ引导端的表达强于后随端(见图2A)。sdf1a主要表达在水平肌隔尾部,且沿着头部向尾部方向逐渐提高(见图2C)。在受精后72 h,cxcr4b的表达则集中在Prim-Ⅱ和Prim-D(见图2B);sdf1a主要表达在水平肌隔的前端和躯干的背侧(见图2D)。由此可见,cxcr4b和sdf1a分别表达于迁移中的后侧线原基和水平肌间隔。
2.2 过表达cxcr7b对Prim-Ⅰ迁移的影响
为了检测Sdf1-Cxcr4信号在后侧线Prim-Ⅰ迁移中的作用,本文作者构建了cxcr7b转基因鱼,通过热激过表达cxcr7b,进而抑制Sdf1-Cxcr4信号。结果表明:热激后的cxcr7b转基因胚胎同野生型在外观形态上没有明显的差异。在ET189b背景下,本文作者观察到野生型的Prim-Ⅰ在32 h迁移至躯干第(9.750 0±0.217 6)个体节,在受精后48 h迁移至尾部末端。但在cxcr7b转基因个体中Prim-Ⅰ在受精后32 h仅迁移至第(4.083 0±0.193 0)个体节,差异显著(p<0.000 1) (见图3A、C);在受精后48 h仅迁移至第(10.000 0±0.492 4)个体节,差异显著(p<0.000 1) (见图3B、D)。基于Prim-Ⅰ所处体节位置,定量分析显示cxcr7b转基因个体Prim-Ⅰ的迁移显著慢于野生型Prim-Ⅰ的迁移。
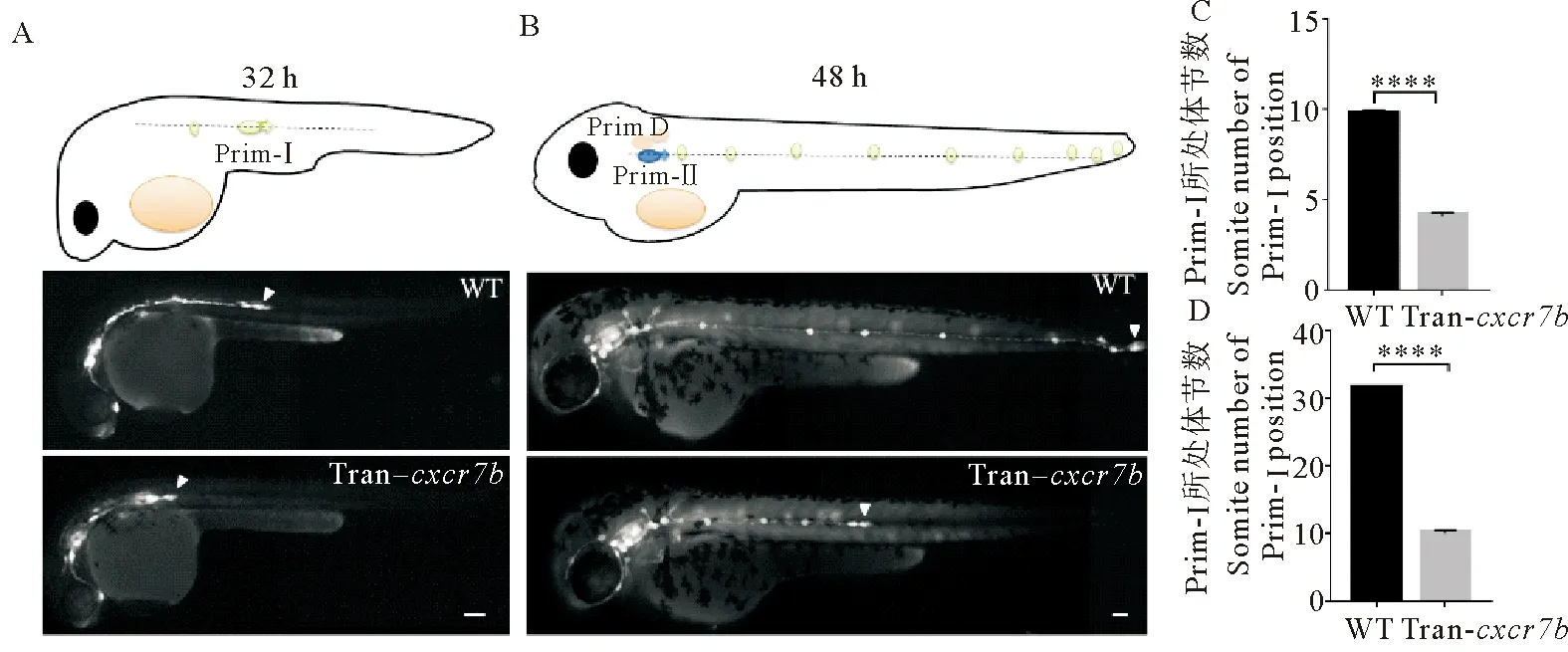
(A:野生型和cxcr7b转基因斑马鱼在受精后32 h Prim-Ⅰ所处位置。B:野生型和cxcr7b转基因斑马鱼在受精后48 h Prim-Ⅱ所处位置。比例尺=100 μm。C:野生型和cxcr7b转基因斑马鱼在受精后32 h Prim-Ⅰ所处体节数定量分析。D:野生型和cxcr7b转基因斑马鱼在受精后48 h Prim-Ⅰ所处体节数定量分析。: p <0.000 1。WT: 野生斑马鱼。 Tran-cxcr7b: cxcr7b转基因斑马鱼。A: The position of Prim-Ⅰ in wild-type and cxcr7b transgenic zebrafish at the 32 h post-fertilization. B: The position of Prim-Ⅱ in wild-type and cxcr7b zebrafish at 48 h post-fertilization. Scale bar=100 μm. C: The quantification analysis of the position of Prim-Ⅰ in wild-type and cxcr7b transgenic zebrafish at 32 h post-fertilization. D: The quantification analysis of the position of Prim-Ⅰ in wild-type and cxcr7b transgenic zebrafish at 48 h post-fertilization. : P <0.000 1. WT: Wild-type zebrafish. Tran-cxcr7b:cxcr7b transgenic zebrafish. )
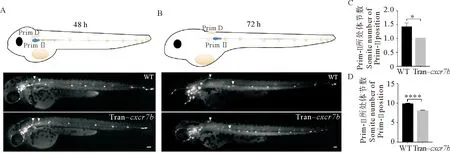
(A:野生型和cxcr7b转基因斑马鱼在受精后48 h Prim-Ⅱ和Prim-D所处位置。B:野生型和cxcr7b转基因斑马鱼在受精后72 h Prim-Ⅱ和Prim-D所处位置。比例尺=100 μm。C:野生型和cxcr7b转基因斑马鱼在受精后48 h Prim-Ⅱ所处体节数定量分析。D:野生型和cxcr7b转基因斑马鱼在受精后72 h Prim-Ⅱ所处体节数定量分析。: P <0.05; :P <0.000 1。WT: 野生斑马鱼。 Tran-cxcr7b: cxcr7b转基因斑马鱼。 A: The position of Prim-Ⅱ and Prim D in wild-type and cxcr7b transgenic zebrafish at the 48 h post-fertilization. B: The position of Prim-Ⅱ and Prim D in wild-type and cxcr7b transgenic zebrafish at the 72 h post-fertilization. Scale bar = 100 μm. C: The quantification analysis of the position of Prim-Ⅱ in wild-type and cxcr7b tiansgenic zebrafish at 48 h post-fertilization. D: The quantification analysis of the position of Prim-Ⅱ in wild-type and cxcr7b transgenic zebrafish at 72 h post-fertilization. : P< 0.05; : P< 0.000 1. WT: Wild-type zebrafish. Tran-cxcr7b:cxcr7b transgenic zebrafish. )
2.3 过表达cxcr7b对Prim-Ⅱ迁移的影响
在Prim-Ⅰ迁移至尾部后,耳后的侧线基板处形成新的原基(Prim-Ⅱ和Prim-D),它们分别向尾部和背部迁移。为了探究Sdf1-Cxcr4信号在Prim-Ⅱ和Prim-D迁移过程中的作用,本文作者从受精后45 h开始热激,然后在受精后48和72 h对野生型和cxcr7b转基因个体的Prim-Ⅱ和Prim-D的迁移位置进行观察。对于野生型而言,在受精后48 h,Prim-Ⅱ和Prim-D刚刚开始从后侧线基板处迁出,迁移至第(1.417 0±0.148 6)体节;在受精后72 h,Prim-Ⅱ大致到达第(9.786 0±0.238 6)体节,Prim-D已接近背中线。在受精后48 h,cxcr7b转基因个体的Prim-Ⅱ和Prim-D迁移至第1体节,差异显著(p=0.010 4) (见图3A、C);在受精后72 h,cxcr7b转基因个体的Prim-Ⅱ大约迁移至第(8.000 0±0.209 7)体节,差异显著(p<0.000 1) (见图3B、D)。Prim-D距离背侧中线还存在一定的距离,它们的迁移速度均显著慢于对照组。
2.4 过表达cxcr7b对体侧中线神经丘腹侧迁移和神经丘生成数量的影响
从受精后3 d开始,斑马鱼躯干中线的神经丘开始向腹侧迁移。本文作者在斑马鱼受精后3 d对cxcr7b转基因和野生型进行热激,受精后6和10 d分别测量体侧中线神经丘与水平肌隔的距离。结果显示:在受精后6 d,野生型组与过表达cxcr7b组两组体侧中线神经丘的腹侧迁移距离分别为(76.980 0±1.760 0)和(76.410 0±1.783 0) μm,两者差异不显著(p=0.822 3) (见图5A、C);在受精后10 d,野生型组与过表达cxcr7b组体侧中线神经丘的腹侧迁移距离分别为(74.520 0± 1.958 0)和(71.970 0±3.044 0) μm,两者差异不显著(p=0.532 9) (见图5B、E)。
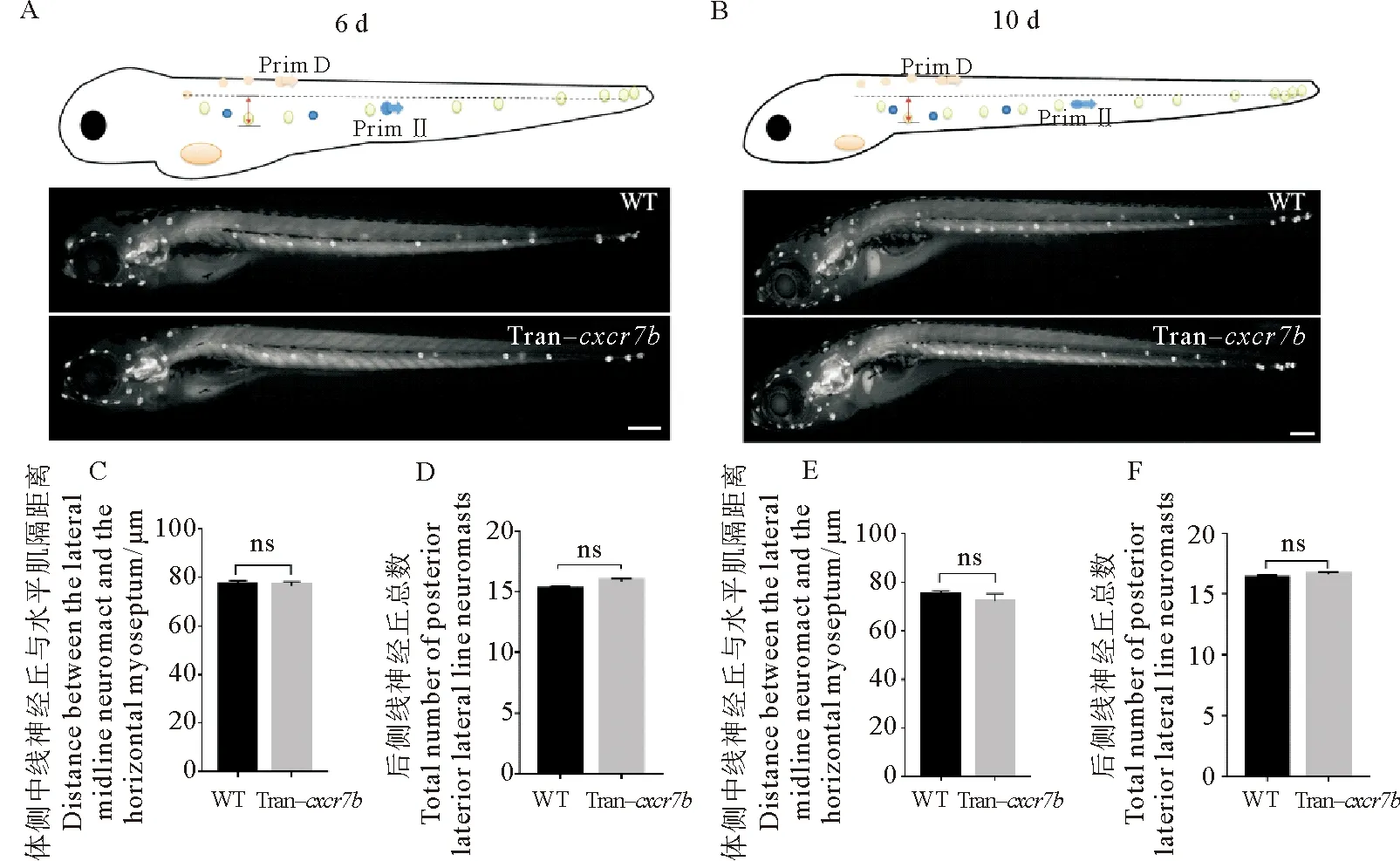
(A:野生型和cxcr7b转基因斑马鱼在受精后6 d侧线神经丘所处位置。B:野生型和cxcr7b转基因斑马鱼在受精后10 d侧线神经丘所处位置。比例尺=500 μm。C、E:表示野生型和cxcr7b转基因斑马鱼在受精后6和10 d体侧中线神经丘与水平肌隔的距离比较。D、F:分别表示野生型和cxcr7b转基因斑马鱼在受精后6和10 d的侧线神经丘总数比较。ns:无显著性差异。WT: 野生斑马鱼。 Tran-cxcr7b: cxcr7b转基因斑马鱼。A: The position of lateral line neuromast in wild-type and cxcr7b transgenic zebrafish at the 6 d post-fertilization. B: The position of lateral line neuromast in wild-type and cxcr7b transgenic zebrafish at the 10 d post-fertilization. Scale bar = 500 μm. C,E: The comparison of the distance between the lateral midline neuromast and the horizontal myoseptum in wild-type and cxcr7b transgenic zebrafish at 6 and 10 d post-fertilization. D, F: The comparison of the total number of lateral line neuromasts in wild-type and cxcr7b transgenic zebrafish at 6 and 10 d post-fertilization. ns: No significant difference. WT: Wild-type zebrafish. Tran-cxcr7b:cxcr7b transgenic zebrafish. )
另外,本文作者通过计数后侧线单侧的神经丘总数反映后侧线神经丘的数量。结果显示:在受精后6 d,野生型组与过表达cxcr7b组单侧侧线神经丘总数分别为(15.200 0±0.279 5)和(15.870 0±0.236 4)个,两者差异不显著(p=0.079 2) (见图5A、D);在受精后10 d,野生型组与过表达cxcr7b组单侧侧线神经丘总数分别为(16.310 0±0.262 7)个和(16.630 0± 0.221 3)个,两者差异不显著(p=0.360 4) (见图5B、 F)。综上表明:过表达cxcr7b对体侧中线神经丘腹侧迁移和神经丘生成总数均没有明显的影响。
2.5 过表达cxcr7b对体侧中线间生神经丘生成的影响
从受精后约15 d开始,原始神经丘间的丘间细胞增殖分化形成间生神经丘,间插在原始神经丘之间。在受精后15 d时对cxcr7b转基因和野生型进行热激,在受精后21 d时计数体侧中线神经丘的总数。结果显示:野生型组与过表达cxcr7b组的体侧中线神经丘总数分别为(18.100 0±1.100 0)个和(16.300 0±1.012 0)个,差异不显著(p=0.244 0) (见图6A、B)。体侧中线神经丘包含原始神经丘和间生神经丘。由于原始神经丘不受过表达cxcr7b的影响,本文作者推测间生神经丘也不受过表达cxcr7b的影响。
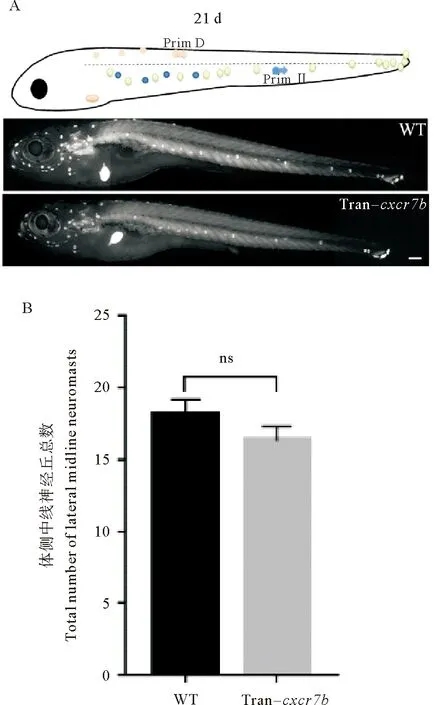
(A:野生型和cxcr7b转基因斑马鱼在21 d post-fertilization侧线神经丘所处位置。比例尺=500 μm。B:野生型和cxcr7b转基因斑马鱼在受精后21 d体侧中线神经丘总数比较。ns:无显著性差异。WT: 野生斑马鱼。 Tran-cxcr7b: cxcr7b转基因斑马鱼。A: The position of lateral line neuromast in wild-type and cxcr7b transgenic zebrafish at the 21 d post-fertilization. Scale bar = 500 μm. B:The comparison of the total number of lateral midline neuromasts between wild-type and cxcr7b transgenic zebrafish at the 21 d post-fertilization. ns: No significant difference. WT: Wild-type zebrafish. Tran-cxcr7b:cxcr7b transgenic zebrafish. )
2.6 过表达cxcr7b对针脚神经丘生成的影响
从受精后约1个月开始,后侧线系统的神经丘套细胞开始向背、腹方向迁移,随之增殖分化形成针脚神经丘。在受精后1个月时对cxcr7b转基因个体和野生型个体均进行持续热激,在受精后1.5个月时对胸鳍和腹鳍间的体侧中线和腹侧线针脚神经丘计数。结果显示:在受精后1.5个月时,野生型组与过表达cxcr7b组后侧线针脚神经丘分别为(4.817 0±0.224 9)和(5.029 0±0.215 7)个,两者数量差异不显著(p=0.504 2) (见图7A、B)。结果表明:过表达cxcr7b对针脚神经丘的生成无明显影响。
3 讨论
本研究利用热激启动子控制的cxcr7b转基因斑马鱼在侧线发育的特定阶段阻断Sdf1-Cxcr4信号通路,研究了Sdf1-Cxcr4信号在斑马鱼后侧线系统发育中的细胞迁移中的作用。斑马鱼的后侧线发育中的Prim-Ⅰ、Prim-Ⅱ和Prim-D的迁移受到过表达cxcr7b的抑制,但中线神经丘向腹侧的迁移、间生神经丘和针脚神经丘的形成均不受Sdf1-Cxcr4信号的影响。成体金枪鱼和斑马鱼侧线模式的差异同仔鱼期中线神经丘的迁移方向有关[17]。这暗示发育阶段的原基迁移和神经丘迁移均参与了鱼类侧线生成的最终模式。Sdf1-Cxcr4信号对后侧线Prim-Ⅰ、Prim-Ⅱ和Prim-D迁移的调控,为理解鱼类多样的侧线模式形成机制奠定了基础。
注射反义吗啡啉敲降cxcr4b或sdf1a可抑制斑马鱼侧线原基的迁移[9]。但是1-细胞期的敲降无法展示发育后期的细胞迁移事件。研究表明:cxcr4b和cxcr7b分别表达在侧线原基的引导区和后随区,这也与原基尾端沉积神经丘相一致[5]。另外,cxcr7b可作为清道夫结合Cxcl12,抑制Sdf1-Cxcr4信号的活性[8]。根据文献[10]报道,过表达cxcr7b可以抑制斑马鱼后侧线Prim-Ⅰ迁移。本研究中建立的Tg(hsp70l:cxcr7b-P2A-mCherry)转基因鱼不仅实现了对Prim-Ⅰ迁移的抑制,也可以抑制同样表达cxcr4b的Prim-Ⅱ和Prim-D的迁移,这表明过表达cxcr7b也可以在侧线原基迁移中抑制Sdf1-Cxcr4信号。这提供了一个在斑马鱼发育过程中可控的抑制细胞迁移的工具。另外,在鱼类的原始生殖细胞归巢和白细胞寻找病灶过程中都有Sdf1-Cxcr4信号的参与[18-19]。因此,cxcr7b转基因鱼对于研究Sdf1-Cxcr4信号在以上过程中的作用具有重要意义。
后侧线系统Prim-Ⅰ和Prim-Ⅱ受到Sdf1-Cxcr4信号的调控,体侧中线神经丘向腹侧、间生神经丘和针脚神经丘等迁移的过程虽然有细胞迁移发生,但它们没有受到过表达cxcr7b的影响。可能是由于成熟神经丘中cxcr4b的表达相对更弱。本研究汇中确实发现cxcr4b仅在Prim-Ⅰ,Prim-Ⅱ和Prim-D上有较强的表达,而在成熟的神经丘中未检测到明显的表达。另外,也可能是由于成熟神经丘周围组织没有形成sdf1的浓度梯度。从受精后20 h开始过表达cxcr7b,尽管看到Prim-Ⅰ的迁移明显慢于对照组,但仍然看到了Prim-Ⅰ的部分迁移。这暗示cxcr7b转基因斑马鱼对Sdf1-Cxcr4信号的抑制并不彻底,丘间细胞和体侧中线神经丘的迁移距离都比较短,其同野生型斑马鱼的差异并不显著。
