血清脂肪酸结合蛋白4与3岁及以下儿童自闭症谱系障碍诊断及神经发育的相关性
2023-10-18张静静贾媛媛胡苗苗成胜权
张静静,贾媛媛,胡苗苗,成胜权
自闭症谱系障碍(autism spectrum disorder,ASD)是以早期社会沟通障碍、语言延迟和重复性感觉运动行为为特征的神经发育障碍[1,2],影响约1%的学龄前儿童[2,3]。尽管ASD被认为是由遗传和环境因素之间的复杂相互作用引起的,但ASD发病机制仍不清楚[4,5]。ASD患儿与早期典型发育(typical developing,TD)儿童相比会表现出不同的发育差异[6]。大脑发育的关键时期是胚胎期至3岁[7],ASD儿童越早接受行为干预就越有可能缓解症状[8]。除了大脑发育差异,多数ASD患儿在早期发育阶段还表现出与脂质代谢相关的特征,这是因为脂肪组织可分泌多种生物活性分子(脂肪因子),其中一些因子可调节大脑功能[9]。脂肪酸结合蛋白4(fatty acid binding protein 4,FABP4)最近被鉴定为一种新型脂肪因子,被认为与脂肪酸(fatty acids,FAs)形成复合物,并作为细胞内FAs的伴侣因子在代谢综合征的病理学中发挥重要作用,这已在精神分裂症患者中得到证实[9,10]。然而,到目前为止,FABP4与ASD之间的关系尚未得到研究。因此,本研究检查了≤3岁ASD儿童的血清样本,以确定血清FABP4水平与神经发育特征之间的对应关系,以期为指导临床预防和控制提供依据。
1 对象与方法
1.1 对象 2019-05至2022-04,从我院儿科和儿童心理科共招募60例ASD儿童(ASD组),男45例,女15例,平均(2.02±0.76)岁。纳入标准:符合《精神障碍诊断和统计手册》第5版(2013年)[11]中ASD诊断标准;儿童自闭症评定量表(childhood autism rating scale,CARS)总分在30分以上;年龄≤3岁;首次确诊。排除标准:诊断为其他精神疾病(如注意力缺陷多动障碍、强迫症)、其他神经发育障碍、遗传代谢疾病或严重神经疾病;脑损伤史;过去3个月内存在急性/慢性感染或使用任何FABP4补充剂;贫血、代谢紊乱、自身免疫性疾病。另外纳入同时期正常发育儿童共68例作为对照组,纳入标准:健康,已知无神经发育或神经系统疾病,无感染且未使用维生素补充剂,年龄(P=0.815)和性别(P=0.360)与ASD组相匹配,平均(1.99±0.69)岁,男46例,女22例,排除标准与ASD组相同。对于所有登记的儿童,均获得了法定监护人的签字知情同意书。这项研究获得了我院伦理委员会的批准。
1.2 观察指标 由ASD患儿和对照儿童的法定监护人完成了信息问卷,包括有关人口统计数据(例如,姓名、年龄和性别)、病史和食物偏好。ASD的症状用Kaufman儿童成套评价测验(Kaufman assessment battery for children,K-ABC)、自闭症诊断观察量表第2版(autism diagnostic observation schedule second edition,ADOS-2)进行评估。K-ABC量表分为智力和成就两个子量表[12]。ADOS-2(自闭症诊断观察量表第二版)是用于诊断和鉴别自闭症的一种评估工具,包括重复刻板行为(restricted and repetitive behaviors,RRB)、社交影响(social affect,SA)两个维度,2个维度得分相加即为总分,并根据模块与年龄转换为标准化的严重程度评分(calibrated severity score,CSS)[13]。分数越高,ASD严重程度越高。
1.3 神经发育评估 采用中国儿童神经心理行为检查量表2016版(children neuropsychological and behavioral scale-revision 2016,CNBS-R2016)评估ASD患儿的神经发育水平,计算发育商(development quotient,DQ);DQ<70分定义为发育障碍(developmental disability,DD)[14]。根据DQ,我们将ASD患儿分为3个亚组:无DD,DQ≥70分;轻度DD,55分≤DQ<69分;中度及以下DD,DQ≤54分。对于交流警示行为能区,其得分<7分表示正常发育,7~<12分提示需要随访,12~30分表示有交流和互动障碍风险,>30分提示高度怀疑ASD[14]。
1.4 血清脂肪因子和代谢生物标志物的测定 采集研究对象3~5 ml全血样本,血清分离,在室温下凝固2 h或-4 ℃过夜,将血样以1350 r/min离心20 min。采集血清并立即储存在-80 ℃,直到分析。使用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(美国Cayman Chemical)测量血清FABP4浓度。此外使用夹心ELISA试剂盒(美国R&D Systems Inc.)测定脂联素、瘦素水平。另外采用75 g葡萄糖耐量试验检测血清胰岛素水平,葡萄糖氧化酶法检测空腹葡萄糖水平。使用游离脂肪酸荧光测定试剂盒测量游离脂肪酸的水平。每个血清样本分析两次,取平均值进行分析。
1.5 统计学处理 使用SPSS26.0软件处理数据,二分类变量以%(频率)表示,进行χ2检验。偏态资料采用[M(Q1,Q3)]表示,进行Mann-Whitney U检验。相关性采用Spearman秩相关系数和多元线性回归进行评估。采用logistic回归模型分析ASD及神经发育障碍的影响因素。双侧P<0.05为差异有统计学意义。
2 结 果
2.1 两组儿童临床特征资料比较 两组儿童挑食、排斥蔬菜和肉类、血清瘦素、血清胰岛素、血清葡萄糖水平差异无统计学意义,但ASD组血清FABP4、血清游离脂肪酸、血清脂联素水平低于对照组,差异有统计学意义(P<0.05,表1)。
2.2 血清FABP4水平与ASD的关系 将表1单因素分析中P<0.1的变量作为自变量,有无ASD作为因变量(无ASD赋值为0,有ASD赋值为1)纳入多因素logistic回归模型,结果显示,血清FABP4是ASD的独立影响因素(P<0.05,表2)。经ROC曲线分析,血清FABP4诊断ASD的曲线下面积为0.778(0.685~0.859),最佳截断值为16.85 ng/ml,敏感度和特异度分别为86.8%和68.3%(图1)。

表1 两组儿童临床特征资料比较 [M(Q1,Q3)]

表2 Logistic回归分析血清自闭症谱系障碍与脂肪酸结合蛋白4的关系
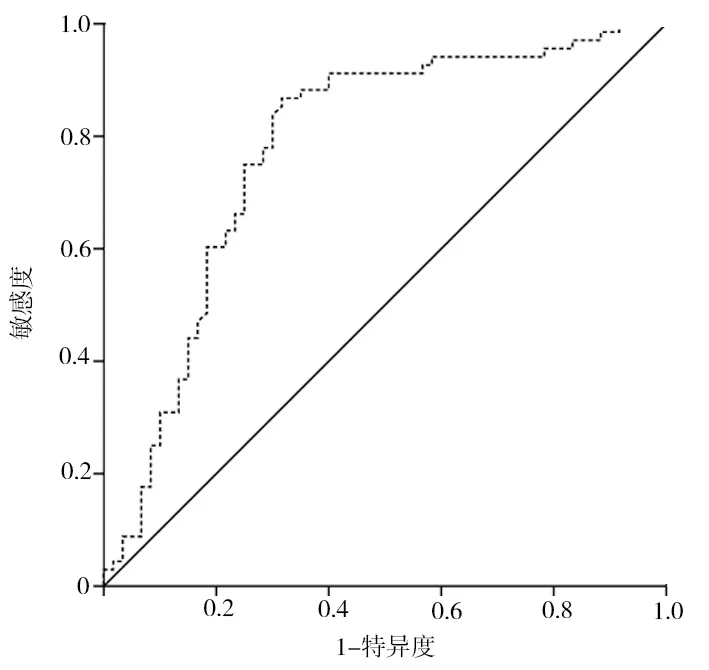
图1 血清脂肪酸结合蛋白4水平与其他脂肪因子和代谢生物标志物的关系
2.3 ASD患儿血清FABP4水平与其他脂肪因子和代谢生物标志物的关系 经Spearman秩相关分析,血清FABP4与瘦素(r=0.352,P=0.006)、游离脂肪酸(r=0.789,P<0.001,图2)呈正相关。进一步校正年龄和性别因素后,ASD患儿血清FABP4水平仍是血清瘦素(β=0.636,95%CI:0.293~0.979,P<0.001)和血清游离脂肪酸(β=19.038,95%CI:10.615~27.461,P<0.001)的独立影响因子。

图2 自闭症谱系障碍患儿血清脂肪酸结合蛋白4水平与其他脂肪因子和代谢生物标志物的关系
2.4 ASD患儿血清FABP4水平与K-ABC、ADOS-2评分的相关性 经SPSS Spearman法分析,ASD患儿血清FABP4水平与K-ABC智力评分(r=-0.611,P<0.001)、成就评分(r=-0.557,P<0.001)、ADOS-2-SA(r=-0.421,P=0.001)、ADOS-2-RRB(r=-0.437,P<0.001)、总分(r=-0.422,P=0.001)、ADOS-2-CSS(r=-0.384,P=0.002)均呈负相关。
2.5 ASD患儿血清FABP4水平与神经发育水平的关系 DQ<70分亚组ASD患儿血清瘦素、血清游离脂肪酸、血清FABP4显著低于DQ≥70分亚组(P<0.05,表3)。此外,进一步经Spearman相关性分析,3岁及以下ASD患儿血清FABP4水平与DQ(r=0.203,P=0.006),CNBS-R2016粗大运动(r=0.176,P=0.018)、精细运动(r=0.158,P=0.035)、语言(r=0.199,P=0.008)评分均呈正相关。此外,将单因素分析中有统计学意义(P<0.05)的变量进一步纳入多因素分析,在校正年龄、性别等干扰因素后,血清FABP4水平是影响ASD患儿神经发育障碍的独立保护因素(OR=0.677,95%CI:0.495~0.925,P=0.014)。
3 讨 论
本研究分析了血清FABP4水平与≤3岁ASD患儿核心症状和神经运动发育水平之间的关系。结果发现ASD患儿血清FABP4水平普遍低于对照组儿童,且与3岁及以下ASD儿童DQ、CNBS-R2016粗大运动、精细运动、语言评分呈正相关,与K-ABC评分、ADOS-S评分呈负相关性,提示血清FABP4水平与≤3岁ASD患儿的神经运动发育水平密切相关。笔者不仅获得了FABP4作为ASD发病基础因子和早期诊断生物标志物的潜力数据,也可能为ASD“脂肪脑轴”假说提供了部分循证医学支持。
全基因组关联研究已经报道了ASD和肥胖的遗传风险位点的重叠[15,16]。此外,低出生体重会增加患ASD的风险[17]。作为一种新型脂肪因子,FABP4则已被证明与脂质代谢紊乱、糖尿病和肥胖症密切相关[18-20]。FABP4是脂肪酸结合蛋白质家族的一员,已被鉴定为与多种疏水化合物(如长链脂肪酸、各种环氧合酶和脂氧合酶代谢产物)相关的外周膜蛋白[21]。其他研究表明,脂肪细胞分化过程中FABP4表达增加,而长链脂肪酸(long-chain fatty acid,LCFA)、氧化低密度脂蛋白、过氧化物酶体增殖物激活受体γ和胰岛素都可以改变FABP4活性[19]。FABP4被认为是一种脂质伴侣,因为它具有将LCFA与高亲和力结合以提高其溶解度并在膜和细胞器之间穿梭的特性[9]。因此,FABP4可影响脂肪酸的摄取、运输、酯化和β-氧化,并调节体内的能量平衡和脂质信号转导。FABP4还将脂肪酸输送到内质网和细胞核,以调节转录和脂质介导的信号传递,并调节酶的活性和生物膜的合成[10]。对于ASD儿童,除了社交能力和沟通能力持续不足,以及行为和兴趣的受限和重复模式等核心特征外,也会逐渐影响胃肠、免疫、肝脏和内分泌系统。既往有研究发现3~12岁ASD儿童血液中的FABP4水平比其他儿童低得多[9]。这与本研究结果基本一致。本研究还发现,≤3岁的ASD儿童血清FABP4水平也明显低于正常发育儿童,且与血清瘦素和血清游离脂肪酸呈正相关,这表明ASD儿童可能普遍具有低血清FABP4水平,并且在脂肪代谢紊乱中与瘦素、游离脂肪酸水平协同变化。此外,本研究结果还发现血清FABP4水平与K-ABC评分、ADOS-S评分呈负相关性,而且ROC曲线也支持了FABP4作为ASD早期诊断生物标志物的潜力。
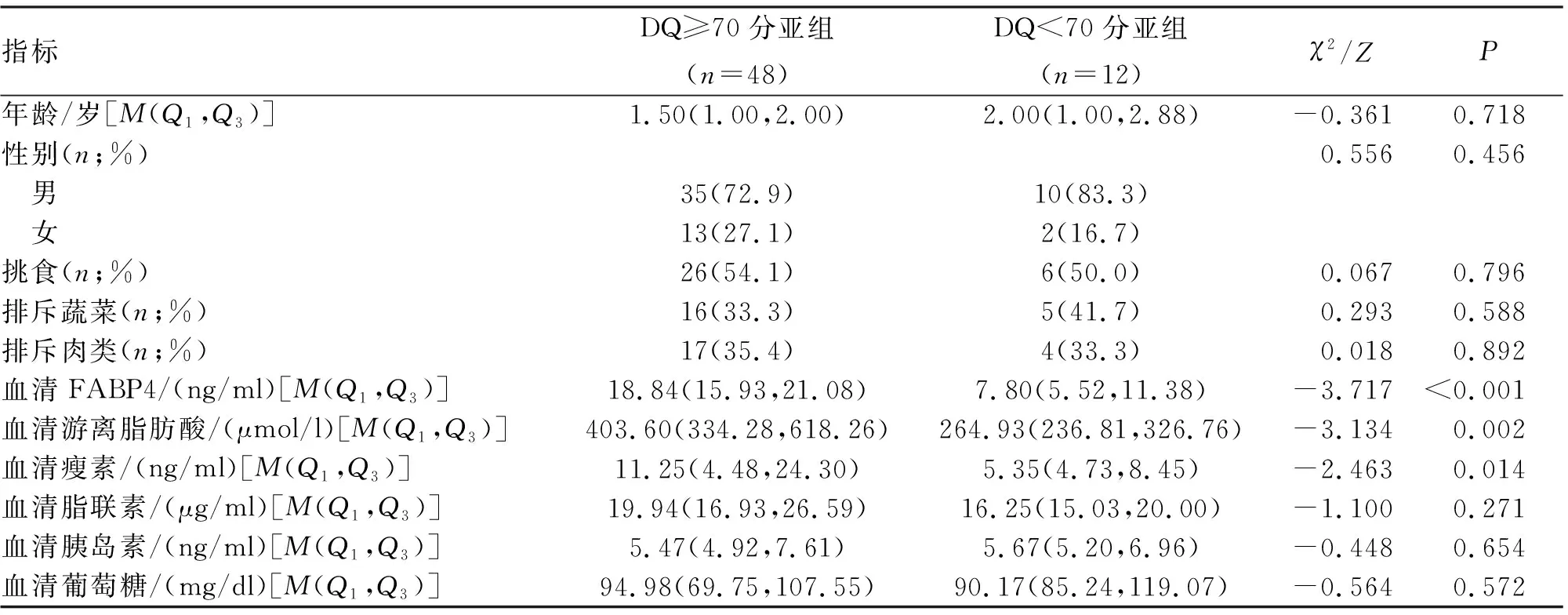
表3 单因素logistic回归分析血清脂肪酸结合蛋白4水平与自闭症谱系障碍患儿神经发育障碍的关系
FAs从血液到大脑的运输失调可能在ASD的病理生理中起着潜在的作用[9,22]。FABP超家族的另一成员FABP5在脑内皮细胞中表达,参与22碳六烯酸的摄取和随后的血脑屏障运输[22]。而FABP4在同一细胞群中表达[9]。因此,笔者推测FABP4可能也在ASD发病机制中发挥作用。它可能参与了FAs在血脑屏障中的转运,并可能影响神经运动发育,这一点已在精神分裂症患者中得到证实[23,24]。此外,既往报道显示脑表达的FABP基因(FABP3、FABP5和FABP7)的遗传变异参与了ASD和精神分裂症的发病机制[9,25]。先前研究还发现,FABP4错义突变会影响配体结合[9]。而且Maekawa等[9]也报道了与野生型小鼠相比,FABP4基因敲除小鼠对陌生小鼠的交流互动更少,且在空间学习和记忆方面有更多困难,证实了FABP4对ASD发病机制的遗传贡献。因此,我们推测外周FABP4可能通过改变脑内脂肪酸组成间接参与了ASD的发病机制。据报道,出生后的前3年是突触形成的高峰期[26]。有证据证明,神经元增殖、髓鞘形成和突触形成等生理过程对大脑的神经发育非常重要[27]。在之前的一项大规模外显子组测序研究中,在ASD患者中发现了FABP4的从头错义变异[28]。他们通过外显子组测序鉴定了102个ASD风险基因,其中大多数参与突触功能和基因表达调控[13]。而FABP4与这102个候选物之间的蛋白质-蛋白质相互作用网络显示,FABP4与CREBBP、MED13L、PTEN和NCOA1相互作用[4,13]。这表明FABP4相关网络在ASD神经发育机制中具有潜在作用。本研究也进一步探讨了血清FABP4水平与ASD神经发育水平之间的关系。结果发现,血清FABP4水平≤3岁ASD患儿的DQ、粗大运动、精细运动、语言评分呈正相关,且血清FABP4水平是影响ASD患儿神经发育障碍的独立保护因素。本研究结果表明,血清FABP4与ASD儿童的认知功能密切相关,而且相对较高的FABP4水平可能对ASD儿童的神经发育更有益。这些结果进一步支持了ASD“脂肪-脑轴”的假说。
综上,本研究发现≤3岁ASD儿童血清FABP4水平低于正常发育儿童,且低血清FABP4水平与ASD儿童神经发育不良有关。对于≤3岁儿童,血清FABP4可能是用于ASD诊断和预测神经发育不良风险的候选生物标志物。本研究存在一些局限性,如样本量较小,且FABP4在ASD中的具体作用机制仍未阐明,需要进行前瞻性和随机对照试验,以进一步观察FABP4在ASD中的潜在作用。
