安罗替尼治疗晚期难治性乳腺癌的效果
2023-10-18何亚萌高会霞王彬
何亚萌,高会霞,王彬
(许昌市中心医院 肿瘤三病区,河南 许昌 461000)
2020年全球乳腺癌新发病例226万例,首次超越肺癌成为全球第一高发的恶性肿瘤。早期多学科综合治疗模式的广泛开展使广大乳腺癌患者获益显著,即使对于失去根治性治疗机会的进展期乳腺癌患者来说,也能通过蒽环类及紫杉醇类化疗药物获得较长时间的无瘤生存。然而不可避免的是,多疗程后这类患者体内肿瘤细胞会逐渐克服一、二线化疗药物的翦灭,获得多重耐药能力,进展为晚期难治性乳腺癌。系统生物学的深入,使人们逐渐意识到血管生成在肿瘤发生发展中的重要性,这也使得研发抗血管生成药物这一设想变为现实[1]。安罗替尼作为一款我国自主研发的、具有独立知识产权的口服的多靶点新型小分子受体酪氨酸激酶(receptor tyrosine kinase,RTK)抑制剂,能通过多靶点抑制血管新生,进而产生抗肿瘤血管生成及抑制肿瘤细胞生长的多效作用[2]。在部分恶性肿瘤的二三线治疗中,安罗替尼显示出良好的疗效及可耐受性。就安罗替尼对晚期乳腺癌是否也具有较好的抗肿瘤作用尚较少文献报道,本研究于2019年1月至2022年12月以安罗替尼治疗多线治疗失败的晚期乳腺癌患者,观察其疗效。
1 资料与方法
1.1 一般资料
回顾2019年1月至2022年12月许昌市中心医院肿瘤诊疗中心收治的晚期女性乳腺癌患者作为研究对象。纳入标准:既往组织病理学检查证实为Ⅳ期浸润性导管癌;既往经一线或者以上系统性全身治疗后,疗程≥2个周期疾病进展(progressive disease,PD),或者疗程≥4个周期未达缓解[完全缓解(complete response,CR)、部分缓解(partial response,PR)];美国东部肿瘤协作组(eastern cooperative oncology group,ECOG)评分[3]为0~3分,预计生存期大于3个月,签署知情同意书。排除标准:男性乳腺癌及非典型性乳腺癌;严重肝肾功能损害及脑病。本研究共纳入110例患者,试验组60例,对照组50例,其中试验组接受盐酸安罗替尼胶囊药物治疗,对照组接受姑息支持治疗。试验组年龄35~78(58.06±10.80)岁,对照组30~73(56.96±11.30)岁,试验组ECOG评分为1(1,2)分,对照组1(1,2)分,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准。
1.2 治疗方法
所有符合纳入标准和排除标准的多线治疗失败的晚期难治性乳腺癌患者,使用盐酸安罗替尼胶囊药物或进行姑息支持治疗。试验组应用盐酸安罗替尼胶囊剂量为每日12 mg,连续口服14 d,停药7 d,21 d为1个周期。
1.3 疗效判断标准
按实体瘤疗效评价标准[5](response evaluation criteria in solid tumors,RECIST)评定,分为CR、PR、疾病稳定(stable disease,SD)和PD,客观有效率(objective response rate,ORR)为CR和PR,疾病控制率(disease control rate,DCR)为CR、PR和SD。无进展生存期(progress free survival,PFS)定义为开始使用药物至确认疾病进展或疾病未进展但发生任何原因死亡的时间。
1.4 不良反应判断标准
依据通用不良反应术语标准4.0版(common terminology criteria adverse events version 4.0,CTCAE v4.0),将不良反应分为0~5级。
1.5 统计学方法
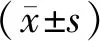
2 结果
2.1 近期疗效
试验组60例患者进行了6~12个周期、中位数7个周期的治疗,所有患者中均无CR的案例。试验组中,ORR患者为31.6%(19/60),DCR患者为51.6%(31/50),对照组中,ORR患者为6.0%(3/50),DCR患者为16.0%(8/50),两组近期疗效差异有统计学意义(P<0.05)。Kaplan-Meier生存分析显示,试验组中位PFS为8个月(95% CI:7.7~8.2个月),对照组中位PFS为3个月(95% CI:2.6~3.3个月)(P<0.05),两组情况如图1所示。

图1 两组PFS比较
2.2 不良反应
本研究中试验组不良反应按发生率依次为高血压、胆固醇异常、甘油三酯异常、肝功能异常、骨髓抑制、蛋白尿、心肌酶异常,对照组不良反应按发生率依次为肝功能异常、高血压、甘油三酯异常,两组不良反应对比,高血压、胆固醇异常、甘油三酯异常、骨髓抑制、心肌酶异常差异有统计学意义(P<0.05),其他不良反应差异无统计学意义,见表1。

表1 两组患者治疗期间不良反应比较[n(%)]
3 讨论
根据2021年新发布的全球癌症数据显示,约有230万新诊断乳腺癌患者和约69万乳腺癌患者死亡[4],究其原因,除了人群筛查意识提高、影像学检查技术进步等外部条件外,与女性生育推迟、分娩哺乳次数减少等乳腺癌高危因素密切相关[5]。乳腺癌发病隐匿,多数乳腺癌患者首诊时已为进展期,大多数乳腺癌患者预后良好,但仍有接受治疗的乳腺癌患者中约40%会出现复发和转移[6]。其中一部分符合以下条件的患者被认为是难治性乳腺癌:(1)经过两种以上的治疗方案后仍无较好的效果,疗程≥2个周期PD,或者疗程≥4个周期未达缓解(CR或PR);(2)2次以上复发。这类患者总生存期低于2 a,目前尚无准确定义。临床中化疗、内分泌治疗等是晚期乳腺癌治疗的常见手段。蒽环类、紫杉类、氟尿嘧啶等经典细胞毒类药物,适应证广泛,通过低选择性的细胞毒作用直接杀伤肿瘤细胞从而发挥抗肿瘤药物活性[7]。但传统化疗药物特异性差且不良反应重,同时无克服肿瘤细胞耐药性克隆的能力,几乎所有接受化疗的患者最终都会耐药性复发。内分泌疗效多呈现激素依赖性,且起效时间长,临床疗效有限。免疫治疗是近些年的研究热点,IMpassion130(NCT02425891) 试验比较了化疗加安慰剂与化疗加阿替利珠单抗,将乳腺癌带入了免疫治疗时代[8],但多数生物制剂造价昂贵,药物可及性差,对原本合并有免疫功能紊乱的患者不友好。因此,开发新型有效的乳腺癌治疗药物仍然是迫切的医学需求。
随着肿瘤分子生物学研究的深入,发现多数肿瘤发生发展均有相对独立的信号转导途径,给肿瘤的靶向治疗及药物开发提供了新思路。目前认为血管生成是肿瘤进展的必要条件,因此通过抗血管生成进而抑制肿瘤进展成为肿瘤分子靶向治疗的重点内容[9]。在生理条件下,血管生成的调节中既有提供促进发生的正性调节信号如血管内皮生长因子及其受体(血管内皮生长因子、血管内皮细胞生长因子受体),也有抗血管生成的负性调节信号如血小板反应蛋白-1。研究证实,随着肿瘤增殖及体积增大,肿瘤中心部位缺氧愈发严重,肿瘤失氧性凋亡及坏死增多,形成的特殊肿瘤微环境赋予了诱导微血管生成的能力[10]。肿瘤内的新生血管为肿瘤细胞提供养料及氧气供应来支持其生存,也为肿瘤侵袭播散转移提供了动力。肿瘤细胞内及肿瘤间质细胞中多条信号转导通路参与了血管生成这一过程,所以通过阻断血管生成相关性信号通路来抑制肿瘤生长已成为临床现实。
安罗替尼为我国独立研发的Ⅰ类创新药物,可通过血管内皮细胞生长因子受体,血小板衍生生长因子受体,成纤维细胞生长因子受体下游的酪氨酸激酶和c-Kit等多个靶点起中强效抑制作用[11]。也有研究发现,安罗替尼可以诱导细胞自噬促进乳腺癌细胞的细胞凋亡和失活的Akt/GSK-3α途径[12],亦可通过抑制细胞生长、诱导细胞凋亡和抑制细胞迁移和侵袭对乳腺癌细胞发挥抗肿瘤作用[13]。本研究结果显示:60例患者进行了6~12个周期、中位数7个周期的治疗,所有患者中均无CR的案例,试验组ORR及DCR分别达到31.6%、51.6%,优于对照组且差异有统计学意义;Kaplan-Meier生存分析显示,试验组无进展生存期达到8个月,优于对照组(3个月),差异有统计学意义。进一步证实了安罗替尼可作为治疗乳腺癌有效的抗肿瘤药物之一。由于本研究观察时间限制,目前尚未统计两组患者总生存期差异。目前有中心已开展的Ⅱ及Ⅲ期临床研究显示,安罗替尼具有广谱的抗癌活性,对晚期肺癌、甲状腺髓样癌及肾细胞癌等均有较好的疗效且安全性好,对晚期乳腺癌其适应证及不良反应的相关临床研究也在同步进行[14]。一期药物临床试验结果显示,安罗替尼的常见不良反应主要为高血压、蛋白尿、胃肠道反应、肝功能异常、高脂血症、出血和手足综合征等。本研究中安罗替尼组中约50%患者出现不同程度高血压,以1级和2级高血压为主,大部分可通过常规降压药物控制稳定血压,对照组中大部分患者高血压为基础疾病,且两组结果对比差异有统计学意义,考虑高血压与试验药物呈现显著相关性。45.0%患者出现血脂异常,两组比较差异有统计学意义,约40.0%的患者都不同程度了肝功能损害,以谷丙转氨酶水平升高、谷草转氨酶水平升高及总胆红素水平升高为主,但两组分析差异无统计学意义。其他较少的不良事件有咯血、咳嗽、腹泻、静脉血栓栓塞、低钠血症、体重减轻、口腔黏膜炎及血尿等,均可通过调节药物剂量或对症治疗药物缓解。一项研究中表明,其中发生率较高的不良反应为呕吐、腹痛、乏力、腹泻、手足综合征等,1~2级不良反应78例(96.3%),3级不良反应3例(3.7%)[15]。然而安罗替尼虽然不良反应较多,但通常为非特异性,且较轻微,期间行不良反应监测、早期积极干预等均可避免严重不良反应的发生,使患者最大程度受益。
4 结论
安罗替尼作为我国一款新型口服RTK抑制剂,能通过高选择性抑制肿瘤血管新生中多条通路发挥抗肿瘤活性,应用于多线化疗失败多药耐药的晚期难治性乳腺癌,有较好的疗效,且总体耐受性好,不良反应多轻微且可控,可作为多线治疗失败耐药的难治性乳腺癌患者的挽救方案。但本研究尚存在不足之处,由于观察时间尚短,中位总生存期未进行对比统计,且样本量有待进一步提高,后续可进行更全面的多中心研究,旨在为晚期难治性乳腺癌患者提供更有效的治疗手段。
