吴茱萸碱衍生物血管舒张活性评价及分子对接模拟研究
2023-10-17高冬梅张玫倩高宇飞聂礼飞
周 静,高冬梅,张玫倩,高宇飞,聂礼飞,王 婷,王 川*
(1.陕西中医药大学药学院,陕西 咸阳 712046;2.杨凌职业技术学院药物与化工系,陕西 杨凌 712100;3.陕西中医药大学基础医学院,陕西 咸阳 712046;4.中国科学院新疆理化技术研究所,新疆 乌鲁木齐 830011)
吴茱萸,始载于《神农本草经》,为芸香科植物吴茱萸及其变种石虎和疏毛吴茱萸的干燥近成熟果实。吴茱萸苦辛,性温热,是一种应用广泛的传统中药,更是温中散寒、疏肝止痛常用药[1]。目前,从吴茱萸中已分离得到20多种生物碱,其中,吴茱萸碱(evodiamine)是一种喹唑啉并咔啉类生物碱[2],具有广泛的生物学活性,如促儿茶酚胺分泌[3]、抗炎[4]、镇痛[5]、抗肿瘤[6]、调节体温、收缩子宫[7]、舒张血管[8]等。但是,吴茱萸碱具有一定的细胞毒性,限制了其在药学领域的应用。因此,通过结构修饰或改造,发展毒性低、药效高的吴茱萸碱衍生物具有重要意义。
网络药理学融合了系统生物学、生物信息学、计算机网络分析技术等,可以揭示药物活性成分与疾病之间的相互关系[9];分子对接是通过受体特征研究蛋白受体与配体结合模式的强有力工具。为了寻找药理作用更广泛、活性更高、毒性更低的吴茱萸碱衍生物,基于噻吩结构存在于很多具有重要生理活性的药物分子中[10],作者所在研究团队[11]合成了6个含噻吩环的吴茱萸碱衍生物5a~5f(图1)。在此,作者基于网络药理学,采用分子对接方法对衍生物5a~5f的血管舒张活性及细胞毒性进行研究,并对舒张血管作用机制进行探究,以期为治疗高血压提供理论依据。

图1 吴茱萸碱衍生物的合成路线
1 实验
1.1 材料、试剂与仪器
SPF级雄性SD大鼠,质量(200±20) g,6~8周龄,由西安交通大学实验动物中心提供,实验动物生产(使用)许可证号:SCXK(陕)2020-030。饲养于陕西中医药大学中药药理实验室,室温(23±2) ℃,光照周期12 h,饲养期间自由进食饮水。
GK10001型CCK-8试剂盒,GLPBIO;吴茱萸碱(纯度≥98%,批号A-JA285),上海贤鼎生物科技有限公司;苯肾上腺素(PE,纯度≥99%,批号84614),西格玛奥德里奇上海贸易有限公司;其它试剂均为市售分析纯。
X-4型显微熔点测定仪(温度计未经校正),北京泰克仪器有限公司;Bruker ARX-400/600型核磁共振仪(TMS为内标),瑞士Bruker公司;MP500Z型分析天平,上海恒平科学仪器有限公司;SZCL-4型数显智能控温磁力搅拌器、电热恒温鼓风干燥箱,巩义予华仪器有限公司;RE-2000A型旋转蒸发仪,西安予辉仪器有限公司;CODA型动物无创血压测量系统,美国 Kent 公司;DMT 630M型离体微血管张力测定系统,丹麦DMT公司;CO2培养箱,美国Thermo Fisher Scientific公司;肌张力描记记录系统,澳大利亚ADI公司;解剖显微镜,日本Olympus公司。
1.2 方法
1.2.1 血管环实验
大鼠动脉血管环的制备:SD大鼠断颈处死,无菌条件下迅速分离出大鼠肠系膜,浸泡于经过滤除菌并预冷的Na+-PSS缓冲溶液(119 mmol·L-1NaCl、15 mmol·L-1NaHCO3、4.6 mmol·L-1KCl、1.2 mmol·L-1MgCl2、1.2 mmol·L-1NaH2PO4、1.5 mmol·L-1CaCl2和5.5 mmol·L-1葡萄糖)中,于解剖显微镜下分离出肠系膜动脉。将5 mL Na+-PSS缓冲溶液加入恒温离体浴槽内,并将含95%O2和5%CO2的混合气体不断通入浴槽内;将分离的肠系膜动脉穿入2根20 μm的金属丝,其中1根金属丝与可调节预张力的张力微调装置相连,另1根连接张力换能器。固定好的血管环平衡40 min后,每15 min施加0.5 mN的预张力,直至2 mN,加入60 mmol·L-1K+-PSS缓冲溶液检验血管环收缩活性,若血管环在2次K+-PSS缓冲溶液中的收缩幅度均大于5 mN并且2次收缩差低于10%时,可将该血管环用于后续实验。
血管环给予10 μmol·L-1苯肾上腺素预收缩,待收缩稳定后,加入梯度浓度(10-10~10-6.5mol·L-1)的吴茱萸碱及其衍生物5a~5f,使用离体微血管张力测定系统记录血管张力,绘制血管张力变化曲线,研究吴茱萸碱衍生物对大鼠血管舒张功能的影响。
1.2.2 CCK-8细胞增殖实验
溶液配制:精密称取吴茱萸碱及其衍生物5a~5f,用DMSO配制成200 μmol·L-1母液,再用DMSO稀释成浓度(μmol·L-1)分别为1、3、10、30、50、100的吴茱萸碱及其衍生物5a~5f溶液。同法配制各浓度顺铂溶液。
取对数生长期的肝癌细胞HepG2,用胰酶消化,收集细胞,1 000 r·min-1离心,弃上清,加入新鲜培养液重悬细胞;计数,调整细胞密度至2.5×104个·mL-1,吸取200 μL细胞悬液加入96孔板中,使每孔细胞为5×103个,并设置空白组、对照组、阳性对照组(顺铂)和溶剂对照组,每组设置6个复孔,置于培养箱中常规培养24 h;次日,将培养液更换为含不同浓度(1、3、10、30、50,μmol·L-1)吴茱萸碱及其衍生物5a~5f的培养液,空白组、对照组更换新鲜培养液,阳性对照组更换为含不同浓度(1、3、10、30、50,μmol·L-1)顺铂的培养液,溶剂对照组加入1 μL的DMSO,分别置于培养箱中常规培养24 h;每孔加入10 μL的CCK-8溶液,置于培养箱中继续孵育2.5 h;用酶联免疫检测仪测定每孔溶液在450 nm处吸光度(A),计算每组吸光度平均值,按式(1)计算抑制率(%):

(1)
1.2.3 内皮细胞毒性实验
细胞培养:人脐静脉内皮细胞HUVEC用含有20%胎牛血清、1%双抗(青霉素和链霉素)的DMEM/F12培养基培养。
取对数生长期的人脐静脉内皮细胞HUVEC,用胰酶消化,收集细胞,1 000 r·min-1离心,弃上清,加入新鲜培养液重悬细胞;计数,调整细胞密度至1×105个·mL-1,吸取100 μL细胞悬液加入96孔板中,使每孔细胞为1×104个,并设置空白组、对照组,每组设置6个复孔,置于培养箱中常规培养24 h:次日,将培养液更换为含不同浓度(1、10、30、50、100,μmol·L-1)吴茱萸碱及其衍生物的培养液,空白组、对照组更换新鲜培养液,分别置于培养箱中常规培养24 h;每孔加入15 μL浓度为5 mg·mL-1的MTT溶液,置于培养箱中继续孵育3 h;小心吸尽各孔培养液,加入100 μL的DMSO,使结晶物充分溶解;用酶联免疫检测仪测定每孔溶液在490 nm处吸光度,计算每组吸光度平均值,按式(1)计算抑制率(%),按式(2)计算存活率(%):
存活率=100%―抑制率
(2)
1.2.4 吴茱萸碱与高血压靶点的搜索
使用TCMSP数据库(http://lsp.nwu.edu.cn/tcmsp.php)搜索吴茱萸碱的相关靶点。以“hypertension”为关键词,使用GeneCards数据库(https://www.genecards.org/)搜索高血压的相关靶点。
1.2.5 分子对接模拟研究
为了研究吴茱萸碱衍生物舒张血管作用机制并且验证配体-受体结合情况,选取吴茱萸碱与高血压密切相关的5个靶点:凝血因子Ⅶ(coagulation factor Ⅶ)、5-羟色胺受体3A(5-hydroxytryptamine receptor 3A)、类固醇受体辅激活剂1(steroid receptor coactivator 1,SRC-1)、雄激素受体(androgen receptor)、内皮型一氧化氮合酶(endothelial nitric-oxide synthase,eNOS),进行分子对接。在PDB数据库(http://www.rcsb.org)中,选取相应的晶体结构(PDB ID:4ZXX[12]、6W1M[13]、5Y7W[14]、2AXA[15]、3NOS[16])作为蛋白靶点进行研究。
使用AutoDock 4.2软件进行分子对接研究。选取具有显著生物活性的吴茱萸碱衍生物作为配体与5个关联靶点进行分子对接,使用ChemDraw Ultra 19.0进行三维定向绘制和优化,并使配体能量最小化,能量最小化后的配体用于分子对接研究;使用PyMOL软件对配体-关联靶点相互作用进行可视化分析。
1.3 统计学方法

2 结果与讨论
2.1 吴茱萸碱衍生物的血管舒张活性
吴茱萸碱及其衍生物5a~5f对大鼠肠系膜动脉血管的舒张作用如图2所示。

图2 吴茱萸碱及其衍生物5a~5f对大鼠肠系膜动脉血管的舒张作用
由图2可知,吴茱萸碱及其衍生物5a~5f均对苯肾上腺素预收缩的大鼠肠系膜动脉血管具有舒张作用,其中吴茱萸碱衍生物5a的舒张作用最强。经拟合,吴茱萸碱及其衍生物5a~5f的logEC50值分别为-7.883、-8.387、-8.363、-8.383、-8.316、-8.047、-7.903。
2.2 吴茱萸碱衍生物对肝癌细胞的抑制率
通过CCK-8细胞增殖实验,测定给予不同浓度的吴茱萸碱及其衍生物5a~5f时肝癌细胞的抑制率,结果见表1。

表1 给予不同浓度的吴茱萸碱及其衍生物5a~5f时肝癌细胞的抑制率
由表1可知,随着吴茱萸碱及其衍生物5a~5f浓度的增加,其对肝癌细胞的抑制率逐渐升高;在浓度为50 μmol·L-1时,与吴茱萸碱比较,衍生物5a对肝癌细胞的抑制率下降最多,衍生物5c稍微下降,衍生物5d、5e、5f略微升高,衍生物5b升幅最大。表明衍生物5a、5c对肝癌细胞的细胞毒性有所降低,衍生物5d、5e、5f略高,衍生物5b最高。
2.3 吴茱萸碱衍生物对内皮细胞的损伤
通过内皮细胞毒性实验,测定给予不同浓度的吴茱萸碱及其衍生物5a时人脐静脉内皮细胞HUVEC的存活率,结果见表2。
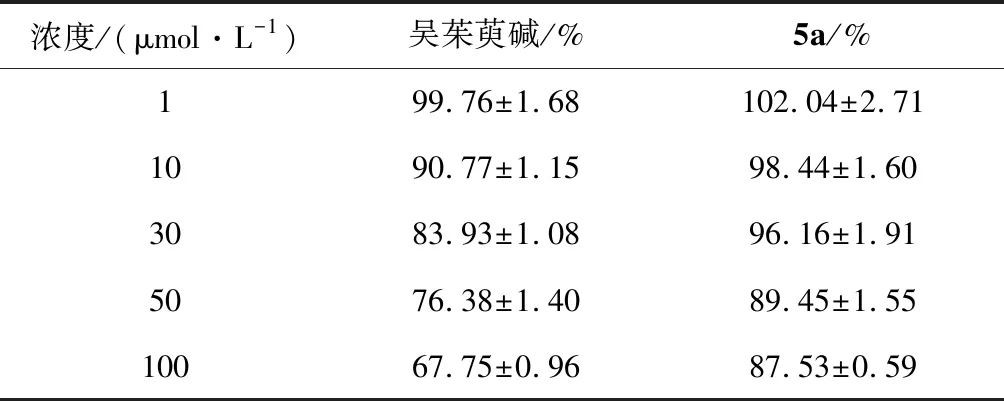
表2 给予不同浓度的吴茱萸碱及其衍生物5a时人脐静脉内皮细胞HUVEC的存活率
由表2可知,随着吴茱萸碱及其衍生物5a浓度的增加,人脐静脉内皮细胞HUVEC的存活率逐渐降低;同浓度下,给予衍生物5a时内皮细胞的存活率均高于给予吴茱萸碱时的。表明衍生物5a对内皮细胞的损伤较吴茱萸碱小。
2.4 吴茱萸碱与高血压的关联靶点
TCMSP数据库搜索显示吴茱萸碱的相关靶点有21个,GeneCards数据库搜索显示高血压的相关靶点有10 517个,二者关联靶点有5个:凝血因子Ⅶ、5-羟色胺受体3A、SRC-1、雄激素受体、eNOS。
凝血因子Ⅶ是外源性凝血途径的唯一启动因子,它在血栓形成过程中起关键作用,与心血管疾病有密切关系[17]。5-羟色胺可以通过5-羟色胺受体介导血管内皮功能障碍,造成血管收缩、血管平滑肌细胞增殖与迁移等过程,促进心血管疾病的发生发展[18];5-羟色胺受体3A是其中的一个亚科,向大鼠静脉注射其受体激动剂会引起血压明显升高[19]。SRC-1协同相关基因共同促进血管紧张素Ⅱ诱导的炎症性细胞因子(IL-6)的分泌,在高血压、动脉粥样硬化等心血管疾病的机体代偿机制中发挥重要作用[20]。雄激素受体是核受体家族的一员,是心血管系统的危险因子,可促进高血压的发生[21]。NO在血管张力调节中发挥至关重要的作用,而NO在内皮细胞上的合成受eNOS调控[22]。
2.5 分子对接结果
以血管舒张活性最强的吴茱萸碱衍生物5a为配体,分别与5个关联靶点凝血因子Ⅶ、5-羟色胺受体3A、SRC-1、雄激素受体、eNOS对接,结果见表3。

表3 分子对接结果
由表3可知,吴茱萸碱衍生物5a与5个关联靶点的结合能均较高,可以通过氢键、疏水作用和碳氢相互作用等多种方式进行对接。吴茱萸碱衍生物5a与凝血因子Ⅶ通过Gly216H、Ser190H形成氢键,对接良好;吴茱萸碱衍生物5a与5-羟色胺受体3A通过Asn101B形成氢键,与Trp156B产生π-σ相互作用,而且衍生物5a可深入5-羟色胺受体3A的口袋,对接良好;吴茱萸碱衍生物5a与SRC-1通过Gln301A形成氢键,与Tyr297A产生π-π堆积作用,对接良好;吴茱萸碱衍生物5a与雄激素受体通过Val685A形成氢键,与Arg752A产生π-正离子相互作用,对接良好;吴茱萸碱衍生物5a与eNOS通过Trp447A形成氢键,与Trp447A、Phe460B产生π-π堆积作用,对接良好。其相互作用模式如图3所示。

图3 吴茱萸碱衍生物5a与5个关联靶点的相互作用模式
由图3可知,噻吩环的存在对吴茱萸碱衍生物5a与5个关联靶点之间的碳氢相互作用有很大的影响,噻吩环并的六元环醚上氧原子的存在对氢键的形成起到了关键作用。表明这类吴茱萸碱衍生物舒张血管的作用机制可能是多靶点共同作用。
3 结论
简单高效合成了6个含噻吩结构的吴茱萸碱衍生物5a~5f,它们均对苯肾上腺素预收缩的大鼠肠系膜动脉血管具有舒张作用,其中衍生物5a的血管舒张活性较吴茱萸碱高。在浓度为50 μmol·L-1时,与吴茱萸碱相比,衍生物5a、5c对肝癌细胞的细胞毒性有所降低,衍生物5d、5e、5f略高,衍生物5b最高。衍生物5a对内皮细胞HUVEC的损伤较吴茱萸碱略小。衍生物5a与5个关联靶点的结合能均较高,可以通过氢键、疏水作用和碳氢相互作用等多种方式进行对接。含噻吩结构的吴茱萸碱衍生物舒张血管的作用机制可能是多靶点共同作用,具有进一步研究的意义。
