比色法和荧光法检测碱性磷酸酶活性的研究进展
2023-10-17吴泽熙韦涵玉王钰萱任乔稚胡娅琪赵灵芝
吴泽熙,韦涵玉,王钰萱,任乔稚,胡娅琪,赵灵芝
(西安医学院药学院,陕西 西安 710021)
碱性磷酸酶(alkaline phosphatase,ALP,EC 3.1.3.1)是一种非特异性酯酶,广泛存在于哺乳动物组织和器官(如骨骼、肝脏、肾脏、肠道、胎盘等)中,可催化底物水解去磷酸化,底物包括生物大分子和有机小分子[1]。ALP参与多个生理、病理过程,在基因转移、细胞代谢等生物过程中起关键作用。临床研究表明,血清ALP活性的异常升高与许多疾病有关,因而ALP被作为诊断各种疾病包括乳腺癌、前列腺癌、肝炎、骨病和糖尿病等的重要标志物[2-4]。
目前,ALP活性检测方法主要有比色法、色谱法、化学发光法、电化学法、电化学发光法、荧光法、表面增强共振拉曼散射法(SERRS)等[5-10]。比色法和荧光法均是基于光学检测技术建立的分析方法,比色法在ALP活性检测中有着较长的历史,具有肉眼可视、操作简单、分析时间短、灵敏度高、成本低等显著优点,可结合纸芯片用于现场快速检测;荧光法具有高灵敏度、非侵入、原位检测和实时成像等优点,被广泛应用于生物活性分子标记、细胞染色和临床医学检验诊断等方面。随着合成技术的突飞猛进,新型纳米材料以及新的探针分子不断涌现,为快速准确检测ALP活性提供了新的思路。
鉴于ALP与多种疾病密切相关以及ALP被广泛用作酶免疫分析中的标记酶,建立简便、灵敏、准确、高效的ALP活性检测方法对人体健康监测、临床诊断和基础研究都具有重要意义。因此,作者着重对近10年发展的用于ALP活性检测的比色法和荧光法策略以及检测机理进行综述,并对其应用前景进行展望。
1 ALP催化的反应和ALP荧光探针检测原理
在碱性环境下,ALP可以催化许多磷酸化物质(S-P,包括核酸、蛋白质和生物小分子)水解生成相应产物(S)和磷酸根离子(Pi),如图1[10]所示。

图1 ALP催化的反应
荧光探针的设计原理主要基于ALP的去磷酸化功能,将荧光探针设计为ALP的底物。从结构上看,这些荧光探针是对母体荧光团直接磷酸化,即探针由荧光团和识别基团即磷酸基通过一个酯键连接起来。当ALP存在时,识别基团磷酸基与ALP发生选择性反应,即荧光探针被去磷酸化造成探针分子结构的改变和内部电子的重新排列,从而引起光学性质发生明显的变化。Wei课题组[11]基于该原理设计了一种ALP近红外荧光探针(图2),酚羟基磷酸化的探针没有荧光或有弱荧光信号,在ALP存在时,探针去磷酸化使酚羟基裸露,酚羟基进一步去质子化后发生分子内电荷转移从而使探针在683 nm处发出较强的荧光,基于探针去磷酸化前后荧光的变化可检测ALP活性。该探针实现了内源性ALP活性成像,具有较高的时间分辨率,特别是成功地用于腹膜腔和酸性肿瘤环境中ALP活性成像,在不同pH值活组织中均有优异表现。此外,多种荧光团(包括罗丹明类、荧光素类、香豆素类、试卤灵类、菁染料类、BODIPY类等)通过羟基磷酸化设计为ALP底物[9],从而发展为ALP荧光探针。

图2 ALP近红外荧光探针的结构和检测原理
ALP的底物具有多样性。多种物质的磷酸酯均可作为ALP的底物,例如:抗坏血酸磷酸酯、酚类物质磷酸酯等;多种荧光团通过羟基磷酸化也可作为ALP的底物;一磷酸盐、双磷酸盐、聚磷酸盐、三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、单磷酸腺苷(AMP)等也可作为ALP的底物。底物多样性为ALP活性检测提供了多种可能性。研究者基于底物或去磷酸化产物发展了多种ALP活性检测方法。
2 基于ALP酶解产物酚类物质发展的比色法和荧光法
酚类物质磷酸酯作为ALP底物,在ALP催化下能发生水解生成相应的酚。酚类物质的化学性质因其苯环上取代基的不同而不同,所以可根据产物不同的性质建立相应的ALP活性检测方法。
磷酸苯二钠可作为ALP的底物。Kay等[12]早在1935年就基于磷酸苯二钠被ALP催化水解得到的去磷酸化产物苯酚发展了ALP比色法(图3a),显色探针是苯酚与4-氨基安替吡啉作用生成橙红色物质,以其定量苯酚,进而定量检测ALP活性。McComb课题组[13]以对硝基苯磷酸盐(p-nitrophenyl phosphate,p-NPP)作为ALP的底物,在ALP 催化下,无色的p-NPP去磷酸化生成黄色产物对硝基苯酚(p-NP),基于p-NP的明显显色反应,创建了ALP活性检测比色法(图3b)。这两种方法均是基于ALP酶解产物酚类物质引发的显色反应创建的比色法,操作简单,反应时间短,已被广泛应用于临床诊断和其它领域。
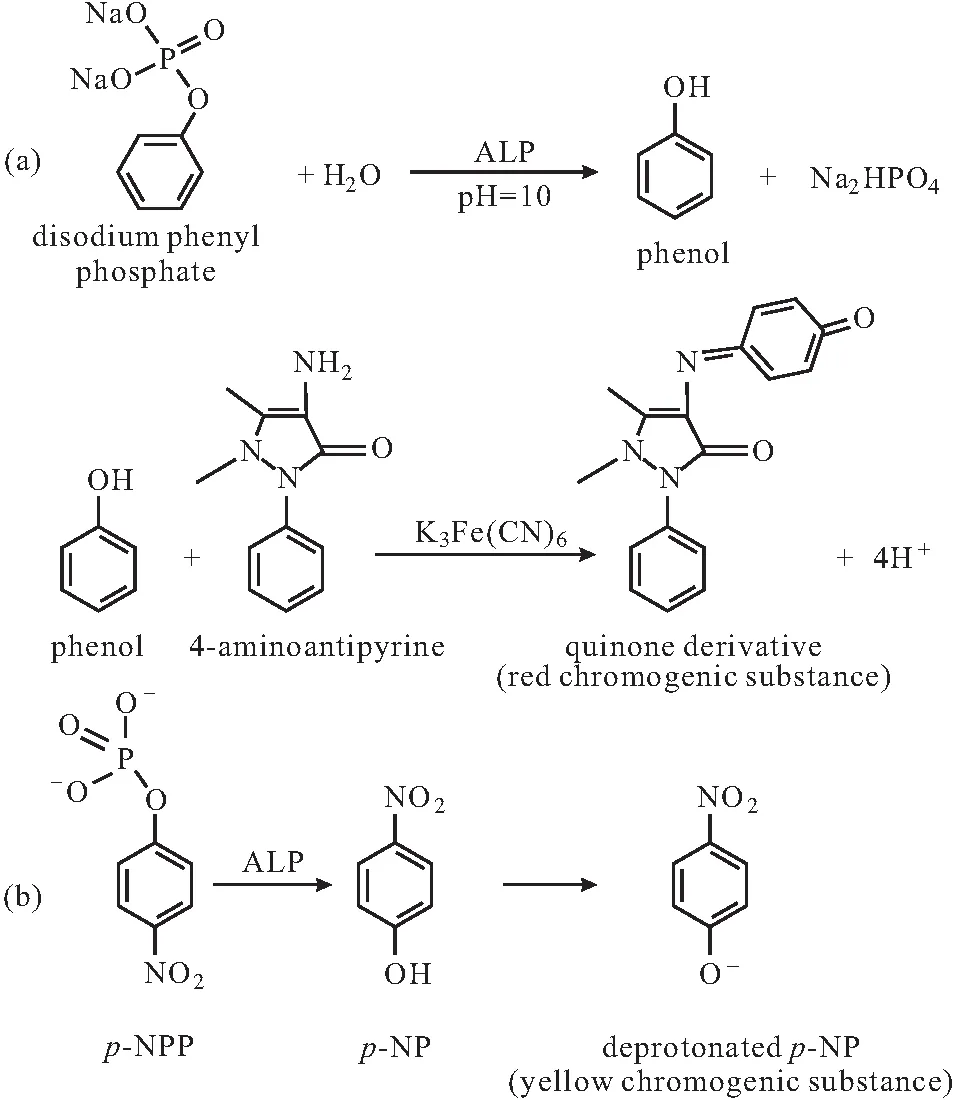
图3 以磷酸苯二钠(a)和对硝基磷酸苯(b)为底物的ALP活性检测比色法
因为p-NP分子结构中的硝基对多种发光纳米材料以及荧光探针具有强烈的猝灭作用,而p-NPP却不具有这种猝灭作用,近10年来,基于底物p-NPP和去磷酸化产物p-NP性质的差异,创建了多种ALP活性检测荧光法。Wang课题组[14]基于p-NP对多巴胺和间苯二酚现场形成的荧光探针具有较强的猝灭作用,建立了一种ALP活性检测荧光法;Zhai课题组[15]基于p-NP对谷胱甘肽修饰的金簇具有较强的猝灭作用,实现了ALP活性的荧光分析;基于p-NP通过内滤效应对发光纳米材料(铜簇、银簇、碳量子点等)的猝灭作用创建的ALP活性检测荧光法也相继被报道[16-18]。
此外,有些酚类物质具有较强的还原性,如对氨基苯酚和对苯二酚,其可作为还原剂与纳米材料前体通过一步混合生成发光纳米材料。Yang课题组[19]以对苯二酚单磷酸酯为底物,在ALP催化下产生对苯二酚,通过对苯二酚还原N-(3-(三甲氧基硅基)丙基)乙二胺(DAMO)生成发光材料含硅聚合物量子点,通过酶促反应前后荧光的变化建立了ALP活性检测荧光法。
3 基于ALP酶解产物抗坏血酸发展的比色法和荧光法
ALP能催化一磷酸底物2-磷酸抗坏血酸(2-phospho-L-ascorbic acid,AAP)去磷酸化生成抗坏血酸(L-ascorbic acid,AA),基于底物AAP不具有还原性而产物AA具有较强的还原性,发展了ALP活性检测方法。Zhang课题组[20]基于AA的还原性,以水溶性Fe2+-邻二氮菲配合物作为显色剂,发展了可视化ALP活性检测方法。在ALP存在下,水解底物AAP生成AA,AA良好的还原性可将Fe3+还原为Fe2+,Fe2+自发和邻二氮菲配位生成红色Fe2+-邻二氮菲配合物,该配合物在可见光区产生强烈的金属-配体电荷转移(metal-to-ligand charge-transfer,MLCT)吸收带,吸收强度与ALP的酶解产物AA量成正比,以此来定量检测ALP活性。
除Fe3+/Fe2+外,AA良好的还原性可用于调节多个氧化还原电对,包括Cu2+/Cu+/Cu[21]、Ag+/Ag[22]、Mn4+/Mn2+[23-24]、Ce4+/Ce3+[25]等。Li等[21]基于AA对氧化还原电对Cu2+/Cu+/Cu的调节,发展了ALP活性检测荧光法,并构建了ALP荧光生物传感器(图4)。ALP的酶解产物AA将Cu2+还原生成中间体Cu+,Cu+附着双链DNA发生歧化,形成双链DNA为模板的铜纳米簇(dsDNA-templated CuNCs),在340 nm光激发下,铜纳米簇在570~600 nm处发出较强的荧光,荧光强度与ALP量成正比,据此可定量检测ALP活性。将ALP荧光生物传感器应用于ALP标记的免疫分析,通过荧光强度检测免疫球蛋白G(IgG),检测限达7 pg·mL-1,为常规酶联免疫分析提供了一种简便、灵敏的荧光检测法。

图4 基于ALP引发的荧光铜纳米簇原位合成的ALP荧光生物传感器
多种纳米材料,包括金纳米颗粒、金属有机框架材料(MOFs)、二硫化钼(MoS2)、二氧化锰纳米片层(MnO2nanosheet)、羟基氧化钴纳米片层(CoOOH nanoflakes)等,具有酶的活性,如:具有氧化酶或者过氧化物酶的性质,被称为纳米酶。纳米酶可直接氧化或催化H2O2氧化3,3′,5,5′-四甲基联苯胺(TMB)、2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)或邻苯二胺(OPD)等无色或浅色底物生成有色产物,即TMB、ABTS或OPD可作为比色探针。AA良好的还原性可影响多种纳米酶的氧化酶或过氧化物酶活性,促使纳米酶和比色探针构成的体系发生颜色改变。基于AA将具有猝灭作用二氧化锰纳米片层还原为Mn2+[27]或将羟基氧化钴纳米片层还原为Co2+,导致纳米材料形貌发生改变或结构被破坏从而失去对荧光探针的猝灭作用[28-29],建立了ALP活性检测荧光法(图5)。Liu课题组[26]基于AA将普鲁士蓝纳米材料(Prussian Blue nanocubes,PBNCs)还原为普鲁士白(Prussian White,PW),使其失去过氧化物酶活性,在H2O2存在下不能使探针TMB显色,发展了ALP活性检测比色法;Zhao[23]基于AA将MnO2纳米片层还原为Mn2+,使其失去氧化酶活性,不能使探针TMB显色,发展了ALP活性检测比色法。
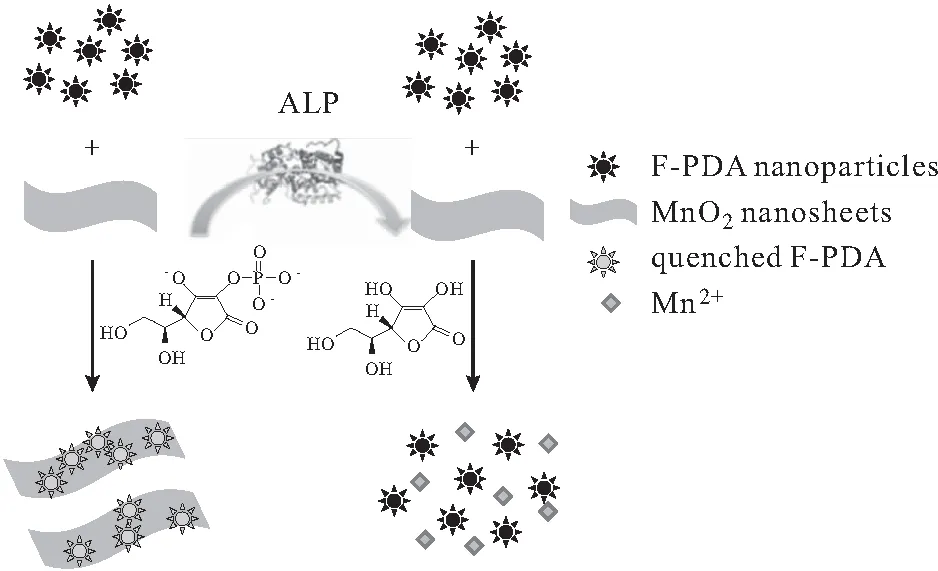
图5 以MnO2为猝灭剂基于荧光共振能量转移作用发展的ALP活性检测荧光法
上述基于ALP酶解产物AA发展的比色法和荧光法,均是基于AA较强的还原性创建的。考虑到生物体内还有其它还原性物质,如多巴胺、五羟色胺、谷胱甘肽、半胱氨酸、同型半胱氨酸等,基于AA还原性发展的比色法和荧光法用于生物体内ALP活性检测时选择性有待提高。
4 基于ALP底物焦磷酸盐离子发展的比色法和荧光法
ALP能催化二磷酸底物如焦磷酸盐离子(PPi)水解成2个Pi,PPi能够与某些金属离子(如Cu2+、Fe3+、Tb3+等)强烈配位,而Pi配位能力较弱甚至不能发生配位,基于PPi、Pi与金属离子配位能力的差异,发展了多种检测ALP活性的比色法与荧光法。Jiang课题组[30]以石墨相氮化碳纳米片(graphitic C3N4nanosheets,g-C3N4)为荧光探针,Cu2+通过光诱导电子转移作用(photo-induced electron transfer,PET)对g-C3N4荧光有非常强的猝灭作用,导致g-C3N4荧光明显减弱;当PPi存在时,PPi取代g-C3N4与Cu2+优先形成配合物,使g-C3N4的荧光得到恢复,基于恢复的荧光可定量PPi,进一步发展为ALP活性检测荧光法(图6),检测限达0.08 U·L-1。Kailasa课题组[31]和Ye课题组[32]也基于Cu2+对纳米材料荧光的猝灭作用和Cu2+与PPi强烈的配位作用,发展了ALP活性检测荧光法。

图6 利用荧光g-C3N4纳米片进行ALP活性检测的无标记荧光分析示意图
除了通过PPi与发光材料竞争配位猝灭剂金属离子发展起来的PPi与ALP活性检测方法外,PPi与某些金属强的配位能力还表现在PPi能直接影响这些金属纳米材料或MOFs的发光性能或模拟酶活性,基于该策略已发展了多种PPi与ALP活性检测的比色法和荧光法。Tan课题组[33]通过一步混合法合成了Cu2+-联吡啶金属有机框架配合物(Cu-MOFs),该配合物具有过氧化物酶活性,在H2O2存在下能使比色探针ABTS氧化显色;PPi吸附于Cu-MOFs,促使其过氧化物酶活性减弱,比色探针ABTS褪色,基于此发展了PPi与ALP活性检测比色法(图7)。Chen课题组[34]通过PPi直接影响发光材料Fe/Eu-MOF过氧化物酶活性,发展了可通过比色和荧光双重定量PPi与ALP活性检测比色法。

图7 基于PPi介导的Cu-MOFs催化活性改变的ALP活性检测比色法
5 以ALP底物其它磷酸化物发展的比色法和荧光法
底物在ALP催化下发生水解去磷酸化后均可生成Pi,Pi能与某些金属离子(如Ce3+或Ce4+)发生配位生成配合物或沉淀,使金属离子浓度降低,从而造成体系颜色、吸光度或者荧光的改变,根据这些变化能够检测ALP活性。Peng课题组[35]以碳量子点为荧光探针,以ATP为ALP底物,Ce3+与碳量子点表面的羧基配位导致碳量子点发生聚集性荧光猝灭;在ALP和ATP共存时,ALP能够催化降解ATP释放Pi,产生的Pi与Ce3+形成沉淀CePO4,从而使碳量子点重新呈现分散状态,荧光得到恢复,基于此发展了ALP活性检测荧光法;该检测体系因为生成了沉淀物CePO4容易从体系中去除,因而可循环使用3次以上。Long课题组[36]以磷酸苯酯(phenyl phosphate,PP)为ALP底物,酶促产物Pi对发光材料锆类MOFs UiO-66-NH2的荧光具有增强作用,通过荧光的变化可定量检测ALP活性。
单磷酸腺苷AMP和GMP可作为ALP底物,它们由一个碱基和一个磷酸基组成,多次作为配体与镧系金属离子如Tb3+和Eu3+形成MOFs。当ALP存在时,促使AMP和GMP去磷酸化形成腺苷,从而失去与中心离子的配位能力,MOFs结构受到破坏导致荧光或其它光学信号发生改变,基于此发展了多种ALP活性检测光学法。Deng等[37]在室温下采用一步混合法合成了包裹香豆素的Tb-GMP纳米颗粒,并以其为荧光探针,ALP催化GMP去磷酸化形成腺苷G,从而导致Tb-GMP结构破坏,包裹的香豆素释放出来,造成上清液荧光增强,基于此发展了ALP活性检测荧光法(图8)。在此基础上,Deng课题组[38]进一步合成了以纳米金为核,表面包一层Tb-GMP的核壳结构纳米材料,Tb-GMP在365 nm光激发下,在490 nm、545 nm、690 nm处均发出较强的荧光,ALP催化GMP去磷酸化,从而导致表层Tb-GMP结构破坏,纳米金核裸露出来;即在ALP存在时,荧光随着Tb-GMP结构破坏迅速衰减,520 nm处吸光度随着纳米金的裸露逐渐增大,基于荧光强度的减弱和吸光度的增大可双重定量检测ALP活性。Deng课题组将所创建的检测法用于监测水体富营养化过程中ALP的周期性变化,对水体富营养化的管理和预警具有重要意义。

图8 用刺激响应性coumarin@Tb-GMP作为荧光探针进行ALP活性检测示意图
6 展望
近10年来,基于ALP底物多样性设计和创建了多种检测ALP活性的比色法和荧光法,具有简便、绿色、快捷等优点,可用于多种生物体液或免疫标记中ALP活性的分析研究。通过对ALP活性检测研究的回顾,今后可在以下几方面深入研究:首先,现有的检测法依然存在灵敏度不高、选择性不好等缺陷,迫切需要通过设计新的磷酸化底物或者酶解产物,提高酶催化效率,增强响应信号,建立新的ALP活性检测方法;其次,纳米材料和新的显色探针制约着ALP活性检测方法的持续快速发展,因而开发出更多的新型材料是未来构建灵敏度高、选择性好的ALP活性检测方法的研究热点;最后,应将发展成熟的检测体系从溶液中转移到固相表面,设计相应的检测试纸,开发智能手机应用程序,最终发展为高效便携的即时检测设备,使发展的检测法应用于临床诊断分析和现场快速检测,满足当今社会的实际分析需求。
