核酸介导功能纳米材料的合成方法及应用
2023-10-17郝强军彭汉勇
郝强军, 叶 子, 温 蓓, 彭汉勇
(1. 中国科学院生态环境研究中心, 环境化学与生态毒理学国家重点实验室, 北京 100085;2. 中国科学院大学杭州高等研究院, 环境学院, 杭州 310024;3. 中国科学院大学, 北京 100049)
随着纳米材料研究的深入进行, 对高效、 精准合成纳米材料的需求日益增加[1]. 纳米材料的合成方法主要包括电或化学还原法、 沉淀法、 水解法及热解法等[2], 但由于化学合成的反应体系中影响因素较多, 纳米材料形貌控制机理尚未完全清晰, 包括尺寸、 晶面、 缺陷、 配位数及界面等[3], 而纳米材料形貌的变化会引起其理化性质和功能的改变, 导致材料性能不稳定[4~6]. 为解决这一难题, 常采用模板法提高化学合成方法对纳米材料形貌的控制, 同时模板自身性质可以增加材料功能的多样性. 常见的合成模板包括二氧化硅、 碳纳米管、 聚合物、 表面活性剂和核酸链等[7,8]. 相较于其它模板材料, 核酸分子具有毒性低、 结构稳定等优点, 因此, 基于核酸链介导构建复杂的纳米结构材料成为纳米技术的重点研究方向之一[9].
将不同序列的核酸链通过链组装方式构建出有序的纳米结构, 作为后续合成纳米材料的模板, 在调控纳米材料结构与形貌方面展现出良好的性能[10,11]. 核酸链作为一种长链生物分子, 尺寸可调, 稳定性和生物相容性高, 可与离子作用的活性位点多, 已在金、 银、 铜、 铂及硅等不同类型的纳米材料合成中得到应用[12,13]. 利用核酸链模板调控纳米颗粒的生长, 对颗粒形貌进行精准调控, 生成新形貌的纳米材料, 能够带来新的理化性质, 同时改善了纳米材料尺寸的均一性. 核酸介导的纳米材料兼具核酸和纳米材料的优异性能, 在分子检测[14]、 催化[15~17]、 生物医学成像和疾病治疗[18~22]等领域具有广泛的应用前景[23,24].
1 核酸介导纳米材料合成的基本原理
核酸包括脱氧核糖核酸(DNA)与核糖核酸(RNA), 由糖-磷酸骨架构成基本骨架, 遵循Waston-Crick碱基互补配对理论, 所包含的核苷酸序列决定了DNA或RNA的结构和功能. DNA双链具有稳定的双螺旋结构, 在B 型DNA 双螺旋结构中, 相邻碱基对的间距为0.34 nm, 螺旋直径2 nm[25~27][图1(A)], 而单链DNA则随序列和存储条件的变化生成多种不同构象[28], 骨架上有更多的自由活性基团, 能够通过静电、 氢键与金属离子相互作用, 因此通过核酸介导金属纳米材料的合成主要采用单链DNA(ssDNA)[29]或单链RNA(ssRNA)[30].
核酸链中磷酸基团和杂环上的氮、 氧原子都呈负电性, 为金属阳离子提供了不同的结合位点[25,31,32]. 在生理pH条件下, 碱基A 中的N1, N3和N7对正电荷H+的亲和力大小顺序为N1>N7>N3, 其中N1是金属阳离子的主要结合位点, 仅在强酸性条件下N1被质子化时, N7才参与结合. 碱基C与金属阳离子结合的位点有: N3, C2=O和C4—NH2. 在pH=7~9时, 碱基T或U的N3丢掉质子, 与过渡金属离子(如Hg2+, Pt2+等)有较强的结合能力, 同时还有另外两个位点C2=O 和C4=O. 碱基G 中N7和C6=O 是金属阳离子的主要结合位点, 与N7结合的金属离子能够同时与C6=O 发生作用, 形成稳定的络合物[33,34][图1(B)]. 碱基通过强配位相互作用在DNA与金属结合过程中起主要作用[35~37], 而疏水相互作用或范德华力的作用都是在杂环氮原子和外环官能团, 与配位作用相比作用力较弱.
碱基性质差异影响了不同序列DNA或RNA与金属离子的相互作用, 改变了核酸链表面金属离子的结合状态, 从而为金属纳米材料生长提供了多样性. 如, 在核酸介导AuNPs的生长过程中, 采用不同碱基DNA链作为模板, 能够产生不同形状的纳米材料, 其中碱基与Au核的亲和力影响金纳米颗粒(AuNPs)的最终形状, 亲和力大小顺序为A>C>G>T. 碱基在金表面上的迁移率影响AuNPs 的粗糙度,迁移率大小顺序为A<G≈T<C. 聚腺嘌呤核苷酸(poly A)是DNA中唯一导致形成表面粗糙颗粒的寡核苷酸. 碱基A与Au核结合最稳定, 在表面上的迁移率较低, Au仅生长在DNA未结合的位置, 生成粗糙的表面; 而碱基C在Au核表面则相对自由, Au均匀生长产生光滑的表面[38].
在核酸链介导纳米材料的生长过程中, 金属在磷酸盐骨架上有规律地沉积, 提高了纳米材料粒径的均一性, 并减少了团聚[34,35]. Hinds等[39]提出的生长过程如下: (1) 起始阶段: 核酸链上的碱基与金属阳离子结合, 形成核酸-金属结合的纳米小簇前体; (2) 颗粒生长阶段: 纳米小簇通过电荷相互作用向热力学更稳定的方向上聚集, 形成大团簇; (3) 反应终止阶段: 当颗粒达到临界尺寸时, 核酸链在纳米颗粒表面形成静电壳层, 终止生长过程, 并抑制纳米颗粒团聚, 保持良好的分散性.
2 核酸介导不同纳米材料的合成策略
在核酸介导纳米材料合成过程中, 核酸主要通过两种方式介导纳米材料生长: 一种是作为模板,通过对核酸序列进行编程设计, 形成具有特定三维结构的模板, 通过核酸模板与金属离子相互作用沉积在模板上, 从而生成特定形状的纳米材料; 另一种是作为种子, 通过非特异性吸附或化学键将核酸组装在纳米颗粒表面, 制备核酸修饰的晶核, 再加入金属离子与核酸相互作用, 在晶核表面生长形成更大的颗粒. 本节综述了主要的几种不同材质纳米材料在不同化学反应类型(包括还原法、 沉淀法和水解法等)下, 使用核酸介导纳米材料生长的合成路线、 机理、 形貌表征和影响因素等.
2.1 还原法合成DNA介导金、 银、 铜、 铂纳米颗粒
金、 银、 铜、 铂金属离子通过与DNA链相互作用, 在DNA链周围富集后, 加入还原性试剂, 如硼氢化钠(NaBH4)、 柠檬酸和对苯二酚等, 可将金属离子还原成单质或稳定金属化合物, 从而在DNA链上沉积生长[27][图2(A)].
在金纳米晶核上修饰不同碱基组成的单链DNA 能够对后续金纳米外壳的生成进行调控[38][图2(B)], 控制颗粒的形状[40]. 如, poly A合成的纳米颗粒是具有粗糙表面的圆形纳米片; 聚胸腺嘧啶核苷酸(ploy T)介导的纳米颗粒生长成六角纳米星; 聚胞嘧啶核苷酸(poly C)合成的颗粒是具有光滑表面的圆形纳米片; 而由聚鸟嘌呤核苷酸(poly G)产生的颗粒则为六边形纳米片. 这是由DNA与AuNPs晶面的亲和力及碱基在金表面上的迁移率所决定的, 嘌呤比嘧啶更强烈地吸附在金表面上, 引导金纳米种子向不同的方向生长. 通过DNA折纸术构建不同结构的DNA模板也能对纳米材料的形貌进行精准控制[41.42][图2(C)]. 带正电荷的金纳米簇(AuNCs)被吸附在带负电荷的DNA折纸模板上, 形成预种子结构, 加入Au+后金离子被还原并聚集在金簇上, 最终生长成特定形状的金纳米材料, 其形貌与DNA折纸模板相匹配, 合成出环形、 杆状和片状金纳米结构. Harb 等[43]在DNA 折纸模板上制备出金纳米线. DNA折纸结构上修饰特定的延长DNA序列, 通过碱基互补配对将DNA修饰的AuNPs附着到加长的主链上, 高密度延伸的DNA链使AuNPs能够紧密地堆积在DNA折纸修饰的区域中.
DNA介导银纳米颗粒(AgNPs)的生长同样也受模板链上碱基组成的影响, 但生成的颗粒形貌却与AuNPs不同. 银纳米棱柱由poly C和poly G介导合成, 而银束和银盘分别由poly A和poly T介导合成.DNA对AgNPs具有不同的亲和力(C>G>A>T), 较高的结合亲和力导致Ag+的沉积速率较慢, 生长速率较慢[44]. DNA介导AuNPs的形貌高度依赖于碱基组成及其二级结构, 但DNA的长度对AgNPs的生长几乎没有影响[45]. 在DNA 折纸术构建的三角形模板上, ssDNA 被延伸出DNA 折纸模板, 通过静电吸附Ag+离子, NaBH4的加入使Ag+还原为Ag0, 并在DNA模板架上形成簇, 使银纳米团簇(AgNCs)选择性结合在单链区域, 从而精准控制后续AgNPs的生长位点[46]. 不同序列的单链DNA形成具有不同荧光发射波长的AgNCs, 荧光特异性合成的机理归因于DNA模板对延伸链构象的空间位阻效应, 导致优先合成具有特定尺寸分布的荧光AgNC 混合物. 利用AuNPs 作为底物, 将ssDNA 接枝在AuNPs 上作为AgNPs的合成模板. DNA修饰的AuNPs在含硝酸银(AgNO3)、 聚乙烯吡咯烷酮和抗坏血酸钠的反应体系中合成了金-银纳米蘑菇结构[47]. 此外, 通过电化学辅助还原法能制备DNA介导银纳米线, 将DNA负载到电极上后, 浸泡在Ag+溶液中一段时间, 随后采用库仑法电解还原DNA链上的Ag+, 使Ag+沉积在DNA链上成为银纳米线[48].
DNA适配子与金属离子亲和力强, 既可以与金属离子高效、 稳定结合, 又能作为模板介导金属纳米材料的生长[图2(D)][49]. Jia等[50]在DNA折纸模板上预留Cu2+结合位点, 通过位点选择性生长, 制备二维铜纳米图案, 在纳米尺度上模仿印刷电路板. Pt2+与ploy G之间的相互作用力较强, 形成金属配合物. Pt(Ⅱ)复合物与1个或2个碱基G结合, 形成Pt与DNA复合物, 其中最有利的结合位点是碱基G中的N7位置, 水解的Pt 配合物在几分钟内配位. 之后, 将二甲胺硼烷加入溶液中, 将Pt(II)还原为金属铂, Pt在还原过程中沿着DNA链生长, 产生超薄的规律性金属簇项链[32].
还原法是目前最主要的DNA介导纳米材料合成方法, 金属均匀沉积在整个DNA结构上, 但当还原反应速率过快时, 存在金属不在DNA支架上沉积的问题, 导致产物结构粗糙和不规则. 此外, 有些还原剂会破坏DNA结构, 并残留在纳米颗粒产物上, 影响后续使用. 因此, 仍需开发沉积位点选择性更高、 降低溶液中金属均相成核的合成方法[27], 如将还原基团(醛基、 硼烷)修饰在DNA上, 赋予DNA模板、 还原剂和封盖剂等功能[51].
2.2 沉淀法合成DNA介导铁、 锌、 锡纳米颗粒
铁、 锌等金属纳米颗粒的合成通常采用沉淀法, 通过调节溶液pH值, 可使金属离子在DNA模板链上析出, 生成纳米尺寸的金属氧化物沉淀颗粒. Fe2+离子通过与DNA配位结合, 自组装生成杂化纳米球[图3(A)]. Fe2+与DNA的摩尔比、 DNA碱基组成等均会影响Fe-DNA 纳米颗粒的形貌和尺寸[52]. 结合在DNA磷酸骨架上的Zn2+在碱性条件下生成Zn(OH)2沉淀[图3(B)], 通过加热促使其分解为稳定的ZnO颗粒. ZnO纳米颗粒沿着DNA链形成, 生成的颗粒形貌受DNA结构调控[53]. 受ZnO纳米颗粒合成的启发, SnO2纳米颗粒也可以通过沉淀法在DNA 链上实现自组装[54][图3(C)]. SnCl2提供的Sn2+与DNA结合, 在碱性条件下形成Sn(OH)2沉淀, 通过加热搅拌促使其分解为稳定的SnO2颗粒. 沉淀法合成DNA介导纳米材料的反应时间短、 过程清晰、 成分简单, 但其合成原理主要是依靠金属离子沉淀反应, 可利用其与DNA碱基的亲和力不同来调控纳米颗粒的尺寸及形貌.

Fig.3 Synthesis of DNA-mediated Fe, Zn and Sn nanoparticles by precipitation
2.3 水解法合成DNA介导无机硅纳米材料
无机材料的可控合成具有较高的难度, 是纳米材料研究领域的重要研究方向之一. DNA介导的无机材料合成为精准控制纳米材料的生长提供了一种新的手段. Liu等[55]报道了一种通过N-[3-(三甲氧基硅基)丙基]-N,N,N-三甲基氯化铵(TMAPS)和正硅酸四乙酯(TEOS) 共水解DNA 折纸的硅化方法[图4(A)], 合成了二氧化硅纳米材料. 将溶液中预水解后带正电的二氧化硅簇吸附到DNA折纸结构上, 随着进一步生长, 二氧化硅簇最终在DNA 折纸结构的表面形成均匀的二氧化硅层. 随后,Nguyen等[56]通过溶胶-凝胶法进一步优化了文献[55]的合成方案[图4(B)], 采用TMAPS作为共结构导向剂(CSDA). 该化合物含有一个带正电荷的季铵基团及硅氧烷基团, 为二氧化硅前体四乙氧基正硅酸盐(TEOS)提供结合位点, 从而使二氧化硅直接在DNA折纸结构上生长. 该方法无需将二氧化硅前体事先吸附到DNA折纸结构表面上即可实现单个DNA折纸物体在溶液中的硅化. Ding等[57]组装出不同图案的DNA折纸模板, 控制二氧化硅在模板上的生长位点, 生成与图案一致的无机硅材料. 整个过程分为两个阶段: 第一阶段, 两种硅烷前体在碱性环境中迅速水解并形成小的带正电荷的二氧化硅簇;第二阶段, 带正电荷的二氧化硅簇通过静电相互作用缓慢接近DNA纳米结构表面, 在DNA纳米结构上形成均匀稳定的二氧化硅壳[图4(C)].

Fig.4 DNA mediated inorganic silicon
2.4 还原法合成RNA介导钯纳米材料
与DNA性质相似, RNA介导纳米材料的形貌同样受到碱基序列的调控. Pd是最常见的研究对象,通过体外选择能够合成六角型Pd颗粒的RNA序列(Pdases). 将RNA序列与Pd颗粒一起孵育, 以RNA为封端剂, 抗坏血酸为还原剂, 可以控制Pd颗粒的生长. 5个吡啶基修饰的RNA序列(Pdases)可以合成出六角板形的Pd 颗粒, 而6 个非相关吡啶基修饰的RNA 序列在相同条件下合成出立方Pd 颗粒[58].这证明了全长Pdases含有活性位点, 能够作为颗粒形状控制的介导剂, 对有机金属配合物进行特异性的分子识别. 将修饰硫醇基团突出链与DNA折纸结合, 然后与Pd前驱体混合. Pd2+吸附在DNA折纸表面的巯基位点上. 通过NaBH4进一步还原Pd2+离子, 使其生长成DNA 折纸上预先定义的形状[59]. 此外, 另一种合成Pd 的方法是将RNA 共价固定在AuNPs 表面上, 以AuNPs 作为载体, 组装六方和立方Pd纳米颗粒的Pdase 共价连接到Au 底物上. 在此过程中, 单个RNA 分子足以使纳米颗粒成核并控制这些粒子的形状. 将形成Pd 六方体的RNA 编码与Pd 立方的RNA 编码与金载玻片结合, 在含有[Pd2(DBA)3]的溶液中培养后, 在金载玻片自发还原形成了不同的六边形和立方Pd颗粒点[60].
2.5 沉淀法合成RNA介导镉、 铅纳米材料
RNA可作为合成CdS纳米颗粒的模板, 将含有Cd2+, S2-和转运RNA(tRNA)的溶液一锅法沉淀合成CdS纳米颗粒, tRNA介导合成的CdS纳米颗粒是平均直径为4.4 nm的球形颗粒. 与普通的CdS纳米颗粒相比, RNA 介导的CdS表现出完全不同的电子、 光子和生物效应[61]. 在介导CdS纳米颗粒生长过程中, 核苷酸在晶体的成核、 生长和钝化过程中发挥重要作用. RNA也是纳米PbS颗粒成核和生长的有效基质[62]. 在pH=9.8时, 将SH-加入到含有RNA的Pb2+溶液中, 沉淀生成包封RNA的PbS小颗粒, 而在不添加RNA的情况下, PbS颗粒快速团聚, 生成大颗粒[63].
3 核酸介导纳米材料的应用
纳米材料的形态决定其光学、 催化及生物相容性等物理和化学性质. 核酸作为一种可编程精确控制结构的材料, 在介导纳米颗粒形成的过程中极大提高了对纳米材料形貌和尺寸的控制精度, 从而能够对纳米材料性质进行调控, 拓展了纳米材料的应用领域.
核酸介导合成纳米材料能够产生独特的光学性质. DNA介导合成的AgNCs能够通过改变DNA模板来调节发射光颜色[64,65], 采用4条不同序列和长度的DNA链介导合成AgNCs, 发射光波段分别在橙色区域、 红色区域和近红外区域等. 影响发射波长的因素包括寡核苷酸长度和碱基序列, C和G各自具有羰基氧和双键环氮, 而A仅具有双键环氮, T(U)仅具有羰基氧, 这两个位点的存在影响发射波长的稳定性. 银簇与各种ssDNA 序列之间的相互作用也可能会影响到发射波长, 银簇是通过核碱基的π-π堆积或特定原子(氮或氧)相互作用. 4个碱基序列中, G与银簇结合强烈, T更倾向于通过特定的原子(O4)与Ag 团簇结合, 而其它的碱基更倾向于通过π-π堆积结合. 同时还能通过DNA 序列调节AgNCs上转换发光功能[66]. 此外, 生长在dsDNA上的AgNPs具有手性光学性质, 是由于多核苷酸固有的螺旋手性对AgNPs不对称的生长诱导[67]. 只有生长在DNA模板上的AgNPs才有手性光学性质, 而在溶液中生长后再与dsDNA结合的AgNPs 则没有. 由于DNA和RNA的碱基类型和结构的不同, 诱导合成的纳米材料在光学性质上有很大差别. DNA 模板合成的PbS NPs 的最大发射波长在1100 nm 处[62],而RNA模板合成的PbS NPs的最大发射波长则在可见光区域~675 nm处[63].
金属纳米颗粒的尺寸、 结构和形状影响着纳米材料的催化活性, 通过核酸控制纳米材料的合成能够调节其催化性能. 锇纳米颗粒在烯烃氢化过程中的催化效果较差, 但DNA介导合成的锇颗粒在催化环己烯转化方面却表现出高活性和良好的重复使用性[68], 其主要原因是DNA 介导下锇纳米颗粒的尺寸超小和比表面积高. 通过DNA介导能够在氧化石墨烯表面合成超细且均匀分布的CoAuPd NP[69], 在甲酸脱氢过程中, CoAuPd/DNA/氧化石墨烯复合材料比单一组分的材料具有更高的催化活性.
核酸介导可以提高纳米颗粒的分散性, 具有更好的生物相容性, 促进纳米材料在疾病诊断及生物医药等领域的应用. Yang 等[23]发现由DNA 介导合成的AgNPs 对HeLa 细胞的毒性效应远低于普通AgNPs, 同时表现出更优的抗菌性能. 采用3 种不同DNA 模板介导合成的AgNCs[包括28 个碱基(Ag-28b)、 19 个碱基(Ag-19b)及发夹结构的DNA 链(Ag-HP)]均表现出较小的的细胞毒性效应[24], 其中Ag-HP介导合成AgNC的生物相容性最好, 在暴露浓度范围内(75 nmol/L~36 mmol/L) 细胞存活率都在80%~100%之间[24]. Martinez 等[70]筛选了一种DNA 模板, 可介导合成出高度稳定的AgNCs, 其细胞毒性比与其它序列模板化的AgNCs更低. 更好的生物相容性是由纳米材料与核酸碱基的不同相互作用以及纳米颗粒与DNA复合物的空间位阻引起的, 它们可以改变纳米材料暴露于细胞结构的程度, 从而提高生物相容性. 此外, DNA在合成过程中嵌入纳米颗粒之间, 使得尺寸更均一, 同时减少了纳米材料的聚集与沉积, 降低了纳米材料的细胞毒性[71].
核酸介导合成的功能纳米材料在光学、 催化和生物相容性等方面具有突出的优势, 已经在环境污染物与生物标志物检测、 环境污染物催化降解、 细胞成像和药物递送等方面广泛应用.
3.1 分子检测
目前在分子检测中的应用主要采用两种方式: 一种是构建基于核酸介导纳米颗粒的探针, 通过测定目标物对荧光信号的影响来进行检测; 另一种是基于目标物影响核酸介导纳米颗粒合成过程, 通过分析合成产物的量来实现目标物的检测[35][图5(A)]. Han 等[72]利用适配体AS1411 以及对映异构体DNA(L-DNA)模板介导合成的AgNC 作为生物稳定的光学探针, 将适配体AS1411 添加到poly C 序列(C10)合成荧光适体-AgNCs探针. AS1411是众所周知的核仁素适配体, 在一些恶性肿瘤细胞表面过表达, 可通过L-C10-AS1411-AgNCs 特异性识别和成像癌细胞[图5(B)]. Qu 等[73]通过DNA 与石墨烯(GO)之间的π-π堆积相互作用, 合成DNA-GO-Pd杂化物, 在有氧的水溶液中作为Suzuki反应的高效催化剂[图5(C)]. Liu等[74]在DNA模板化介导二氧化硅纳米球(MSN)上构建AgNPs. 肿瘤细胞中的GSH等还原性物质将AgNPs还原成银离子, 暴露出二氧化硅纳米球和负载药物, 进而实现药物在癌细胞中的靶向释放[图5(D)]. 可见, 核酸介导纳米材料具有独特的光学性质, 在分子检测应用方面极具潜力[75].
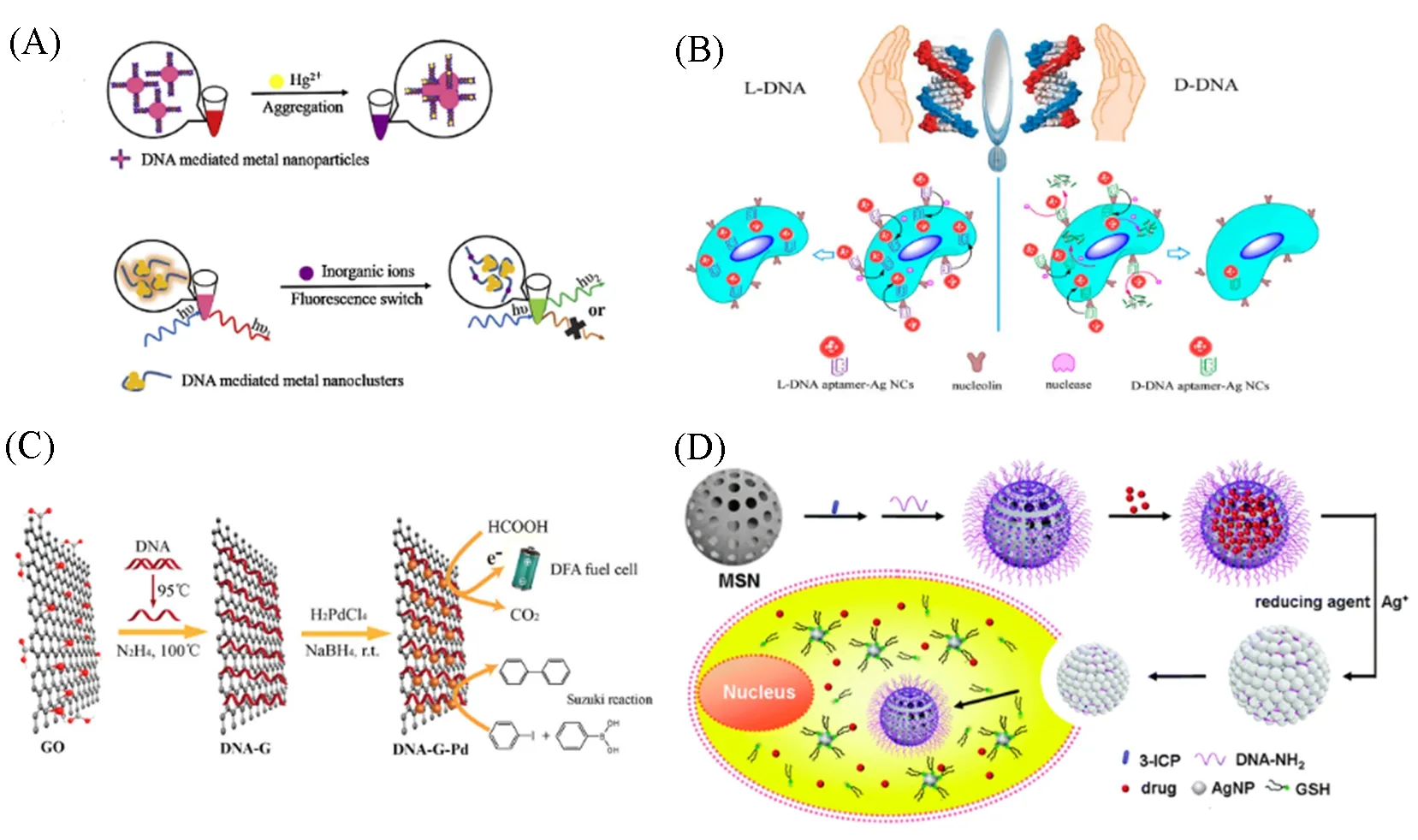
Fig.5 Diverse applications of nucleic acid mediated nanomaterials
核酸介导合成的金属AgNCs具有较宽范围的荧光发射带, 通过改变碱基序列能够覆盖整个可见光和近红外范围[76]. 使用不同DNA模板介导合成的AgNCs作为荧光探针还能用于检测Hg2+, Pb2+, Ag+等金属离子[77,78]及毒素等环境污染物. Hg2+可以使AgNCs的荧光猝灭, AgNCs的荧光猝灭可能是通过Hg2+介导的粒子间聚集机制发生的. 通过游离羧酸(以AgNCs -配体共轭物表面的还原硫辛酸形式存在)进行聚合[79], 该羧酸容易与Hg2+发生相互作用. 通过对荧光的检测达到检测Hg2+的目的. 此方法的检出限为5 nmol/L, 抗干扰能力强, 整个测试过程仅用时2 min. Zhu 等[80]利用含有poly T 和poly C 嵌段的DNA模板介导合成AuNCs作为检测Hg2+的探针, 其原理是利用形成的T-Hg2+-T双链诱导DNA-AuNCs聚集, 导致荧光减弱, 从而实现检测Hg2+的目的. Chen等[81]开发了基于DNA介导合成的AgNCs的荧光传感器, 用于检测小麦的赭曲霉毒素A(OTA), 该方法具有超高灵敏度, 检测限低至2 pg/mL. Cao等[82]将DNA-AgNCs用于氰化物的检测, 可选择性地检测低浓度的氰化物. Enkin等[83]开发了基于DNA杂交的AgNCs, 用于检测爆炸物三硝基苯酚(TNP). Liu 等[84]合成了DNA-AgNCs, 并将这种新型红色纳米探针应用于检测D-青霉胺(D-Pen). 该方法可以检测0.025~0.7 μmol/L 范围内的D-Pen, 检测限低至8 nmol/L, 比其它荧光纳米探针的灵敏度高1~3个数量级.
核酸介导合成的AgNCs分散性好, 具有良好的生物相容性, 能够用于复杂生物体系中生物标志物的检测. Dadmehr 等[85]设计出DNA 介导的AgNCs 用于甲基化DNA 的检测, 这种对甲基化DNA 的检测可以直接用于癌症早期诊断. Lee 等[86]利用寡核苷酸介导合成的AgNCs 检测腺嘌呤核苷三磷酸(ATP), 可在0.1~10 μmol/L范围内检测到ATP, 检测限为33 nmol/L. 该DNA-AgNCs探针的实用性通过测定MDA-MB-231 乳腺癌细胞裂解物中的ATP 浓度得以验证. Liu 等[87]利用DNA 模板介导合成的AgNCs 的荧光可以被过氧化氢或醌猝灭的性质, 分别检测了产生过氧化氢的氧化酶或产生醌的酶.Wang等[88]将利用短链DNA介导合成的AgNCs用于检测生物体中的生物硫醇. 利用银与硫原子之间的配位作用形成Ag-硫醇络合物, 这是一种荧光络合物, 可通过检测Ag-硫醇络合物的荧光达到检测生物硫醇的目的.
为了进一步增强金属纳米簇的荧光强度, Lan 等[89]将Cu2+引入到DNA 介导合成AgNCs 的体系中,制备Cu/Ag合金纳米团簇的时间更短, 在同一波长下比单独的AgNCs具有更强的荧光. Su等[90]开发了硫醇淬火DNA介导铜/银合金纳米团簇探针的方法, 在Cu2+的存在下催化硫醇化合物氧化为二硫化物,恢复合金纳米团簇的荧光, 实现对Cu2+的检测. Au/AgNCs 具有相似的性质, 已被用于检测碘离子[91].Liu 等[92]利用DNA 介导合成的Ag-Au 合金纳米簇可用作表面增强拉曼散射(SERS)底物, 实现对2,4,6-三硝基甲苯(TNT)和癌胚抗原的高灵敏检测.
不同浓度的目标分析物与核酸链结合能够影响核酸介导纳米颗粒的合成过程, 从而带来金属纳米颗粒产物光学性质或产量的变化. Liu等[93]提出了一种使用poly T的DNA单链介导CuNPs生长的策略来检测Hg2+, 其中ss-DNA 模板中的碱基T 在CuNPs 荧光发射中具有主导作用. Hg2+介导的T-T 碱基对有利于荧光CuNPs的形成, 而对于其它金属离子则没有影响. Zeng等[94]提出使用随机的dsDNA介导合成CuNPs 作为荧光探针来检测Pb2+. 其中, 在dsDNA-CuNPs 传感系统中加入Pb2+后, 荧光显著降低.dsDNA-CuNPs对Pb2+的选择性优于其它金属离子, 并且灵敏度高, 检测限为5 nmol/L. Chen等[95]建立了利用Au/AgNCs 的荧光猝灭检测S2-的方法, 通过硫化物的形式对S2-进行检测. Liu 等[96]使用dsDNA 模板介导合成铜纳米簇(CuNCs), 通过S2-与dsDNA-CuNCs 的相互作用, 使 dsDNA-CuNCs 探针的荧光强度发生变化, 从而检测S2-, 可以在5 min 内检测到80 nmol/L 的S2-. Lei 等[97]发现Cu2+能与硫氰根离子(SCN-)反应, 并基于此开发了一种基于DNA-CuNCs荧光猝灭检测SCN-的方法. 当不存在SCN-时, Cu2+被抗坏血酸还原后堆积在DNA 模板上, 呈现高荧光; 当存在SCN-时, Cu2+与硫氰酸酯反应后, 剩余未反应的Cu2+被抗坏血酸还原, 产生少量的CuNCs和微弱的荧光.
目标分析物与核酸链结合可改变纳米颗粒的空间构象, 产生光学性质的变化. Zhang 等[98]使用M-DNA(Pb2+适配体)模板化的AgNCs检测Pb2+, 原理是基于DNA模板中间的Pb2+适配体片段. 加入Pb2+后, Pb2+适配体与Pb2+之间的高度特异性和亲和力导致适配体的构象变化, 并使DNA-AgNCs相互聚集,从而显著增强了AgNCs的荧光, 并使Pb2+的检测变得灵敏(检测限为3.0 nmol/L). 该检测方法是一种低毒、 简单、 灵敏且选择性强的Pb2+检测方法, 已经成功地应用于实际水样中Pb2+的检测.
Yu等[99]提出了一种基于ssDNA- CuNCs 增强荧光的策略, 用于检测三聚氰胺, 其检测机理依赖于三聚氰胺与poly T之间产生的氢键键合显著提高了ssDNA-CuNCs的荧光强度. 三聚氰胺与胸腺嘧啶碱基的强相互作用可以使poly T形成双链poly T-三聚氰胺复合物. 双链聚胸腺嘧啶稳定CuNCs的荧光强度高于单链聚胸腺嘧啶稳定CuNCs. 随着三聚氰胺浓度的增加, 荧光增强. Li 等[100]也开发了一种ssDNA-CuNCs探针, 通过探针的荧光猝灭实现对TNP的检测. 加入TNP后, TNP中缺电子的硝基与供电子DNA模板之间形成供体-受体配合物, 导致TNP和CuNCs之间紧密接近. 此外, TNP的酸度有助于系统的pH值降低. 这些因素结合在一起, 显著猝灭了DNA-CuNCs的荧光, 为TNP传感提供了一种“信号关闭”策略. 该策略对TNP测定具有高灵敏度, 并获得了0.03 μmol/L的检测限, 低于使用有机荧光材料时的检测限. Song等[101]利用DNA适配体模板介导合成CuNPs, 用于检测ATP的浓度. ATP的添加可以有效地阻碍适配体衍生寡核苷酸的消化. 因此, 底物DNA 5′末端的剩余聚胸腺嘧啶可以作为红色发光荧光CuNPs 的有效模板, 用于测定ATP 的浓度, 检测限为93 nmol/L. Chen 等[102]开发了一种以ssDNA模板化的CuNCs为荧光探针检测碘离子的方法. 当I-存在时, 铜纳米颗粒由于具有双层电性和较大的表面积, 会吸收I-. 因此, 在碘化物和附近铜离子的存在下, ssDNA-CuNPs表面发生氧化还原反应形成CuI, 从而改变CuNCs荧光发射.
Lee 等[103]以胞嘧啶为模板合成了具有红色荧光的AgNCs. Ag+的加入可使红色荧光转变为绿色荧光, Ag+通过在2个Cyt12-AgNCs之间形成桥梁, 诱导Cyt12-AgNCs的二聚体结构, 其中Cyt12为胞嘧啶12-mer, 这种二聚体的形成导致Cyt12-AgNCs 的荧光从红色变为绿色. 该方法使用Ag+触发荧光开关,对Ag+的检测浓度低至10 nmol/L.
3.2 细胞成像
与分子检测方法开发原理类似, 核酸介导的金属纳米材料作为光学探针在生物成像应用上得到了快速发展. Yu等[104]用DNA-AgNCs进行活细胞表面标记, 通过抗原-抗体特异性作用对细胞表面目标蛋白进行高灵敏成像. 硫酸肝素(HS)是一种线性、 多硫酸盐和高电荷的多糖, 附着在细胞表面基质蛋白上; 将ssDNA偶联到HS抗体上, 并用AgNCs标记. 抗体偶联的DNA-AgNCs与细胞表面HS键合, 进行高灵敏成像. Antoku 等[105]将DNA-AgNCs 与脂质体转染试剂共孵育, 显著提高了AgNCs 的进胞效率.Sun 等[106]采用一段Sgc8 适配体(CCRF-CEM 细胞核内体的特异性适体)和一段poly C 序列的DNA 模板介导合成AgNCs, 通过修饰特定的DNA模板与人急性淋巴细胞白血病T淋巴细胞(CCRF-CEM)的细胞核进行特异性结合, 从而实现对细胞核的靶向成像. Wang 等[107]和Li 等[108]分别将AgNCs 直接沉积在AS1411和MUC1适配体支架上用于细胞成像. Zhang等[109]基于羟基自由基剪切DNA模板, 干扰AgNCs周围的微环境而猝灭AgNCs 荧光, 设计出由羟基自由基激活的特异性DNA-AgNCs 细胞成像探针.Xu等[110]将适配体模板介导合成的AgNCs与聚乙烯乙二醇包被的超微钆氧化纳米颗粒结合, 制备了一种用于光学/磁共振双模态生物成像同时靶向癌细胞的纳米探针, 适当调整AgNCs 与氧化钆纳米颗粒的比例, 可以提高探针的发射信号和磁共振信号. Shi 团队[111]利用DNA 精确调控普鲁士蓝纳米颗粒(PBNPs)的形貌, 并给出了不同核酸序列介导PBNPs 呈现不同形貌的可能机理. 在生长过程中,C30/T30 诱导PBNPs 晶体成核, 并作为支架将花瓣紧密粘合. 相比之下, A30 或G10 的质子化效率较低, 只有少量前驱体被吸附在DNA 链上, 因此形成了立方体堆积结构. 富含胞嘧啶的DNA(Oligo-C)介导的普鲁士蓝纳米花(PB Nanoflowers) 具有优异的光热性能、 模拟过氧化物酶活性、 生物识别能力、芬顿催化性能和光散射性能, 可广泛应用于生物传感及成像等领域.
3.3 催化降解
核酸介导的纳米颗粒具有较大的比表面积和较高的表面活性, 通过改变核酸碱基序列和链的长度可以对纳米材料的理化性质进行微调, 为设计具有独特性质的催化剂提供了新的思路. 通过对纳米材料形状和结构的控制, 使其具备光热、 模拟过氧化物酶及芬顿催化等性能, 在有机合成反应、 污染物降解等领域极具潜力.
Wang等[112]合成了4种金属-DNA纳米杂化物(Pd, Au, Ag和Pt), 作为硝基苯基化合物氢化为苯胺衍生物过程的催化剂, 产生的催化活性从高到低依次为Pd-DNA, Pt-DNA, Au/Ag-DNA, 同时Au-DNA在1-苯基乙炔醇的氧化反应中有着良好的重复使用性. Hori等[113]用DNA模板化钯纳米粒子(PdNPs)作为氢化反应和Suzuki-Miyaura 偶联反应的催化剂, 连接苯基硼酸与芳基卤化物之间的C—C 键. Mart等[114]将不同剂量的钯前体Pd(OAc)2、 PdCl2与鲑鱼精子DNA 混合进行反应生成Pd-DNA 催化剂, 提高了芳基溴化物与苯基硼酸的Suzuki-Miyaura交叉偶联效率, 同时通过简单的相分离回收催化剂, 可重复使用7个循环. Higuchi等[115]使用DNA适配体介导Pt纳米颗粒的生长, 合成的DNA-Pt纳米酶不仅具有过氧化物酶的酶活性, 还保留了核酸适配体的特异性结合能力. Fu等[116]研究了poly G和poly C等对Pt纳米酶活性的影响. Zhang 等[117]利用DNA 介导合成AgNCs 用于模拟过氧化物酶的催化特性, DNA/AgNCs的过氧化物酶特性为溶菌酶适配体传感器提供了可检测的电化学信号.
对硝基苯胺主要用作染料中间体、 分析试剂、 农药、 防腐剂和抗氧化剂, 被联合国、 国际海事组织等定性为有毒污染物. Li等[118]利用插入基序DNA(i-motif DNA)介导合成不同大小的Pd纳米团簇, 用于还原对硝基苯酚, 由i-motif DNA的胞嘧啶碱基部分包围的含有8~9个Pd原子的亚纳米簇对硝基苯酚的还原效率最高. Zinchenko等[119]利用DNA水凝胶作为模板合成超小AuNPs, 在硝基苯酚转化为氨基酚的氢化反应中表现出较高的催化活性. Kundu等[120]将DNA模板化的金纳米线用于还原水溶液中的4-硝基苯胺(4-NA)与NaBH4; 此外, 还合成了线状和蜂窝状锇纳米簇(NC), 用于还原对硝基苯胺.
四环素是新兴污染物医药和个人护理产品(PPCPs)中的一种, 因其在畜禽及水产养殖中的大量使用在环境中造成一定的残留, 目前成为一个较突出的环境风险问题. He等[121]采用水热合成法合成了以DNA 为模板的Bi2MoO6纳米材料, 在可见光照射下降解四环素(TC)的最佳光催化剂是γ-Bi2MoO6.γ-Bi2MoO6的光催化降解效率约为77.2%, 比α-Bi2MoO6提高了2.6%. 此外,γ-Bi2MoO6光催化剂表现出良好的稳定性、 可循环利用等性质, 在废水处理中具有广阔的应用前景.
3.4 其它应用
随着纳米医学研究的深入, DNA介导合成的功能性纳米材料在疾病治疗、 抗菌、 药物递送以及细胞毒性机制研究方面极具优势, 通过肿瘤微环境刺激包括pH值、 谷胱甘肽(GSH)及蛋白酶等产生纳米结构的响应型改变, 从而进行靶向治疗. Mandal 等[122]发现生长在DNA 模板上的叶酸功能化Fe-Au 核壳纳米粒子可以杀死癌细胞, 叶酸功能化使颗粒能够对癌细胞标记. Song 等[123]利用x形和y形DNA模板合成了支链结构的纳米金, 在近红外区域具有宽阔的吸收波长, 可以作为治疗癌细胞的高效光热增敏剂, 实现癌症的光动力治疗. Wang 等[124]合成了水溶性金包被的DNA 功能化单壁碳纳米管(SWNTs), 可使用近红外(NIR)激光器作为激发源, 利用光热效应进行肿瘤成像和治疗. 最近, Zhao等[125]利用DNA 介导合成了超小硫化铋纳米颗粒, 该材料具有明确的纳米结构、 优异的光漂白性和良好的水分散性, 可用于心肌梗死发生部位的光声成像. Ocsoy等[126]采用dsDNA模板在氧化石墨烯表面制备AgNPs, 对番茄叶片上的黄单胞杆菌具有良好的抗菌效果. Zhou等[127]利用DNA 和表面活性剂与季铵盐基团的静电络合, 开发了一种超刚性DNA-HAP块状复合材料. 该材料具有高硬度和出色的抗菌能力, 适用于牙科镶嵌.
DNA介导合成的纳米材料在其它领域也展现出极高的应用潜力, 包括纳米电子学、 能量转换和存储等. Keren等[128]将采用DNA支架分子介导合成的碳纳米管作为分子电子学的理想构建模块. Ongaro等[129]通过DNA 模板引导两条金纳米线的生长, 并将其用于纳米电子器件, 在纳米电子学领域展现出广阔的应用前景. Peera等[130]提出利用DNA介导石墨纳米纤维上Pt纳米颗粒的生长, 制得的材料具有出色的分散性, 可提高电解质燃料电池的氧还原反应(ORR)电催化效率. Li等[131]采用ssDNA介导金属Pt, 制备了可用作甲醇燃料电池阳极的材料.
4 总结与展望
本文从核酸介导纳米材料合成的原理出发, 综述了相关合成机理、 路线和材料性质, 并概述了核酸介导功能纳米材料在分子检测、 催化、 疾病诊断和治疗等方面的应用进展. 以核酸链作为模板的纳米材料合成, 主要采用还原法、 沉淀法及水解法等方法, 是在温和反应条件控制纳米材料尺寸和形貌的有力手段. 尽管基于核酸介导合成纳米材料的技术取得了巨大的进展[132], 但其理论和应用研究仍面临着诸多挑战, 主要包括: (1) 核酸序列和二级结构复杂多样, 对不同金属离子在模板上沉积的影响因素尚未完全明晰, 仍需完善核酸介导纳米材料生长的理论基础; (2) 已开发的核酸介导金属或非金属材料种类有限, 对于不同类型材料受核酸链精准调控结构后带来的新理化性质难以预测; (3) 核酸链模板通常较短, 且均为实验室合成, 成本相对较高, 因而利用生物体内天然生物大分子介导合成新材料将成为重要发展方向之一, 如长链核酸模板、 蛋白质分子等; (4) 现阶段核酸介导纳米材料合成方法仍处于纳米尺度, 尚未拓展至微米或更大尺寸, 而将核酸链介导生长与组装相结合, 如DNA 折纸术,有望实现对大尺寸材料进行形貌、 结构控制.
