新疆盐碱土壤中克百威降解菌群结构解析及降解菌株特性
2023-10-17阿孜古力库尔班马无为
阿孜古力·库尔班,王 洁,马无为,谢 滔,张 伟
(新疆特殊环境物种保护与调控生物学实验室,新疆特殊环境物种多样性应用与调控重点实验室,新疆师范大学校级重点学科生物学学科,新疆师范大学 生命科学学院,乌鲁木齐 830054)
氨基甲酸酯类农药是农业生产中应用最为广泛的高毒性杀虫剂[1],属于胆碱酯酶抑制剂,也是一种内分泌干扰物[2]。目前氨基甲酸酯类农药种类多达1 000种以上。对该类农药的不合理使用,不但对生态环境造成破坏,药物残留还直接危害到人类的身体健康[3-4]。根据作用机制,氨基甲酸酯类农药与有机磷农药相似,会抑制动物或人体内乙酰胆碱酯酶活性使之不断积蓄,从而产生毒性。若该农药在体内长期累积还会致畸、致癌、致突变,甚至死亡[5-7]。克百威(Carbofuran)是最常用的氨基甲酸酯类农药之一,在中性和偏酸性的环境中比较稳定,半衰期可长达10 a以上。目前该农药已被禁用[8],但以克百威为代表的氨基甲酸酯类农药长期大量的使用对土壤、地下水等造成的污染仍将长期存在。
新疆地区位于亚洲腹地,气候干旱少雨,土壤pH达8.01以上,是中国受土壤盐渍化危害最严重的地区,因此被称为世界盐渍化土壤的博物馆[9]。同时,土地开发加大、土地利用方式的改变,使新疆盐渍化土壤的类型、数量、分布等发生了新的变化,并引发了许多生态环境问题[10],导致土壤盐渍化问题日益突出。阿克苏地区是新疆土壤盐渍化较为严重的地区之一,也是中国重要的优质商品棉生产基地。由于该地区独特的气候条件、地形特征、土壤类型等因素极易引起大面积盐渍化发生[11-14],由此带来土壤微生物多样性的快速下降,土传病虫害明显加重、土壤持续供给养分能力不足及产量明显下降等严重后果。与此同时,农作物种类单一、棉花长期连作现象较为严重等因素带来病虫害持续加重[15]、土壤中农药污染长期积累等生态问题[16-17]。因此,为控制土壤盐渍化及连作导致的病虫害大规模爆发,克百威等农药被广泛、大量、常年使用,各类农药在土壤中积累的同时,势必使该地区土壤中也富集了具有降解各类农药的菌株[18]。由于微生物降解农药具有低成本、效率高、无二次污染、生态恢复较好等特点,利用微生物处理农药污染已成为解决环境中农药残留的重要途径[19-20]。至今,国内外学者从各种环境中分离到多种能够降解克百威的微生物,分类学上隶属于无色杆菌属、产黄菌属、假单胞菌属、鞘氨醇单胞菌属、新鞘脂菌属、金黄杆菌属、地杆菌属、屈挠杆菌属、葡萄球菌属、副球菌属等[21]。同时对这些微生物降解克百威的条件及降解效率等也做了研究。例如,Pseudomonassp. AEBL3能够在120 h内对100 mg·L-1克百威的降解率达到96.2%,最适降解pH为6.0[22];Sphingomonassp.CDS-1能够在14 h内完全降解100 mg·L-1的克百威农药,最适降解条件为pH6.0~7.0[23];Novosphingobiumsp.FND-3最佳降解条件为pH6.0[24];Paracoccussp. YM3能够在6 d内完全降解50 mg·L-1的克百威,最佳降解条件为pH为7.0[25];Pseudomonassp. KBW-1能够在108 h内完全降解200 mg·L-1的克百威,最适降解pH为7.0[26];Novosphingobiumsp. KN65.2在24 h内对200 mg·L-1克百威的降解率为40%,最适降解pH为7.0[27]等。其中降解pH条件大多数适应于酸性和中性。但是由于新疆地区土壤盐渍化较严重、大陆干旱半干旱等环境特点,类似的研究成果并不适合用来解决当地碱性土壤中克百威的残留问题,而从这样环境中分离出的具有克百威降解功能的微生物的分类和代谢途径都可能与已经报道的有所不同。
本研究从新疆长期连作棉田土壤中富集培养得到在pH8.0条件下可稳定传代并降解克百威的菌群,进而从菌群中分离出71株降解菌株,并从中筛选出2株能够具有较高降解克百威能力的菌株KJ71、KJ74,进而对这2株菌的降解特性进行研究,并确定这2株菌最适降解条件。本研究从新疆盐碱土壤中分离克百威降解菌株,为解决当地土壤氨基甲酸酯类农药污染提供微生物资源的同时,开展克百威降解菌株的降解特性研究,为后期研究碱性条件下的克百威的生物降解途径奠定基础。
1 材料与方法
1.1 材 料
1.1.1 土壤样品 采集自新疆阿克苏棉区 (79°45′81″~79°46′55″E,39°31′47″~39°45′50″N)连作10 a以上的土壤。采用五点采样法,采样后将土壤样本带回实验室-20 ℃保存。
1.1.2 主要试剂 克百威原药购自广西广酞农业化工有限公司,纯度≥98%。在甲醇中配置成10 g·L-1的储备液,使用时将适量储备液加入到培养基中稀释成需要的浓度即可。细菌基因组提取试剂盒购自天根生化科技(北京)有限公司;PCR引物由上海生工合成。
1.1.3 培养基 基础无机盐培养基:NH4NO31.0 g,MgSO4·7H2O 0.2 g,KH2PO40.5 g,K2HPO41.5 g,NaCl 0.5 g,(NH4)2SO40.5 g,用蒸馏水溶解,pH=8.0,定容至1 000 mL,加入克百威储备液至100 mg·L-1。
R2A培养基:酵母膏0.5 g,蛋白胨0.5 g,酪氨酸0.5 g,葡萄糖0.5 g,可溶性淀粉0.5 g,K2HPO40.3 g,MgSO4·7H2O 0.05 g,丙酮酸钠0.3 g,用蒸馏水溶解,pH=8.0,定容至1 000 mL,克百威100 mg·L-1。
LB培养基:蛋白胨10 g,酵母膏5 g,NaCl 10 g,用蒸馏水溶解,pH=8.0,定容至1 000 mL,克百威100 mg·L-1。
固体培养基:以上培养基中添加18 g·L-1琼脂粉调为固体,在1×105Pa灭菌30 min后使用。
1.2 方 法
1.2.1 克百威降解菌群的富集 称取5.0 g土壤样品,加入装有100 mL含100 mg·L-1克百威的基础无机盐培养基的250 mL三角瓶中,于37 ℃(编号为KBW 37)、120 r·min-1培养7 d。随后以3%接种量传代于新的含有上述培养基的三角瓶中,继续在相同条件下培养。这样连续传代6次以上,部分菌液保存,部分菌液用于提取菌群总DNA,部分菌液用于分离纯化克百威降解菌株。按同样的方法富集28 ℃生长的克百威菌群(编号为KBW 28用作和KBW 37降解菌群做对比)。
1.2.2 菌群的高通量测序及数据分析 富集的KBW 28和KBW 37菌群和土壤样品(编号为TR)按照QIAGEN○RDNeasyRULtraClean○RMicrobial Kit步骤要求提取总DNA,电泳检测合格后送至诺禾致源生物科技有限公司对样品进行高通量测序。
运用FLASHv1.2.7软件[28]对每个测序样本的序列(Reads)进行拼接,获得原始拼接序列Tags数据,对其进行严格的过滤处理获得高质量的Tags数据[29]。通过Uparsev 7.0.1001软件对所有样本进行聚类,用Mothur方法与SILVA 132的SSUrRNA数据库进行物种注释分析,获得在各个分类水平分类学信息。通过Qiime v1.9.1软件计算各样品的Chao1、Shannon、Simpson指数,使用R v2.15.3软件进行各样品的Alpha多样性指数组间差异分析。此外,对高通量数据获得的克百威菌群OTU数据进行标准化处理,在MENA网站(http://ieg4.rccc.ou.edu/mena)进行上传数据后,构建Pearson相关性矩阵。基于RMT(随机矩阵理论,RandomMatrixTheory)设置合适的阈值,构建克百威降解菌群微生物分子生态网络,研究不同温度条件下富集的微生物群落之间的相互作用,获得网络拓扑参数文件,根据Deng等[30]的研究对微生物网络构建进行详细的分析。
1.2.3 克百威降解菌株的分离与纯化 将富集得到的37 ℃降解菌群,分别使用基础无机盐培养基、R2A培养基、LB培养基采用稀释涂布法从中分离微生物。将系列稀释液分别涂布于含有克百威的上述培养基中,37 ℃、55%恒温培养箱中培养3~7 d,挑取生长较快、菌落形态有明显差异的单菌落,连续划线纯化培养获取不同形态菌落的纯培养物。
1.2.4 菌株的16S rRNA鉴定 依照TIANamp Bacteria DNA Kit基因组提取试剂盒操作流程提取各菌株的DNA并作为模板,使用通用引物27F和1492R进行16S rRNA基因PCR扩增。PCR扩增在Applied biosystems 2720扩增仪上进行,扩增体系为25 μL。PCR反应条件为:94 ℃ 5 min(预变性);94 ℃ 30 s(变性),55 ℃ 30 s(退火),72 ℃ 1 min(延伸),循环30次;72 ℃ 10 min(延伸)。PCR产物送至上海生工公司完成测序。测序数据在NCBI网站上进行同源性比较,并提交至NCBI获得菌株序列GenBank登录号(MV866517-MV866520、MW301219-MW301257、MW819911-MW819933、 OL960556-OL960560)。用MEGA 7.0[31]软件构建Neighbor-Joining系统发育树。
1.2.5 克百威含量的检测 克百威标准曲线制作:称取一定量的克百威原药,用色谱甲醇作为溶剂配置成质量浓度为10 g·L-1储备液,逐级稀释配制质量浓度为0、10、20、40、60、80、100 mg·L-1的标准液,进行液相色谱分析,测定峰面积,根据峰面积与浓度的对应关系制作标准曲线。
待测样检测:从待测样品中取500 μL培养液,加入等体积的色谱甲醇萃取克百威,剧烈震荡后在12 000 r·min-1条件下离心8 min,移取上层有机相,过孔径0.45 μm的有机相针头过滤器过滤后,用液相色谱测定样液中克百威的含量。液相色谱条件为:C18 DiamosilTM反相柱;色谱柱 (250 mm×4.6 mm,粒径5 μm);流动相:甲醇/水(体积比70∶30),流速1 mL·min-1;紫外检测器:波长280 nm;进样量:10 μL;柱温: 25 ℃;保留时间:6 min。参考文献[32]计算克百威降解率,克百威降解率=[1-(实测含量/添加量)]×100%。
1.2.6 降解菌株的筛选 将从克百威降解菌群中分离到的各菌株先于富含高浓度克百威的LB液体培养基中培养,检测降解菌株能否耐受并高效降解不同浓度的克百威农药,从而确定其生物修复应用能力,其次以1%的接种量接入装有100 mL基础无机盐培养基(克百威浓度20 mg·L-1)的250 mL三角瓶中(每个样品3个重复),于37 ℃、120 r·min-1震荡培养,24 h后采用液相色谱法测定克百威残留浓度,从中选出对克百威降解能力较强的菌株。
1.2.7 细菌生长曲线的测定 将对克百威降解能力较强的菌株KJ71和KJ74划线接种到LB液体培养基中培养18 h,作为种子液。将种子液以5%的接种量接入到250 mL LB培养基中, 37 ℃、120 r·min-1培养,每隔2 h测定菌株OD600,以OD600值为纵坐标,时间为横坐标绘制菌株的生长曲线。
1.2.8 克百威浓度、温度、pH对降解克百威效率的影响 在1%接种量,120 r·min-1摇床中避光培养72 h为基本条件进行单因素试验。在 “1.2.6”中得到的KJ71和KJ74菌株种子液,将在LB液体培养基中培养至对数期后,取出10 mL, 4 ℃、8 000 r·min-1离心5 min收集菌体,(菌体用1 mL无菌水重悬)以1%的接种量分别测定在 37 ℃条件下克百威质量浓度分别为20、50、100 mg·L-1环境中菌株对克百威的降解;将上述方法收集的菌体悬液,以1%的接种量分别测定在 37 ℃条件下pH为6.0、7.0、8.0和 9.0环境中菌株对50 mg·L-1克百威的降解;在pH为7.0和9.0,以1%的接种量条件下分别测定温度为25、30和35 ℃环境中菌株对50 mg·L-1克百威的降解。以上试验验均在250 mL三角瓶中加入100 mL含有克百威的基础无机盐培养基中接入菌体悬液避光培养,以不接菌只含有克百威的基础无机盐液体培养基为对照,每次试验设3次重复,用液相色谱法测定菌株对克百威的降解率。
1.2.9 添加营养物质对降解率的影响 对单菌及菌群降解特性的比较,在250 mL三角瓶中加入100 mL基础无机盐培养基(含有克百威浓度为50 mg·L-1)分别添加葡萄糖、酵母膏、牛肉膏、蛋白胨,使它们的终浓度达到1 g·L-1。将菌体悬液及菌群以1%的接种量接入上述培养基中,于37 ℃,120 r·min-1摇床中震荡培养72 h(菌群培养36 h),同时设置不添加营养物质的作为对照,样品经处理后,检测克百威降解效率。
2 结果与分析
2.1 高通量测序结果及微生物群落多样性分析
克百威降解菌群测序结果显示:总序列数 9 554.6条,总碱基数为11 338 836.4 bp,其中有效序列为7 778条,占总序列的80.73%,无效序列为1 776.6条。序列平均长度为1 456.4 bp。采用Shannon和Simpson指数等对KBW 28、KBW 37和TR中微生物的多样性进行评价,采用Observed species和Chao1对该微生物菌群的丰度进行评价。结果表明,原土壤样品中细菌的多样性指数及丰度明显高于不同温度富集的克百威菌群,表明原土壤中微生物群落种群差异性较大;28 ℃条件下富集的克百威降解菌群中所含物种数较37 ℃富集的菌群高,二者微生物菌群丰度差异明显;原土壤样品的覆盖率都大于28 ℃和37 ℃富集的克百威降解菌群,说明样品文库的覆盖率很大,样品中序列没有被测出的概率极低(表1)。
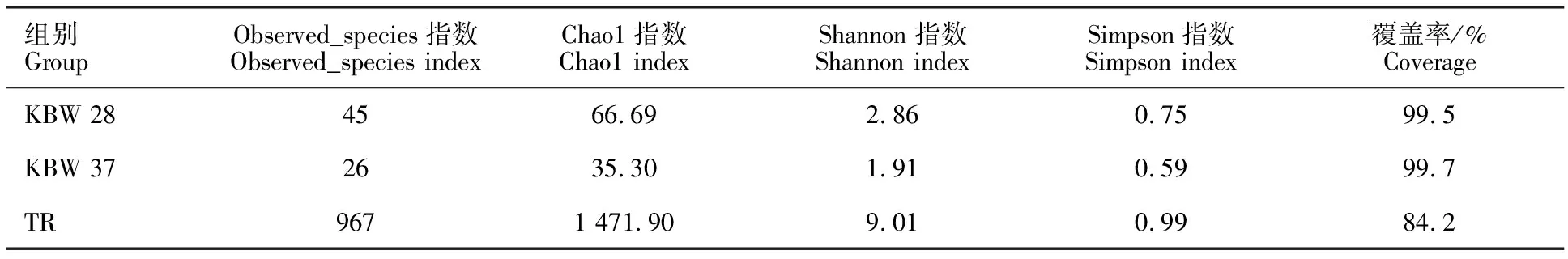
表1 样品多样性指数Table 1 Sample diversity index
2.2 克百威降解菌群结构组成分析
在门分类水平上相对丰度前10物种比较结果显示:KBW 28菌群和KBW 37菌群中最丰富的菌门为变形菌门(Proteobacteria),相对丰度分别为 98.87%、88.24%;拟杆菌门(Bacteroidetes),相对丰度分别为1.13%、11.47%;而TR菌群中占优势的细菌门有变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteria),相对丰度分别为26.17%、23.51%、13.71%、7.49%、 5.16%;在属水平上,KBW 28菌群中的优势菌属依次为Aquamicrobium(27.52%)、Methyloversatilis(19.36%)、Hyphomicrobium(6.93%)、Achromobacter(5.48%),在KBW 37菌群中占优势的菌属依次为Pseudoxanthomonas(54.30%),Hyphomicrobium(13.98%)、Hydrogenophaga(3.32%)、Aquamicrobium(3.13%),TR菌群中优势菌属为Hyphomicrobium(0.1%),其余99.8%的菌属没有检测出来。
由此可见,通过使用克百威农药胁迫培养,从该棉区土壤中富集出了新的微生物群落结构组成。同时温度对克百威菌群结构的影响也较大,当温度与土壤真实值接近时,在门和属水平上检测出的优势菌门属虽然相对丰度较低,但较为多样。当温度为37 ℃时,细菌生长代谢较快,但菌群结构趋于简单或者导致部分菌属的丰度下降(图1)。
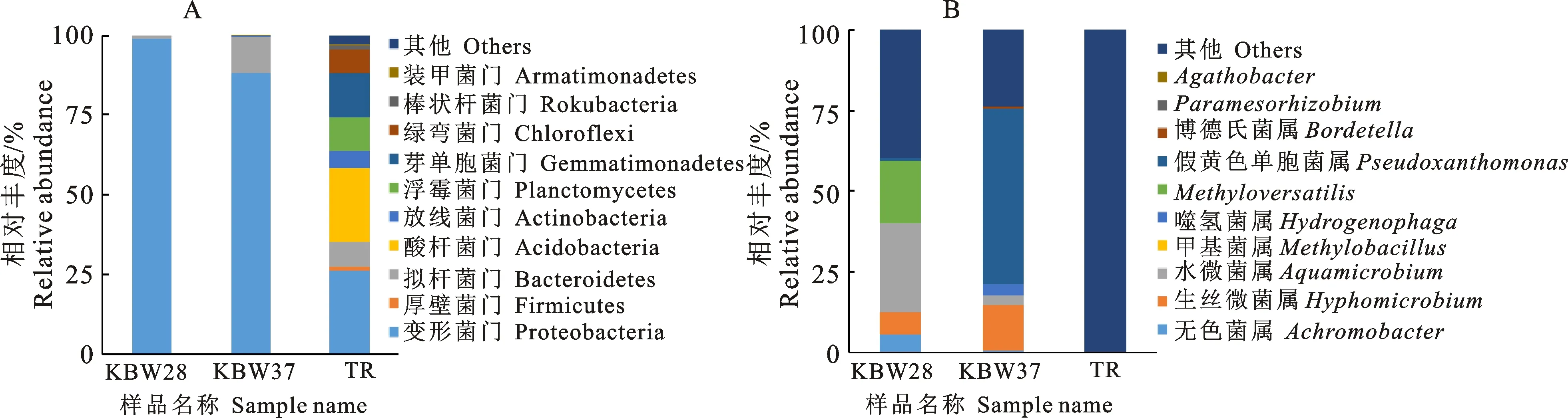
图1 门分类水平top 10相对丰度(A)和属分类水平top 10(B)Fig.1 TOP10 at phylum level(A) and TOP10 at genus level(B)
2.3 克百威降解菌群的共发生模式
2.3.1 网络结构 分别基于28 ℃和37 ℃富集的克百威降解菌群的测序结果构建分子生态网络(图2)。结果显示,KBW 37微生物群落共发生的物种、物种所属于的属、物种之间的正相关关系较KBW 28多。其中KBW 28群落网络由16个节点和30条边线组成,隶属于16个菌属,连通度较大的微生物类群为变形菌门(Proteobacteria);KBW 37微生物分子生态网络的节点数总计为19,隶属于19个菌属,细菌物种间连接数较多,在菌群中变形菌门(Proteobacteria)的连通度较高,也存在部分芽单胞菌门(Gemmatimonadetes)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)。在KBW 28中度较大的节点主要来有Methyloversatilis、Aquamicrobium、Diaphorobacter、Achromobacter、Hyphomicrobium、Pseudoxanthomonas、Brevundimonas。而在KBW 37中度较大的节点主要有Noviherbaspirillum。此外,KBW 28菌群中正相关比负相关占多数,表明该菌群中物种间更多的是合作或共生关系。但是KBW 37菌群来说,网络图中正相关及负相关数占比一样多,说明该菌群中物种间的相互作用较为复杂,种间也存在竞争关系。
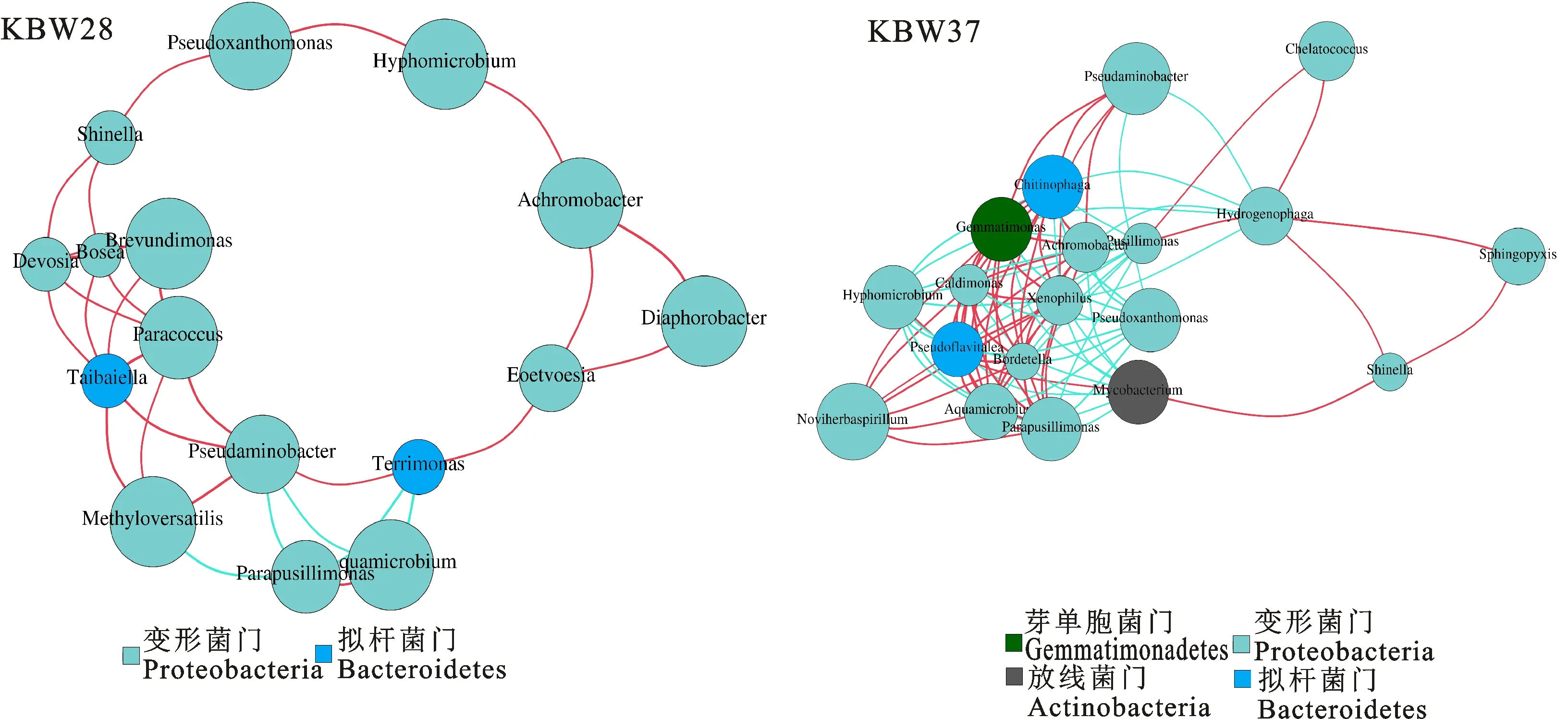
图2 不同处理克百威菌群共线性网络图谱Fig.2 Network co-occurrence analysis of carbofuran flora under different treatments
2.3.2 拓扑特性 对比不同温度富集的克百威降解菌群网络拓扑特性中可以看出(表2), KBW 37中的网络总节点数、总连接数和平均连通度较KBW 28更高,表明37 ℃富集的克百威降解菌群的微生物网络规模更大,相互作用的关系更为复杂;微生物网络路径距离代表物种间传递物质、能量及信息的效率[33],相比较于KBW 28,KBW 37的网络平均路径距离较短,说明KBW 37中微生物间响应速度更快,当外界温度发生变化时该菌群中群落结构更易波动。
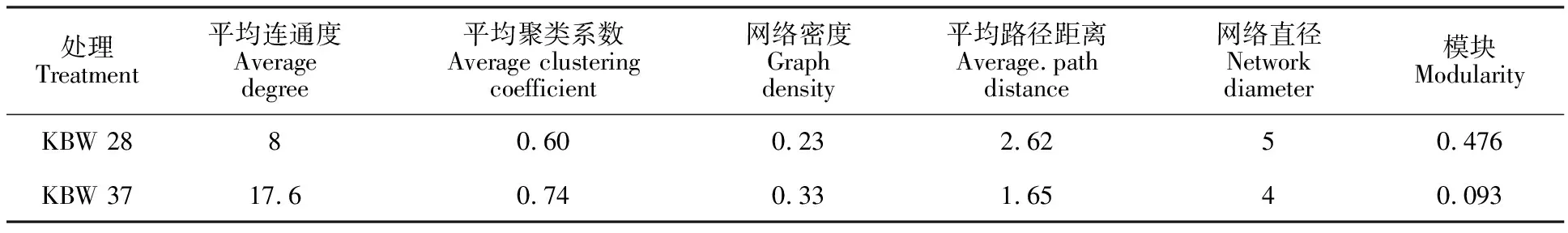
表2 不同处理微生物作网络拓扑性质Table 2 Topological properties of microbial interaction network relative to treatment
2.4 克百威降解菌的分离与初步鉴定
从克百威菌群中共分离筛选出71株菌株,它们分别隶属于芽孢杆菌属(Bacillus)48株、埃希氏杆菌属(Escherichia)11株、志贺氏菌属(Shigella)5株、短芽胞杆菌属(Brevibacillus)2株、类芽孢杆菌属(Paenibacillus)2株、肠杆菌属(Enterobacter)1株、不动杆菌属(Acinetobacter)1株、红球菌属(Rhodococcus)1株等8个属。分别选择与71株菌株的16S rRNA序列GenBank相似性最高的Enterobacterhormaecheisubsp.Xiangfangensis10-17、Bacillustequilensis10b、RhodococcuspyridinivoransPDB9、PaenibacilluslautusNBRC15380、AcinetobacterlwoffiiJCM6840等菌株序列进行比对并构建进化树(图3)。

图3 71株菌株的系统发育树Fig.3 Phylogenetic tree of 71 strains
2.5 菌株降解能力筛选
从71株菌株中分别获得3株能够在富含高浓度克百威的培养基中生长的菌株,并利用高效液相色谱法测定该3株菌株对克百威的降解能力。根据回归方程y=0.069 5x+ 0.045 2 (R2=0.996 3),计算该3株菌对克百威的降解能力并进行比较。结果表明,菌株KJK44、KJ71、KJ74菌降解率分别为37.58%、41.40%、 39.23%,其中KJ71和KJ74具有较好的降解率。鉴于此,本研究选择KJ71(隶属于红球菌属,登录号为MW819928)和KJ74菌株(隶属于类芽孢杆菌属,登录号为MV866520)为研究对象,进行下一步的研究(图4)。
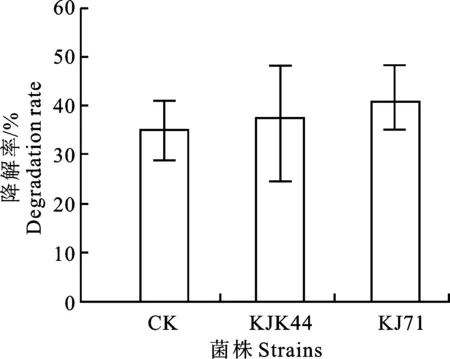
图4 不同菌株克百威的降解率Fig.4 Degradation rate of different strains in degradating carbofuranin
2.6 菌株KJ71和KJ74的生长特性
图5为KJ71和KJ74两株菌在5%接种量,37 ℃、120 r·min-1培养条件下的生长曲线,0~2 h时,菌株生长较为缓慢,处于生长缓慢期,2 h后,OD600数值迅速增加,该两株菌进入对数生长期,代谢活动较为活跃,其中KJ71菌株生长20 h后,KJ74菌株30 h后生长速度下降,增长较为缓慢,菌株的生长曲线为后期微生物菌剂的制备提供了条件。
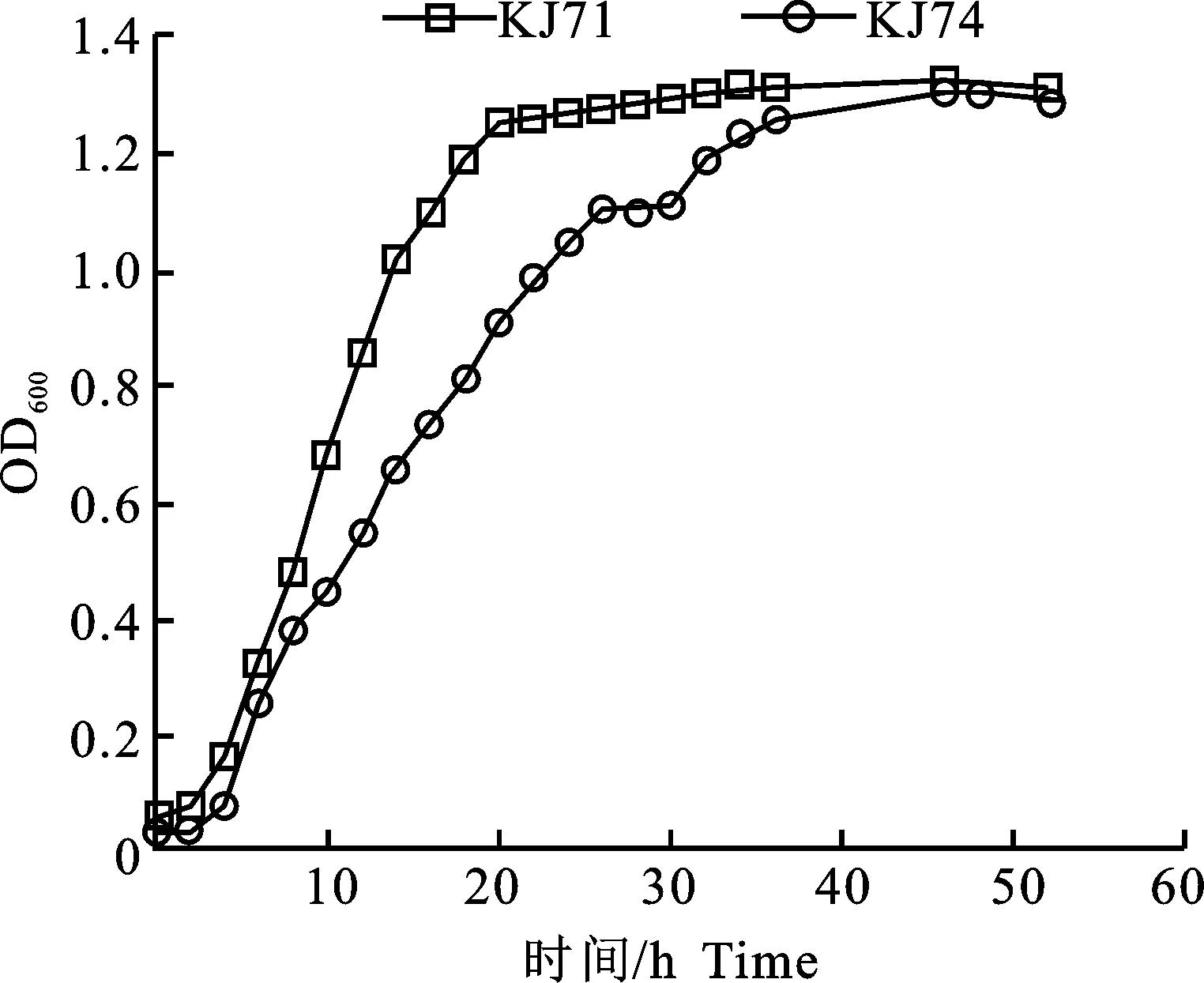
图5 2株菌生长曲线Fig.5 Growth curve of 2 strains of bacteria
2.7 菌株KJ71和KJ74的降解特性
2.7.1 克百威质量浓度对菌株降解能力的影响 随着克百威浓度的增高,菌株KJ71和KJ74对克百威降解率随之增高,当克百威质量浓度为50 mg·L-1时,降解率达到最高,分别为67.90%、71.00%。克百威质量浓度超过50 mg·L-1时,降解率随之降低,这说明克百威质量浓度过高会抑制KJ71和KJ74菌株对克百威的降解(图6)。
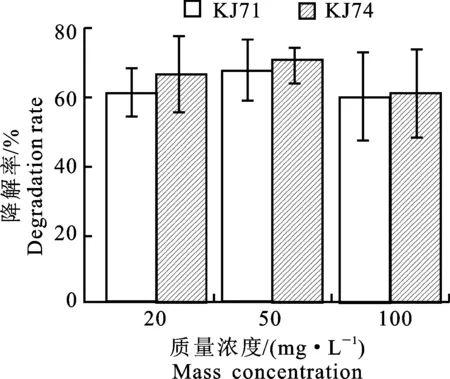
图6 不同克百威初始质量浓度下2株菌降解克百威的降解率Fig.6 Degradation rate of two strains of bacteria in degradating carbofuran in differnet initial concentations
2.7.2 pH对菌株降解能力的影响 在初始pH分别为6.0、7.0、8.0、9.0,克百威质量浓度为50 mg·L-1的富集培养基中,KJ71在pH为6.0~9.0时,克百威的降解率变化不大,其中72 h, pH=9.0时该菌株降解克百威的降解率达到最大,为63.88%;对KJ74菌株来说,pH在6.0~9.0,该菌株对克百威的降解率先升高后降低,培养72 h,pH=7.0时对克百威的降解效率达到最大,为70.22%(图7)。
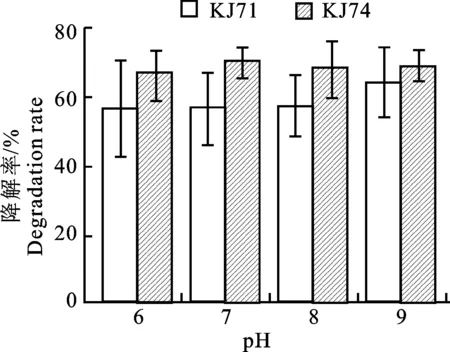
图7 不同初始pH下2株菌降解克百威的降解率Fig.7 Degradation rate of 2 strains of bacteria in degradating carbofuran in differnet initial pH
2.7.3 温度对菌株降解能力的影响 在25、30、35 ℃条件下,菌株KJ71对克百威的降解率分别为28.65%、27.20%、27.70%,降解效率变化不大;对菌株KJ74来说,在不同的温度下,对克百威的降解效率先升高后降低,当温度为30 ℃时降解效率达到最大为36.30%(图8)。
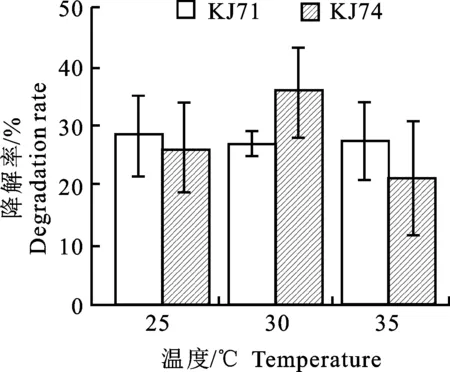
图8 不同温度下2株菌降解克百威的降解率Fig.8 Degradation rate of 2 strains of bacteria in degrading carbofuran in different temperatures
2.7.4 添加营养物质对降解效率的影响 添加少量有机氮源,如蛋白胨、牛肉膏可提高菌株KJ71和KJ74对克百威的降解率,添加少量有机碳源葡萄糖时菌株对克百威的降解率受到抑制,添加酵母膏时降解率不变。原因在于当培养基中添加外加氮源能够促进菌株的生长,使其生物种群增大,从而促进该2株菌株对克百威的降解,但是外加碳源却抑制菌株的生长,导致降解率较只加氮源有明显降低。但是对于克百威菌群来说,添加不同的营养物质均有助于提高菌群对克百威的降解能力,这说明菌群在利用有机碳源及氮源快速增长的同时加大了对克百威的分解利用。特别是在蛋白胨体系中(图9)。
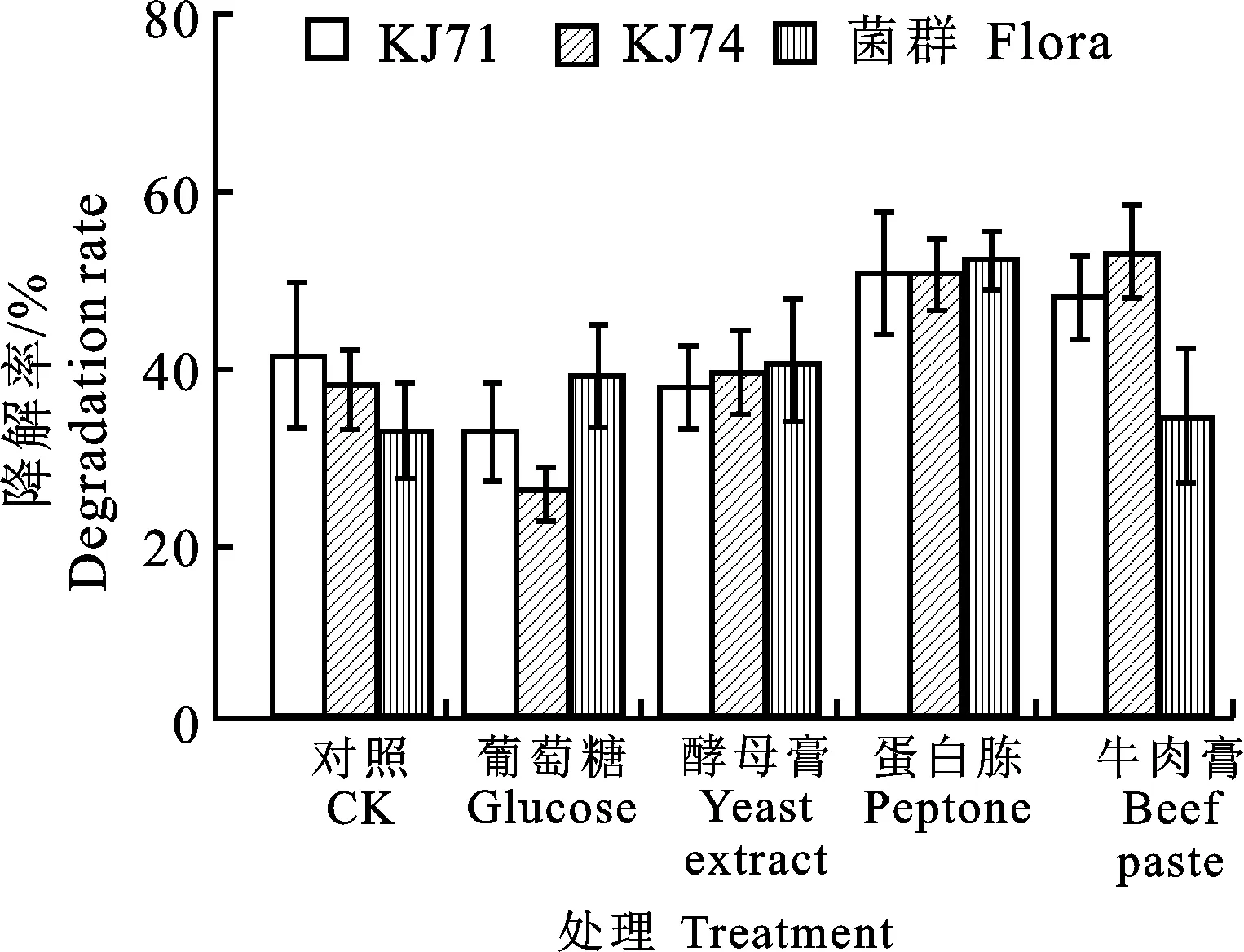
图9 添加营养物质单菌和菌群降解克百威的降解率Fig.9 Degradation rate of single bacteria and microflora in degrading carbofuran in nutrient addition
3 讨论与结论
土壤是最复杂的微生态系统之一,气候条件、土壤理化性质、栽培作物的种类,甚至其栽培管理措施等都是影响土壤微生物群落结构组成的重要因素。新疆特殊的气候和土壤性质使该地区拥有独特的微生物资源,而棉区作物种类单一等因素又促使土壤演替出新的微生物群落结构组成[34]。通过研究发现,在仅有克百威农药作为碳源的胁迫下,富集到的菌群结构组成与长期连作棉田土壤微生物群落结构相比发生了巨大改变。首先,在门水平上,占优势的门及其相对丰度就发生了很大变化。如Proteobacteria所占比例由 26.17%增加到88.24%,而原来相对丰度10%左右的Acidobacteria、Planctomycetes、Chloroflexi在克百威降解菌群中几乎未检测到。在属分类水平上,克百威降解菌群中占优势的Pseudoxanthomonas、Hyphomicrobium、Hydrogenophaga等属在土壤微生物群落结构中的相对丰度依次仅为0.08%、0.10%、0.01%。其次,在不同的温度条件下农药克百威胁迫形成的菌群之间相比,尽管菌群来源及使用农药一样,但富集后的菌群结构依然在门和属水平及其相对丰度上仍然存在差异。从两个不同温度培养菌群整个网络的结构来看,KBW 37微生物群落成员共发生的物种数和其所属的菌属均较KBW 28多。由此可见,温度条件对降解菌群结构组成造成很大的影响,同一种农药胁迫下不同培养温度能富集到结构不同的降解菌群。说明,新疆地区盐渍化严重、干旱等特殊的气候条件使该地区形成了特殊的微生物类群,也进一步解释了在其他地区使用的克百威降解菌株却在该土壤中不适用的原因。因此,本研究在高通量水平上为后期更好地研究适合新疆当地土壤环境克百威降解菌株的挖掘提供了理论依据。
1986年Karns等[35]首次从受克百威污染的活性污泥中分离到一株克百威降解菌VW1(Achromobacter),从此拉开了克百威降解菌筛选工作的序幕。至今,国内外研究者已经从不同环境中分离到多株能够降解克百威的微生物,它们在分类学上隶属于不同的种属,其中以Pseudomonas居多。本研究从降解菌群中分离筛选出71株菌株,分别隶属于芽孢杆菌属(Bacillus)、埃希氏杆菌属(Escherichia)、志贺氏菌属(Shigella)、短芽胞杆菌属(Brevibacillus)、类芽孢杆菌属(Paenibacillus)、肠杆菌属(Enterobacter)、不动杆菌属(Acinetobacter)、红球菌属(Rhodococcus)。这与高通量测序结果完全不一致,与目前已报道的能够降解克百威的菌株进行属水平的比较也存在一定的差异。原因可能在于:第一,分离培养使用的培养基或者pH、温度等培养条件仍然无法满足部分菌株的生长需求,而未能培养出来;第二,很有可能是土壤样本采集地环境所孕育的物种差异导致的。那么来自不同环境下的不同菌属在降解克百威的降解效率以及代谢通路上是否也存在差异,值得进一步研究。
研究表明,微生物农药降解受很多因素的影响,如微生物自身特征、农药初始浓度、温度、pH以及营养物质等[10]。目前国内外研究者,从各种污染环境中筛选出多株克百威降解菌株,它们对克百威的降解效率有高有低,降解条件pH大多数偏向于中性和酸性环境。然而,新疆地区由于土壤盐渍化严重、干旱等独特的环境特点,适合内地环境条件的克百威降解菌株在新疆并不一定适用。因此本研究以当地土壤环境为研究对象,在碱性条件下进行菌群富集培养并从中筛选出能适应碱性条件的克百威降解菌株,利用高效液相色谱法研究克百威分离菌株与克百威菌群在不同培养阶段的降解效率,探究不同条件对菌株降解克百威的影响。研究过程中发现,隶属于红球菌属(Rhodococcus)及类芽孢杆菌属(Paenibacillus)的菌株KJ71和KJ74是从本地土壤中分离获得的具有降解克百威能力的菌株。而已有的研究表明,目前已发表的参与克百威降解的细菌中,尚未有Rhodococcus、Paenibacillus的菌株被报道,同时隶属于Rhodococcus、Paenibacillus的菌株KJ71和KJ74是首次获得的能在碱性条件下参与克百威降解能力的细菌。因此通过高效液相色谱法对该2株菌株进行了降解特性的研究,发现在25 ℃~35 ℃,温度对KJ71降解克百威没有显著影响,对KJ74菌株来说,当温度为 30 ℃时降解效果最好,这个特性与当地作物种植季节土壤温度相符;在pH为6.0~9.0,当pH分别为 9.0、7.0时KJ71和KJ74对克百威的降解效率达到最好,分别为63.88%和 70.22%,较宽的pH适应范围非常有利于开发利用。在培养基中添加营养物质对菌株及菌群降解克百威效率的影响中发现,当添加少量有机氮源时可促进菌株对克百威的降解效率,添加少量有机碳源葡萄糖时菌株对克百威的降解率受到抑制;对菌群来说添加有机碳源及有机氮源均有助于提高菌群对克百威的降解效率。由此可见,KJ71和KJ74菌株在降解克百威的过程中,具有良好的环境适应性,该研究结果可为开发该地区环境条件下的克百威降解基因及降解途径、新疆地区土壤环境修复打下基础。
由于克百威本身对于生物安全具有危害性,且已经被大量应用于农业生产过程中,所以研究以克百威为代表的氨基甲酸酯类农药的生物降解仍具有重要的意义。筛选出能够高效降解克百威的菌株是生物降解的基础,探究降解菌的降解特性对日后将降解菌推向新疆盐碱土壤中氨基甲酸酯类农药污染的修复等方面具有应用价值。当然,探究这些菌株在碱性条件下的生物降解途径相关问题还尚待深入。
