鱼类致病荧光假单胞菌外膜蛋白LolB多克隆抗体制备、鉴定与免疫活性分析
2023-10-17简思杰
晁 嘉,简思杰,2,孙 薇,3,陈 锐,4,丁 锐,4,陈 琛,3,5,刘 祥,2
(1.陕西理工大学 生物科学与工程学院 中德天然产物研究所,陕西汉中 723001;2.阜阳师范大学 生物与食品工程学院,安徽阜阳 236037;3.陕南秦巴山区生物资源综合开发协同创新中心,陕西汉中 723001;4.陕西理工大学,秦巴生物资源与生态环境省部共建国家重点实验室(培育),陕西汉中 723001;5.陕西省资源生物重点实验室,陕西汉中 723001)
随经济建设繁荣发展,人们的生活水平不断提高,鱼类消费也在逐年增加,《2021中国渔业统计年鉴》显示,2020年中国水产品总量达到 6 549.02万t,渔业灾情造成的经济损失达 1 525 996.46万元[1],其中病原菌感染是影响渔业发展的重要问题[1-2]。荧光假单胞菌(Pseudomonasfluorescens)是鱼类感染的主要病原菌[3-4],可感染鲫鱼、草鱼、鲤鱼等常见养殖鱼类[5-6],主要的感染症状为鱼体发炎,鳞片脱落,鳍条充血糜烂,呈现赤皮病。荧光假单胞菌的防治主要为抗生素,但抗生素滥用易出现耐药性菌株,且存在残留以及污染坏境等问题[7];中草药治疗的机制暂不明确且效果不明显;灭活疫苗处于研究初期,在安全性和批量生产上存在不足,水产应用较少,有必要开发新型疫苗。重组亚单位疫苗,是利用基因工程或化学方法生产的可使人或动物激活体内免疫反应的免疫活性片段,具有安全、高效等优点,是目前疫苗研究的热点领域[8-9]。
外膜蛋白是革兰氏阴性菌外膜上的一类蛋白,负责胞外信息的接受以及胞内通路的激活,还具有物质运输、结构支撑等多种特性,尤其是免疫原性较强[10],在重组疫苗上备受关注。目前已经有一系列基于外膜蛋白免疫原性的鱼类疫苗研究,Tang等[11]将鱼肠弧菌的5个外膜蛋白进行原核表达,发现rOmpT具有良好的保护性,保护率可达到79.6%;毛然然等[12]将嗜水气单胞菌外膜蛋白OprM原核表达并进行免疫保护作用评价,发现外膜蛋白OprM的保护率可达89.47%;荣娜等[13-14]构建重组菌株并获取嗜水气单胞菌外膜蛋白P5、TolC,发现外膜蛋白P5对嗜水气单胞菌的鱼类保护率为69%,TolC则在抗血清滴度1∶6 400时仍具有与嗜水气单胞菌相互结合的能力。外膜蛋白中脂蛋白定位系统(Localization of lipoprotein system,Lol)负责脂蛋白的转运与定位,其与生物致病力及耐药性密切相关[15]。Lol系统由LolA-E 5 个蛋白构成,其中脂蛋白定位系统因子B(Localization of lipoprotein B,LolB)在脂蛋白转运过程中负责转运的最后一步,将脂蛋白插入到外膜,是一种重要的外膜蛋白[16]。目前外膜蛋白LolB对鱼类的保护性研究缺乏,本文选取LolB蛋白进行探究,期望为后续鱼类疫苗研发提供可行性参考。
荧光假单胞菌是革兰氏阴性菌,其表面分布的外膜蛋白暴露在细胞外,更易激活宿主的免疫系统。Sun等[17]制备荧光假单胞菌外膜蛋白ExbB并评价其被动免疫保护作用,发现ExbB对荧光假单胞菌的保护率可达54%,同时对嗜水气单胞菌具有交叉免疫保护作用,保护率为38.4%;Liu等[18]构建表达的荧光假单胞菌外膜蛋白PF1380同样具有交叉被动免疫保护作用,对荧光假单胞菌保护率为57%,对嗜水气单胞菌的保护率为50%。可见荧光假单胞菌外膜蛋白的免疫原性较好,有疫苗候选潜质。
综上所述,本研究选择荧光假单胞菌外膜蛋白LolB对其进行分子克隆原核表达,免疫红鲫(Carassiusauratus),评价免疫原性,为后续重组蛋白疫苗研发奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菌株及供试动物 荧光假单胞菌 ATCC 13525、EscherichiacoliDH5a、BL21菌株及pET-32a质粒由陕西理工大学中德天然产物研究所保存;红鲫购自汉中市水族馆,体表健康,平均体质量约18 g,身长平均约10 cm,试验前在90 L水箱中饲养两周,每天换水1/3,饲养用水经过处理,平均水温(22 ± 2) ℃,饲料(上海傲滋水族科技有限公司)每日供给鱼体质量的1%,使用气泵不间断供给空气。
1.1.2 主要试剂 rTaq聚合酶、T4-DNA连接酶、限制性核酸内切酶BamH Ⅰ 及XhoⅠ 购自日本TaKaRa 公司;细菌基因组提取试剂盒购自北京天根试剂公司,质粒提取试剂盒、胶回收试剂盒购自杭州博日公司;异丙基-β-D-硫代半乳糖苷(Isopropyl-beta-D-thiogalactopyranoside,IPTG)、氨苄西林(Ampicillin,AMP)购自北京索莱宝;TMB显色液为上海生工公司产品;酸性磷酸酶(Acid phosphatase,ACP)、碱性磷酸酶(Alkaline phosphatase,AKP)、溶菌酶(Lysozyme,LZM)、免疫球蛋白M(ImmunoglobulinM,IgM)、过氧化氢酶(Catalase from micrococcus lysodeikticus,CAT)、超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)、丙二醛(Malondialdehyde,MDA)试剂盒购自南京建成生物工程研究所;弗氏完全佐剂、弗氏不完全佐剂购自MP生物医疗公司;动物总RNA抽提试剂盒购自上海生物工程有限公司;Evo M-MLV反转录试剂盒、SYBR Green ProTaqHS预混型qRT-PCR试剂盒购自湖南艾科瑞生物工程有限公司;引物合成、基因测序由西安奥科生物公司提供;大鼠抗鱼血清为实验室自制;HRP标记山羊抗大鼠IgG(免疫球蛋白G,Immunoglobulin G)购于Sigma公司。
1.2 试验方法
1.2.1 生物信息学分析 从NCBI(美国国家生物技术信息中心,National center of biotechnology information,https://www.ncbi.nlm.nih.gov/)上获取不同菌株外膜蛋白LolB序列,利用GeneDoc 3.2软件绘制不同菌株外膜蛋白的氨基酸序列比对图进行同源性分析,以MEGA 5.0软件绘制不同菌株系统发育树,比较不同菌株亲缘关系。
1.2.2 重组质粒的构建 NCBI数据库中查找荧光假单胞菌 ATCC 13525 全基因组,根据全基因组设计lolB的扩增引物。lolB基因登录号为SNY09892.1,大小为618 bp,上游引物:5′-ACCGGATCCATGTTTTTGCGCCACGTT-3′,下游引物:5′-CCACTCGAGTTATTGCCCCAG CTTGCG-3′,下划线处为酶切位点。扩增模板为荧光假单胞菌基因组;利用rTaq聚合酶进行扩增,扩增体系为50 μL,预变性温度、退火温度与退火时间分别为94 ℃、55 ℃、90 s;对PCR产物进行琼脂糖凝胶电泳鉴定并切胶纯化;使用BamH Ι 与XhoⅠ 对PCR回收产物与pET-32a双酶切,再对酶切产物(目的片段和载体)进行切胶回收;通过T4-DNA 连接酶将目的片段与载体进行连接,16 ℃连接16 h。将连接后的产物进行E.coliDH5α转化,转化成功后提取质粒,即得构建成功的重组质粒。利用双酶切与基因测序技术鉴定重组质粒,准确无误后将重组质粒转化入E.coliBL21中,进行蛋白的原核表达。
1.2.3 重组蛋白的表达与纯化 挑取重组单菌落培养8 h,以1∶100转接至新的含氨苄青霉素液体培养基,培养至OD600=0.5后用0.1 mol/L的IPTG诱导8 h。完成后取1 mL菌液并离心收菌,加入300 μL的2×SDS上样缓冲液后于沸水中煮5 min,通过变性聚丙烯酰胺凝胶电泳(Sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测目的蛋白的表达;重组菌株成功构建后,吸取重组菌液以1∶100转接至新的600 mL含氨苄青霉素的液体培养基,培养至OD600=0.5后用0.1 mol/L的IPTG诱导8 h,结合包涵体洗涤和SDS-PAGE蛋白电泳切胶法纯化目的蛋白,冻干后-80 ℃保存,备用。
1.2.4 蛋白诱导表达条件的优化 采用L9(34)正交试验模型探究目的蛋白的最佳表达条件。主要分为以下步骤:将过夜培养的蛋白表达菌液以1∶100的比例接入600 mL培养液中,按照要求(表1)加入不同浓度的IPTG,按照不同温度与时间培养至设定的OD600值,每组进行3次重复。取1 mL诱导菌液,离心收菌后菌体加入300 μL 2×SDS 蛋白上样缓冲液,沸水浴5 min,SDS-PAGE电泳获得不同诱导条件下的LolB蛋白表达图谱。通过软件Phoretix 1D和SPSS 22.0分别对表达图谱光密度和因子进行显著性分析。
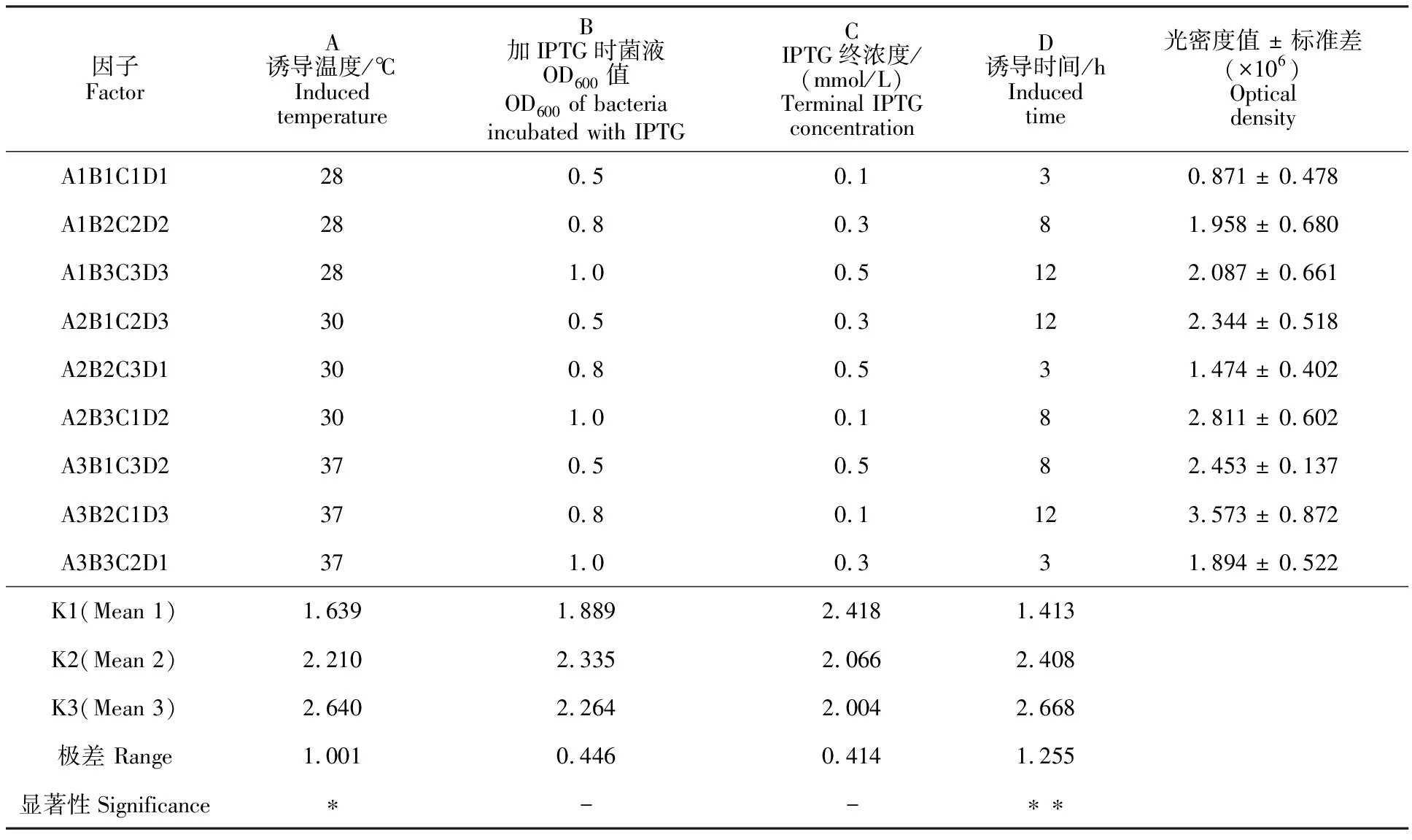
表1 蛋白表达条件正交试验Table 1 Factors and levels of orthogonal test for protein expression condition
1.2.5 红鲫LolB多克隆抗体制备、特异性与效价检测 试验组与对照组各15条红鲫,试验组按照2 μg/g体质量的LolB蛋白剂量进行免疫,蛋白溶液与福氏不完全佐剂按照1∶1的比例混合,置于摇床中过夜乳化,腹腔注射免疫红鲫(每尾40 μL),对照组注射无菌水;14 d后进行第2 次免疫,21 d后进行第3 次免疫,操作同上,免疫完成后7 d,红鲫尾静脉取血,血液4 ℃静置2 h, 4 ℃、3 000 r/min离心10 min获取血清。免疫印迹(Western blotting)夹心法验证LolB红鲫血清抗体特异性,步骤如下:将荧光假单胞菌全蛋白进行SDS-PAGE电泳;将硝酸纤维素(Nitrocellulose membrane,NC)膜置于电转槽中,80 V电转1 h,随后将NC膜于脱脂牛奶中充分封闭;将封闭好的NC膜在不同稀释倍数的红鲫血清(1∶100, 1∶200)中于37 ℃中孵育40 min,随后用TBST溶液洗涤3 次,每次10 min;随后于 1∶400的大鼠抗鱼血清中孵育,具体步骤同上;再于1∶3 000山羊抗大鼠抗体中孵育,完成后TBST溶液10 min洗涤3 次,利用DAB进行显色并确定抗原-抗体的结合。
1.2.6 红鲫免疫活性及抗氧化指标的检测 红鲫第3 次免疫LolB蛋白后7 d,尾静脉取血,对血清中ACP、AKP、LZM和IgM进行测定,免疫因子对机体免疫功能的激活具有参考意义。第3 次免疫后7 d对红鲫攻毒荧光假单胞菌,3 d后取血,血清中SOD、CAT、GSH-Px和MDA的含量测定对机体抗氧化自由基的能力具有参考意义。本试验采用南京建成生物工程研究所试剂盒进行测定,按说明书步骤进行。
1.2.7 细胞吞噬试验 红鲫第3次免疫LolB蛋白后7 d,尾静脉取血,鱼血浆(加抗凝剂)200 μL和1%甲醛生理盐水灭活的金黄色葡萄球菌(6×108cfu/mL)200 μL混合,25 ℃水浴60 min(每10 min振荡混匀1 次);随后制作血涂片,用快速姬姆萨染色试剂盒(上海生工)进行染色,油镜下观察吞噬细胞,计数吞噬细胞中金黄色葡萄球菌,SPSS 22.0检测显著性。吞噬百分数(PP)=(发生吞噬的吞噬细胞数/所观察的吞噬细胞)×100%;吞噬指数(PI)=(巨噬细胞吞噬的金黄色葡萄球菌数/参与吞噬的吞噬细胞数)×100%[19]。
1.2.8 体外模拟鱼血清对荧光假单胞菌的免疫识别作用 红鲫第3 次免疫LolB蛋白后7 d,尾静脉取血。酶联免疫吸附测定法[20](Enzyme Linked Immunosorbent Assay,ELISA)检测鱼血清与荧光假单胞菌的相互作用。步骤简述如下:将荧光假单胞菌培养至OD600约1.0后将菌体离心并洗涤;生理盐水调整OD600至1.0(菌浓度109cfu/mL),分装菌体每管150 μL,再与不同稀释倍数的血清(1∶100,1∶200,1∶400,1∶800, 1∶1 600,1∶3 200),对照为阴性血清,37 ℃条件下孵育90 min,再与1∶400的大鼠抗鱼血清(实验室自制)孵育90 min;最后与1∶3 000羊抗大鼠抗体孵育1 h。将洗涤好的菌体与20 μL PBS混合后加入酶标板,再加入200 μL的TMB显色液;再用50 μL 2 mol/L H2SO4终止反应,450 nm读数。
1.2.9 实时荧光定量法检测红鲫炎症因子 红鲫第3 次免疫LolB蛋白后攻毒荧光假单胞菌, 3 d后取组织(肾、脾、鳃),液氮静置30 min预冷,研磨至粉碎,TRIzol法提取总RNA,Evo M-MLV反转录试剂盒反转为cDNA,利用SYBR Green ProTaqHS试剂盒和实时荧光定量基因扩增仪(CFX96)进行荧光定量检测,具体设置如下。预变性温度95 ℃,30 s(初始1 个循环);变性95 ℃,5 s,退火-延伸60 ℃,30 s(40 个循环)。实时荧光定量基因扩增仪上查看炎症因子IL-1β和TNF-α表达情况,SPSS 22.0分析显著性。
1.2.10 组织病理学观测 红鲫第3 次免疫LolB蛋白后攻毒荧光假单胞菌,3 d后取组织(肾、脾、肠)。病理切片主要分为3 个步骤,即组织包埋、组织切片与H&E染色。组织包埋:将取出的组织立即浸泡在改良的Davidson’s[21]固定液中,固定18~24 h后转入10%甲醛溶液中继续固定;将固定好的组织于梯度浓度(80%,90%,95%,100%)的乙醇中脱水,放入二甲苯中透明;将透明好的组织于60 ℃的石蜡中浸泡,再将组织包埋于折叠好的模具中。切片:将包埋好的组织修正成约1 cm3的立方体,石蜡切片机切成厚度为4 μm的切片,将其附着于载玻片上,烘干。H&E染色:使用苏木素与伊红进行染色。首先将烘干的切片放入二甲苯中脱蜡;再于梯度浓度的乙醇中复水,复水结束后苏木素染色30 s,使细胞核上色,伊红染色20 min,使细胞质着色。继续于梯度浓度的乙醇中脱水,在二甲苯中透明,最后用中性树脂封片,完成后置于37 ℃恒温箱过夜,以备观察。
2 结果与分析
2.1 同源性与系统发育分析
在NCBI上获取不同菌种的外膜蛋白氨基酸序列,利用GeneDoc 3.2软件绘制同源分析图,对氨基酸序列进行BLAST比对,结果显示,荧光假单胞菌的LolB蛋白序列作为母本,乳酸假单胞菌的LolB蛋白序列相似度达到94.63%,卡尼斯假单胞菌为94.63%,奥加拉假单胞菌为 87.32%,大肠杆菌为28%,嗜水气单胞菌为 28.16%,副溶血弧菌为28.85%,奥奈达希瓦氏菌为26.24%,可见,假单胞菌蛋白质序列相似度明显高于其他菌(图1);利用MEGA 5.0软件绘制菌株进化树,结果显示假单胞菌属间亲缘关系较近(图2)。结合同源分析图、BLAST序列比对、菌种发育树,发现荧光假单胞菌外膜蛋白LolB可能对不同假单胞菌具有交叉免疫保护作用。

图1 氨基酸同源性分析Fig.1 Amino acid homology analysis
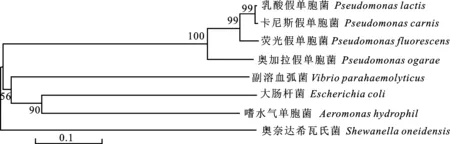
图2 系统发育树Fig.2 Phylogenetic tree
2.2 重组质粒的构建及蛋白的纯化
PCR扩增获得lolB基因,在600 bp左右处有单一且清晰的条带(图3-A),与NCBI公布的理论值相同;重组质粒pET-32a-lolB经过BamH Ι 与XhoΙ 双酶切鉴定,在600 bp左右获得条带,与理论值相同(图3-B),证明重组质粒构建成功。重组质粒经E.coliBL21转化,IPTG诱导后,利用包涵体洗涤与SDS-PAGE切胶法纯化后在42 ku处获得LolB蛋白(图3-C)。
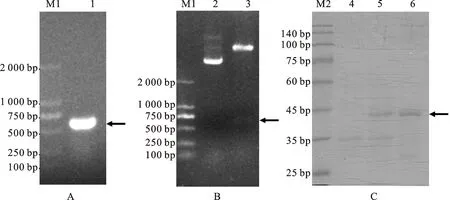
A.PCR扩增lolB基因; B.重组质粒pET-32a-lolB的双酶切; C.LolB蛋白的表达纯化.M1.DNA Marker; M2.蛋白Marker; 1.lolB基因; 2.重组质粒pET-32a-lolB; 3.BamHⅠ和XhoⅠ 双酶切; 4.未诱导菌株; 5.诱导菌株; 6.纯化的LolB蛋白
2.3 蛋白表达条件的优化
设计L9(34)正交试验模型,探索荧光假单胞菌外膜蛋白LolB的最佳诱导表达条件,每组条件3个重复,结果显示,不同诱导条件下蛋白质的表达有差异(图4),利用Phoretix 1D软件进行光密度分析(表1),再利用SPSS 22.0软件极差分析数据,最终获得最佳表达条件:A3B2C1D3(诱导温度37 ℃,菌液浓度OD600=0.8,IPTG终浓度0.1 mmol/L,诱导时间12 h);显著性分析显示,诱导温度、诱导时间对蛋白表达影响显著(表1)。

A,B,C为3 次重复;M.蛋白质Marker;1.未诱导菌株;2~4.诱导温度为28 ℃,OD600分别为0.5,0.8,1.0; 5~7.诱导温度30 ℃,OD600分别为0.5,0.8,1.0;8~10.诱导温度为37 ℃,OD600分别为0.5,0.8,1.0; 2,7,9.IPTG浓度为0.1 mmol/L; 3,5,10.IPTG浓度为0.3 mmol/L;4,6,8.IPTG浓度为0.5 mmol/L; 2,6,10.诱导时间为3 h;3,7,8.诱导时间为8 h;4,5,9.诱导时间为12 h
2.4 红鲫抗血清的特异性、效价检测
红鲫免疫LolB蛋白后,获取血清进行特异性、效价检测,Western blotting试验结果发现在22 ku处具有特异性条带,且LolB抗血清的效价可达1∶200(图5)。
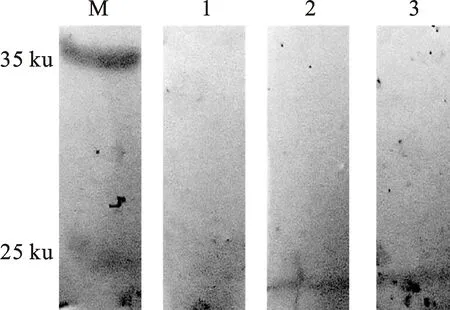
M.蛋白质 Marker; 1.阴性对照; 2.血清稀释倍数为 1∶100; 3.血清稀释倍数为1∶200
2.5 红鲫抗血清与荧光假单胞菌的免疫识别作用
ELISA试验结果表明,LolB抗血清与荧光假单胞菌在体外具有相互识别作用,且抗体滴度在1∶3 200仍具有识别作用(图6)。
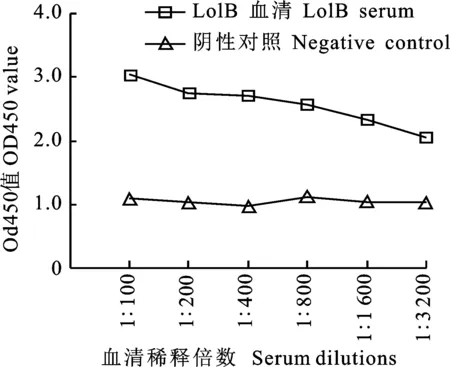
图6 红鲫抗血清与荧光假单胞菌体外相互识别Fig.6 Mutual recognition between C.auratusserum and P.fluorescens in vitro
2.6 红鲫免疫相关因子检测
红鲫免疫LolB蛋白后,获取血清检测免疫因子(AKP、ACP、LZM、IgM),结果显示均呈上升趋势(图7),大多数达到显著性(P<0.05),表明LolB蛋白激活了红鲫的非特异性免疫。
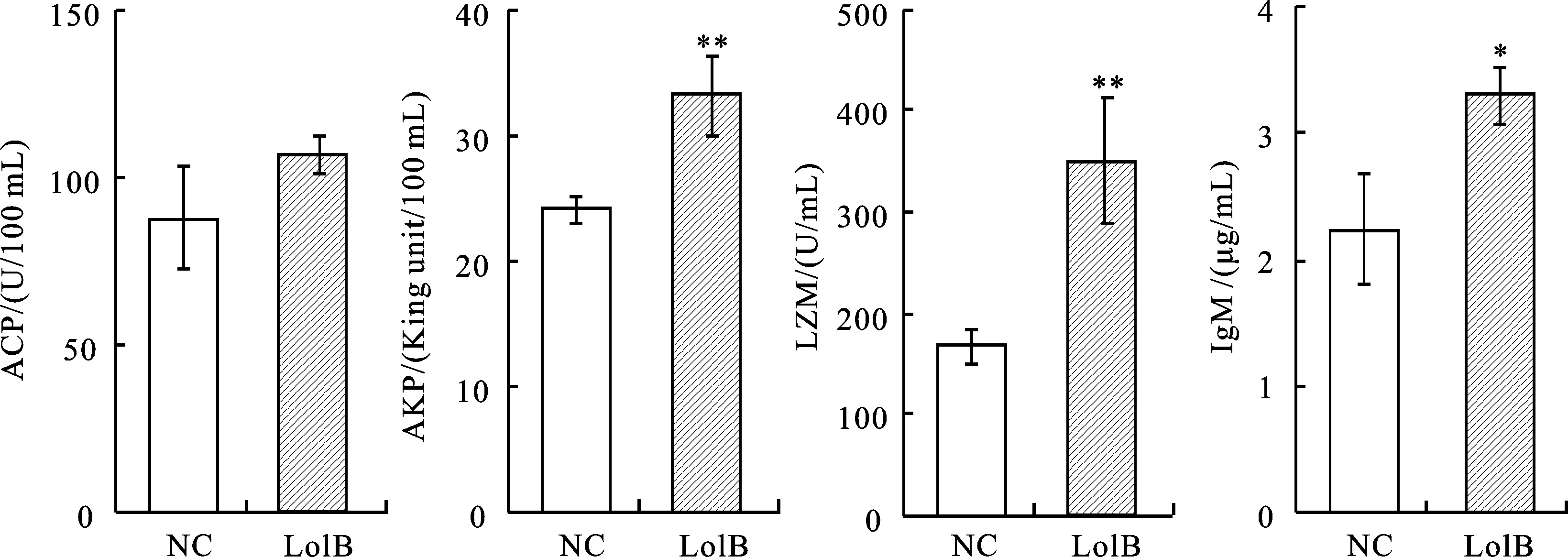
*表示P<0.05; **表示P<0.01; NC表示对照组; 图8,9同
2.7 红鲫细胞吞噬作用
红鲫免疫后获取血浆,细胞吞噬作用结果(表2)显示免疫后吞噬百分数和吞噬指数呈上升趋势,且吞噬百分数达到极显著升高(P<0.01)。
表2 红鲫免疫血浆细胞吞噬作用Table 2 Phagocytosis of immune plasma cell in C.auratus
2.8 荧光假单胞菌攻毒红鲫抗氧化因子检测
红鲫免疫LolB蛋白后攻毒荧光假单胞菌,获取血清检测抗氧化因子(CAT、SOD、MDA、GSH-Px),结果(图8)显示血清抗氧化指标较对照组大部分呈降低趋势,表明免疫LolB蛋白对荧光假单胞菌感染具有一定的抗氧化保护作用。
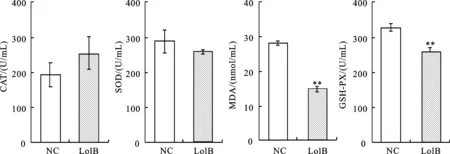
图8 荧光假单胞菌攻毒红鲫后血清抗氧化因子指标检测Fig.8 Detection of serum antioxidant factor in C.auratu after challenge with P.fluorescens
2.9 荧光假单胞菌攻毒红鲫炎症因子检测
红鲫免疫LolB蛋白后攻毒荧光假单胞菌, 3 d后取组织(肾、脾、鳃),采用荧光定量PCR法进行检测,结果显示炎症因子均呈下降趋势,脾脏的IL-1β下降趋势达到显著性,肾脏的TNF-α下降趋势达到极显著性(图9)。
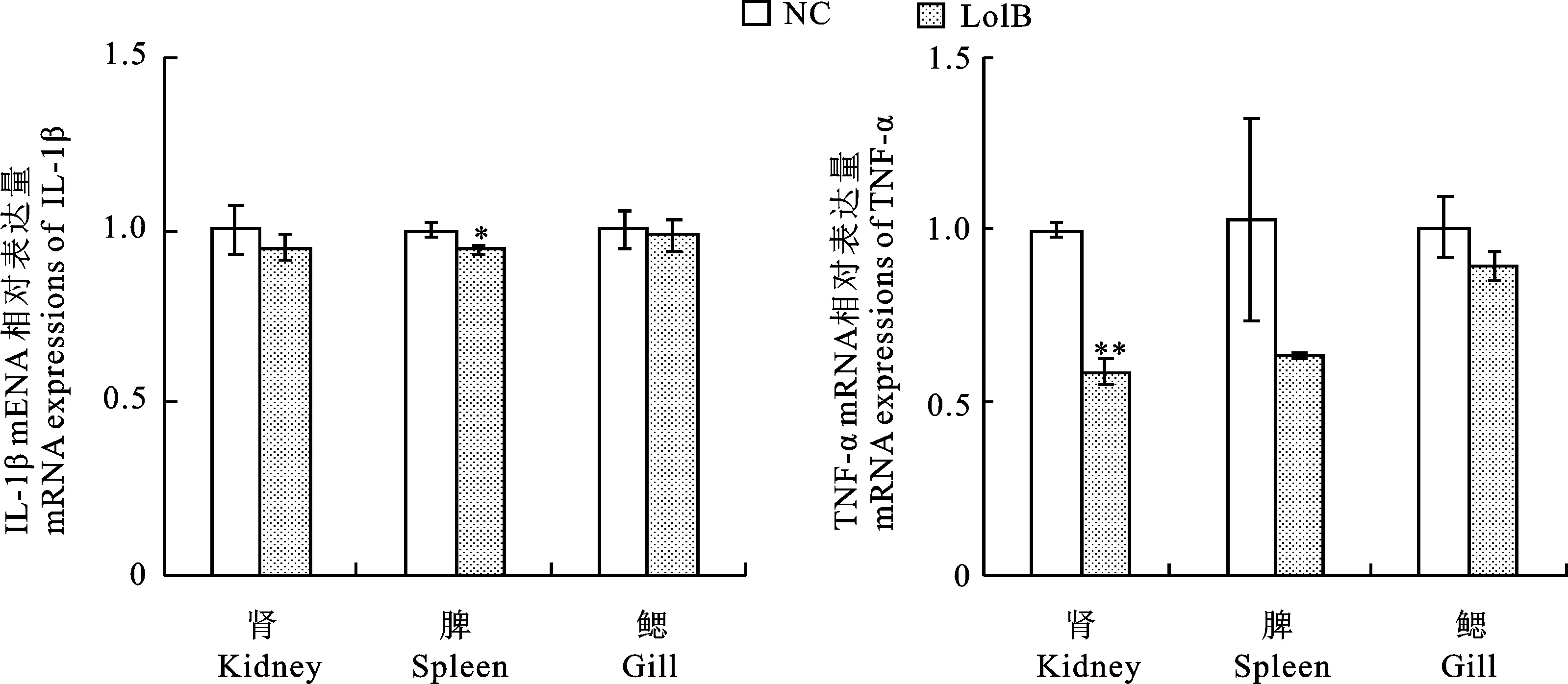
图9 荧光假单胞菌攻毒红鲫后炎症因子检测Fig.9 Detection of inflammatory factor after invasion of C.auratu by P.fluorescens
2.10 荧光假单胞菌攻毒红鲫病理切片观测
红鲫免疫LolB蛋白后攻毒荧光假单胞菌, 3 d后取组织(肾、脾、肠)进行病理学切片;对照组肾脏结构不完整,肾小球退化、组织间隙增大;脾脏细胞密度减少、细胞核损伤、细胞凋亡;肠道结构松散、细胞游离、细胞边界界限不规则。红鲫免疫LolB蛋白后攻毒荧光假单胞菌组织形态较为完好(图10)。
3 讨 论
荧光假单胞菌是鱼类养殖的主要病原菌之一,生物信息分析发现荧光假单胞菌外膜蛋白LolB在假单胞菌属间同源性较高,进化树图谱也发现假单胞菌属间亲缘关系较近。史姿聪等[22]生物信息预测鸭源鸡杆菌tolC基因多菌种间同源性较高,最后发现鸭源鸡杆菌TolC蛋白是具有交叉免疫保护性的抗原;康超等[23]生物信息学分析嗜水气单胞菌外膜蛋白AH6169,发现AH6169在气单胞菌间有较高同源性,最后得出AH6169可为不同种类的气单胞菌提供交叉免疫保护作用的结论。因此LolB蛋白也可能对不同假单胞菌有交叉保护作用。
分子克隆技术是获取重组蛋白的一种常见方法。伍娜娜等[24]利用分子克隆成功构建重组菌株获取大肠杆菌外膜蛋白OmpF。赵亮等[25]利用原核表达系统构建大肠杆菌重组菌株,获取马铃薯V病毒外壳蛋白。笔者也采用分子克隆技术构建荧光假单胞菌外膜蛋白LolB的重组表达菌株,通过SDS-PAGE电泳检测重组外膜蛋白的诱导表达情况,采用包涵体洗涤和SDS-PAGE电泳切胶法纯化获得纯度较高的重组蛋白。本文通过分子克隆成功构建pET-32a-lolB重组菌株,发现最佳诱导表达条件为:OD600=0.8,IPTG=0.1 mmol/L,温度为37 ℃培养12 h,为LolB蛋白的批量获取奠定基础。
多克隆抗体制备常采用动物免疫法,因其具有操作简便和制备周期短的优点而被广泛使用。刘望等[26]用嗜水气单胞菌外膜融合蛋白免疫斑马鱼,成功制备鱼抗血清;Khushiramani等[27]纯化Omp48蛋白并免疫兔子,成功获得兔抗血清。本文也采用动物免疫法制备多克隆抗体,通过对红鲫免疫LolB蛋白,成功制备红鲫LolB抗血清,可为后续免疫学试验奠定基础。
鱼体的非特异性免疫应答可防御外界入侵[28-29],鱼类血液是机体进行免疫反应的重要场所,血清相关指标的检测可间接解释不同免疫原对鱼体的影响情况[30]。赵林辉等[31]对鲤鱼免疫OmpA、FlaA重组蛋白,发现血清中AKP、IgM等指标上升;马少鸿[32]对鱼体免疫flgE蛋白,发现血清中lZM、IgM等指标上升,说明激活了鱼体的非特异免疫。本文对红鲫抗血清进行免疫因子检测,发现免疫组均高于对照组,且AKP、LZM、IgM达到显著水平。江叶舟等[33]对鼠类过表达miR-223进行研究,发现细胞吞噬是机体非特异性免疫的重要指标;赵娜等[34]对牙鲆进行海豚链球菌胞外产物免疫后,其吞噬指标上升。本文也发现红鲫免疫LolB蛋白组相较未免疫蛋白组,其吞噬百分比和吞噬指数均存在上升趋势,且吞噬百分数达到极显著水平。孙薇等[35]利用 Western blotting 发现免疫外膜蛋白的动物血清和荧光假单胞菌具有特异性结合;荣娜等[13]利用Western blotting和ELISA对P5鱼抗血清进行评价,显示P5抗血清可与嗜水气单胞菌特异性结合,ELISA显示P5抗血清与嗜水气单胞菌存在识别作用。本文也对红鲫LolB抗血清与荧光假单胞菌全蛋白进行Western blotting,结果发现LolB抗血清与荧光假单胞菌全蛋白特异性结合,效价比达到 1∶200。红鲫LolB抗血清与荧光假单胞菌进行ELISA模拟体外相互识别,结果识别滴度达1∶3200。免疫因子、吞噬指数和吞噬百分数的上调确定LolB蛋白具有增强机体免疫力的效果,Western blotting确定红鲫LolB抗血清和荧光假单胞菌可以特异性结合,结合ELISA试验确定红鲫LolB抗血清和荧光假单胞菌可以相互识别,表明鱼体的非特异免疫已被激活。
蛋白保护原对动物感染致病菌的保护效果可以通过抗氧化因子、炎症因子以及病理学切片来综合评价。抗氧化因子是转化机体自由基的一类抗氧化关键酶,其代谢水平可以间接反应机体损伤程度,Liu等[36]对小鼠免疫大肠杆菌外膜蛋白OmpA后对后攻毒大肠杆菌,发现小鼠MDA、SOD等因子下调,减轻大肠杆菌对小鼠肝脏和肾脏的损伤;刘娇等[37]对鸭粮添加葡萄糖氧化酶后攻毒大肠杆菌,发现MDA、DAO活性和D-LA含量呈下降趋势,减少了细菌内毒素的产生。本文对攻毒红鲫血清中进行检测,抗氧化因子多数呈降低趋势,其中MDA、GSH-Px达到极显著水平。炎症因子是机体炎症反应中出现的一类炎症介质,黄瑞玲等[38]对白羽鸡人工感染禽腺病毒血清4型,IL-1β等因子呈上升趋势,攻毒会促进外周血炎症因子的释放,炎症因子水平的高低可反应机体炎症的严重程度;杨光等[39]通过苍术内酯Ⅱ对骨关节炎大鼠软骨损伤的研究,发现苍术内酯Ⅱ可降低炎症因子IL-1β、TNF-α等水平,得出苍术内酯Ⅱ降低氧化应激及炎症反应从而缓解OA模型大鼠软骨损伤的结论。本文对红鲫攻毒组织采用实时荧光定量PCR法进行检测,发现鱼体试验组中的IL-1β、TNF-α表达量均低于对照组,表明蛋白保护原对感染荧光假单胞菌起到降低炎症的效果。研究人员普遍认为组织病理学切片可区分出患病和正常的组织细胞[40],兰蕾等[41]对艾烟染毒后大鼠的心、肝、脾、肺等脏器组织进行组织病理学切片观察,发现染毒后均有损伤;王振军等[42]建立貂细小病毒病动物模型,通过组织病理学切片发现感染致病菌后貂的内脏有损伤。本文通过组织病理学切片观测到,与对照组相比,蛋白免疫组攻毒后细胞形态较为完好,表明免疫LolB蛋白对感染荧光假单胞菌具有一定的保护功能。
综上所述,本文通过分子克隆构建重组菌株获取LolB蛋白,正交试验探索蛋白表达优化条件。红鲫免疫LolB蛋白制备多克隆抗体,通过免疫因子和吞噬活性发现LolB蛋白可以激活红鲫的非特异性免疫,通过Western blotting和体外模拟识别发现荧光假单胞菌可以与LolB抗血清特异性识别与结合,通过切片和炎症因子发现其对鱼体有保护脏器和降低炎症的效果,故LolB蛋白对感染荧光假单胞菌有一定的保护作用,有作为防治水产病害疫苗的潜力。
